La tromboembolia de pulmón (TEP) y la hipertensión pulmonar (HP) son comorbilidades frecuentes que empeoran el pronóstico de los pacientes diagnosticados de enfermedad pulmonar intersticial difusa (EPID). Pese a los avances en el diagnóstico y tratamiento de estas entidades, su impacto en el manejo y la progresión de la EPID no está suficientemente estudiado. Este artículo incluye una revisión y actualización del diagnóstico y tratamiento de la TEP y de la HP en pacientes con EPID de base.
Pulmonary embolism (PE) and pulmonary hypertension (PH) are common comorbidities that worsen the prognosis of patients diagnosed with interstitial lung disease (ILD). Despite advances in the diagnosis and treatment of these entities, their impact on the management and progression of ILD is not sufficiently studied. This article includes a review and update of the diagnosis and treatment of PE and PH in patients with underlying ILD.
Los pacientes diagnosticados de enfermedad pulmonar intersticial difusa (EPID) presentan un mayor riesgo de manifestar tromboembolia de pulmón (TEP) e hipertensión pulmonar (HP)1–3. La inmovilización, el estado procoagulante, el cáncer o la progresión propia de la EPID podrían explicar la aparición de TEP e HP4. En un estudio prospectivo se realizó una angiotomografía computarizada (angioTC) de tórax y una ecografía venosa de extremidades inferiores a 57 pacientes con EPID idiopática o asociada a conectivopatías; 15 pacientes presentaron enfermedad tromboembólica venosa (ETV), incluyendo 3 casos de trombosis venosa profunda (TVP) y 12 de TEP durante el ingreso hospitalario o en el seguimiento a los 3 meses5. En un estudio retrospectivo se evaluaron los resultados obtenidos en la angioTC de 48 individuos con EPID; 7 pacientes fueron diagnosticados de TEP, siendo la fibrosis pulmonar idiopática (FPI) la entidad con mayor número de casos (4/7), seguida de la EPID asociada a conectivopatías (2/7) y la neumonitis por hipersensibilidad fibrótica (1/7)6. Sin embargo, las estimaciones sobre la prevalencia de la TEP en los pacientes con EPID podrían ser imprecisas debido a la dificultad para diferenciar ambas entidades en la práctica habitual7. Por otro lado, la HP se identifica inicialmente en aproximadamente el 8-15% de pacientes con FPI, y en el 60% de casos con la misma enfermedad en fase avanzada8. La prevalencia de la HP puede ser variable en las distintas EPID: en la neumonía intersticial no específica se describe una prevalencia del 31%, mientras que es del 44% en la neumonitis por hipersensibilidad fibrótica9. En la actualidad disponemos de distintos métodos diagnósticos y tratamientos para las EPID y sus comorbilidades, como la TEP y la HP. No obstante, el infradiagnóstico y la dificultad para el acceso a distintos fármacos sigue siendo un reto en el tratamiento combinado de dichas entidades.
El objetivo de esta revisión es proporcionar una actualización en el diagnóstico y tratamiento de la TEP y de la HP en la EPID. La fisiopatología de las distintas entidades no se contempla en esta revisión.
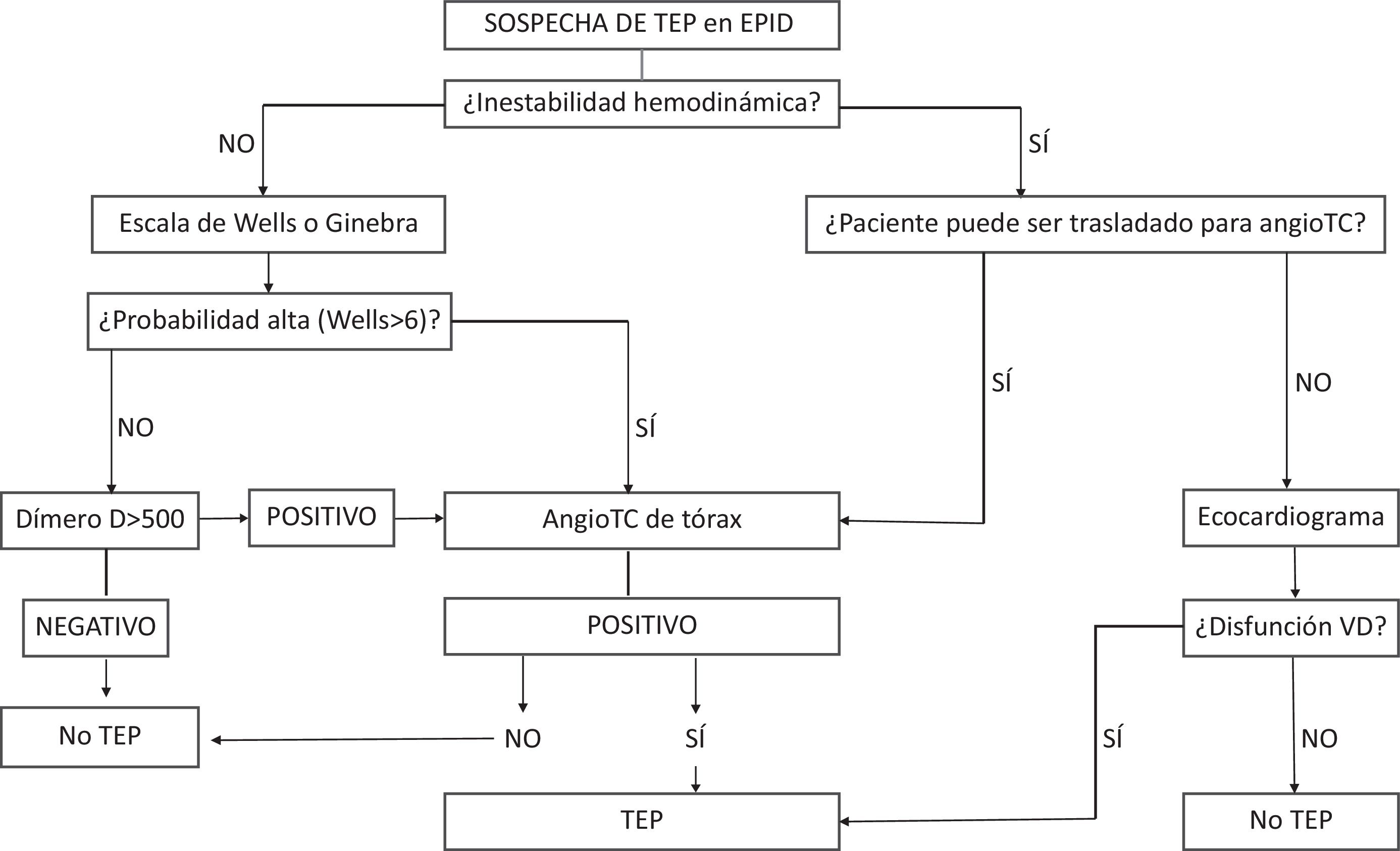
Diagnóstico de la tromboembolia de pulmón en la enfermedad pulmonar intersticial difusaLos síntomas de la TEP son inespecíficos e incluyen disnea, hemoptisis, dolor torácico, presíncope, síncope o inestabilidad hemodinámica, y con frecuencia se solapan con los de la agudización de la propia EPID10. El diagnóstico de la TEP requiere la combinación de la sospecha clínica, los resultados del dímero D (DD) y las pruebas de imagen (fig. 1)11. Por tanto, la TEP queda excluida con seguridad al combinar la sospecha clínica baja o intermedia (escala de Wells<6 o escala de Ginebra<11) y un DD negativo; mientras que si el DD es positivo o la probabilidad clínica es alta se requerirá de un estudio de imagen como la angioTC12. En la actualidad, las guías de práctica clínica no hacen recomendaciones específicas para el diagnóstico y tratamiento de la TEP en pacientes con EPID.
La escala de Wells y la escala de Ginebra se han validado extensamente para la estimación de la probabilidad clínica de TEP. Sin embargo, existen estudios con resultados contradictorios acerca de la utilidad de dichas escalas en pacientes diagnosticados de EPID5,7. Los autores de esta revisión recomiendan el empleo de las mencionadas escalas hasta la disponibilidad de nuevos estudios concluyentes al respecto.
Dímero DEl DD puede elevarse en casos de agudización de EPID debido a la afectación de la cascada de la coagulación relacionada con el daño tisular y no necesariamente por la presencia de ETV13. Sin embargo, en la actualidad no disponemos de estudios exclusivos que determinen un punto de corte del DD que mejore su especificidad en pacientes con EPID. Ante la escasez de evidencia se recomienda mantener el criterio de un punto de corte fijo del DD de 500ng/ml, a partir del cual será necesario progresar a estudios de imagen. Existen otros puntos de corte que han demostrado seguridad y eficiencia para descartar la TEP cuando el valor es inferior al límite ajustado. El uso de punto de corte de DD de 1.000ng/ml en pacientes con probabilidad clínica baja de TEP, y de 500ng/ml en probabilidad clínica moderada según la escala de Wells, o el uso de un punto de corte de DD ajustado a la edad en pacientes mayores de 50 años con sospecha de TEP (edad×10) han demostrado disminuir el número de pruebas de imagen necesarias14. La estrategia YEARS emplea un punto de corte del DD de 1.000ng/ml si no existen ni hemoptisis, ni signos clínicos de TVP, ni la TEP es el diagnóstico más probable; en caso contrario se utiliza el punto de corte habitual de 500ng/ml15. No existen estudios en la actualidad acerca del uso del DD ajustado en pacientes con sospecha de TEP y EPID concomitante, pero se consideran estrategias válidas en este ámbito.
Estudios de imagenA pesar de la falta de estudios que evalúen de forma exclusiva el empleo de la angioTC en el diagnóstico de la TEP en pacientes con EPID, la angioTC sigue siendo el estudio de imagen de elección y podría ser útil en el diagnóstico diferencial y para identificar signos radiológicos sugestivos de agudización de EPID1. La gammagrafía de ventilación/perfusión se utiliza en casos de alergia a contraste o insuficiencia renal grave (aclaramiento de creatinina<30ml/min), aunque su rentabilidad diagnóstica en EPID se ve limitada por la afectación parenquimatosa que conduce a una interpretación errónea de defectos de perfusión1,10. La angiografía por resonancia magnética y la tomografía computarizada por emisión de fotón simple podrían llegar a considerarse alternativas; actualmente, están limitadas por su escasa disponibilidad y la necesidad de estudios robustos que validen su empleo y unifiquen criterios diagnósticos16.
El ecocardiograma transtorácico puede revelar signos de dilatación y disfunción del ventrículo derecho (VD), pero debe reservarse para el diagnóstico de la TEP aguda sintomática con inestabilidad hemodinámica17. Finalmente, la ecografía venosa de extremidades inferiores tiene indicación ante la sospecha de TVP en pacientes con TEP concomitante y como la primera prueba de imagen en embarazadas con sospecha de TEP10,18.
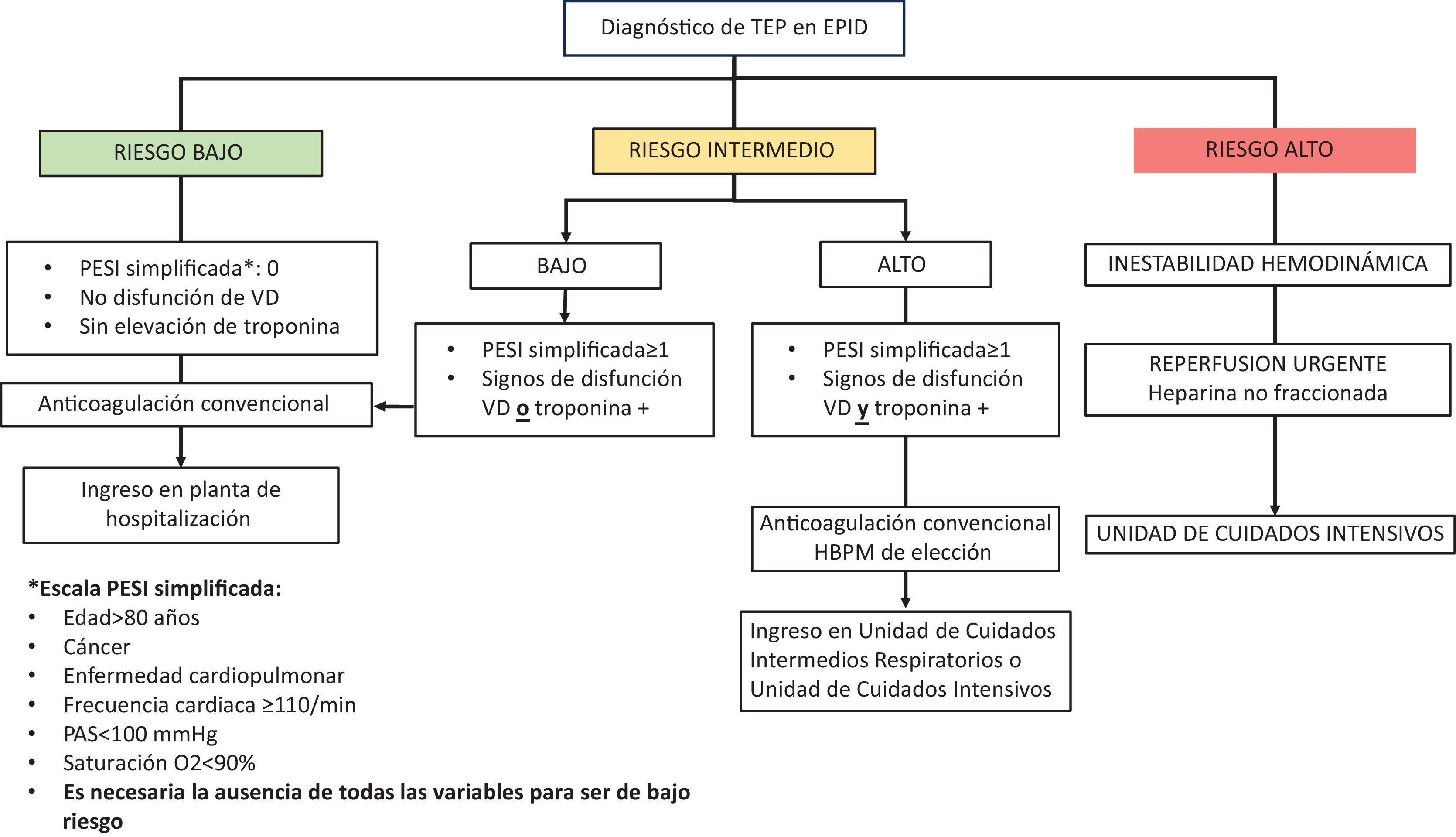
Estratificación pronóstica de la tromboembolia de pulmónLa estratificación pronóstica tras el diagnóstico de la TEP es fundamental para la elección del tratamiento y del lugar apropiado para administrarlo (hospitalización, unidad de cuidados intensivos o unidad de cuidados respiratorios intermedios)19. La inestabilidad hemodinámica se define como parada cardiorrespiratoria, shock obstructivo (presión arterial sistólica [PAS]<90mmHg, uso de vasopresores para mantener PAS≥90mmHg, en combinación de signos de hipoperfusión), o hipotensión persistente (PAS<90mmHg o una caída de ≥40mmHg de su PAS habitual durante>15minutos, no debida a sepsis, hipovolemia o arritmia)10. Estos pacientes son identificados como de riesgo alto y requieren reperfusión urgente20. Por otro lado, los pacientes hemodinámicamente estables con signos de disfunción del VD (en angioTC o ecocardiograma) y/o elevación de biomarcadores que sugieren daño miocárdico (troponinas de elección) son considerados de riesgo intermedio y requieren ingreso hospitalario y tratamiento anticoagulante21. Finalmente, los pacientes considerados de riesgo bajo (escala Pulmonary Embolism Severity Index [PESI] simplificada negativa, sin disfunción de VD ni incremento de biomarcadores cardiacos) deben recibir tratamiento anticoagulante convencional y se podría considerar el alta precoz, o incluso el tratamiento ambulatorio de su enfermedad (fig. 2)22. Los autores de esta revisión no recomendamos el alta precoz de los pacientes con EPID y TEP concomitante, debido a la inexistencia de estudios en este ámbito y la gravedad asociada a 2 enfermedades potencialmente mortales.
Medidas de soporteLa administración de oxigenoterapia está indicada en pacientes con TEP aguda y saturación de oxígeno menor a 90%; en casos de hipoxemia refractaria podría considerarse la ventilación mecánica (invasiva o no invasiva) o la oxigenoterapia de alto flujo con cánula nasal10. Particularmente, la indicación de ventilación mecánica invasiva deberá individualizarse debido a la alta mortalidad asociada a la insuficiencia respiratoria refractaria en este grupo de pacientes.
Tratamiento de la tromboembolia de pulmón en pacientes estables con enfermedad pulmonar intersticial difusaLos antagonistas de la vitamina K (AVK), los anticoagulantes orales de acción directa (ACOD) y las heparinas, como la heparina de bajo peso molecular (HBPM), o la heparina no fraccionada son los tratamientos de primera línea ante el diagnóstico de TEP23. La anticoagulación parenteral (HBPM, heparina no fraccionada o fondaparinux) deberá emplearse antes del inicio del tratamiento con dabigatrán, edoxabán y solaparse cuando se emplean los AVK. Los ACOD, apixabán y rivaroxabán, pueden emplearse desde el momento del diagnóstico sin requerir otros tratamientos previos (tabla 1)24. De forma general, los ACOD son los tratamientos de elección para los pacientes con TEP aguda sintomática, salvo en el síndrome antifosfolípido triple positivo, insuficiencia renal grave y durante el embarazo y la lactancia15. Los AVK se prefieren en casos de síndrome antifosfolípido triple positivo e insuficiencia renal grave y la HBPM en pacientes embarazadas y en la TEP de riesgo intermedio-alto11,15. Aunque actualmente no existen estudios que comparen directamente la eficacia y seguridad de los AVK y ACOD en pacientes con EPID, los ACOD se han asociado a un riesgo menor de muerte o trasplante respecto a AVK en pacientes con EPID25. A pesar de la posible interacción entre los fármacos antifibróticos y los anticoagulantes orales, algunos estudios sugieren que los ACOD son la opción más segura y efectiva en pacientes que reciben tratamiento con nintedanib, sobre todo en individuos con riesgo alto de complicaciones hemorrágicas26,27. Finalmente, el filtro de vena cava recuperable se recomienda en casos de TEP aguda sintomática y contraindicación absoluta para cualquier tipo de anticoagulación15.
Opciones de tratamiento anticoagulante en la tromboembolia de pulmón aguda
| Fase inicial | Fase de continuación |
|---|---|
| Apixabán 10mg/12h vía oral durante 7 días | Apixabán 5mg/12h vía oral |
| Rivaroxabán 15mg/12h vía oral durante 21 días | Rivaroxabán 20mg/24h vía oral |
| HBPM subcutánea ajustada al peso (1mg/kg/12h o 1,5mg/kg/24h) | |
| Administrada durante un mínimo de 5 días | Dabigatrán 150mg/12h vía oral |
| Administrada durante un mínimo de 5 días | Edoxabán 60mg/24h vía oral |
| Administrada durante un mínimo de 5 días más el antagonista de la vitamina K oral hasta un INR>2 | Antagonista de la vitamina K vía oral con objetivo de INR 2-3 |
HBPM: heparina de bajo peso molecular; INR: índice internacional normalizado.
Adaptado de Kahn et al.11.
En caso de TEP y agudización de EPID concomitante, los autores de esta revisión recomiendan la HBPM en dosis terapéuticas debido a un menor riesgo de interacción con fármacos como los corticoides y antibióticos de amplio espectro empleados habitualmente en la agudización de EPID28,29. Para los pacientes con TEP de riesgo alto se recomienda la anticoagulación con heparina no fraccionada y reperfusión urgente con vigilancia estrecha en la unidad de cuidados intensivos30. Las distintas terapias de reperfusión urgente y los fármacos empleados exceden el objetivo de esta revisión. En casos de EPID y TEP de riesgo alto concomitante los autores recomiendan seguir las indicaciones establecidas para la población general.
Hipertensión pulmonar en la enfermedad pulmonar intersticial difusaLa HP es una comorbilidad frecuente en la EPID. Se clasifica dentro del grupo 3: HP asociada a enfermedades pulmonares y/o hipoxia (HP-EPID)8. La presencia de HP ensombrece el pronóstico de los pacientes con EPID, siendo la HP-EPID una de las formas de HP con mayor mortalidad31,32.
Diagnóstico de la hipertensión pulmonar en la enfermedad pulmonar intersticial difusaAunque los síntomas de HP pueden confundirse con los de la propia EPID, se sospechará de HP-EPID en pacientes con empeoramiento sintomático respiratorio, signos de insuficiencia cardiaca derecha o una disminución desproporcionada de la capacidad de difusión del monóxido de carbono (DLCO) respecto a los hallazgos radiológicos y las mediciones espirométricas33. Debe tenerse en cuenta que los pacientes con EPID pueden tener HP de otro origen, por ejemplo, poscapilar o tromboembólica, por lo que ante la sospecha de HP deben descartarse estas posibilidades8,33. Asimismo, también debe valorarse si existen comorbilidades que se asocian a hipertensión arterial pulmonar, como las enfermedades autoinmunes o sistémicas, la infección por VIH o la hipertensión portal34.
El diagnóstico de HP-EPID se establece mediante cateterismo cardiaco derecho (CCD), con valores de presión arterial pulmonar (PAP) media>20mmHg, presión de oclusión de la arteria pulmonar≤15mmHg y resistencia vascular pulmonar (RVP)>2UW (tabla 2)8. De acuerdo con las últimas guías clínicas se considera que la HP-EPID es grave cuando la RVP es>5UW8,32. No obstante, en la EPID inclusive la HP no grave tiene un impacto negativo en las exacerbaciones, los síntomas y la supervivencia8,35. No existen criterios bien definidos para realizar un CCD en la HP-EPID, aunque estará indicado en caso de valoración para trasplante pulmonar, si existen dudas del posible origen poscapilar de la HP y si se espera que su realización modifique el manejo terapéutico8,32.
Definición hemodinámica de la hipertensión pulmonar
| Características hemodinámicas | Definición |
|---|---|
| PAPm>20 mmHg | Precapilar aislada |
| PAWP≤15mmHg | |
| RVP>2UW | |
| PAPm>20mmHg | Poscapilar aislada |
| PAWp≥15mmHg | |
| RVP≤2 | |
| PAPm>20mmHg | Combinada pre y poscapilar |
| PAWP>15mmHg | |
| RVP>2UW |
PAPm: presión arterial pulmonar media; PAWP; presión de enclavamiento pulmonar; RVP: resistencias vasculares pulmonares; UW: unidades Wood.
Adaptado de las guías de la ESC/ERS 20228.
La sospecha de HP en la EPID es clínica. Reforzarán dicha sospecha los valores elevados de propéptido natriurético cerebral N-terminal (NT-proBNP) y del péptido natriurético auricular tipo B (BNP); valores normales de BNP/NT-proBNP tienen un alto valor predictivo negativo sin excluir completamente la HP36. En un estudio se identificó que valores inferiores a 95ng/l de NT-proBNP permitían excluir HP en pacientes con EPID y que los niveles elevados de NT-proBNP, ácido úrico, troponina-T y DD se asocian a peor pronóstico37. El electrocardiograma muestra signos de hipertrofia ventricular derecha y desviación del eje hacia la derecha, además de ser útil en el diagnóstico diferencial8.
Pruebas de función respiratoriaLos valores de volúmenes pulmonares y de DLCO, y su relación con la afectación parenquimatosa evidenciada en la tomografía computarizada de alta resolución (TCAR) de tórax, nos ayudarán en la sospecha de HP en la EPID8,38. La capacidad vital forzada (FVC)>70% acompañada de una disminución marcada de la DLCO, que no se corresponde con la afectación radiológica ni con la enfermedad de base, nos hará sospechar de HP39,40. Los pacientes con HP-EPID tienen menor tolerancia al ejercicio en la prueba de la marcha de 6 minutos (PM6M), aunque su interpretación es compleja debido a que cualquier limitación puede reflejar tanto el componente vascular como el parenquimatoso33,41.
La prueba de esfuerzo cardiopulmonar ha adquirido progresivamente un papel importante en el diagnóstico y seguimiento de la HP42. Los pacientes con HP-EPID tienen peor eficiencia ventilatoria, con menor presión parcial de dióxido de carbono (CO2) al final de la espiración y mayor pendiente de la relación entre ventilación y producción de CO2 (VE/VCO2)42,43.
Estudios de imagenLa ecocardiografía transtorácica (ETT) es el estudio inicial de elección ante la sospecha de HP y para descartar otras causas asociadas, como la afectación cardiaca izquierda8. La velocidad de regurgitación tricuspídea>2,8m/s, así como la presencia de otros signos como el desplazamiento sistólico del plano del anillo tricuspídeo (TAPSE)<18mm, la relación del diámetro VD/ventrículo izquierdo (VI)>1,0 y el aplanamiento del septo interventricular son signos sugestivos de HP8,44. Aunque cabe recalcar que la ETT deberá combinarse con los otros estudios complementarios mencionados previamente debido a las discrepancias en la correlación respecto a CCD en pacientes con EPID33,36.
La TCAR de tórax se emplea para el diagnóstico, seguimiento y monitorización del tratamiento en pacientes con EPID. También puede poner de manifiesto signos sugestivos de HP como el incremento del diámetro de la arteria pulmonar (≥27mm en mujeres o≥29mm en hombres), la relación entre los diámetros de arteria pulmonar y aorta ascendente>1 o la hipertrofia del VD44,45. No obstante, debido al rendimiento variable de estas medidas, la sociedad Fleischner propuso en 2021 medidas ajustadas al contexto clínico del paciente (hallazgo incidental vs. sospecha de HP)46.
Finalmente, la resonancia magnética cardiaca puede ofrecer una evaluación morfológica y hemodinámica del VD y de la HP, siendo una técnica prometedora en la estimación del pronóstico y efecto del tratamiento en HP-EPID44,47.
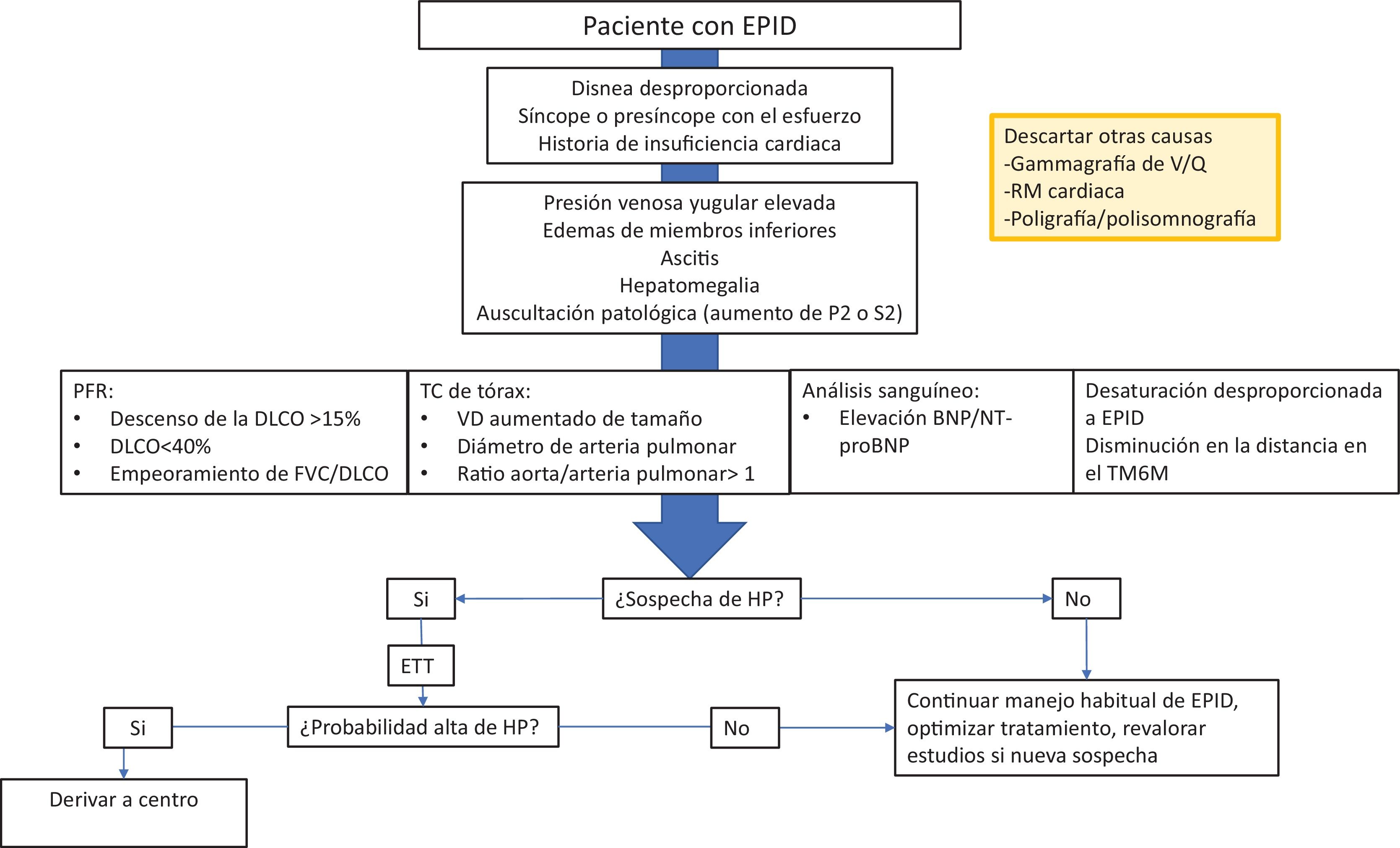
Cribado de la hipertensión pulmonar en pacientes con enfermedad pulmonar instersticial difusaEn la actualidad no disponemos de guías de práctica clínica para el cribado de HP en las EPID. Parikh et al. han propuesto una herramienta para la detección temprana de HP en distintos tipos de EPID mediante datos clínicos, resultados de PFR y PM6M, hallazgos en TC de tórax y biomarcadores cardiacos con una alta sensibilidad y especificidad asociada48. Dicha herramienta clasifica a los pacientes en: riesgo bajo (seguimiento), riesgo intermedio (ETT) y riesgo alto (ETT y valoración para CCD)48. Un estudio DELPHI identificó que los niveles elevados en BNP/NT-proBNP y los signos sugestivos de HP en ETT ayudan a la detección temprana de esta enfermedad en EPID49. Los síntomas y signos de insuficiencia cardiaca derecha, los hallazgos sugestivos de HP en la TCAR de tórax y el empeoramiento injustificado en las PFR y la PM6M podrían incrementar la sospecha de esta entidad49. Ante la falta de estudios concluyentes para la detección de HP en pacientes con EPID, los autores de esta revisión recomiendan realizar espirometría forzada y DLCO anuales y progresar a ETT y medición de BNP/NT-proBNP únicamente en caso de sospecha clínica (fig. 3).
Algoritmo de cribado en hipertensión pulmonar-enfermedad pulmonar intersticial difusa.
BNP: péptido natriurético cerebral; DLCO: difusión de monóxido de carbono; ETT: ecocardiograma transtorácico; NT-proBNP: fracción N-terminal de propétido natriurético cerebral; PFR: pruebas de función respiratoria; RM: resonancia magnética; TC: tomografía computarizada; TM6M: test de la marcha de 6 minutos; V/Q: ventilación/perfusión.
Dado el carácter crónico y la gravedad de la HP-EPID, estos pacientes deben recibir un apoyo psicológico adecuado50.
Se recomienda la vacunación frente a neumococo, SARS-Cov-2 e influenza en este grupo de pacientes51,52. Recomendamos igualmente la vacunación frente al virus respiratorio sincitial (VRS).
En los pacientes con HP debemos buscar e implementar el tratamiento de otros trastornos que puedan empeorar la oxigenación, incluyendo suplementación de hierro si existiera déficit8,50. Dadas las características epidemiológicas de estos pacientes es frecuente la asociación de enfermedad cardiaca, fundamentalmente las arritmias, siendo las más frecuentes el flutter y la fibrilación auricular. En estos casos se ha visto que la mejor estrategia es el control de ritmo50. Si a pesar de todas las medidas el paciente presenta una presión parcial de oxígeno<60mmHg en la gasometría arterial basal deberá iniciarse oxigenoterapia domiciliaria, así como durante la realización de vuelos8,50,51. La historia de hábito tabáquico se ha relacionado con una disminución de la supervivencia, e incluso con un empeoramiento de las RVP en modelos animales, por lo que es fundamental su abandono51.
En caso de insuficiencia cardiaca derecha se administrarán diuréticos. Para ello suelen emplearse diuréticos de asa y antagonistas de la adosterona8,50.
No se recomienda la anticoagulación oral crónica en este grupo de pacientes, salvo que esté indicada por otras razones40.
Tratamiento farmacológicoLa optimización del tratamiento de la entidad subyacente es la estrategia inicial más importante, incluyendo inmunosupresores y antifibróticos si existiera indicación.
En general, los ensayos clínicos con fármacos aprobados para la hipertensión arterial pulmonar (HAP) no han sido efectivos en la HP-EPID51. Incluso, 2 ensayos clínicos controlados tuvieron que interrumpirse por resultados desfavorables: un ensayo con riociguat (RISE IIP study) y otro con ambrisentán (ARTEMIS-IPF study), por lo que actualmente se desaconseja su uso en pacientes con HP-EPID8,51,53,54.
En ensayos con inhibidores de la fosfodiesterasa 5 (iPDE5), como sildenafilo, se han obtenido resultados controvertidos, tanto el estudio STEP-IPF como el estudio INSTAGE fallaron en alcanzar su objetivo primario, aunque se observaron beneficios limitados en otros desenlaces40,54.
El único ensayo clínico con resultados positivos hasta la fecha en pacientes con HP-EPID ha sido el estudio INCREASE, en el que se evaluó el treprostinil inhalado a dosis de 72μg 4 veces al día en pacientes con HP-EPID, observándose una mejoría en la PM6M, en la concentración de NT-proBNP y en la FVC8,35,53. Se especula si dicha mejoría es debida solo a un cambio en el lecho vascular o si podría ser por efecto antifibrótico33. Actualmente, el treprostinil inhalado solo ha sido aprobado para el tratamiento de la HP-EPID en Estados Unidos52,53. El fármaco se administra mediante un sistema de nebulización ultrasónico a pulsos, cada inhalación equivale a unos 6μg de treprostinil55. La dosis inicial es de 3 inhalaciones en 4 sesiones diarias (excluyendo horas de sueño) y se realiza una subida progresiva limitada por síntomas hasta un objetivo de 9 a 12 inhalaciones por sesión55. Los principales efectos secundarios incluyen tos, disnea, alteraciones gastrointestinales y cefalea55.
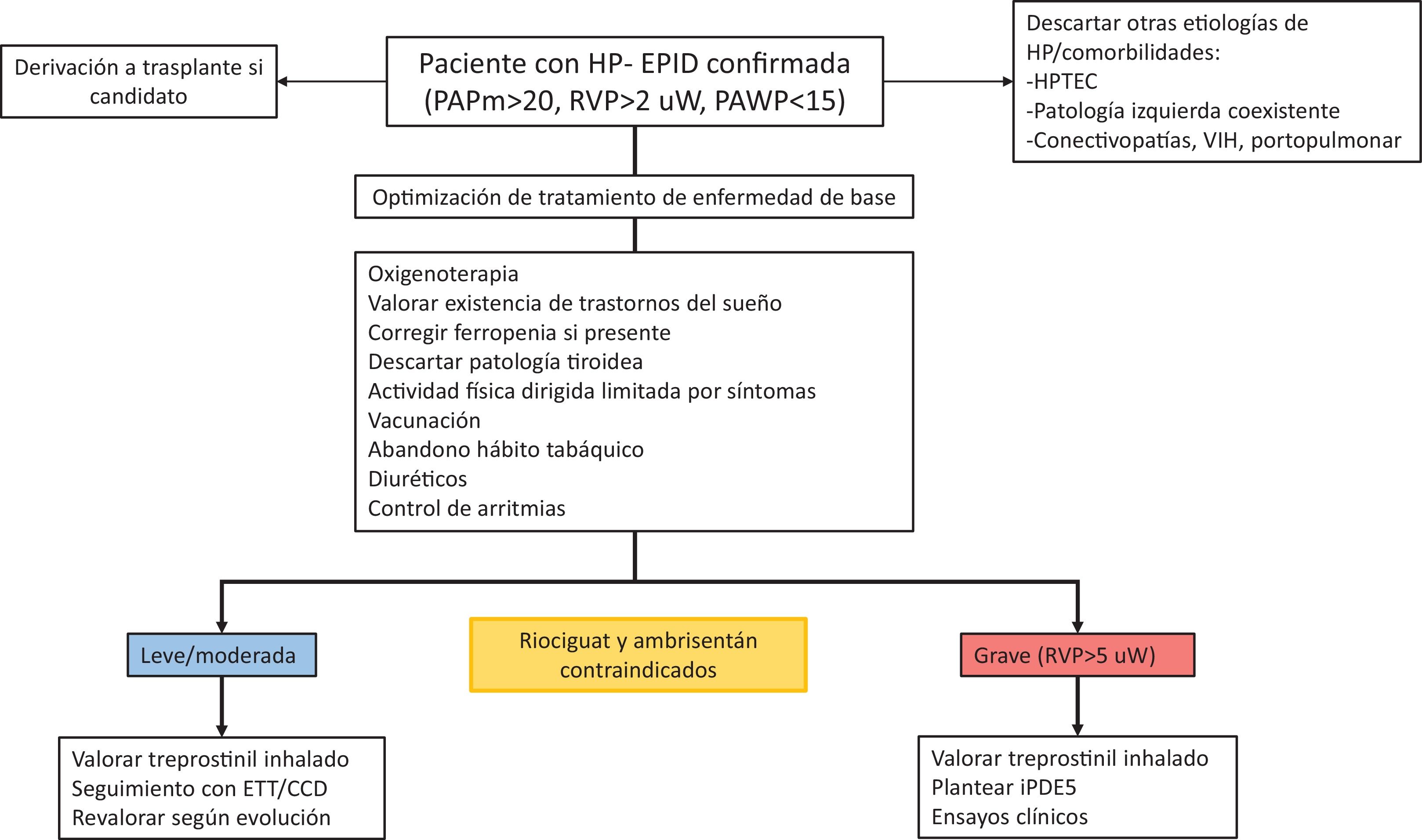
Dado que el treprostinil inhalado todavía no ha sido aprobado para el tratamiento de la HP-EPID en Europa, la guía clínica ESC-ERS recomienda que los pacientes con dicha enfermedad sean tratados en unidades expertas en HP y considerar el empleo de iPDE5 en los pacientes con HP grave (RVP>5UW)8. No se recomienda el uso de fármacos para la HAP en pacientes con HP no grave (fig. 4).
Algoritmo de manejo terapéutico en pacientes con hipertensión pulmonar-enfermedad pulmonar intersticial difusa
CCD: cateterismo cardiaco derecho; ETT: ecocardiograma transtorácico; HPTEC: hipertensión pulmonar tromboembólica crónica; iPDE5: inhibidores de la fosfodiesterasa-5; PAPm: presión arterial pulmonar media; PAWP: presión de enclavamiento pulmonar; RVP: resistencias vasculares pulmonares; UW: unidades Wood; VIH: virus de la inmunodeficiencia humana.
Dada la ausencia de alternativas terapéuticas en el grupo de pacientes con HP-EPID, en caso de fracaso ventilatorio y/o cardiocirculatorio severos recomendamos individualizar la situación, evitando la intubación orotraqueal (IOT) salvo causa reversible o paciente candidato a trasplante pulmonar56,57.
Trasplante pulmonarLa sospecha de HP por ETT o confirmada mediante CCD en un paciente con EPID es por sí mismo un criterio para inclusión en lista de espera de trasplante pulmonar, por lo que deberá ser la primera consideración a efectuar en los pacientes con HP-EPID, siempre y cuando no existan contraindicaciones absolutas40,52,58.
FinanciaciónNo hemos recibido financiación para el artículo.
Contribuciones de los autoresFrancisco León-Román y Beatriz Pintado-Cort: han contribuido por igual en la concepción, diseño y escritura del artículo; Joan Albert Barberà y David Jiménez: escritura y revisión crítica; Jacobo Sellarés-Torres, David Iturbe, Marco López-Zubizarreta, Teresa Peña-Miguel y Diego Durán-Barata: revisión.
Conflictos de interésLos autores no declaran conflictos de interés relacionados con este estudio.