Marco legal, tramitación y suministro
Los recursos terapéuticos españoles son muy amplios, pero en algún caso no son suficientes para tratar determinadas enfermedades. Se crea así un vacío terapéutico debido a que el medicamento no está comercializado en nuestro país o porque todavía no hay un tratamiento eficaz. En determinados casos, la Agencia Española del Medicamento y Productos Sanitarios (AEMyPS) puede autorizar la utilización de un medicamento en investigación o un medicamento para una indicación no contemplada en su ficha técnica, cuando se considere indispensable para un paciente concreto, mediante el procedimiento de uso compasivo de medicamentos.
Si un medicamento que no se comercializa en España está comercializado en otro país, la AEMyPS puede autorizar su importación para el tratamiento de un paciente concreto a través del Servicio de Suministro de Medicamentos Extranjeros. En otros casos más excepcionales, la AEMyPS puede autorizar la utilización de un medicamento en investigación o un medicamento para una indicación no contemplada en su ficha técnica, cuando, a partir de la bibliografía existente y bajo el criterio del médico, se considere indispensable para un paciente concreto, mediante el procedimiento de uso compasivo de medicamentos.
Definición
Se entiende por uso compasivo de medicamentos la utilización en pacientes aislados, y al margen de un ensayo clínico, de medicamentos en investigación, incluidas especialidades farmacéuticas para indicaciones o condiciones de uso distintas de las autorizadas, cuando el médico bajo su exclusiva responsabilidad considere indispensable su utilización.
El término «uso compasivo» puede llevar a confusión, ya que induce a pensar que se refiere a un tratamiento altruista, paliativo o placebo, cuando en realidad procede de la traducción literal del inglés compassionate exemption, que no se ajusta al concepto en español, en el que el término «compasivo» hace referencia a sentimientos.
El uso compasivo de medicamentos es un procedimiento restringido a casos excepcionales, pero cada vez más utilizado para el tratamiento de determinadas enfermedades para las que no hay un tratamiento alternativo eficaz. Esta vía únicamente se podrá utilizar para pacientes concretos, al margen de un ensayo clínico, bajo la responsabilidad exclusiva del médico, una vez que el paciente o su representante legal hayan dado su consentimiento y se haya obtenido la autorización de la AEMyPS. La legislación vigente también contempla que, una vez concluido un ensayo clínico, toda continuación en la administración del medicamento en investigación, en tanto no se obtenga la autorización administrativa para esas condiciones de uso, se regirá por las normas que regulan el uso compasivo.
Los principales motivos por los que se recurre al uso compasivo son:
• Desconocimiento por parte del médico de la indicación autorizada.
• Inexistencia de tratamientos eficaces para determinadas enfermedades.
• Falta de interés o dificultad para llevar a cabo ensayos clínicos para enfermedades poco frecuentes o con determinados grupos de población, como niños o embarazadas.
Marco legal
El procedimiento de uso compasivo se encuentra regulado en dos normas:
• RD 223/2004, de 6 de febrero, por el que se regulan los ensayos clínicos con medicamentos (artículos 28 y 29).
• Ley 29/2006, de 26 de julio, de Garantías y Uso Racional de los Medicamentos y Productos Sanitarios (artículo 24).
El RD de ensayos clínicos recoge la definición de uso compasivo y los requisitos necesarios para su tramitación. Por otra parte, la Ley 29/2006 establece que se determinará reglamentariamente la prescripción y la aplicación de los medicamentos no autorizados a pacientes no incluidos en un ensayo clínico con el fin de atender como uso compasivo necesidades especiales de tratamientos de situaciones clínicas de pacientes concretos. Asimismo, se establecerán las condiciones para la prescripción, con carácter excepcional, de medicamentos autorizados cuando se utilicen en condiciones distintas a las autorizadas.
Actualmente, el Ministerio de Sanidad y Consumo está trabajando en la redacción de un texto legal que regule los distintos aspectos relacionados con el uso compasivo y responda a las distintas cuestiones planteadas en las solicitudes y que la legislación actual no aclara.
El uso compasivo es el marco legal del que dispone el médico para poder utilizar, fuera de un ensayo clínico, un medicamento en condiciones de uso distintas a las reflejadas en su ficha técnica, la que revisa y autoriza la AEMyPS. El hecho de no hacerlo de este modo puede provocar efectos adversos graves para los pacientes y consecuencias legales para el médico. Sin embargo, en la práctica clínica diaria se detectan muchos casos en los que se prescribe un medicamento para una indicación no autorizada, basados generalmente en las últimas publicaciones de resultados satisfactorios obtenidos en estudios científicos novedosos o la asistencia a congresos. Las causas por las que no se solicita el uso compasivo principalmente son:
• Desconocimiento de los trámites legales por parte de los profesionales sanitarios.
• Rechazo a la burocracia de la solicitud.
• Falta de una normativa que aclare las lagunas existentes con la legislación actual (p. ej., ¿qué centros pueden solicitar la autorización, hospitales, centros de salud, consultas privadas con depósito de medicamentos vinculado a una oficina de farmacia? ¿Para qué enfermedades? ¿Qué medicamentos?).
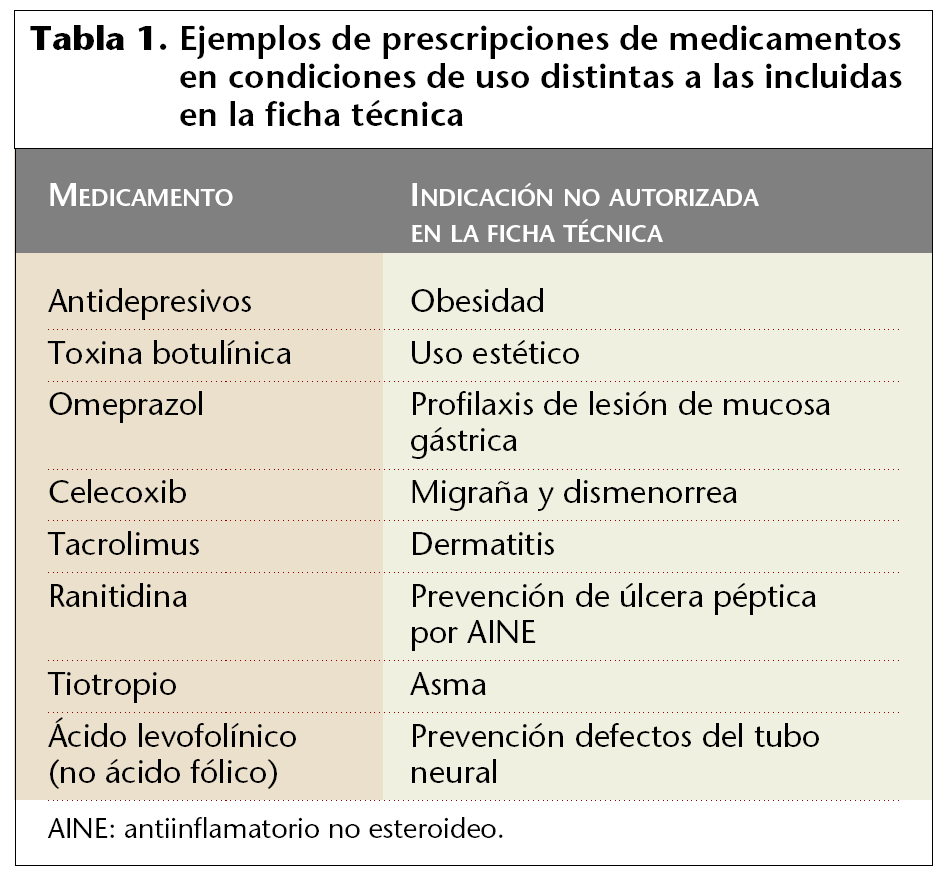
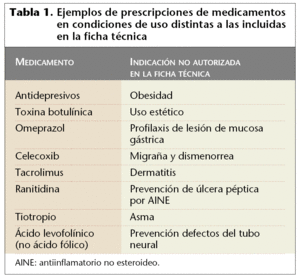
En la tabla 1 se señalan algunos ejemplos de prescripciones de medicamentos en condiciones de uso distintas a las incluidas en la ficha técnica.
Todos ellos son tratamientos no autorizados y, por tanto, si no se administran por la vía del uso compasivo y durante el tratamiento se reprodujera un efecto adverso para el paciente, el médico prescriptor no tendría amparo legal, ya que el laboratorio farmacéutico sólo se haría responsable en los casos que el medicamento se hubiera prescrito en las indicaciones señaladas en su ficha técnica.
Tratamientos autorizados como uso compasivo
En España no hay ninguna ley que regule qué medicamentos o enfermedades pueden beneficiarse del uso compasivo, si bien las enfermedades tienen que tener la entidad suficiente como para justificar el posible riesgo que se corre con productos que aún no han finalizado sus ensayos clínicos o, en el caso de solicitarse para otras indicaciones que no sean las autorizadas, carecen de estudios suficientes que avalen su eficacia.
Los pacientes que se acogen a estos tratamientos pueden acceder a los últimos avances terapéuticos, aunque todavía no estén comercializados, lo que en muchos casos permite prolongar su supervivencia o mejorar su calidad de vida, tal y como ocurre con los pacientes oncológicos, los afectados por el virus de la inmunodeficiencia humana adquirida o los que presentan alguna de las enfermedades denominadas «huérfanas».
Este tipo de tratamientos se utiliza básicamente en el ámbito hospitalario, principalmente en las especialidades de pediatría, oncología, psiquiatría y cuidados paliativos. En la atención primaria, su autorización no está tan justificada, debido al gran número de medicamentos disponibles en el mercado.
Otros campos en los que se está proponiendo el uso compasivo es el de los trastornos adictivos. Los resultados satisfactorios obtenidos en ensayos de uso controlado de heroína para tratar a pacientes dependientes a opiáceos, llevados a cabo en distintos países, avalan y añaden más evidencia científica a este tipo de tratamientos. Así, en 2003, la Generalitat Valenciana reguló esta modalidad en su comunidad autónoma, señalando que se fomentará el uso compasivo de medicamentos agonistas, incluidos los que dieron lugar a la adicción, siempre que los tratamientos sustitutivos con opiáceos u otros fármacos con demostrada eficacia clínica no obtuvieran efectos positivos para el paciente. Para ello debe haber evidencia científica de su utilidad terapéutica constatada por los organismos internacionales competentes, ensayos clínicos favorables realizados en muestras españolas, y obtener las autorizaciones correspondientes.
A continuación, se señalan algunos de los tratamientos autorizados por la AEMyPS mediante uso compasivo en los últimos años, si bien actualmente algunos de ellos ya tienen la indicación aprobada, como es el caso del erlotinib:
• Temozolamida (Temodal): metástasis cerebrales de adenocarcinoma de pulmón.
• Cetuximab (Erbitux): tumores de cabeza y cuello.
• Bevacizumab (Avastin): cáncer de colon, pulmón y mama.
• Erlotinib (Tarceva): cáncer pulmonar, riñón y páncreas.
• Trastazumab (Herceptin): fases no avanzadas de tumor de mama.
• Gefitinib (Iressa): cáncer de pulmón no microcítico avanzado.
• Talidomida (Talidomida Pharmion): mieloma múltiple.
• Octreótido (Sandostatín): ascitis quilosa.
• Interferón alfa-2a pegilado (Pegasys): hepatitis B.
• Toxina botulínica (Botox): hipertonia esfinteriana.
• Ciclosporina (Sandimmun): síndrome mieloproliferativo.
Tramitación
La solicitud para la autorización de un medicamento como uso compasivo se tramitará a través de los servicios de farmacia (generalmente del ámbito hospitalario, pero la legislación no lo aclara) e irá dirigida a la Subdirección General de Medicamentos de Uso Humano de la AEMyPS, acompañada de la documentación siguiente:
Consentimiento informado del paciente
El médico responsable será quien obtenga el consentimiento informado del paciente. Para ello, le entregará una hoja de información al paciente que incluirá información relevante, expresada en términos claros y comprensibles para el paciente, sobre una serie de aspectos del tratamiento (tabla 2).
En los casos de pacientes menores de edad y adultos incapaces para dar el consentimiento, éste lo otorgará su representante legal, tras haber recibido y comprendido la hoja de información. Cuando las condiciones del paciente lo permitan, en el caso de adulto con incapacidad y siempre que los menores tengan más de 12 años, deberán prestar además su consentimiento para recibir el tratamiento.
Informe del médico en el que justifique la necesidad del tratamiento
Este informe incluirá: los tratamientos utilizados anteriormente, el motivo de no poder administrar otros tratamientos alternativos si los hubiera, bibliografía existente, datos de eficacia, resultados obtenidos en otros estudios, las fases de investigación clínica en la que se encuentra y, en caso de que se estuviera realizando un ensayo clínico autorizado con este medicamento, los motivos por los que no se puede incluir el paciente en este estudio.
Consentimiento del director del centro en el que se va a llevar a cabo el tratamiento
En el caso de Extremadura, esta conformidad la concede la Comisión de Uso Compasivo de Medicamentos creada a tal efecto, mediante la Orden de 13 de febrero de 2006. Esta comisión está adscrita a la Dirección General de Asistencia Sanitaria del Servicio Extremeño de Salud y, una vez otorgue la conformidad, la Dirección General dará traslado a la AEMyPS de la solicitud.
Otros requisitos
Adicionalmente, la AEMyPS podrá solicitar requisitos específicos en función del perfil de toxicidad del medicamento para el que se solicita el uso compasivo, tal es el caso de la talidomida, para el que se exige un examen neurológico y hematológico del paciente y la realización de un programa de gestión de riesgos establecido por el laboratorio suministrador.
Valorada la solicitud, si se estima conveniente, la AEMyPS procederá a autorizar el uso compasivo de ese medicamento, que sólo podrá administrarse a ese paciente en concreto y para la enfermedad para la que se ha aprobado el uso compasivo. El tiempo que tarda la AEMyPS en tramitar estas solicitudes es de 10-15 días.
Suministro
Una vez obtenida la autorización de la AEMyPS, el servicio de farmacia procederá a adquirir el medicamento, y pueden darse dos situaciones:
• Medicamento comercializado en España. El servicio de farmacia realizará la petición al laboratorio suministrador y procederá a la dispensación al paciente.
• Medicamento no comercializado en España. El servicio de farmacia realiza el pedido al laboratorio suministrador, que solicitará la autorización para la importación del medicamento al servicio de suministros de medicamentos extranjeros de la AEMyPS, e indicará que se utilizará como uso compasivo. El laboratorio, una vez obtenga esta autorización, remitirá el medicamento junto con la factura directamente al hospital.
Actualmente, no se requiere solicitar a la AEMyPS autorización de ampliación de un tratamiento inicial previamente autorizado, en caso de que fuera necesario continuar con él. El médico responsable deberá realizar un estricto seguimiento del paciente, ya que tendrá que comunicar a la AEMyPS los resultados del tratamiento, así como las sospechas de reacciones adversas que puedan ser debidas a éste.
Consideraciones finales y conclusión
El uso compasivo y los ensayos clínicos son las herramientas legales de las que dispone el médico para administrar medicamentos no autorizados o en condiciones de uso distintas de las incluidas en su ficha técnica.
La principal ventaja del uso compasivo es que permite a determinados pacientes, por el tipo de enfermedad que presentan o por la gravedad de su estado, que se beneficien de los últimos avances farmacológicos, incluso antes de superar todos los trámites administrativos necesarios para su comercialización, siempre que haya evidencia científica que avale su eficacia y seguridad para la indicación para la que se solicita su uso. Sin embargo, el uso compasivo se debe limitar únicamente a los pacientes para los que pueda obtenerse un beneficio clínico y que no cumplan los criterios de inclusión del ensayo clínico correspondiente. No se debe recurrir a esta vía como alternativa a la realización de ensayos clínicos, ya que el uso compasivo no supone un medio de evaluación de un medicamento ni permite obtener datos de su eficacia. Por tanto, siempre que haya suficientes datos que indiquen la eficacia de un medicamento para el tratamiento de una enfermedad, pero no esté suficientemente contrastada o no se haya demostrado de forma concluyente, se debería llevar a cabo un ensayo clínico, única herramienta válida reconocida para garantizar la calidad, la seguridad y la eficacia de un medicamento.
Bibliografía general y notas
García Campello I. Consideraciones legales y bioéticas sobre uso compasivo de medicamentos. Trabajo práctico del curso de especialista en derecho sanitario y bioética. 2005.
Ley 29/2006, de 26 de julio, de Garantías y Uso Racional de los Medicamentos y Productos Sanitarios (BOE, nº 178, 27 de julio de 2006).
Monedero MA. Uso compasivo. En: Suñé JM, Bel E. Formación Continuada para Farmacéuticos de Hospital. Libro del residente. Barcelona: Ferrer Grupo; 2001. p. 109-16.
Muruzabal L. Medicamentos extranjeros y uso compasivo de medicamentos. Boletín de Información Farmacoterapéutica de Navarra. 2005;13:20-4.
Oficio de 12 de febrero de 1992, de la Dirección General de Farmacia y Productos Sanitarios.
Orden, de 13 de febrero de 2006, por la que se crea y regula la Comisión de Uso Compasivo de Medicamentos en el ámbito de la Comunidad Autónoma de Extremadura (DOE n.º 25; 28 de febrero de 2006).
Perancho I. Enfermos privilegiados. El Mundo. Suplemento de Salud n.º 633. 8 de octubre de 2005.
RD 223/2004, de 6 de febrero, por el que se regulan los ensayos clínicos con medicamentos (BOE, nº 33, 7 de febrero de 2004).