Entre las reacciones graves a los medicamentos cabe señalar las miopatías, en algunos casos transitorias y leves, sin grandes repercusiones clínicas, pero en otros --más bien excepcionales-- susceptibles de tener consecuencias clínicas muy graves al evolucionar a rabdomiolisis y fallo renal. En este artículo se explicarán las posibles intervenciones farmacéuticas en este campo, centrando la atención en las miopatías secundarias al tratamiento con fármacos diferentes a las estatinas.
El Sistema Español de Farmacovigilancia de Medicamentos de uso Humano (SEFV-H) enfoca las sospechas de reacciones adversas a los medicamentos (RAM) en tres direcciones: medicamentos «nuevos», reacciones «graves» y las originadas por «interacciones». Desde la atalaya de observación privilegiada que es la oficina de farmacia, el farmacéutico interviene en las situaciones a las que alude el SEFV-H; pero además interviene en otras muchas situaciones a demanda de los pacientes, ante problemas relacionadas con «medicamentos de siempre» y en reacciones inicialmente «no graves». Asimismo, las interacciones entre medicamentos son cada vez más frecuentes como resultado del mayor número de tratamientos concomitantes y de larga duración, en especial en ancianos, al incrementarse notablemente el riesgo de interacciones fármaco-fármaco por un peor funcionamiento de los sistemas enzimáticos de metabolización conforme avanza la edad. Entre las reacciones adversas se encuentran las miopatías.
Los profesionales sanitarios recordarán como en 2001 la empresa Bayer se vio obligada a retirar Lipobay (en otros países Baycol), al comprobarse que su principio activo, la cerivastatina (estatina de tercera generación, que actúa como potente reductor de la hipercolesterolemia al disminuir drásticamente los niveles plasmáticos de la fracción LDL del colesterol), producía rabdomiolisis fatales en monoterapia, pero con mayor frecuencia en terapia combinada para el tratamiento de dislipemias mixtas cuando algunos médicos asociaron su prescripción con gemfibrozilo, utilizado como reductor de la hipertrigliceridemia1. Posiblemente este caso es solamente la punta del iceberg de situaciones farmacológicas mucho más frecuentes, para las que el farmacéutico tiene que estar preparado llevando a la práctica diaria una atención farmacéutica de calidad, que vele por la seguridad de la medicación. Muchos de los nuevos fármacos, al igual que las estatinas, son potentes y selectivos inhibidores enzimáticos, cuyas RAM originan en ciertos pacientes algún tipo de miopatía.
Miopatías y rabdomiolisis
Las miopatías pueden producirse tanto por miotoxicidad crónica, tal como se ha observado en pacientes tratados durante años con cloroquina2, como por miotoxicidad aguda, que se produce a las pocas horas de instaurar un nuevo tratamiento farmacológico.
La prevención de miopatías es posible mediante la identificación de los pacientes de riesgo gracias a una adecuada información sanitaria y practicando la conveniente atención farmacéutica3.
La atención médica posterior debe valorar la continuidad o exclusión del tratamiento, con frecuencia mediante un seguimiento seriado de los niveles plasmáticos de creatininfosfoquinasa (CPK). Esta práctica es recomendable, ya que al inicio de algunos tratamientos se origina, con frecuencia, un aumento moderado, pero transitorio, de los niveles plasmáticos de CPK.
El proceso, que va desde un simple daño muscular origen de una miopatía, pasando por rabdomiolisis, hasta la muerte por fallo renal, es un camino que puede ser muy corto, como los casos descritos de miotoxicidad aguda producida tras la ingestión de una primera y única dosis de cocaína4, 5, o suficientemente largo como para que, con la intervención sanitaria adecuada, el desenlace no sea fatal.
Tal como señalan Law y Rudnicka6, los términos miopatía y rabdomiolisis describen casos más o menos graves de un mismo tipo de lesión muscular. La rabdomiolisis se caracteriza, entre otros aspectos clínicos, por mioglobinuria.
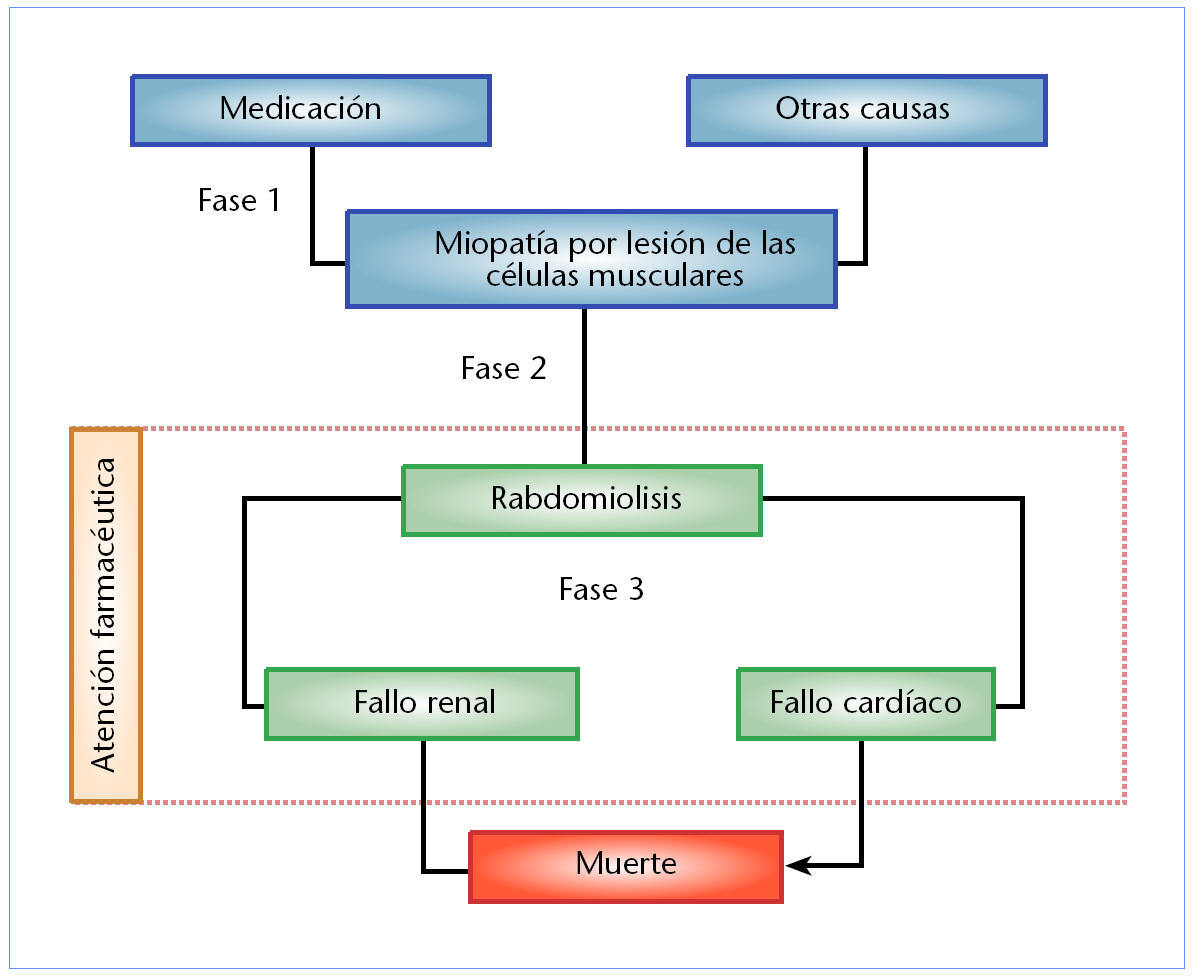
La figura 1 esquematiza el probable proceso evolutivo que media entre el daño muscular y un fallo renal producido por rabdomiolisis. Se señalan también las posibilidades que tiene el farmacéutico para intervenir en dicho proceso mediante atención farmacéutica y seguimiento farmacoterapéutico3.
Fig. 1. Proceso evolutivo de una miopatía grave y posibilidad de intervención farmacéutica.
Se han propuesto distintos mecanismos que pueden estar en el origen patológico de las miopatías y de la rabdomiolisis. En el caso de las miopatías que tienen su origen en tratamientos con estatinas, se atribuyó inicialmente a una deficiencia excesiva de colesterol7. La inhibición de la síntesis hepática del colesterol mediante bloqueo de la enzima HMG-CoA reductasa, involucrada en la síntesis del ácido mevalónico, precursor del colesterol, puede producir una deficiencia de este lípido en la pared de la célula muscular, que a su vez causa el debilitamiento y la destrucción del sarcolema.
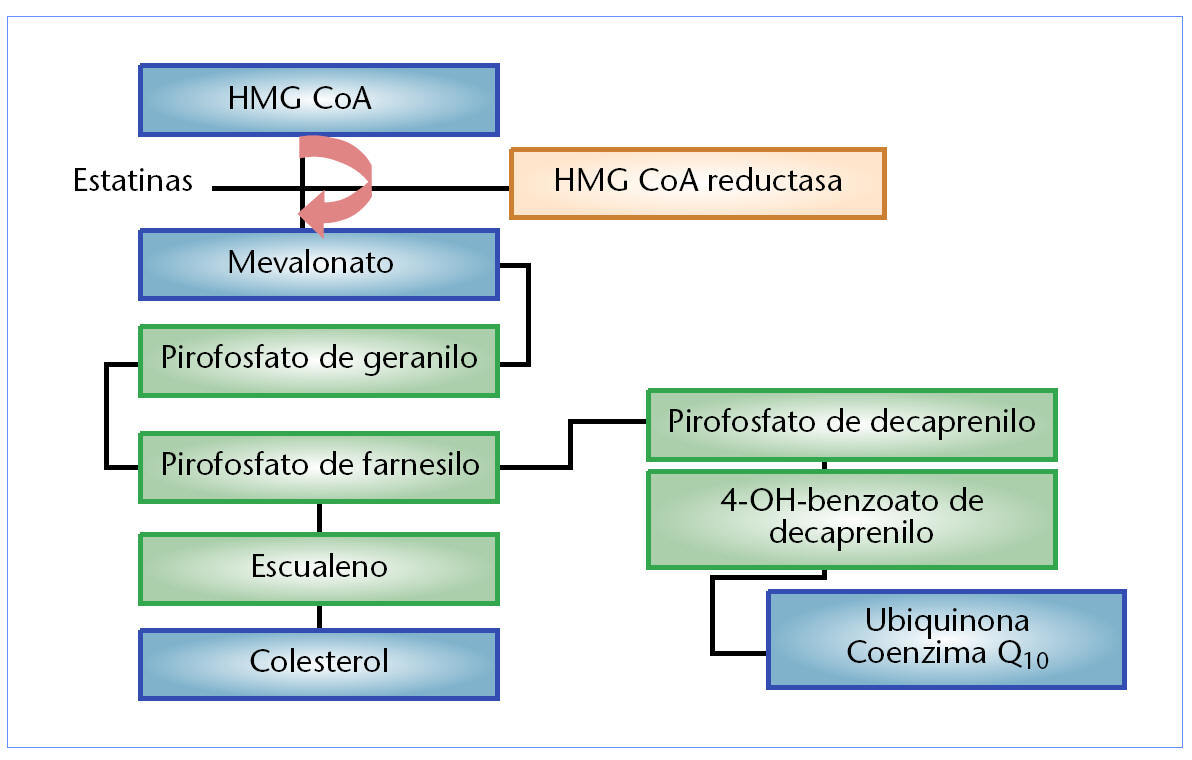
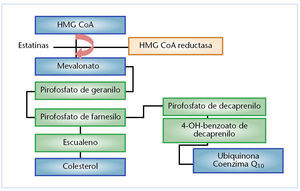
Sin embargo, más recientemente8 se ha señalado que el ácido mevalónico es también un precursor de pirofosfato de farnesilo, y este a su vez es un metabolito intermedio en la biosíntesis del coenzima Q10 o ubiquinona. La figura 2 muestra las vías metabólicas que relacionan la biosíntesis del colesterol y de la ubiquinona, señalando la acción de las estatinas como inhibidores competitivos específicos del enzima HMG-CoA reductasa. La ubiquinona es una sustancia que desempeña un papel predominante en la función mitocondrial relacionada con la obtención de la energía celular. Además es un transportador de electrones y protones necesario para la síntesis del ATP en la membrana mitocondrial interna y también para estabilizar la membrana celular preservando su integridad y función.
Fig. 2. Modo de acción de las estatinas en la biosíntesis del colesterol y de la ubiquinona.
Muchas de las miopatías producidas por fármacos, drogas, etc., tienen su origen, al parecer, en alteraciones en la cadena respiratoria mitocondrial y en la fosforilación oxidativa. Este defecto rara vez se circunscribe como daño al músculo esquelético, sino que puede afectar a cualquier otro tejido, por lo que también se utiliza el término más general de citopatías mitocondriales9. Sin embargo las manifestaciones clínicas se expresan principalmente en tejidos con gran dependencia energética del metabolismo oxidativo, como el músculo estriado, cerebro, miocardio, hígado o riñón.
Algunos fármacos, como la cloroquina, pueden actuar como neuromiotoxinas, afectando a nervios y músculos esqueléticos y cardíacos, además de a otros órganos y tejidos, como la retina. La toxicidad de la cloroquina se debe a la acumulación de fosfolípidos y residuos glicosílicos, lo que origina una miopatía necrosante-vacuolar que se puede observar en la biopsia del músculo.
De entrada hay que señalar que tanto las miopatías, como la rabdomiolisis consecuente, pueden estar originadas por causas muy diferentes, muchas heredadas y otras adquiridas. Entre las adquiridas cabe citar: medicamentos, drogas de abuso (alcohol, cocaína, anfetaminas, etc.), trastornos metabólicos (hipopotasemia, cetoacidosis), intoxicaciones (monóxido de carbono), infecciones víricas y bacterianas graves, cirugía mayor, traumatismos graves, quemaduras, e incluso ejercicio físico excesivo10.
Práctica desde la oficina de farmacia
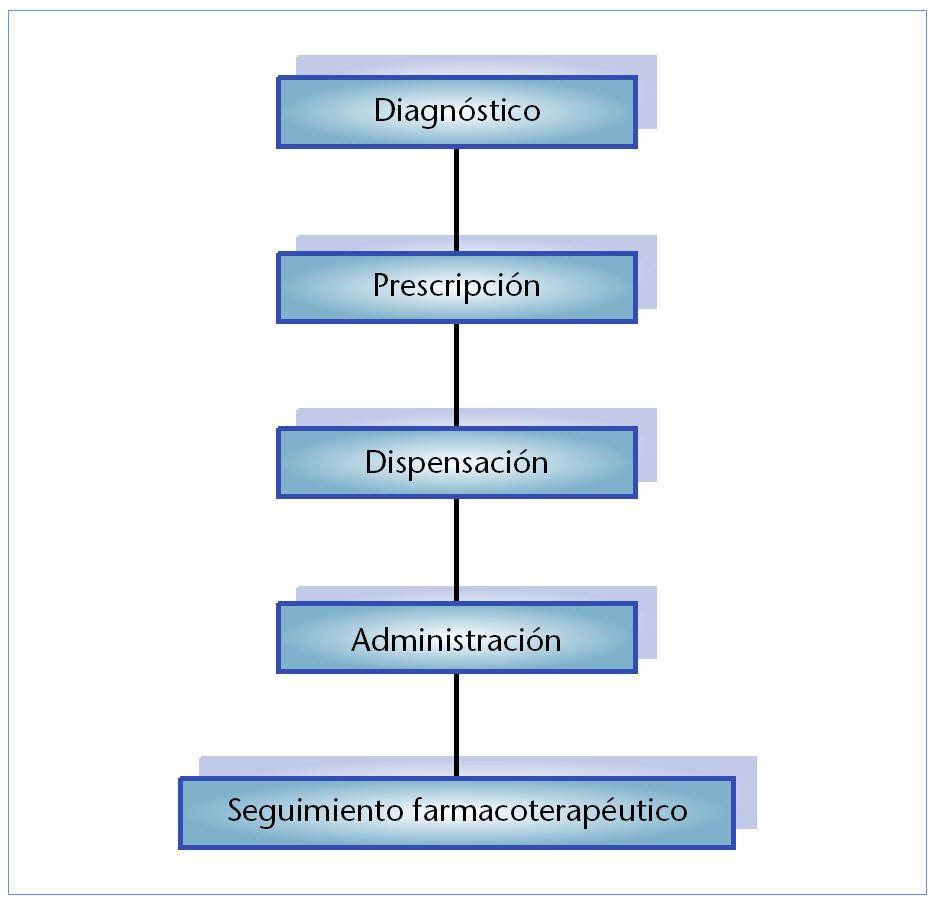
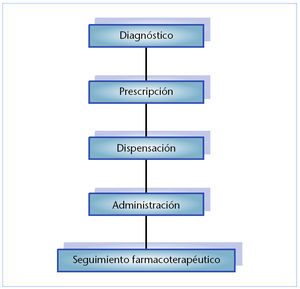
Generalmente se considera en cualquier tratamiento medicofarmacológico la cadena de acontecimientos que se muestra en la figura 3. La atención farmacéutica se vincula con los tres eslabones últimos de la citada cadena con la finalidad de hacer más eficaz y seguro el tratamiento farmacológico. La utilización de medicamentos para prevenir, tratar, aliviar o curar enfermedades implica siempre un acto de decisión que involucra la valoración entre beneficio y riesgo, incluso para aquellas especialidades que han superado los más rigurosos controles analíticos y farmacotoxicológicos.
Fig. 3. Atención farmacéutica en las miopatías relacionadas con la administración de fármacos.
La enorme actividad biológica de los fármacos actuales entraña un riesgo ineludible: su toxicidad, con sus efectos laterales y secundarios. En este sentido, una atención farmacéutica adecuada puede minimizar los efectos de los procesos relacionados con el daño muscular cuando este es consecuencia de la administración de fármacos, principalmente por medio de tres tipos de intervención del farmacéutico:
• Informar al paciente o a su familia de los efectos adversos relacionados con la miotoxicidad de algunos medicamentos, de modo que si se producen estén prevenidos.
• Dirigir al paciente a su médico de atención primaria, en caso de que el farmacéutico sospeche, por los síntomas referidos, una lesión importante de las células musculares.
• Dirigir al paciente directamente a los servicios de urgencias, en caso de que el paciente describa síntomas de rabdomiolisis.
Fase 1: dispensación activa
La palabra miopatía significa enfermedad del tejido muscular. Se trata de una enfermedad que origina problemas con el tono y contracción de los músculos del esqueleto que controlan los movimientos voluntarios. La debilidad, la rigidez muscular (llamada miotonía), las mialgias y la miositis son síntomas de daños o lesiones de las células musculares que pueden tener diferentes grados de severidad y un gran número de causas, pero que, con frecuencia, los pacientes comentan con el farmacéutico tras la instauración de un nuevo tratamiento. Sin embargo, el farmacéutico puede o debe intervenir en una etapa anterior, que podemos considerar como fase 1 de atención farmacéutica en la dispensación activa.
Tal como se reconoce en el trabajo de Sirvent et al11, los médicos tienen que ser cautelosos cuando prescriben fármacos de nueva generación que se presentan con menos interacciones teóricas, pero que pueden resultar igualmente peligrosos. Una vez sentada la indicación terapéutica correcta, se debería informar a los pacientes sobre la aparición de dolor o debilidad muscular para que consulten de forma temprana y se adopten las medidas oportunas. Estos autores insisten en que la miotoxicidad grave debería prevenirse mediante la monitorización periódica de la CPK y la corrección de los posibles factores que pudieran favorecerla.
En la dispensación activa, el farmacéutico debe saber si el nuevo tratamiento puede implicar cierto riesgo de miopatía secundaria a la administración de fármacos, considerando los factores personales que predisponen a un mayor riesgo identificando si el paciente tiene alguna predisposición especial por antecedentes clínicos, insuficiencia renal, enfermedad hepática, tratamientos concomitantes con otros medicamentos, etc. (tabla 1).
Del mismo modo, es importante tener en mente, además de las estatinas y de los fibratos, aquellos medicamentos a los que se ha asociado con más frecuencia algún tipo de miopatía, tales como corticoides, ciclosporina, zidovudina, cloroquina, amiodarona, colchicina, vincristina, D-penicilamina, tiopronina, etc. (tabla 2).
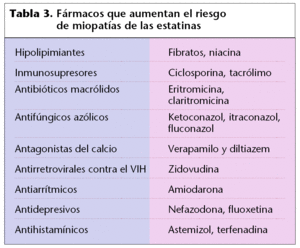
Por lo que se refiere a la polimedicación, los riesgos descritos más frecuentemente se vinculan a enfermos que siguen tratamientos con estatinas. Hay que destacar un mayor riesgo cuando, junto a las estatinas, se administran algunos fármacos de uso frecuente, como el citado gemfibrozilo, algunos antibióticos macrólidos (eritromicina, claritromicina, etc.), antifúngicos azólicos, antihistamínicos (astemizol, terfenadina, etc.), antidepresivos (fluoxetina, nefazodona), antagonistas del calcio (diltiazem, verapamilo), inmunosupresores (ciclosporina), antiarrítmicos (amiodarona), inhibidores de la transcriptasa inversa del VIH, etc. (tabla 3).
El farmacéutico puede saber con facilidad si el médico ha advertido al paciente de los posibles efectos adversos y complementar la información que aquél pudiera haberle dado. Sin alarmar al paciente, éste o su familia deben saber que los primeros días o semanas del tratamiento puede experimentar reacciones como debilidad o rigidez muscular, dolores musculares persistentes, micciones anaranjadas u oscuras, etc. Debe tener conocimiento, asimismo, de que, en caso de persistir, deberá consultar al médico de atención primaria para que este, o en su caso el especialista, valoren mediante seguimiento bioquímico y clínico la continuidad o la suspensión del tratamiento, o la instauración de una terapia alternativa.
Se ha sugerido, al menos en ciertas miopatías, la existencia de predisposición genética individual12. Es un hecho contrastado que hay variaciones muy importantes en la susceptibilidad interindividual de las RAM relativas al binomio estatinas-miopatía, posiblemente13, 14 en lo que afecta a su metabolización hepática por sobresaturación o inhibición del proceso oxidativo de eliminación, en el que intervienen isoenzimas del citocromo P450, identificadas como 3A4. Este sería el mecanismo por el que aumentan el riesgo de miopatías de las estatinas fármacos como amiodarona, diltiazem, itroconazol, verapamilo, etc., al ser igual que las estatinas sustratos de dicha enzima. Otros fármacos, sin embargo, actúan por inhibición del referido citocromo P450 3A4. Es el caso de eritromicina, ciclosporina, tacrólimo, itroconazol, etc.
La dotación genética de un individuo, o mejor de un grupo de individuos, se expresa fenotípicamente en la estructura, configuración y concentración de sus proteínas, de modo que éstas, al estar implicadas en diversos tipos de interacciones con los fármacos, condicionan la respuesta farmacológica, incluso con dosis de fármacos consideradas normales y, por tanto, seguras. La aparición de efectos tóxicos sólo en algunos individuos se puede atribuir a determinados factores genéticos. Los conocimientos actuales de farmacogenética9, 15 indican que los avances en este campo pueden, en un futuro próximo, identificar correctamente a los individuos de riesgo y seleccionar aquellos medicamentos más apropiados para un paciente concreto. Ello se conseguiría al identificar los genes, alelos, polimorfismos genéticos particulares, etc., que codifican las proteínas involucradas en cada terapia y su nivel de expresión en la síntesis de las mismas.
Fase 2: identificación de las causas
Los especialistas, antes de instaurar un tratamiento con estatinas, suelen preguntar a sus pacientes si presentan o tienen antecedentes de algunos de los síntomas relacionados con las miopatías, no sólo dolor, sino debilidad y/o agarrotamiento muscular. Ello les sirve para seleccionar con mejor conocimiento de causa la estatina y para que, una vez instaurado el tratamiento, el paciente se comunique con él si observa alguno de estos síntomas.
En el tratamiento con otros fármacos, la sensibilización de médicos, farmacéuticos y pacientes no es la misma, a pesar de que la miopatía inducida por fármacos es relativamente frecuente y en ella se han implicado gran cantidad de sustancias. En cualquier caso, al farmacéutico sus clientes le hacen, con relativa frecuencia, comentarios del tipo: «desde que estoy tomando tal medicamento me duelen, se me agarrotan o siento debilidad en los brazos, piernas, etc.». Algunos pacientes incluso subrayan que cuando los han dejado de tomar desaparecen las molestias.
La atención farmacéutica se debe orientar en esta fase a asegurarse de si la miopatía tiene, o no, un origen medicamentoso, e identificar en su caso el/los medicamento/s que pueden causarla; definir adecuadamente el tipo de problema relacionado con los medicamentos, normalmente de seguridad cualitativa o cuantitativa; comunicar con el médico y, si procede, informar al paciente. Es necesario que el paciente busque asistencia médica inmediata cuando:
• Las molestias musculares persisten durante días.
• El dolor es intenso e inexplicable.
• Las molestias musculares han sido asociadas con el comienzo o el cambio de dosis de un medicamento, en particular estatinas.
• El paciente experimenta debilidad muscular o incapacidad para mover alguna parte del cuerpo.
• Presenta dificultad para respirar o deglutir.
En algunos casos, la debilidad muscular reseñada por los pacientes limita la capacidad laboral y social, pero rara vez impide la deambulación o afecta a la musculatura respiratoria. El diagnóstico médico posterior se realiza midiendo los niveles séricos de las enzimas musculares, generalmente CPK, observando alteraciones electromiográficas sugestivas de miopatía y/o demostrando cambios histológicos de los músculos afectados. Una ventaja de este tipo de miotoxicidad es que el cuadro de molestias musculares remite, generalmente sin secuelas importantes, al eliminar el factor tóxico responsable. Puede ocurrir que, a la retirada del fármaco, la regresión de la sintomatología sea incompleta y, excepcionalmente, se han dado casos de muerte por daño cardíaco irreversible tras un diagnóstico correcto y la retirada del fármaco.
El farmacéutico puede saber con facilidad si el médico ha advertido al paciente de los posibles efectos adversos y complementar la información que aquél pudiera haberle dado.
Recientemente18 Guis, Mattéi y Lioté han realizado una revisión muy completa de los fármacos que inducen miopatías, resaltando los utilizados en tratamientos reumatológicos. En la tabla 2 se recogen los principales fármacos para los que se han descrito algún tipo de miopatía y en la tabla 4 se hace referencia a las principales miopatías causadas por fármacos.
No se incluyen en dichas tablas, por su ámbito de utilización exclusivo, los fármacos anestésicos utilizados durante intervenciones quirúrgicas. Como es sabido, en ocasiones, ciertos anestésicos inhalados (como el halotano) y ciertos miorrelajantes musculares (como la succinilcolina) causan un síndrome muy grave conocido por hipertermia maligna, caracterizado por un aumento de la temperatura del cuerpo, contracciones musculares y rabdomiolisis. Las personas que ya sufren algún tipo de miopatía hereditaria por defectos en los canales de iones presentan mayor riesgo de sufrir este tipo de reacciones.
Fase 3: actuación
El término rabdomiolisis designa un síndrome biológico cuya presentación clínica es extremadamente variable. Generalmente cursa con debilidad muscular, mialgias, edema muscular, rigidez, calambres y emisión de orina de color naranja o rojo-oscura, de color coca-cola o café, debido al contenido de mioglobina (mioglobinuria) en ausencia de hematuria. El color se debe a la mioglobina o a algún producto de su oxidación. En 1982 se propuso como indicativo de rabdomiolisis toda determinación de la CPK sérica que supere en cinco veces sus niveles los normales en pacientes cuya elevación de la CPK no sea atribuible a enfermedad cardíaca o cerebral. Esta definición comprende no sólo las rabdomiolisis debidas a necrosis muscular, sino también las debidas a miopatías, tanto tóxicas como inflamatorias, e incluso a determinadas fases de las distrofias.
Actualmente se reserva el término rabdomiolisis-mioglubinuria para los casos en los que mialgias y debilidad muscular van acompañadas de mioglubinuria y elevación de los enzimas musculares CPK más de 50 -100 veces su valor normal. En ocasiones el enfermo entra rápidamente en un estado comatoso, y surgen complicaciones asociadas como fallo renal agudo, hiperpotasemia, acidosis metabólica, etc. La lista de causas posibles de esta situación clínica es muy grande, pero se suelen clasificar en hereditarias y adquiridas (tabla 5), aunque hay otras clasificaciones (endógenas y exógenas, traumáticas y no traumáticas).
Desde el punto de vista de la atención farmacéutica, interesa señalar que el farmacéutico debe estar especialmente sensibilizado con este problema ya que, aunque sea infrecuente su aparición como efecto adverso de una medicación bien pautada, se puede producir como consecuencia de la administración de fármacos, por interacciones medicamentosas o de drogas y medicamentos. Se han descrito algunos casos de rabdomiolisis tras ejercicio intenso en personas portadoras del rasgo drepanocítico o falciforme9.
El farmacéutico debe actuar de inmediato remitiendo al paciente a un servicio de urgencias hospitalario en el caso de que razonablemente sospeche, por los síntomas descritos, que aquel puede presentar un cuadro de rabdomiolisis. La debilidad muscular prolongada puede ser un indicador determinante. La posible gravedad de la situación aconseja tomar medidas rápidas, especialmente porque el fallo renal agudo que suele seguir a la rabdomiolisis tiene buen pronóstico si al paciente se le instaura de forma temprana el tratamiento adecuado.
Una vez reconocido por los correspondientes servicios médicos el síndrome de rabdomiolisis mediante pruebas de laboratorio (hiperpotasemia, hiperfosfatemia, hipo o hipercalcemia, hiperuricemia, elevación de la urea, creatinina y enzimas musculares en el suero, etc.), se trata al enfermo con el objetivo principal de mantener sus funciones vitales. Se trata de prevenir el desarrollo de insuficiencia renal mediante hidratación y alcalinización de la orina. Si se produce fallo renal se practica diálisis y, en ocasiones, plasmaféresis, puesto que es la mioglobina la causante de daño renal y ésta no es dializable.
Si el paciente supera la fase aguda del fallo renal, el cuadro clínico es totalmente reversible sin que aparezcan secuelas renales graves.