Cada año aparecen unos 2 millones de casos nuevos de leishmaniosis en el mundo, por lo que esta enfermedad parasitaria constituye un importante problema de salud pública. En el presente trabajo se revisa la etiología, epidemiología, clínica, diagnóstico, tratamiento y control de la leishmaniosis.
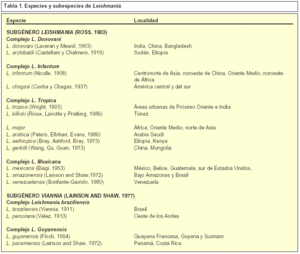
El término leishmaniosis hace referencia al conjunto de manifestaciones clínicas producidas por diversas especies del género Leishmania. Al menos existen 20 especies patógenas de Leishmania (tabla 1), que transmitidas por medio de la picadura de un mosquito flebotomo causan distintas manifestaciones clínicas en el hombre.
Etiología
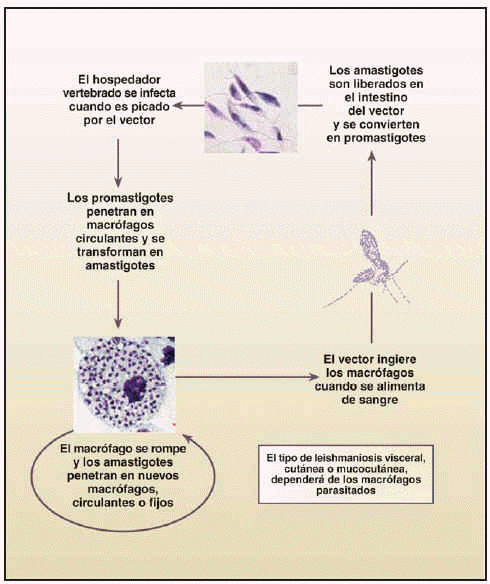
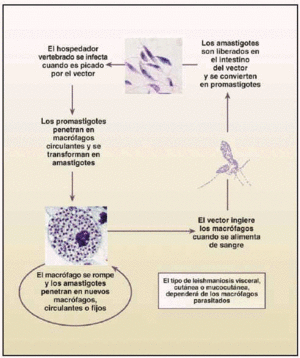
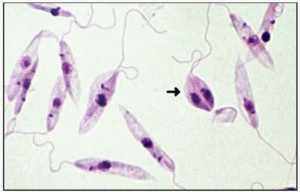
La mayor parte de las leishmaniosis son zoonosis parasitarias en las que diferentes especies de animales actúan como reservorios del parásito. En su ciclo biológico (fig. 1) se incluyen unos mosquitos, los flebotomos, también conocidos con el nombre de beatillas o moscas de los arenales. El parásito se presenta bajo dos formas: amastigote (en hospedadores vertebrados) y promastigote (en mosquitos y medios de cultivo).
Fig. 1. Ciclo biológico de Leishmania spp.
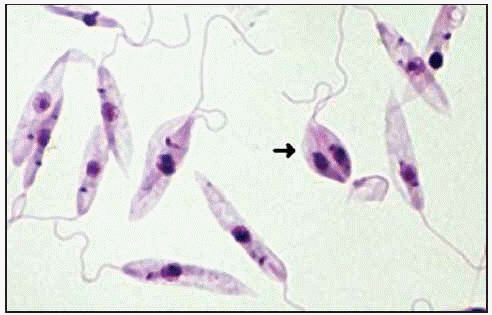
El mosquito se infecta al ingerir sangre con formas amastigote del parásito, contenidas en sangre de mamíferos. Durante 4-25 días, el parásito sigue su desarrollo y se transforma en promastigote, comenzando a dividirse por fisión binaria, aumentando su número y migrando hacia la faringe y boca, para ser inyectadas en la siguiente picadura. Después de ésta, las formas promastigote entran en contacto con la circulación sanguínea del vertebrado y son fagocitadas por células del sistema retículo endotelial, para transformarse en amastigotes y comenzar a multiplicarse también por fisión binaria, hasta que rompen la célula y quedan libres en la circulación siendo fagocitadas de nuevo y repitiéndose el ciclo en el hospedador vertebrado hasta que son ingeridas por un nuevo mosquito.
Epidemiología
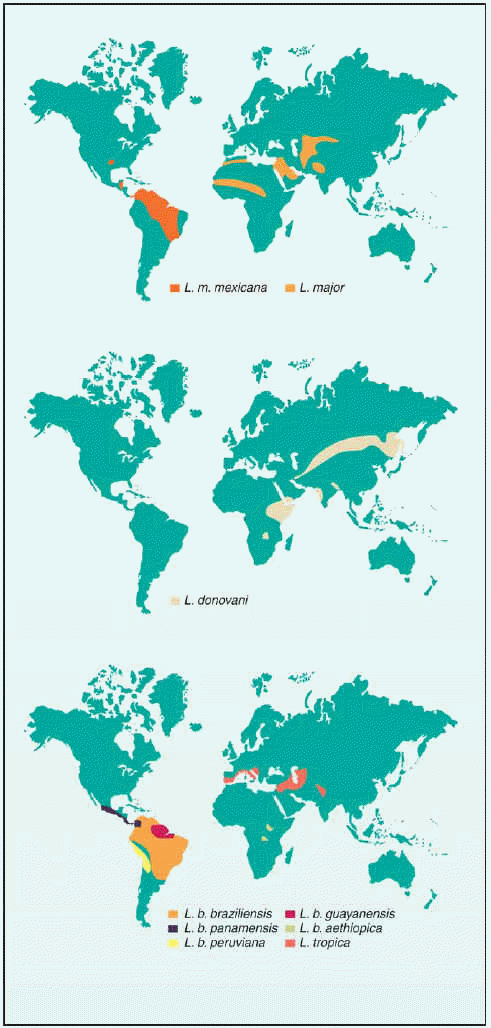
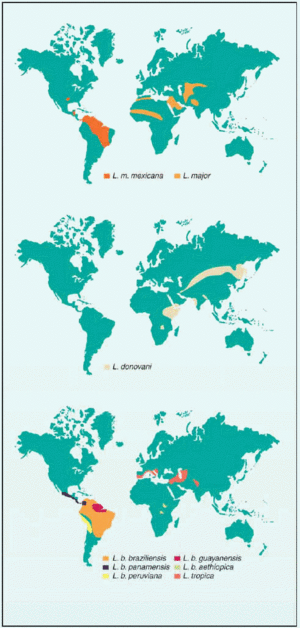
La leishmaniosis constituye un importante problema de salud pública, ya que la población con riesgo de contraerla se eleva aproximadamente a 368 millones de personas. Esta parasitosis ha sido registrada en 88 países del mundo (fig. 2) con una prevalencia aproximada de 14 millones de personas.
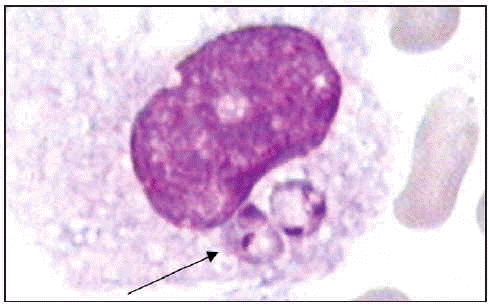
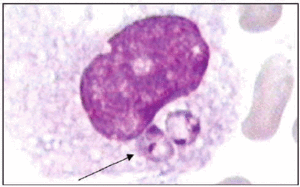
Formas amastigote intracelulares.
Fig. 2. Mapa de distribución de las principales especies de Leishmania.
En el transcurso de un año aparecen aproximadamente unos 2 millones de casos nuevos de los que la mayoría se engloban dentro de la leishmaniosis cutánea.
Todos estos datos aportados anteriormente son aproximados porque la prevalencia y la incidencia sólo pueden ser estimadas de forma aproximada, ya que esta enfermedad se localiza en zonas remotas en las que la asistencia médica es ínfima y por tanto, la mayor parte de las parasitosis no son diagnosticadas.
El número de casos está experimentando un gran incremento, debido a los movimientos turísticos a zonas potencialmente peligrosas. Las áreas epidemiológicas favorables son los bosques con abundancia de reservorios y vectores donde el clima es cálido, con una temperatura media que oscila entre los 25 o 30 ºC, a los fenómenos migratorios, a la mejor detección de los enfermos y al incremento de los contagios producidos por compartir jeringuillas en caso de drogadictos que padecen la enfermedad.
El mayor impacto de la enfermedad se produce en zonas como la India o el sur de Sudamérica, aunque también en Europa se ha registrado un aumento de los casos ligados a la coinfección Leishmania/VIH1.
En el nuevo mundo la leishmaniosis cutánea se conoce como úlcera de los chicleros o botón de Bahía y es producida por subespecies de Leishmania mexicana
Clínica
La clínica de la leishmaniosis viene determinada por la capacidad, o más bien por el grado de invasión de las formas promastigotes una vez que han sido inoculadas por el vector en el hospedador vertebrado2.
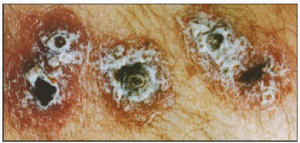
Si la infección queda limitada a la zona de la picadura se produce el cuadro clínico característico de la leishmaniosis cutánea3 también conocida en el viejo mundo como Botón de Oriente. Las leishmanias del complejo Leishmania tropica son el agente causal de esta parasitosis y están presentes en el litoral Mediterráneo. En el nuevo mundo la leishmaniosis cutánea se conoce como úlcera de los chicleros o botón de Bahía y es producida por subespecies de Leishmania mexicana.
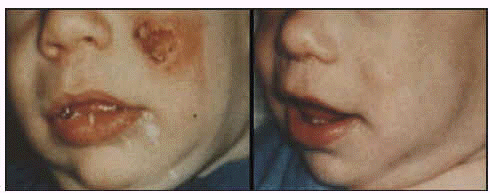
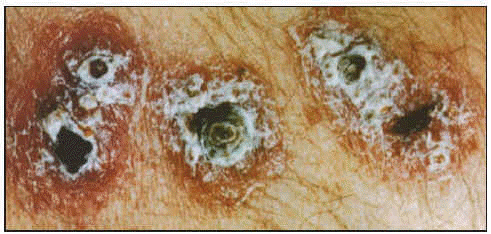
Se caracteriza la lesión por ser una pápula ulcerada con exudado seroso con fondo limpio de aspecto granular y bordes hiperémicos y engrosados. Esta pápula puede presentar un área necrótica y se acompaña de adelgazamiento de la piel o ulceración. En ocasiones su curación es espontánea dejando como única secuela una cicatriz, generalmente en la cara. Su período de incubación puede ser superior a 1 año. En ocasiones el parásito se disemina sobre toda la superficie cutánea originando la leishmaniosis cutánea difusa.
Formas promastigote.
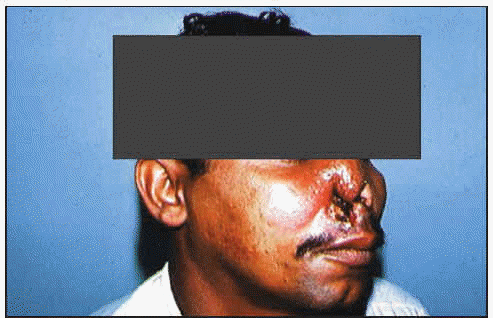
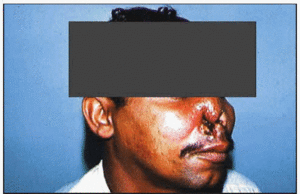
La migración de los parásitos hacia las mucosas es el origen de la espundia (conocida con este nombre principalmente en Brasil) o leishmaniosis mucocutánea, en la que se encuentra comprometida la mucosa del tracto respiratorio superior en la que se origina hiperemia, edema, ulceración y necrosis. Si bien la lesión del cartílago también puede aparecer simultáneamente con la lesión cutánea, hay casos en los que aparece años después de que la primera haya cicatrizado.
Un aspecto muy importante generalmente ligado a la manifestación mucocutánea de la leishmaniosis es la aparición de infecciones secundarias próximas a las áreas necrosadas y que pueden acabar produciendo la muerte del individuo parasitado.
Si la respuesta inmunitaria falla, el parásito se puede localizar en las vísceras4 dando lugar a la aparición de la leishmaniosis visceral, conocida mundialmente con el nombre hindú de kala-azar y producida por tres subespecies de Leishmania donovani. Este tipo de parasitosis afecta principalmente a niños menores de 5 años, a mal nutridos y/o a pacientes inmunodeprimidos. Los principales órganos afectados son el bazo, hígado y médula ósea. En los vasos sanguíneos se produce hipertrofia y su posterior taponamiento que va a producir necrosis en los tejidos, alterándose así su funcionamiento normal. El período de incubación aproximado es de 2 a 4 meses y los principales síntomas son fiebre alta, irregular y de duración superior a 2 semanas, acompañada de astenia, pérdida de peso, anemia, dolor abdominal vago, aumento del tamaño del abdomen, hepato y esplenomegalia, hemorragia gingival y nasal, además de linfoadenitis.
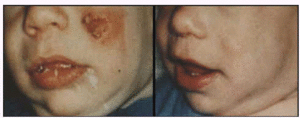
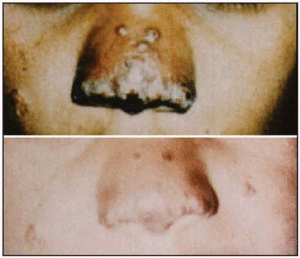
Leishmaniosis cutánea antes y después del tratamiento.
En el diagnóstico de la leishmaniosis visceral, a pesar de que el cuadro clínico suele ser característico, se debe basar en el aislamiento de los parásitos
Diagnóstico
El diagnóstico de esta parasitosis debe comenzar con la realización de una anamnesis detallada. Las preguntas deben dejar claro cuál es el lugar de residencia del individuo posiblemente parasitado, al igual que los lugares a los que ha viajado tanto recientemente como en un pasado próximo. Esto se realiza para saber si el individuo ha estado en zonas endémicas de Leishmania, y en caso de haber estado conocer el tipo de parasitosis que presenta.
Una vez realizada la anamnesis y según el resultado obtenido, que generalmente es determinante, debemos llevar a cabo otras pruebas que confirmen el diagnóstico.
El diagnóstico definitivo de la leishmaniosis cutánea se obtiene tras el hallazgo de formas amastigotes después de la realización de una punción, biopsia o aspirado del líquido existente bajo la pústula. Este diagnóstico es muy complicado. Es importante estar muy familiarizado en el diagnóstico de la enfermedad, ya que es complicada la observación de las formas amastigote.
Las muestras también pueden ser cultivadas en el laboratorio en medio NNN (Novy-MacNeal médium modificado por Nicolle) y en medio Schneider, como resultado aparecerían en el cultivo las formas promastigotes del parásito.
El diagnóstico de la leishmaniosis cutánea y mucocutánea también se puede confirmar después de la inyección de extractos de Leishmania en la piel. Esta reacción se conoce como test cutáneo de Leishmania o reacción de Montenegro y es una prueba de hipersensibilidad retardada. Se realiza llevando a cabo la inyección intradérmica de una suspensión de promastigotes muertos y los resultados obtenidos suelen ser positivos en un amplio porcentaje de individuos parasitados.
También se han utilizado para el diagnóstico de esta parasitosis pruebas de microscopia que si bien permiten determinar la existencia de la enfermedad, no permiten distinguir cuál es la especie causante de la misma.
Además, está referenciada la utilización de métodos serológicos en el diagnóstico de la leishmaniosis visceral y entre ellos destaca el test de aglutinación directa y la técnica ELISA.
En el diagnóstico de la leishmaniosis visceral, a pesar de que el cuadro clínico suele ser característico, se debe basar en el aislamiento de los parásitos. La punción del hígado puede ser un medio para la observación de los parásitos porque, aunque sería más fácil, la punción del bazo es una técnica arriesgada. Muchos autores consideran el aspirado en la médula ósea como la técnica de elección.
Leishmaniosis serosa.
Tratamiento
En el tratamiento de la leishmaniosis cutánea se considera al gluconato de antimonio y sodio como el principio activo más efectivo. Su administración es por vía intravenosa o intramuscular y se debe considerar que presenta efectos secundarios como tos, dolor de cabeza y vómitos, todos ellos frecuentes tras la administración de derivados antimoniales.
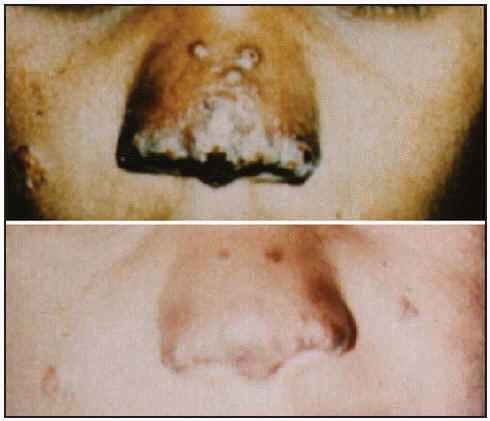
También podemos hablar de otros principios activos utilizados, sobre todo frente a la forma etiópica, como la pentamidina.
El gluconato de antimonio y sodio también es efectivo en el tratamiento de la forma mucocutánea, si bien aquí, el arsenal terapéutico es mayor. Entre los principios activos utilizados destacamos el pamoato de cicloguanil (inhibidor del ácido fólico) y la anfotericina B, que no puede ser utilizada durante períodos prolongados, ya que produce depresión en la médula ósea y daño renal.
En el tratamiento de la leishmaniosis cutánea se considera al gluconato de antimonio y sodio como el principio activo más efectivo
En el tratamiento de la leishmaniosis visceral también se referencia como principio activo de elección el gluconato de sodio y antimonio. Si bien, si el parásito es resistente a los derivados antimoniales, el tratamiento se debe realizar con pentamidina.
Leishmaniosis mucocutánea producida por Leishmania braziliensis.
El uso de una vacuna realizada a partir de formas promastigotes de distintas cepas de Leishmania ha demostrado resultados esperanzadores frente a la posible reinfección del individuo parasitado
Control
En las zonas donde la parasitosis es endémica debe lucharse contra el vector, por lo menos a pequeña escala con insecticidas.
En las zonas donde el vector pudiera estar presente el saneamiento constituye una manera de control fundamental.
El perro constituye y actúa como un importante reservorio de esta parasitosis, por tanto muchas de las medidas de control están centradas en él. Así, podemos citar como importantes medidas de control los análisis periódicos que se deben realizar sobre los cánidos para obtener de esta manera un valioso diagnóstico temprano. Los perros, fundamentalmente en zonas endémicas, deben dormir en lugares cerrados para evitar la picadura de los vectores durante la noche.
Leishmaniosis aethiopica antes y después del tratamiento.
Los perros parasitados deben ser sometidos a controles exhaustivos y en caso de que la parasitosis no fuese controlada deberían ser sacrificados.
En humanos debe llevarse a cabo una estrecha vigilancia epidemiológica que permita conocer la mejor distribución de la enfermedad.
El uso de una vacuna realizada a partir de formas promastigotes de distintas cepas de Leishmania ha demostrado resultados esperanzadores frente a la posible reinfección del individuo parasitado.