Como cada año, Offarm dedica un artículo al análisis de las disposiciones legales que han afectado a la farmacia española durante el año anterior. La autora aborda de forma general las novedades legislativas que afectaron al sector farmacéutico durante 2002. Farmacopeas, medicamentos, farmacovigilancia y productos dietéticos y sanitarios fueron los principales temas legislados durante el año pasado, sin olvidar la ya clásica remodelación del organigrama del Ministerio de Sanidad y Consumo o las modificaciones a la Ley del Medicamento.
El año 2002 se iniciaba con la culminación del proceso de transferencias de la gestión sanitaria a las comunidades autónomas. Este hecho, junto al cambio de ministra de Sanidad y Consumo, condujo en pleno verano a una reestructuración del Ministerio, proceso que según las noticias aparecidas en la prensa especializada no está concluido, ya que se prevén para un futuro próximo importantes cambios. Incluso se comenta la posible supresión de la Dirección General de Farmacia y Productos Sanitarios (DGFyPS), asumiendo algunas de sus competencias la Agencia Española del Medicamento (AEM). Pero, no es momento de adelantar acontecimientos, sino de repasar las disposiciones aprobadas durante el año.
Farmacopeas
Desde que el 1 de enero de 1997 entró en vigor la primera edición de la Real Farmacopea Española1 hasta la fecha, se ha visto modificada por diversas adiciones y actualizaciones. Esta situación, junto con la necesidad de incorporar 89 nuevas monografías y 14 nuevos capítulos generales de la Farmacopea Europea, han conducido a la aprobación de la segunda edición de la RFE, que comprende 1.605 monografías y 266 capítulos generales.
En relación con la Farmacopea Europea hay que señalar la entrada en vigor del primer suplemento y del segundo suplemento de la cuarta edición, el 1 de abril y el 1 de julio de 2002, respectivamente. También cabe destacar la supresión de la monografía relativa a la «vacuna contra la hepatitis canina contagiosa, viva liofilizada (Vaccinum hepatitidis contagiosae caninae vivum cryodesiccatumm [n.º 0446])»2.
Medicamentos
Especialidades farmacéuticas publicitarias
Mediante Orden SCO/1.377/2002, de 5 de junio3, se procede a la incorporación de nuevos principios activos susceptibles de ser empleados en especialidades farmacéuticas publicitarias incluidos en el anexo de la Orden de 17 de septiembre de 1982, a saber:
Analgésicos de uso interno. Diclofenaco (DOE): máximo 25 mg/UD y 75 mg/día. Únicamente para mayores de 14 años.
Antihistamínicos sistémicos. Cetirizina (DOE) 2HCl: únicamente una semana de tratamiento. Mayores de 12 años: máximo 10/día. Niños de 6 a 12 años: máximo 5 mg/día.
Mucolíticos. Ambroxol (DOE) HCl: máximo 60 mg/UD y 120 mg/día. Únicamente para mayores de 12 años.
Nasales. Corticosteroides nasales tópicos. Beclometasona (DOE) dipropionato: aerosol nasal, máximo 100 µg/aplicación, 400 µg/día, monofármaco y una semana de tratamiento. Únicamente para mayores de 18 años.
Las modificaciones de las dosis y las restricciones de los principios activos son las siguientes:
Mucolíticos. Acetilcisteína (DOE): mayores de 18 años, un máximo de 600 mg/UD y día; niños de 12 a 18 años, un máximo de 200 mg/UD y 600 mg/día, y niños de 6 a 12 años, un máximo de 100 mg/UD y 300 mg/día.
Nasales. Descongestivos nasales vía oral. Fenilpropanolamina (DOE): dosis máxima para adultos de 100 mg/día en varias tomas.
Productos para el tratamiento del tabaquismo. Nicotina (comprimidos sublinguales): máximo de 4 mg/UD.
En las disposiciones transitorias de la Orden de 5 de junio de 2002 se establecen los procedimientos a seguir por los laboratorios que tienen registradas EFP que deban adecuar su composición a lo dispuesto en esta orden, así como las que actualmente tienen la clasificación de EFP y no pueden adaptarse a lo dispuesto.
Psicotropos
Mediante la Orden SCO/469/2002, de 19 de febrero4, se aprueba la inclusión de las siguientes sustancias en el anexo I del RD 2.829/1977, de 6 de octubre, por el que se regulan las sustancias y productos psicotrópicos:
La sustancia 2C-B (4-bromo-2,5-dimetoxifeniletilamina), así como las sales, ésteres o éteres que de ésta sea posible su formación. Se incluye en la lista II.
La sustancia GHB (ácido γ-hidroxibutírico), así como las sales, ésteres o éteres que de ésta sea posible su formación. Se incluye en la lista IV.
La sustancia zolpidem [N,N,6-trimetil-2-p-tolilimidazol(1,2-α)piridina-3-acetamida], así como las sales, ésteres o éteres que de ésta sea posible su formación. Se incluye en la lista IV.
En la disposición se especifican las medidas que deben adoptar las entidades fabricantes, importadoras o exportadoras, los laboratorios de especialidades farmacéuticas, así como las entidades de comercialización y distribución, con tal de ajustarse a la normativa vigente.
A su vez, por la Orden SCO/1.906/ 2002, de 15 de julio5, se incluye la sustancia PMMA (parametoximetilanfetamina) de fórmula N-metil-1-(4-metoxifenil)-2-aminopropano, en la lista I del Anexo I del RD 2.829/1977, de 6 de octubre, y, por tanto, hay que aplicarle las prescripciones previstas para las sustancias que integran esa lista. En consecuencia, se prohíbe el uso, fabricación, importación, exportación, tránsito, comercio, distribución y tenencia de dicha sustancia, así como los preparados que la contengan.
Conjuntos homogéneos y precios de referencia
El Ministerio de Sanidad y Consumo, mediante la Orden SCO/3.215/2002, de 4 de diciembre6, aprueba la incorporación de 39 nuevos conjuntos homogéneos de presentaciones de especialidades farmacéuticas a los ya existentes y les asigna su correspondiente precio de referencia.
Estas modificaciones conllevan a la reducción del precio de las presentaciones de especialidades farmacéuticas no calificadas como bioequivalentes utilizadas para el cálculo del precio de referencia cuando el que poseen supera el precio de referencia establecido. También se da opción a que voluntariamente los laboratorios comercialicen las presentaciones de las especialidades farmacéuticas a un precio inferior al autorizado para adecuarlo a un nivel igual o inferior al de referencia.
Las disposiciones adoptadas para la aplicación de esta orden se estudian detalladamente en un artículo monográfico dedicado a los nuevos conjuntos homogéneos y sus precios de referencia (véase en este mismo número de Offarm la sección «Derecho Farmacéutico»).
Fórmulas magistrales y preparados oficinales
En el resumen de 2001, al estudiar el RD 175/2001, de 23 de febrero, sobre normas de correcta elaboración y control de calidad de fórmulas magistrales y preparados oficinales, comentábamos que el COF de Valencia había interpuesto recurso contencioso-administrativo ante la Sección Cuarta de la Sala Tercera del Tribunal Supremo contra ese real de decreto.
Los representantes del COF de Valencia pretendían en su demanda impugnar la validez de la disposición, alegando para ello la falta de habilitación legal para su aprobación y, a su vez, calificando de «arbitraria» la actuación en el ejercicio de la potestad discrecional de la Administración sanitaria. En su argumentación también se descalificaban aspectos concretos de la disposición y una supuesta invasión de la competencia atribuida a la Comunidad Valenciana. Todos estos aspectos han sido revocados en los fundamentos de derecho de la sentencia y, en consecuencia, el 25 de septiembre de 2002 la sala desestima el recurso.
Productos dietéticos
Según la Orden de 30 de abril de 1997, tienen la consideración de tratamientos dietoterapéuticos complejos aquellos que se llevan a cabo con alimentos dietéticos destinados a usos médicos especiales para los usuarios del Sistema Nacional de Salud que padezcan alguno de los trastornos metabólicos congénitos que figuran en el anexo de la disposición.
Estos productos deben inscribirse en el Registro General Sanitario de Alimentos como «Alimentos dietéticos destinados a usos médicos especiales», y los envases de los alimentos financiados por el SNS contarán con un precinto identificativo cuyas características se describen en la Orden de 15 de diciembre de 2000.
El Comité Asesor para Prestaciones con Productos Dietéticos ha considerado necesaria la actualización del listado de patologías que figuran en el anexo de la Orden de 30 de abril de 1997. La Orden SCO/585/2002, de 5 de marzo7, incluye en su anexo nuevos trastornos metabólicos congénitos del metabolismo de los hidratos de carbono, del metabolismo de los aminoácidos y alteraciones del ciclo de la urea, y se actualizan los tipos de productos dietéticos asociados a dichos trastornos.
Cabe resaltar que la Ley 53/2002, de 30 de diciembre, de Medidas Fiscales, Administrativas y del Orden Social8, en su artículo 123, faculta al Gobierno para que, a propuesta del Ministerio de Sanidad y Consumo, y previo informe del Consejo Interterritorial del SNS, establezca importes máximos de financiación por cada tipo de productos facilitado en las prestaciones con productos dietéticos. Además, contempla para este tipo de productos medidas similares para el procedimiento de financiación pública a las establecidas en el artículo 94 de la Ley del Medicamento para las especialidades farmacéuticas.
Productos sanitarios
Productos sanitarios a medida
La Ley General de Sanidad, en el artículo 100.1, otorga a la Administración del Estado capacidad para exigir a licencia previa a las personas físicas o jurídicas que se dediquen a la importación, elaboración, fabricación, distribución o exportación de productos sanitarios y a sus laboratorios y establecimientos. El artículo 76 de la Ley 55/1999, de 29 de diciembre, de medidas fiscales, administrativas y del orden social, distingue las competencias de las comunidades autónomas en relación con los establecimientos y las personas físicas o jurídicas, que se dedican a la fabricación de productos sanitarios a medida y reserva al Ministerio de Sanidad y Consumo la facultad de elaborar los criterios para la concesión de la licencia previa para el funcionamiento de estos establecimientos. Estos criterios se establecen en el RD 437/2002, de 10 de mayo9, que tiene la condición de norma básica.
A grandes trazos, los requisitos exigibles a los fabricantes de productos sanitarios a medida para que los órganos competentes de las comunidades autónomas puedan otorgarles las licencias son los siguientes:
Deben poder garantizar la calidad de los productos y la ejecución de los procedimientos y controles procedentes.
Deben disponer de instalaciones, procedimientos, equipamiento y personal adecuado en relación con las actividades y productos que fabriquen.
Deben contar con un responsable técnico, cuya titulación acredite una cualificación adecuada en función de los productos que tenga a su cargo, que supervisará directamente la actividad realizada por la empresa.
Deben disponer de un sistema de archivo documental de cada producto fabricado y contar con un registro de todos los productos dispuestos para su comercialización en el territorio nacional.
Deben designar a una persona de contacto con las autoridades sanitarias para actuaciones relacionadas con el sistema de vigilancia, que puede recaer en el responsable técnico de la empresa.
Por último, deben disponer de un procedimiento que garantice las medidas de restricción o seguimiento de la utilización de los productos y las que, en su caso, puedan adoptar las autoridades sanitarias.
Productos sanitarios que incorporen derivados de la sangre o plasma humanos
La aprobación de la Directiva 200/70/CE del Parlamento Europeo y del Consejo, de 16 de noviembre, y de la Directiva 2001/104/ CE del Parlamento Europeo y del Consejo, de 7 de diciembre, modificando ambas la Directiva 93/42/CEE del Consejo relativa a los productos sanitarios, en lo que se refiere a los productos sanitarios que incorporen derivados de la sangre o plasma humanos, hace que tengamos que incorporar dichas modificaciones en nuestro ordenamiento jurídico, concretamente en el RD 414/1996, de 1 de marzo, por el que se regulan los productos sanitarios; ello se efectúa mediante el RD 710/2002, de 19 de julio10. Los productos sanitarios que incorporen otras sustancias derivadas de tejidos humanos quedan excluidos del ámbito de aplicación de esta disposición.
Con esta modificación se establece que todos los productos que incorporen como parte integrante de él una sustancia derivada de la sangre humana en la clasificación se incluirán en la clase III. También se contemplan las particularidades de estos productos en la reglamentación general de productos sanitarios, concretamente en los anexos relativos a los requisitos esenciales relativos al diseño y a la fabricación, a la declaración CE de conformidad, examen CE de tipo, verificación CE y declaración CE de conformidad.
Cupón-precinto de los efectos y accesorios
El formato del cupón-precinto que figura en los efectos y accesorios incluidos en la financiación del SNS ha sufrido una modificación11 y se ha homogeneizado con el que presentan las especialidades farmacéuticas. Por este motivo, se ha suprimido el precio, que pasa a incluirse en el embalaje exterior (preferentemente en la parte inferior del cupón-precinto) y se le ha incorporado el código de barras.
Los datos que deben figurar en el cupón-precinto de efectos y accesorios incluidos en la financiación del SNS se distribuyen entre dos zonas teóricas; en la parte superior figuran las siglas ASSS, tipo de producto, nombre comercial-presentación (dimensiones, tallajes, número de unidades), ofertante y código nacional del producto; en la parte inferior, y sin que exista ninguna línea o señal impresa que las delimite, figura el código de barras EAN-13/SF.
Si se trata de efecto y accesorio al que le corresponde la aportación reducida llevará, además de los datos generales, un cícero de color negro delante de las siglas ASSS y si es un producto para cuya dispensación se requiere visado de inspección, el cupón-precinto se diferencia mediante un recuadro negro de 1 mm de ancho que enmarca su teórica zona superior.
Prestaciones ortoprotésicas
El artículo 124 de la Ley 53/2002, de 30 de diciembre, de Medidas Fiscales, Administrativas y del Orden Social8 faculta al Gobierno para que, a propuesta del Ministerio de Sanidad y Consumo, y previo informe del Consejo Interterritorial del SNS, establezca importes máximos de financiación para cada tipo de productos incluidos como prestación ortoprotésica.
Farmacovigilancia
El RD 711/2002, de 19 de julio, regula la farmacovigilancia de medicamentos de uso humano12. Esta norma desarrolla la Ley del Medicamento y adecua la legislación española en materia de farmacovigilancia a lo establecido en la Directiva 2000/38 de la Comisión, de 5 de junio, que introdujo notables cambios en la normativa europea, en concreto, el capítulo V bis «Farmacovigilancia» de la Directiva 75/319/CEE del Consejo relativa a la aproximación de las disposiciones legales, reglamentarias y administrativas sobre especialidades farmacéuticas; directivas que en la actualidad están derogadas y su contenido incorporado en la Directiva 2001/83/CE del Parlamento Europeo y del Consejo de 6 de noviembre, por la que se establece un Código Comunitario sobre Medicamentos para Uso Humano (Título IX: artículos 101 a 108).
La farmacovigilancia es una responsabilidad compartida por las autoridades competentes, los titulares de la autorización de comercialización y los profesionales sanitarios. El ámbito de aplicación de la nueva normativa contempla a la farmacovigilancia de medicamentos de uso humano como actividad de salud pública destinada a la identificación, cuantificación, evaluación y prevención de los riesgos asociados al uso de dichos medicamentos.
El reglamento, dentro del capítulo dedicado a las disposiciones de carácter general, define los conceptos más utilizados en esta materia y relaciona las posibles fuentes de información en farmacovigilancia. En el resto de los capítulos se desarrolla la estructura y las funciones del Sistema Español de Farmacovigilancia, las obligaciones de los titulares de la autorización de comercialización, las intervenciones administrativas y los estudios postautorización. Debido al interés que suscitan estos temas, se estudiarán detalladamente en otros artículos monográficos de esta revista (véase: Montpart E, Martín MP. El Sistema Español de Farmacovigilancia. Offarm 2003;22[2]:120-8.
Nueva estructura ministerial
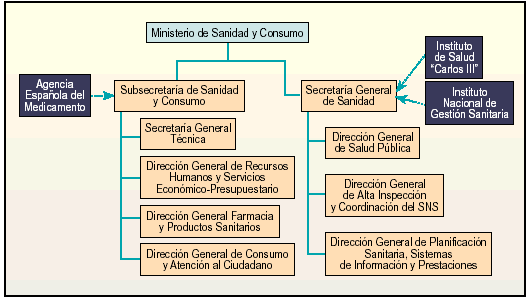
El RD 840/2002, de 2 de agosto13, establece una nueva estructuración del Ministerio de Sanidad y Consumo (fig. 1). Como órganos directivos dispone de la Subsecretaría de Sanidad y Consumo y la Secretaria General de Sanidad, esta última de nueva creación.
Fig. 1. Nueva estructura orgánica del Ministerio de Sanidad y Consumo.
La DGFyPS mantiene sus funciones y sigue dependiendo de la Subsecretaría del Ministerio, junto a la Dirección General de Recursos Humanos y Servicios Económico-Presupuestarios y la recientemente creada Dirección General de Consumo y Atención al Ciudadano, a la que le corresponde la propuesta de ordenación en materia de consumo y el desarrollo de las funciones relativas al buen funcionamiento del mercado para la protección de los consumidores, promoción y fomento de los derechos de los consumidores y usuarios, y las funciones de información de los derechos de los ciudadanos como usuarios del sistema sanitario.
De la nueva Secretaría General de Sanidad dependen la Dirección General de Salud Pública, la Dirección General de Alta Inspección y Coordinación del Sistema Nacional de Salud, y la Dirección General de Planificación Sanitaria, Sistemas de Información y Prestaciones. A su vez, se le adscriben como organismo autónomo el Instituto de Salud Carlos III y la entidad gestora Instituto Nacional de Gestión Sanitaria.
El Instituto de Salud Carlos III es un organismo público de investigación. La Orden de 27 de diciembre14 crea para la ejecución de las actividades los siguientes centros: Centro Nacional de Microbiología, Centro Nacional de Sanidad Animal, Centro Nacional de Alimentación, Centro Nacional de Medicina Tropical, Centro Nacional de Epidemiología, Centro de Investigación sobre el Síndrome del Aceite Tóxico y Enfermedades Raras, Escuela Nacional de Sanidad, Escuela Nacional de Medicina del Trabajo, y Biblioteca Nacional de Ciencias de la Salud.
El Instituto Nacional de la Salud (INSALUD) pasa a denominarse Instituto Nacional de Gestión Sanitaria. Conserva la personalidad jurídica y naturaleza de entidad gestora de la Seguridad Social, el régimen jurídico, económico, presupuestario y patrimonial, pero adquiere una menor dimensión al haberse procedido a las transferencias correspondientes a las comunidades autónomas, excepto las prestaciones sanitarias efectuadas en Ceuta y Melilla.
Modificaciones a la Ley del Medicamento
Un año más, la Ley del Medicamento se ve sometida a notables modificaciones. La primera tiene su origen en la incorporación al ordenamiento jurídico español de la normativa europea en materia de protección de los intereses de los consumidores y usuarios.
El Parlamento Europeo y el Consejo aprobaron la Directiva 98/27/CE, de 19 de mayo de 1998, relativa a las acciones de cesación en materia de protección de los intereses de los consumidores, modificada por las Directivas del Parlamento Europeo y del Consejo 1999/44/CE de 25 de mayo y 2000/31/CE de 8 de junio, con objeto de proteger los intereses colectivos de los consumidores con tal de garantizar el buen funcionamiento del mercado interior. Para ello, se deben aproximar las disposiciones legales, reglamentarias y administrativas de los estados miembros relativas a las acciones de cesación, destinadas a la protección de los intereses colectivos de los consumidores que se encuentran incluidos en diferentes directivas, entre las que subrayamos la Directiva 92/28/CEE sobre publicidad de los medicamentos.
Mediante la Ley 39/2002, de 28 de octubre, de transposición al ordenamiento jurídico español de diversas directivas comunitarias en materia de protección de los intereses de los consumidores y usuarios15, se modifica la Ley 25/1990, de 20 de diciembre, del Medicamento. Se adiciona un nuevo título, el XI, con la rúbrica «De la acción de cesación», que comprende dos artículos: el 120 y el 121.
Cabe comentar que la Ley 39/2002 también modifica la Ley 34/1988, de 11 de noviembre, General de Publicidad, en materia de publicidad comparativa, e incorpora las acciones de cesación en caso de publicidad ilícita.
El resto de las modificaciones de la Ley del Medicamento se aprueba en la Ley 53/2002, de 30 de diciembre, de Medidas Fiscales, Administrativas y del Orden Social8.
Una de las modificaciones tiene como objetivo incorporar parcialmente la Directiva 2001/20/CE del Parlamento Europeo y del Consejo, de 4 de abril de 2001, relativa a la aproximación de las disposiciones legales, reglamentarias y administrativas de los estados miembros sobre la aplicación de buenas prácticas clínicas en la realización de ensayos clínicos de medicamentos de uso humano; para ello se modifican el apartado 11 del artículo 8; los artículos 38, 59 y 60; el apartado 1 del artículo 62; el apartado 3 del artículo 63, y el artículo 65.
En el artículo 117, relativo a la cuantía de la tasa, se crea el grupo XI en el apartado 1, correspondiente a «Procedimientos de financiación con cargos a fondos de la Seguridad Social y fijación de precio de los efectos y accesorios», que incluye dos epígrafes.
Otras leyes modificadas
Con este apartado genérico tan sólo pretendemos hacer referencia a dos leyes que han sido modificadas y consideramos que su conocimiento puede resultar de interés.
Concretamente nos referimos a la Ley 11/1986, de 20 de marzo, de Patentes, que ha sido modificada con tal de incorporar al ordenamiento jurídico español la Directiva 98/44/CE del Parlamento Europeo y del Consejo, de 6 de julio, relativa a la protección jurídica de las invenciones biotecnológicas16; y a la Ley 41/2002, de 14 de noviembre, básica reguladora de la autonomía del paciente y derechos y obligaciones en materia de información y documentación clínica, por la que expresamente se derogan los apartados 5, 6, 8, 9 y 11 del artículo 10, el apartado 4 del artículo 11 y el artículo 61 de la Ley 14/1986 General de Sanidad17.
Para concluir este resumen, reseñar que el Tribunal Constitucional, por providencia de 12 de marzo de 2002, ha admitido a trámite la cuestión de inconstitucionalidad planteada por la Sección Segunda de la Sala de lo Contencioso-Administrativo del Tribunal Superior de Justicia de Castilla-La Mancha en relación con el artículo 22.6 de la Ley 4/1996, de 26 de diciembre, de Ordenación del Servicio Farmacéutico en esta comunidad autónoma (dispone que no pueden concursar a una oficina de farmacia los farmacéuticos mayores de 65 años), por presunta vulneración del artículo 14* de la Constitución Española18.