Requisitos de las instalaciones
Estudiados en un trabajo anterior el concepto de cosmético, la reglamentación nacional que los regula y los aspectos más novedosos de la normativa comunitaria1, es momento de tratar de forma específica la comercialización de los productos cosméticos en España y analizar los requisitos que han de cumplir las instalaciones en las que se fabriquen, su control sanitario y la regulación del etiquetado y la publicidad.
El artículo 18 del RD 1.599/1997 sobre productos cosméticos2 establece que para poder fabricar, controlar, envasar, acondicionar, etiquetar, almacenar e importar de países de fuera de la Unión Europea un producto cosmético es necesario obtener previamente la autorización de actividades por parte de la Subdirección General de Productos sanitarios. Si bien, de acuerdo con la disposición adicional tercera, las oficinas de farmacia que fabrican productos cosméticos para su dispensación en la misma oficina no tienen la obligación de disponer de esta autorización. De lo que no están exentas es de cumplir los requisitos como si fueran a disponerla.
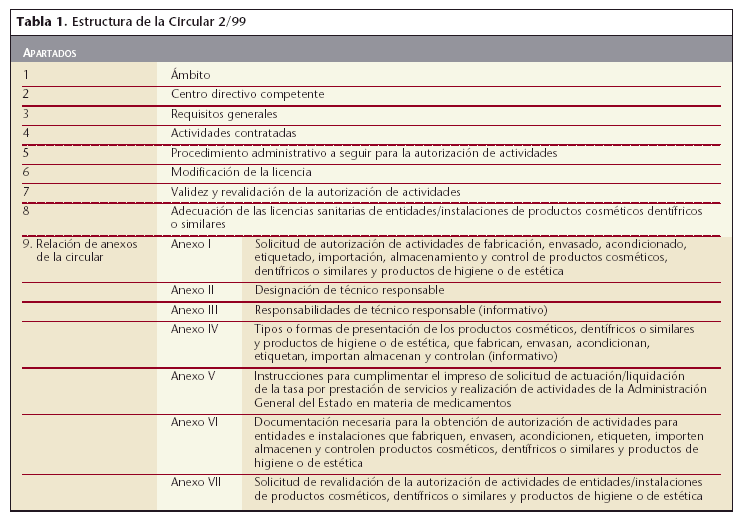
La Circular 2/993 de la Dirección General de Farmacia y Productos Sanitarios desarrolla el citado artículo 18, a través de 8 apartados y 7 anexos (tabla 1), con el fin de facilitar a las compañías implicadas los trámites administrativos a seguir para la obtención de esta autorización.
La compañía titular que va a comercializar el producto cosmético puede fabricarlo, controlarlo, envasarlo, acondicionarlo, etiquetarlo y almacenarlo, o puede contratar una, varias o todas estas actividades a otras compañías, siempre que éstas dispongan de la correspondiente autorización.
Los requisitos para poder obtener la autorización de actividades son los siguientes:
• La empresa debe disponer de personal suficiente y adecuadamente cualificado para la fabricación, importación y control de los productos cosméticos.
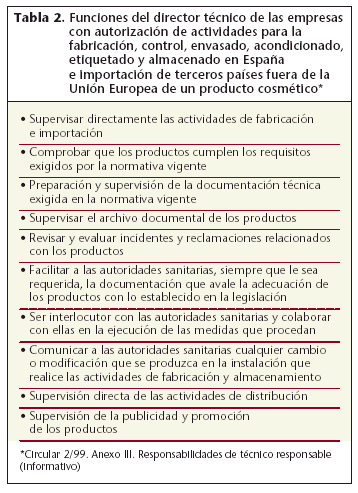
• La empresa debe disponer de un técnico responsable con titulación universitaria o titulación oficial equivalente relacionada con las funciones que realizará y que se enumeran en el Anexo III de la Circular 2/99 (tabla 2). El técnico responsable puede realizar actividades en más de una empresa siempre que el volumen de actividad, la localización de las empresas y el tiempo de dedicación se lo permita. El nombramiento de este técnico responsable debe comunicarse a la Subdirección General de Productos sanitarios y seguir el modelo estándar descrito en el Anexo II de la Circular 2/99.
• La empresa debe disponer de unos locales y unos equipamientos adecuados para la fabricación, el control y la conservación de los productos cosméticos que fabrique o importe.
Procedimiento administrativo
Cumplidos los requisitos anteriores, se seguirá un procedimiento administrativo que pasamos a detallar a continuación.
Pago de tasas
La empresa solicitante debe efectuar el pago de las tasas siguiendo las instrucciones descritas en el Anexo V de la Circular 2/99.
Presentación de la solicitud
La solicitud seguirá el modelo estándar descrito en el Anexo I de la Circular 2/99 y se presentará a la Subdirección General de Productos Sanitarios junto con el justificante de pago de tasas y los documentos que se relacionan en el Anexo V de la citada circular (tabla 3).
Concesión de la autorización de actividades
La Subdirección General de Productos Sanitarios evalúa la documentación presentada y efectúa u ordena la realización de las inspecciones que considere oportunas. Si todo es correcto, concede a la empresa solicitante la autorización de actividades.
La autorización de actividades es válida por 5 años a partir de la fecha de autorización. Después de este período, la autorización debe revalidarse 3 meses antes de su vencimiento mediante la presentación del escrito de solicitud que seguirá el modelo estándar descrito en el Anexo VII de la Circular 2/99, el correspondiente pago de tasas y el documento original de autorización que será devuelto a la empresa con un nuevo período de validez de 5 años más. Además, cualquier modificación en las condiciones de la autorización de actividades también debe ser evaluada y autorizada por la Subdirección
General de Productos sanitarios. En este caso, la empresa solicitante debe presentar la solicitud firmada por el representante legal de la empresa y el técnico responsable con la documentación de soporte necesario y el justificante de pago de tasas.
Los cosméticos fabricados en las oficinas de farmacia para un consumidor en particular están exentos de disponer de esta autorización de actividades, si bien deben cumplir con los requisitos.
Control sanitario
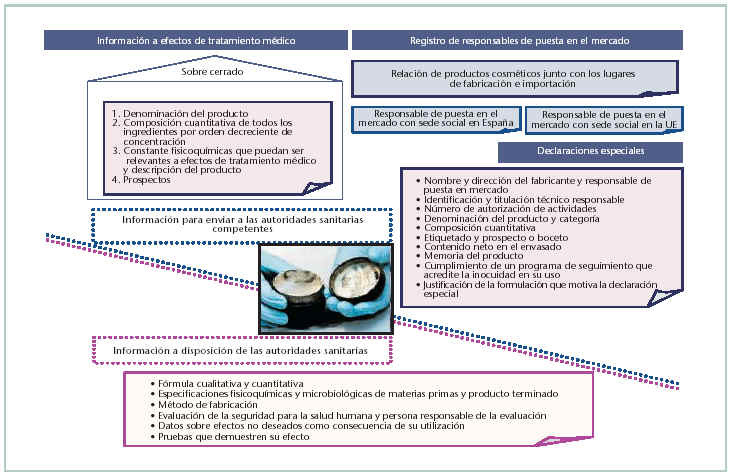
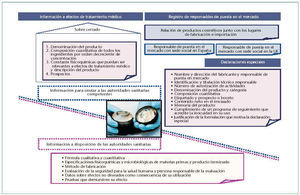
Una vez se dispone de la autorización de actividades del lugar en el que se fabrica, controla, envasa, acondiciona, etiqueta, almacena e importa de terceros países el producto cosmético, para poder comercializarlo, se debe enviar y disponer de la información que pasamos a comentar (fig. 1):
• Información a efectos de tratamiento médico.
• Información sobre los productos cosméticos fabricados en España e importados.
• Declaraciones especiales, si procede.
Información a efectos de tratamiento médico
Se remitirá a la Subdirección General de Productos Sanitarios, dentro de un sobre cerrado y a no más tardar del día en que se haga efectiva la comercialización, toda la información relacionada con un adecuado y rápido tratamiento médico, en caso de molestias debidas al producto cosmético.
En el exterior del sobre y en el escrito de presentación se indicará el nombre y la dirección del responsable de la puesta en el mercado, la denominación del cosmético y la fecha de presentación. La copia del escrito de presentación, sellada por el registro de entrada a la Subdirección General de Productos Sanitarios, será el comprobante de su presentación. La Subdirección General de Productos Sanitarios mantendrá esta información actualizada a disposición del Instituto Nacional de Toxicología.
La Subdirección General de Productos Sanitarios evalúa la documentación presentada y efectúa u ordena la realización de las inspecciones que considere oportunas
A los 10 años desde el envío de esta información, el responsable de la puesta en el mercado del producto cosmético debe comunicar a la Subdirección General de Productos Sanitarios su intención de seguir comercializándolo. Además, cualquier modificación en los datos enviados deberá comunicarse siguiendo el mismo procedimiento.
Las oficinas de farmacia que fabrican productos cosméticos para su dispensación en la misma oficina no precisan proporcionar la información a efectos de tratamiento médico, siempre que el producto cosmético esté destinado a un consumidor en particular, si bien debe quedar constancia de su elaboración.
Información sobre los productos cosméticosfabricados en España y los importados
Los responsables de la puesta en el mercado de productos cosméticos fabricados y de los importados, con sede social en España, deben enviar por duplicado a la autoridad sanitaria de la comunidad autónoma, en la que esté establecida su sede social, una relación de los productos cosméticos junto con los lugares de fabricación e importación antes de su comercialización. La comunidad autónoma debe enviar una de las copias a la Subdirección General de Productos Sanitarios. En el caso en que la sede social del responsable de la
puesta en el mercado de productos cosméticos se encuentre establecida en un Estado miembro de la Unión Europea distinto de España, esta relación se debe enviar directamente a la Subdirección General de Productos Sanitarios. Si los productos cosméticos son fabricados en un Estado miembro de la Unión Europea distinto de España, los responsables de la puesta en el mercado deben comunicar, además, los lugares de fabricación a las autoridades competentes del Estado miembro.
La Subdirección General de Productos Sanitarios mantendrá esta información actualizada a disposición de las autoridades sanitarias de las comunidades autónomas. Este requisito no es de aplicación para las oficinas de farmacia que fabrican productos cosméticos para su dispensación en la misma oficina.
Declaraciones especiales
Las declaraciones especiales hacen referencia a la utilización excepcional de algunos colorantes, agentes conservantes y filtros ultravioleta no incluidos en los anexos del RD 1.599/97, sobre productos cosméticos. Las declaraciones especiales se deben presentar a la Subdirección General de Productos Sanitarios y deben contener los datos que se indican en la figura 1.
Fig. Fig. 1. Esquema de la información sobre el producto cosmético.
La Subdirección General de Productos Sanitarios dispone de 90 días para la evaluación de la declaración especial, y una vez transcurridos, se pronunciará favorable o desfavorablemente. En caso favorable, se informará de ello a las comunidades autónomas y a la Comisión de la Unión Europea. La declaración especial tendrá una validez de 3 años. El producto deberá etiquetarse de forma que se diferencie del resto de productos cosméticos.
Otra información a disposiciónde las autoridades
En la figura 1 se indica la información que el responsable de la puesta en el mercado del producto cosmético debe disponer a petición de las autoridades sanitarias.
Las oficinas de farmacia que fabrican productos cosméticos para su dispensación en la misma oficina no precisan disponer de esta información, siempre que el producto cosmético esté destinado a un consumidor en particular.
Regulación del etiquetado y de la publicidad
De acuerdo con el artículo 15 del RD 1.599/1997, el texto impreso adherido al recipiente y al embalaje de cualquier producto cosmético debe contener la información que se resume a continuación:
• Denominación del producto.
• El nombre o la razón social y la dirección o el domicilio social del fabricante.
• El contenido nominal.
• La fecha de caducidad mínima, si es inferior a 30 meses, mediante el texto «utilícese preferentemente antes de final de...».
• Las precauciones particulares de empleo.
• El número de lote de fabricación.
• El país de origen, si no es comunitario.
• La función del producto, si no se desprende de su presentación.
• La lista de ingredientes por orden decreciente de importancia ponderal en el momento de su incorporación, precedida de la palabra «ingredientes». Por razones comerciales, el fabricante puede, previa autorización por parte de la autoridad competente, mantener la confidencialidad de alguno de los ingredientes del producto cosmético durante 5 años y prorrogable hasta un máximo de 3 años más. En estos casos, el ingrediente confidencial se sustituye por el número de registro concedido que, de acuerdo al anexo IX del RD 1.599/1997, consta de 7 cifras: 2 cifras para el año de concesión de la confidencialidad, 2 según el Estado miembro que lo haya concedido (a España le corresponde el número 11) y las 3 últimas asignadas por la autoridad competente.
El código nacional es concedido siempre que el producto cumpla la legislación vigente, con lo que su concesión aporta seguridad al consumidor
Además de esta información, en el etiquetado de los productos cosméticos también se debe indicar el precio. La normativa sobre la indicación del precio en los productos cosméticos se encuentra en el RD 3.423/2000, de 15 de diciembre, por el que se regula la indicación de precios de los productos ofrecidos a los consumidores y usuarios. Es obligatorio indicar el precio de venta y el precio por unidad de medida, que en los productos cosméticos se refiere a 100 g o 100 ml.
Los productos cosméticos, como el resto de productos de parafarmacia, no son de venta exclusiva en oficinas de farmacia. Pese a ello, las compañías solicitan al Consejo General de COF un código nacional que mejore la gestión informática de sus productos en las oficinas de farmacia. El código nacional es concedido siempre que el producto cumpla la legislación vigente, con lo que su concesión aporta seguridad al consumidor.
En materia de publicidad cabe destacar el RD 1.907/1996, de 2 de agosto, sobre publicidad y promoción comercial de productos, actividades o servicios con pretendida finalidad sanitaria. De acuerdo a este Real Decreto, está prohibida cualquier clase de publicidad o promoción directa o indirecta, masiva o individualizada que atribuya a los productos cosméticos propiedades distintas de las reconocidas a tales productos, conforme a su normativa especial. Además, el artículo 16 del RD 1.599/1997 establece que las denominaciones de los productos cosméticos no deben dar lugar a confusión con medicamentos, especialidades farmacéuticas o productos alimenticios. Los envases y presentaciones de estos productos tampoco deben dar lugar a confusión con los alimentos y otros productos de consumo, con el fin de evitar riesgos sanitarios.