La enfermedad de Parkinson es un proceso degenerativo de presentación generalmente esporádica. Descrita por primera vez por James Parkinson en 1817, es de causa desconocida, aunque probablemente su origen sea multifactorial. En los últimos tiempos se han hecho importantes progresos en su posible etiopatogenia, por lo que actualmente se dispone de diferentes opciones farmacoterapéuticas. En el presente artículo se revisan los principales medicamentos que componen el arsenal farmacoterapéutico aplicable a esta enfermedad.
Abordaje terapéutico y farmacológico
La enfermedad de Parkinson es un proceso crónico y progresivo provocado por la degeneración neuronal en la sustancia nigra, lo que conlleva una disminución en los valores de dopamina. Su etiología es desconocida y probablemente multifactorial. Pueden estar implicados factores genéticos, ambientales, daño oxidativo y envejecimiento cerebral acelerado o apoptosis.
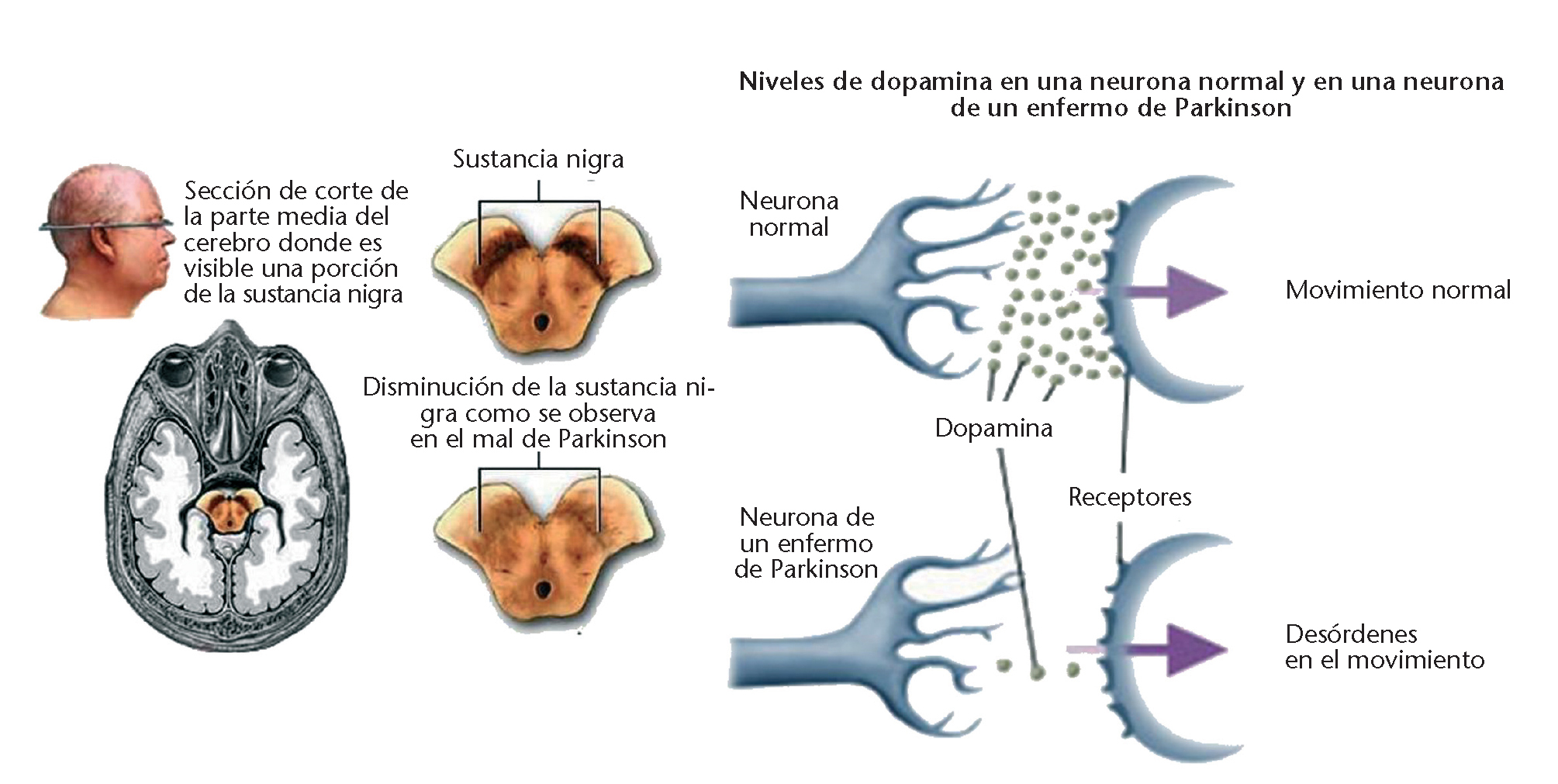
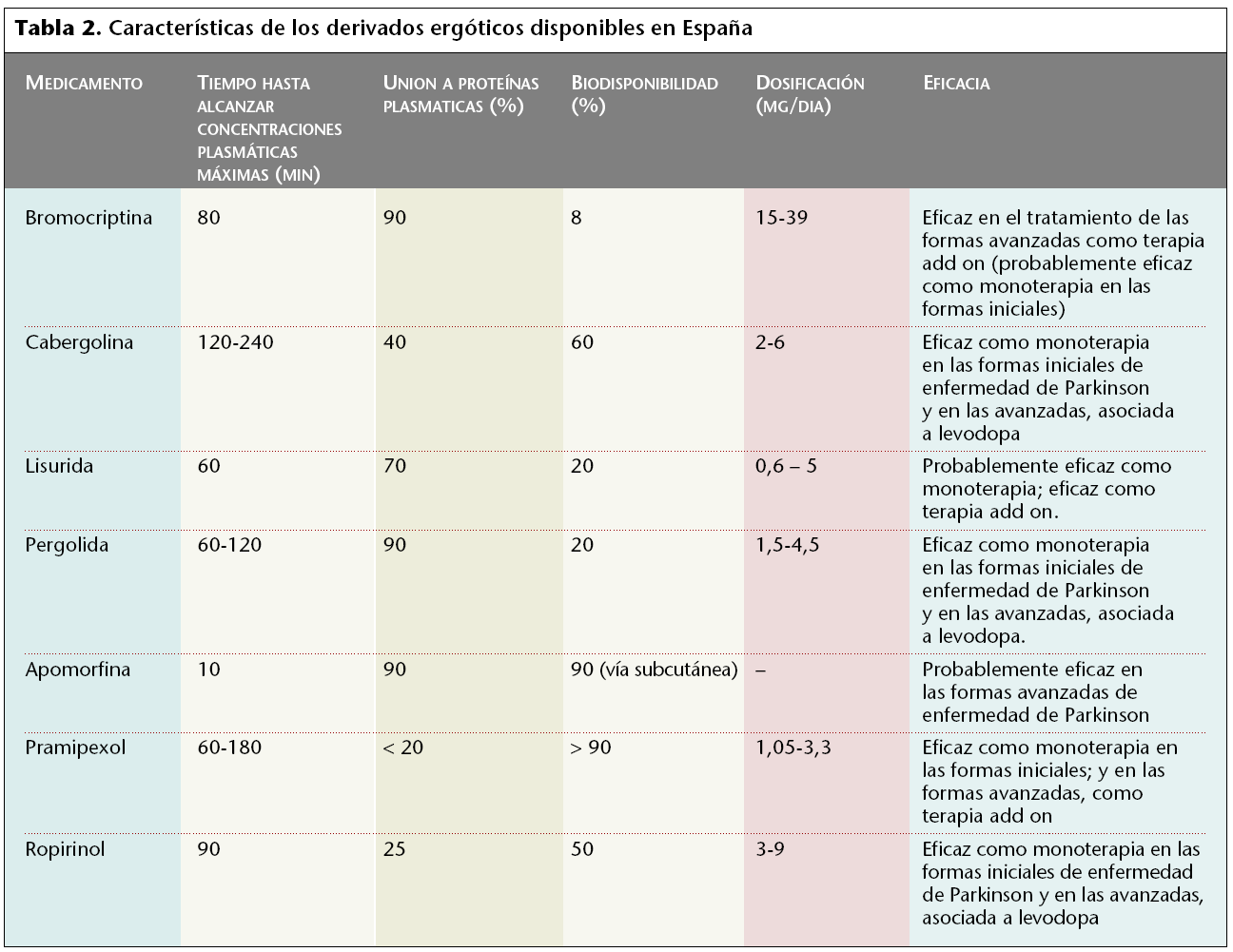
La lesión fundamental de la enfermedad de Parkinson recae en la parte compacta de la sustancia nigra, que forma parte de los ganglios basales. En esta enfermedad se produce una desaparición progresiva de las neuronas dopaminérgicas del sistema nigroestriado, con despigmentación y consecuente gliosis, mientras que en las neuronas supervivientes aparecen los cuerpos de Lewy. La degeneración axonal de las células nígricas en el estriado explica la disminución de la dopamina en esta localización y el fallo en la transmisión dopaminérgica. Esta afectación de los ganglios basales, cuya función es el mantenimiento de la postura corporal y de las extremidades, junto con la producción de movimientos espontáneos y automáticos que acompañan a los actos voluntarios, justifica las alteraciones motrices que aparecen con esta enfermedad (fig. 1).
Fig. 1. Sustancia nigra y dopamina en la enfermedad de Parkinson.
Desde la perspectiva epidemiológica, se calcula que en España hay unos 70.000 enfermos; se estima una incidencia de 16/100.000 personas y una prevalencia de 1.000/100.000 personas. La edad media de comienzo se sitúa en torno a los 55 años, teniendo la mayoría de los enfermos unas edades comprendidas entre los 50 y los 80 años de edad. Como ya se ha mencionado con antelación, su curso es progresivo y el proceso aumenta la mortalidad.
Clínicamente se caracteriza por un comienzo insidioso, por lo que en ocasiones su diagnóstico es difícil. Su inicio suele ser unilateral, aunque posteriormente se hace bilateral. Los síntomas guía incluyen los siguientes:
• Temblor, que es el primer síntoma en el 75% de los casos. Se caracteriza por ser de reposo, aunque a veces se presenta al mantener una postura, es grosero, desaparece con el sueño y empeora en situaciones de estrés. Afecta a las manos, los pies, la cara, la mandíbula y los músculos de la lengua.
• Bradicinesia (enlentecimiento de los movimientos), acinesia (dificultad para el movimiento) e hipocinesia (reducción de la amplitud de los movimientos). Afecta principalmente a la cara y a los músculos axiales, por lo que se convierte en uno de los síntomas más incapacitantes. Es responsable de la dificultad o bloqueo para comenzar algunos movimientos y de la micrografía, entre otras alteraciones.
• Rigidez causada por el aumento del tono, que conlleva una mayor resistencia para la realización del movimiento pasivo en la extremidad afectada.
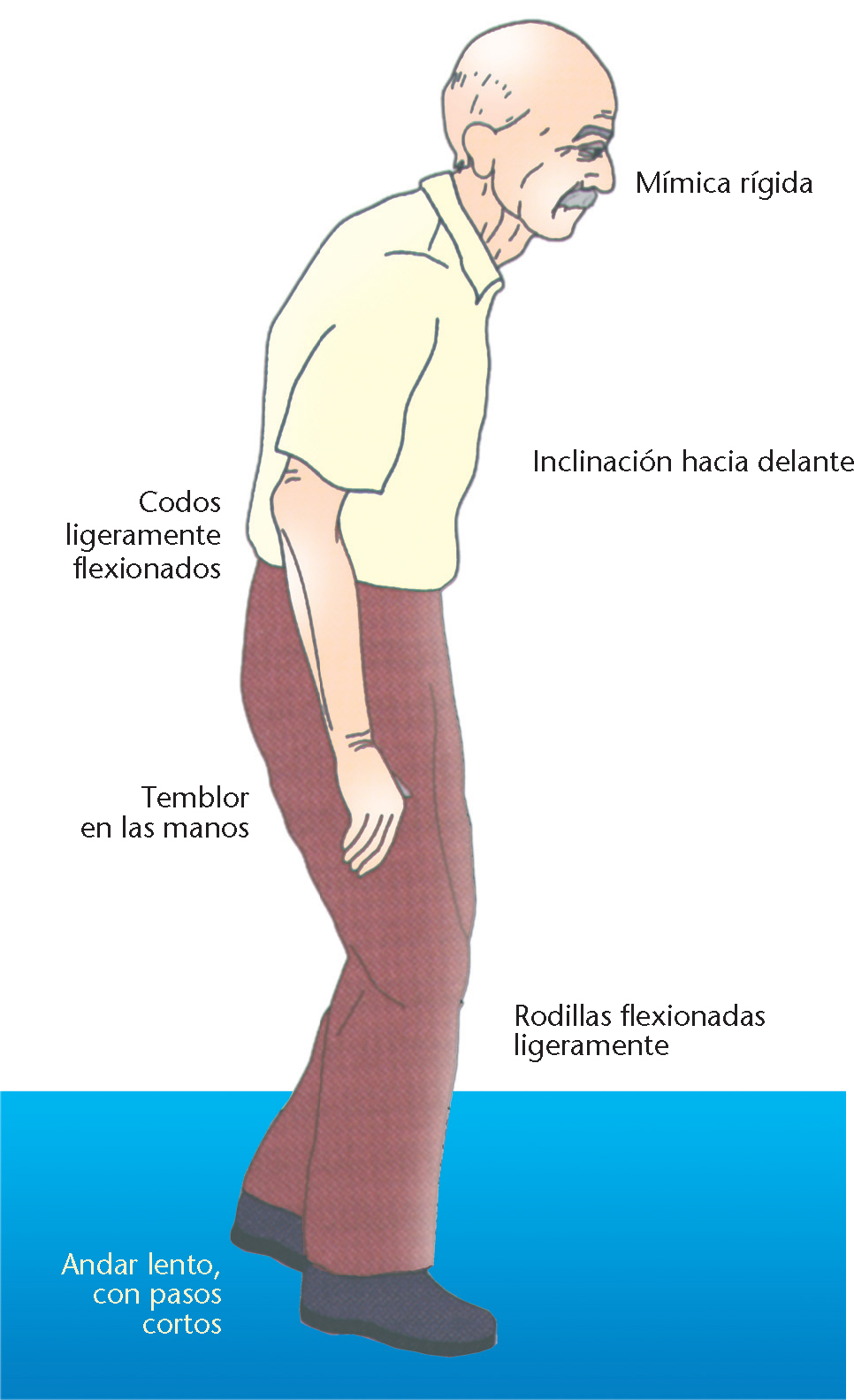
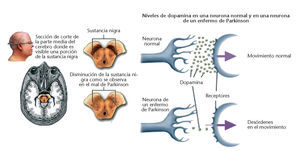
Otros síntomas que pueden objetivarse incluyen alteración de los reflejos posturales (fig. 2), afectación de la estabilidad y el equilibrio, trastornos cognitivos y neuropsiquiátricos, trastornos del sueño, del habla y de la deglución, trastornos sensoriales y alteraciones autonómicas.
Fig. 2. Postura típica del enfermo de Parkinson.
Su diagnóstico es exclusivamente clínico y es tan complejo que algunos autores recomiendan definirlo como «confirmado», «probable» o «posible» en función de la evolución de varios aspectos neurocognitivos que se obtienen de diferentes escalas.
Abordaje terapéutico
Una vez realizado el diagnóstico de la enfermedad de Parkinson, el médico debe tomar la decisión de tratar o no la enfermedad, y si el tratamiento está indicado, qué fármaco usar. Actualmente, el tratamiento se divide en 4 categorías:
• Preventiva o neuroprotectora. Interfiere con la causa que origina la muerte neuronal, con objeto de intentar evitar o enlentecer la progresión de la enfermedad.
• Sintomática. Su finalidad es restaurar la función dopaminérgica estriatal. Puesto que la enfermedad de Parkinson se produce por una deficiencia de dopamina en el cuerpo estriado, uno de los objetivos del tratamiento es restaurar los valores normales de esta sustancia.
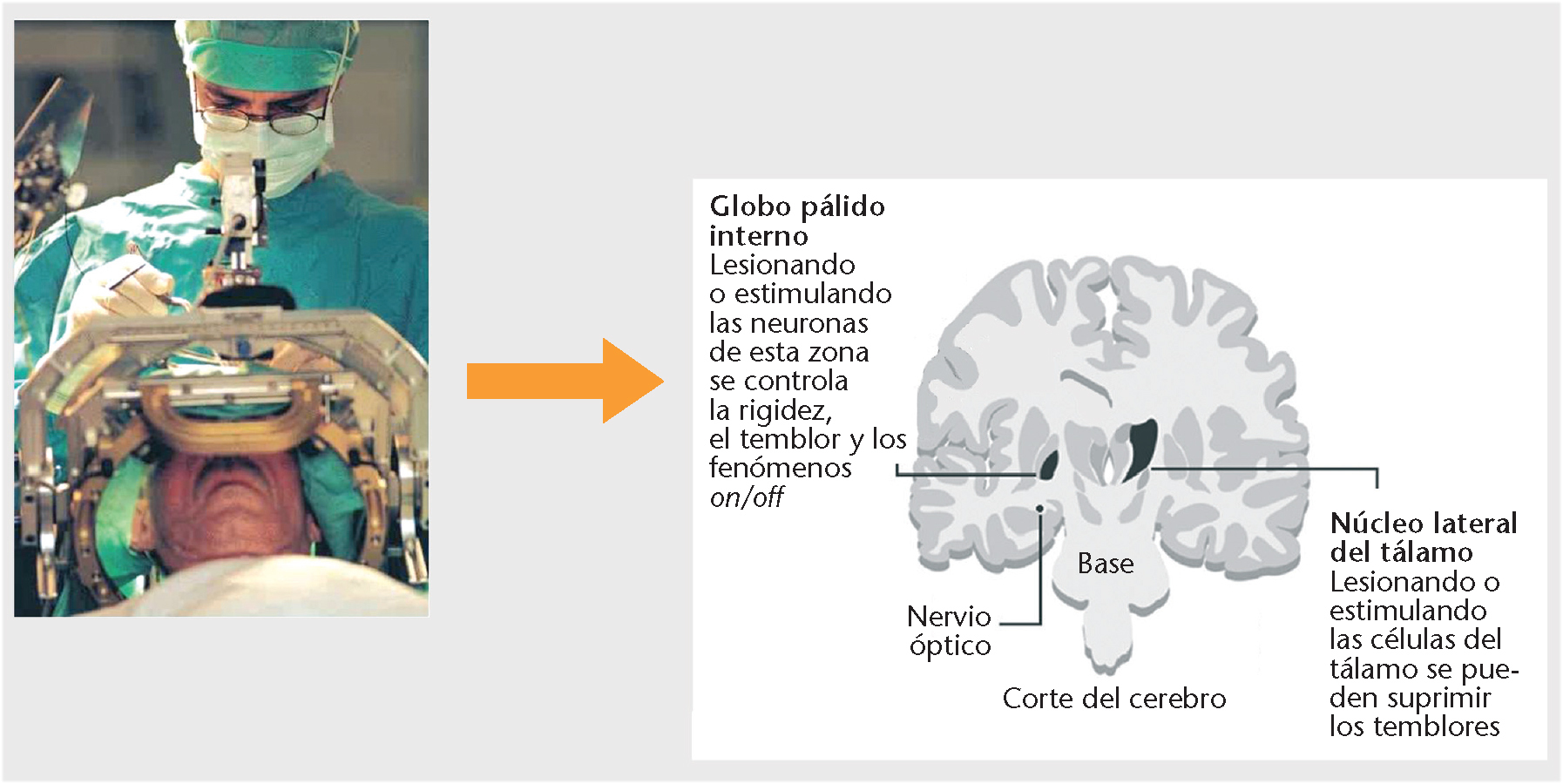
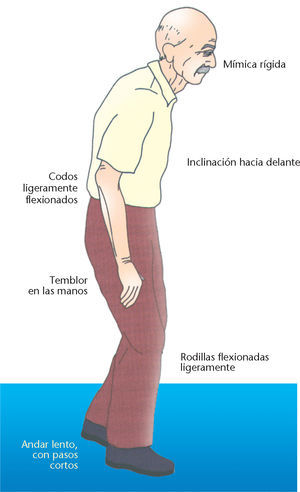
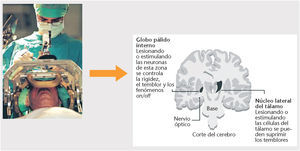
• Cirugía. A través de diferentes técnicas quirúrgicas (lesión o estimulación) se interfiere en los mecanismos fisiopatológicos de la enfermedad de Parkinson (fig. 3).
Fig. 3. Cirugía en la enfermedad de Parkinson.
• Restauradora. Esta terapia aporta nuevas células o estimula células normales o enfermas. A esta función se dedican buena parte de las investigaciones actuales, que intentan estimular las células para que produzcan más dopamina.
Farmacoterapia
Los objetivos del tratamiento farmacológico difieren en función de la situación del paciente:
• Ante un paciente con enfermedad de Parkinson en estadio inicial, el objetivo será mantener la autonomía e independencia de éste el mayor tiempo posible mediante el control de los síntomas.
• Si el paciente presenta enfermedad de Parkinson en estadio avanzado, el objetivo será controlar las complicaciones derivadas del uso de los fármacos en esta enfermedad (discinesias, fluctuaciones motoras o complicaciones neuropsiquiátricas).
Hasta el momento, ningún fármaco ha demostrado tener propiedades neuroprotectoras capaces de detener el curso de la enfermedad. Tampoco hay un consenso claro sobre cuál es el mejor fármaco para iniciar el tratamiento, ni cuándo es el momento preciso para hacerlo. Es conveniente esperar a tener un diagnóstico concreto y un plan de cuidados diseñado por un especialista; en general, no hay ninguna urgencia en iniciar el uso de fármacos.
Es recomendable iniciar el tratamiento cuando el paciente comience a notar que la sintomatología interfiere en sus actividades de la vida diaria y en su calidad de vida.
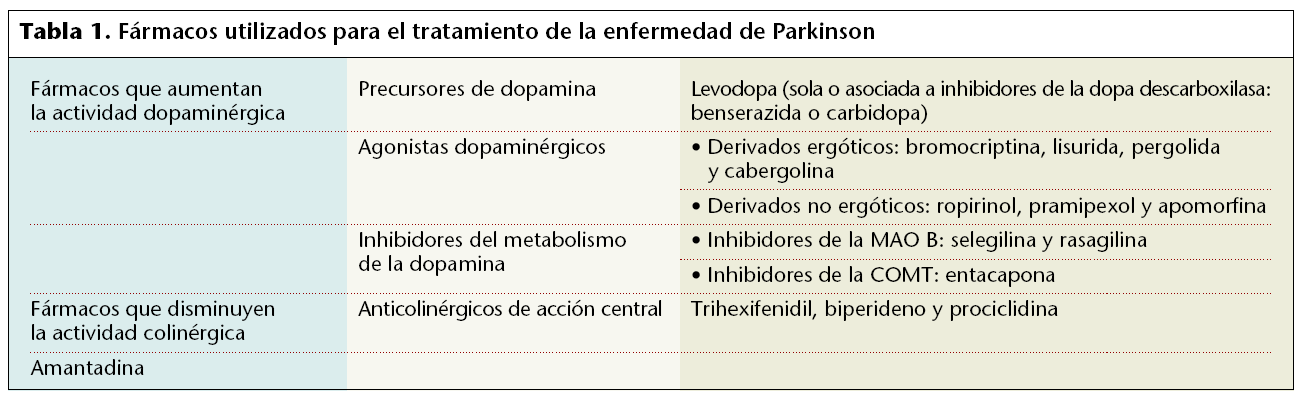
Los fármacos que se utilizan en la farmacoterapia de la enfermedad de Parkinson pueden clasificarse como se indica en la tabla 1.
La levodopa es en realidad la forma de aportar dopamina para compensar la deficiencia de este neurotransmisor
Levodopa
Este medicamento es en realidad la forma de aportar dopamina para compensar la deficiencia de este neurotransmisor. Actualmente es el fármaco disponible más eficaz para tratar la enfermedad de Parkinson.
La levodopa es, pues, un precursor de la dopamina que se absorbe en el tracto gastrointestinal y atraviesa la barrera hematoencefálica. Cuando se administra por vía oral, se metaboliza periféricamente por la dopa descarboxilasa y la catecol-O-metiltransferasa (COMT), lo que genera diversos metabolitos, responsables de sus efectos secundarios sistémicos. Por esta razón, actualmente la levodopa se adiciona con un inhibidor de la dopa descarboxilasa (carbidopa o benserazida) que no atraviesa la barrera hematoencefálica y actúa sobre la levodopa extracerebral, lo que permite minimizar esos efectos y disminuir sus requerimientos diarios.
Este fármaco reduce marcadamente la mayoría de los síntomas de la enfermedad (rigidez y bradicinesia principalmente, ya que es menos eficaz para otros como disfunción autónoma o demencia), prolonga el tiempo en que el paciente es capaz de realizar su vida normal e incluso hay trabajos que lo relacionan con una disminución de la mortalidad en estos pacientes. Las dosis medias oscilan entre 300 y 600 mg/día y es poco común superar los 1.000 mg/día. Habitualmente hay que individualizar la dosis necesaria del fármaco porque su respuesta no se correlaciona ni con la gravedad de los síntomas ni con el tiempo de evolución de la enfermedad. Conviene iniciar el tratamiento con dosis bajas, 50 mg 3 veces al día, junto con los alimentos, y aumentarla de forma progresiva 100-200 mg/día, para reducir así efectos secundarios. En las fases más avanzadas de la enfermedad debe tomarse 30-60 min antes de las comidas o 1-2 h después de ellas.
La respuesta al tratamiento es rápida, de tal forma que si con dosis de 1.000 mg/día los pacientes no mejoran, habrá que pensar que no se trata de una enfermedad de Parkinson idiopática.
En cuanto a su mecanismo de acción exacto, éste es desconocido. Se asume que es utilizada por las neuronas dopaminérgicas residuales, descarboxilada por la descarboxilasa de aminoácidos aromáticos de estas neuronas supervivientes y finalmente liberada en las terminales sinápticas del núcleo estriado. De acuerdo con esta hipótesis, la eficacia de la levodopa disminuiría paralelamente a la pérdida de neuronas dopaminérgicas; sin embargo, muchos pacientes siguen respondiendo al fármaco a lo largo de toda su enfermedad. Esto sugiere que hay mecanismos alternativos de manejo presináptico de levodopa y que el lugar exacto de la descarboxilación de la levodopa exógena a dopamina permanece desconocido. En el núcleo estriado la dopamina es preferentemente desaminada por la monoaminooxidasa (MAO) y metilada por la COMT central, lo que da lugar a ácido homovanílico. Sin embargo, la vía primaria que determina el fin del efecto de la dopamina es su recaptación dentro de la terminal sináptica. Hay evidencias que sugieren que la disminución de las células nígricas causa sobrerregulación de los receptores postsinápticos D2, lo que facilita la llamativa respuesta inicial a la levodopa como terapia sustitutiva en los pacientes con enfermedad de Parkinson no tratados.
A pesar de la eficacia de la levodopa, tiene problemas derivados de su empleo; estos problemas no sólo incluyen efectos adversos como náuseas, vómitos o hipotensión ortostática, sino otros más importantes como las fluctuaciones motoras, las discinesias y las alteraciones psíquicas que aparecen tras años de tratamiento (el 50% de los pacientes presenta fluctuaciones motoras a los 5 años). Estos problemas del uso de la levodopa a largo plazo no se sabe si se deben a la propia progresión de la enfermedad o a la levodopa en sí misma, pues se ha hablado de que sus metabolitos podrían actuar como neurotóxicos. Las fluctuaciones motoras suponen la aparición de períodos de empeoramiento en síntomas motores (períodos off) al final de cada intervalo posológico (wearing off) o alternados con otros de respuesta (fenómenos on/off).
Agonistas dopaminérgicos
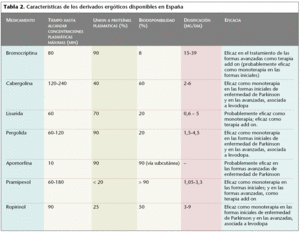
Estos fármacos estimulan directamente los receptores dopaminérgicos; en algunos casos los D1 y los D2, en otros los D2 solamente. Tienen las ventajas de su posible empleo en monoterapia o asociados a levodopa, una menor incidencia de fluctuaciones motoras y su posible (aunque no totalmente confirmado) papel neuroprotector. Sin embargo, presentan los otros efectos adversos de la levodopa (náuseas, vómitos, hipotensión ortostática, alteraciones neuropsiquiátricas), algunos otros específicos, sobre todo los compuestos con estructura de derivados ergóticos, como la eritromelalgia (tabla 2). Además, no son tan eficaces como la levodopa.
Inhibidores de la MAO B
La selegilina puede recomendarse antes de la introducción de fármacos dopaminérgicos. Utilizada en monoterapia proporciona una eficacia sintomática moderada. Sin embargo, no hay pruebas concluyentes de que los IMAO-B administrados en etapas tempranas retrasen de forma significativa la progresión de la enfermedad. Cuando se asocia con levodopa puede aumentar el período on y disminuir la dosis necesaria de levodopa hasta un 25%, aunque no detiene la progresión de la enfermedad ni previene las discinesias a largo plazo.
No hay evidencia suficiente como para decir que este fármaco ejerce un efecto neuroprotector.
La dosis inicial de selegilina es de 5 mg/día y al cabo de una semana, si no han ocurrido efectos secundarios, se puede pasar a 10 mg/día, aunque dosis menores se emplean principalmente en pacientes ancianos que han experimentado efectos secundarios.
La rasagilina es la última aportación a este grupo farmacológico. En pacientes con fluctuaciones motoras, reduce los períodos off.
Inhibidores de la COMT
Estos fármacos aumentan los valores cerebrales de levodopa al inhibir su metabolismo. Su uso, por tanto, está indicado en asociación con levodopa en pacientes con dopaterapia y fluctuaciones motoras. En este sentido, aumentan los períodos on y disminuyen los off en pacientes con estas fluctuaciones, en enfermedad leve a moderada.
El hecho de que aparentemente también mejore la función motora en pacientes sin fluctuaciones, hace que algunos autores propongan su uso asociado a la levodopa desde el inicio del tratamiento, aunque este punto aún no está establecido con claridad. El uso de inhibidores de la COMT, sin embargo, puede aumentar el riesgo de discinesias.
En la actualidad, en Europa sólo está disponible como agente de este grupo entacapona. Su dosificación es de 200 mg con cada dosis de levodopa (máximo, 2 g/día). El primer agente comercializado, tolcapona, fue retirado por problemas de toxicidad hepática.
Anticolinérgicos
Fueron una de las primeras terapias antiparkinsonianas. En este caso, su efecto se basa en su antagonismo de la neurotransmisión colinérgica central. Puede que también tengan una acción inhibidora de la recaptación de dopamina.
Su eficacia se limita casi de manera exclusiva al temblor, la sialorrea y otros síntomas vegetativos; además, sus efectos adversos pueden limitar su uso. Todo esto justifica que sean fármacos más empleados en pacientes relativamente jóvenes, en los que el síntoma predominante es el temblor.
No contamos con datos suficientes para recomendar el uso preferente de alguno de ellos.
Las dosis se prescribirán de forma individualizada y se aumentarán progresivamente hasta alcanzar el control terapéutico; su retirada también se hará de forma gradual para no empeorar los síntomas motores. La dosificación más usual es la siguiente: biperideno (1-4 mg/día), prociclidina (7,5-30 mg/día) y trihexifenidilo (1-10 mg/día).
Amantadina
Antiviral utilizado para el tratamiento de la gripe, tiene también efecto antiparkinsoniano, aunque por un mecanismo no muy bien conocido: puede mejorar la transmisión dopaminérgica, posee algunas propiedades anticolinérgicas y últimamente se ha subrayado su carácter como antagonista NMDA.
Suele ser más efectivo que los anticolinérgicos en el control de la bradicinesia y la rigidez, y menos en el control del temblor. Puede utilizarse en las fases iniciales de la enfermedad cuando la bradicinesia y la rigidez predominan sobre el temblor, y en fases más avanzadas para el control de las discinesias y fluctuaciones motoras, aunque con precaución por el riesgo de desarrollar deterioro cognitivo. Se administra en monoterapia, con anticolinérgicos o con levodopa. Su eficacia clínica parece disminuir a lo largo de los meses.
La dosis utilizada es de 200-300 mg/día, aunque, al igual que ocurre con otros fármacos antiparkinsonianos, su introducción y su retirada deben ser graduales.
Sus efectos secundarios incluyen edemas maleolares, livedo reticularis y boca seca. Por lo general, estos efectos son transitorios y reversibles.
Controversias en el tratamiento
En el tratamiento de la enfermedad de Parkinson no se han establecido evidencias concluyentes respecto a los siguientes puntos:
• Que la levodopa sea neurotóxica y contribuya a la producción de la enfermedad por su capacidad de generar radicales libres en el paso de levodopa a dopamina, lo que puede inducir estrés oxidativo y aumentar el daño de la sustancia nigra. De hecho, hay estudios recientes que señalan que puede ser neurotrófica.
• Que la selegilina enlentezca la progresión de la enfermedad de Parkinson en fases tempranas. No se ha demostrado clínicamente un efecto neuroprotector, pero hay estudios que indican que puede disminuir las necesidades de levodopa a largo plazo en pacientes con enfermedad en estadios iniciales.
• Que deba retrasarse el comienzo del tratamiento con levodopa; en este sentido, aunque hay indicios racionales, se han esgrimido razones teóricas para retrasar su administración (complicaciones a largo plazo de la enfermedad: discinesias y fluctuaciones). Faltan, de momento, datos concluyentes sobre los beneficios de retrasar el inicio de la levodopaterapia y/o disminuir las dosis de levodopa con el empleo de otros fármacos.
• Tampoco se ha demostrado el argumento opuesto, lo que equivale a decir que no hay consenso en el tema de que los factores determinantes para el desarrollo de fluctuaciones y discinesias sean la gravedad de los signos motores en el momento del inicio de la levodopaterapia y la evolución de la enfermedad, por lo que no habría razón para retrasar el inicio de la terapia con levodopa en pacientes con incapacidad significativa.
• Que la prolongación de la estimulación dopaminérgica que se obtiene con los preparados retardados de levodopa o la combinación temprana de levodopa y un agonista dopaminérgico pueda retrasar a largo plazo la aparición de fluctuaciones motoras y discinesias.
• Que los agonistas dopaminérgicos actualmente disponibles difieran significativamente en sus efectos clínicos debido a su diferente estructura química y capacidad de estimular diferentes receptores.
• Que los agonistas dopaminérgicos tengan un efecto neuroprotector al minimizar la formación de metabolitos oxidativos potencialmente tóxicos.
• Que la neurocirugía funcional (palidotomía, estimulación palidal y subtalámica) sea capaz de proporcionar una mejoría duradera de la mayoría de los síntomas en pacientes con enfermedad avanzada y de conseguir una disminución efectiva a largo plazo del tratamiento de reemplazo dopaminérgico. La evidencia es todavía incompleta, pero ya se han publicado trabajos que apuntan datos positivos en ambos sentidos.
Faltan de momento datos concluyentes sobre los beneficios de retrasar el inicio de la levodopaterapia y/o disminuir las dosis de levodopa con el empleo de otros fármacos
Bibliografía general
Agonistas dopaminérgicos en el tratamiento inicial de la enfermedad de Parkinson. Boletín Terapéutico Andaluz. 2006;22:5-8.
Casariego E, Castiñeira MC, Costa C, González C, Louro A, Viana C. Enfermedad de Parkinson. Guías Clínicas 2007 [consultado 15-2-2007]. Disponible en: http://www.fisterra.com/guias2/parkinson.asp#mismo
Enfermedad de Parkinson. El médico interactivo (serie en Internet); 2001 [consultado 15-2-2007]. Disponible en: http://www.medynet.com/ elmedico/aula2001/tema9/parkinson.htm
Enfermedad de Parkinson. Guía terapéutica de la Sociedad Catalana de Neurología; 1999 [consultado 15-2-2007]. Disponible en: http://www.scn.es/sp/form/guias/park/parkinson.htm
Herreros A, Ferrari JM, Goyache MP, Porta J. Neurología. Libro de Farmacia Hospitalaria. Tomo 2 [consultado 15-2-2007]. Disponible en: http://sefh.interguias.com/libros/tomo2/Tomo2_Cap13.pdf
Pastor P, Tolosa E. La enfermedad de Parkinson: diagnóstico y avances en el conocimiento de la etiología y en el tratamiento. Medicina Integral. 2001;37:104-17.