El trastorno de conducta de sueño REM (TCSR) se caracteriza por conductas violentas (gritos, patadas, sueños vívidos) durante la fase REM del sueño. Tiene una prevalencia del 1-2% de la población general, especialmente en varones y en mayores de 60 años. En la última década se ha asociado como pródromo a una enfermedad neurodegenerativa. Nos proponemos analizar las patologías asociadas a los 33 pacientes con TCSR atendidos en la Unidad Multidisciplinar de Trastornos del Sueño del Hospital Infanta Sofía, y su respuesta al tratamiento farmacológico.
Pacientes y métodosAnálisis descriptivo, retrospectivo, observacional, de los pacientes con diagnóstico de TCSR, atendidos en la consulta monográfica de Neurología, desde octubre de 2012 hasta diciembre de 2015. Se valoran la edad, el sexo, las enfermedades asociadas, y los tratamientos empleados.
ResultadosDe los 365 pacientes valorados en la consulta, 33 presentan TCSR: 13 mujeres (40%) y 20 hombres (60%), con una edad media de 62,72 años. En el 48% se identifica una patología asociada: la más frecuente es el deterioro cognitivo leve (69%). El porcentaje de TCSR con patología asociada en mayores de 60 años se eleva al 68%. El 82% de los casos han requerido tratamiento. El fármaco más utilizado ha sido el clonazepam (76%), seguido de melatonina (9%), gabapentina (6%) y trazodona (3%).
DiscusiónEn nuestra serie el 48% de los pacientes presentan una patología asociada. La mayor edad influye directamente en la posibilidad de encontrar una patología asociada. La gran mayoría han precisado tratamiento farmacológico por la severidad de los síntomas, siendo el clonazepam (76%) el fármaco más utilizado.
REM sleep behaviour disorder (RBD) is characterised by violent behaviours (screaming, kicking, vivid dreams) during REM sleep. It has a prevalence of 1% to 2% of the general population and is especially frequent in men and the population older than 60. In the last decade, RBD has been suggested to be a prodrome of neurodegenerative disease. We analysed associated neurological diseases and responses to drug treatment in 33 patients with RBD treated in the multidisciplinary sleep disorders unit at Hospital Infanta Sofía.
Patients and methodsWe conducted an observational descriptive retrospective analysis of patients diagnosed with RBD and treated in our multidisciplinary sleep disorders unit between October 2012 and December 2015. We recorded age, sex, associated diseases, and treatments administered to these patients.
ResultsA total of 365 patients were attended at our unit, including 33 with RBD: 13 women (40%) and 20 men (60%). Mean age was 62.72 years. An associated disorder was identified in 48%, with the most common being mild cognitive impairment (69%). The percentage of patients with RBD and an associated disorder among patients older than 60 was 68%. Eighty-two percent of the patients required treatment. The most commonly used drug was clonazepam (76%), followed by melatonin (9%), gabapentin (6%), and trazodone (3%).
DiscussionIn our series, 48% of the patients had an associated disorder. The likelihood of detecting an associated disorder increases with patients’ age. The vast majority of patients required drug treatment due to symptom severity; the most frequently administered drug was clonazepam (76%).
Los trastornos del sueño son muy prevalentes en la población general, llegando a afectar al 30% de la población a lo largo de la vida. Dentro de los más frecuentes, destacan sin duda: el insomnio, el síndrome de apneas-hipopneas (SAHS), el síndrome de piernas inquietas (SPI), y el bruxismo. Sin embargo, la prevalencia del trastorno de conducta de sueño REM (TCSR) es muy inferior, estando en el 1-2% de la población mayor de 60 años, habitualmente en varones. Se caracteriza por conductas violentas de los pacientes (gritos, patadas, insultos, sueños vívidos) durante la fase de sueño REM, con una pérdida de la atonía muscular, característica de esta fase, y pesadillas1,2. Los pacientes suelen recordar parte de estos episodios (especialmente los sueños desagradables), encontrándose al despertar cansados y con somnolencia diurna3-5.
El TCSR se conoce desde hace más de 30 años1,2. Varios trabajos más han documentado casos aislados, o pequeñas series de patologías neurológicas asociadas a este trastorno, como narcolepsia, enfermedad de Parkinson (EP), deterioro cognitivo leve (DCL), atrofia multisistémica (AMS), enfermedad de Alzheimer (EA), enfermedad de Huntington, demencia frontotemporal (DFT), degeneración corticobasal (DCB)6-15, y parálisis supranuclear progresiva (PSP)16,17. Aunque la prevalencia de TCSR en mayores de 60 años es muy baja (1-2%), en el año 2015, y como parte de los criterios de EP prodrómica de Berg et al., se ha valorado que más del 75% de pacientes con TCSR en 5 series publicadas evolucionan a una sinucleinopatía18; especialmente en pacientes mayores de 60-65 años, en quienes la probabilidad de padecer EP también comienza a aumentar (1,25% a los 60 años, 2% a los 65 años)18.
En el año 1996 apareció la primera referencia a la posible relación entre la EP y el TCSR: Schenk et al. publicaron una serie de 29 pacientes, en la que el 38% de estos fueron inicialmente diagnosticados de TCRS2; posteriormente, en 2006, autores españoles describieron una serie de 44 pacientes con TCSR y su asociación con enfermedades neurodegenerativas en el 45% de los casos6. Esta segunda serie tiene, además, el interés de que los mismos autores describen en 2013 la evolución de su serie de 44 pacientes, y cómo han pasado del 45% con una enfermedad neurodegenerativa asociada, al 82% (especialmente pacientes con EP y demencia por cuerpos de Lewy)7.
Nos proponemos analizar los casos de TCSR atendidos en la Unidad Multidisciplinar de Trastornos del Sueño del Hospital Infanta Sofía, la presencia de patologías asociadas y los tratamientos empleados.
Pacientes y métodosEl Hospital Universitario Infanta Sofía, de San Sebastián de los Reyes, pertenece a la red de hospitales públicos de la Comunidad de Madrid. Tiene un área sanitaria asignada de 305.000 habitantes.
Desde la apertura del hospital en 2008 se creó la Unidad Multidisciplinar de Trastornos del Sueño. Actualmente está formada por los servicios de Neurología, Neumología, Pediatría y Otorrinolaringología, con consultas monográficas de trastornos del sueño y un laboratorio de sueño, con 3 camas hospitalarias polivalentes donde se realizan polisomnografías (PSG), test de latencias múltiples, poligrafías respiratorias, y monitorización video-EEG, compartido entre estos servicios.
Realizamos un análisis descriptivo, retrospectivo, observacional, de los pacientes con diagnóstico de TCSR, atendidos en la consulta de Neurología de nuestro centro, desde octubre de 2012 hasta diciembre de 2015. Se ha empleado el programa estadístico SPSS 19 para el registro y análisis de los resultados. Para el diagnóstico de TCSR, se deben cumplir los criterios diagnósticos internacionales (tabla 1) y se debe haber realizado una PSG nocturna en el 100% de los pacientes. Aquellos con sospecha clínica de TCSR, pero sin PSG hecha, no se han incluido en este trabajo.
Criterios diagnósticos del trastorno de conducta de sueño REM (TCSR)
| Criterios diagnósticos | |
|---|---|
| A | Presencia de un sueño REM sin atonía: aumento de la actividad electromiográfica en el mentón o un aumento de la actividad fásica electromiográfica en el mentón o en las extremidades (inferiores o superiores) |
| B | Como mínimo uno de estos dos: Historia de conductas vigorosas durante el sueño que producen lesiones, tienen el riesgo de producir lesiones o fragmentan la continuidad del sueño Conductas anormales durante el sueño REM detectadas durante el estudio polisomnográfico |
| C | Ausencia de actividad epileptiforme durante el sueño REM coincidiendo con la actividad motora |
| D | El trastorno del sueño no se explica por otra alteración del sueño, enfermedades médicas, neurológicas o psiquiátricas, o por el uso de un fármaco o una sustancia |
Fuente: Clasificación internacional de los trastornos del suñeo ICSD-3.
Para el diagnóstico de pacientes con DCL y EA, hemos considerado los criterios del National Institute of Aging and The Alzheimer's Association group (NIA-AA) de McKhann et al.19 y de Sperling et al.20. Para el diagnóstico de EP se han considerado los criterios internacionales descritos por Suchowersky et al.21 de la Academia Americana de Neurología, y para el diagnóstico del paciente con DCB, los criterios de Amstrong et al.22.
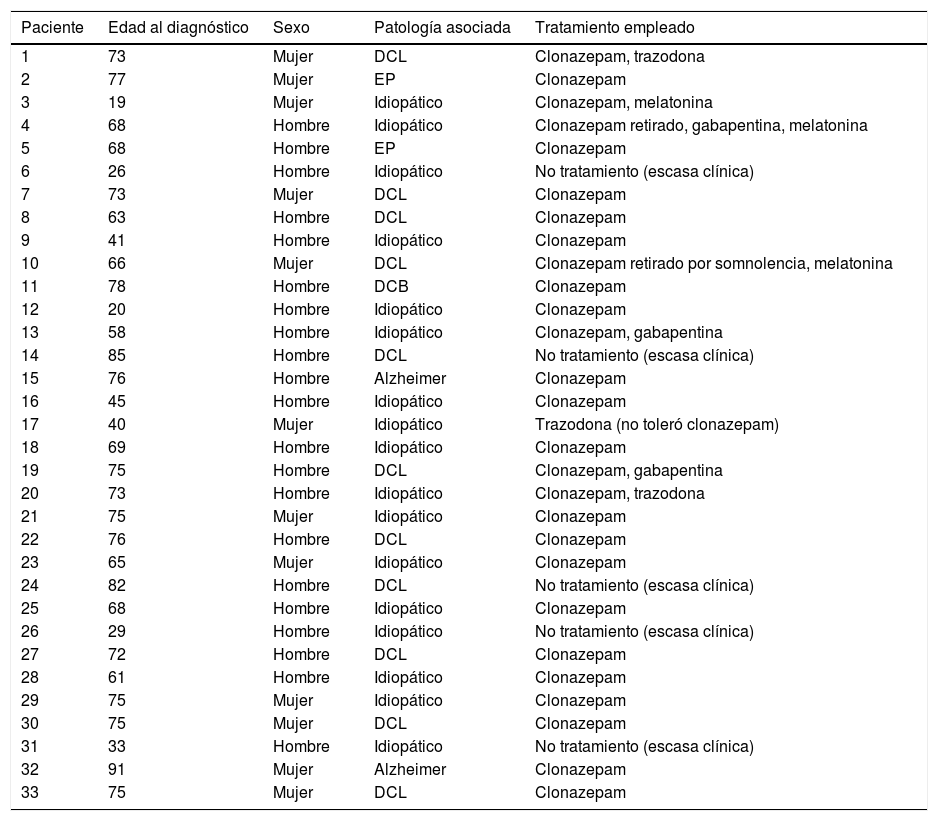
ResultadosDe los 365 pacientes, valorados en la consulta de Neurología de la Unidad Multidisciplinar de Sueño, se han diagnosticado 33 pacientes con TCSR: 13 mujeres (40%) y 20 hombres (60%), con una edad media al diagnóstico de 62,72 años (rangos de edad desde los 19 a los 91 años) (tabla 2).
Descripción de los pacientes incluidos en nuestra serie
| Paciente | Edad al diagnóstico | Sexo | Patología asociada | Tratamiento empleado |
|---|---|---|---|---|
| 1 | 73 | Mujer | DCL | Clonazepam, trazodona |
| 2 | 77 | Mujer | EP | Clonazepam |
| 3 | 19 | Mujer | Idiopático | Clonazepam, melatonina |
| 4 | 68 | Hombre | Idiopático | Clonazepam retirado, gabapentina, melatonina |
| 5 | 68 | Hombre | EP | Clonazepam |
| 6 | 26 | Hombre | Idiopático | No tratamiento (escasa clínica) |
| 7 | 73 | Mujer | DCL | Clonazepam |
| 8 | 63 | Hombre | DCL | Clonazepam |
| 9 | 41 | Hombre | Idiopático | Clonazepam |
| 10 | 66 | Mujer | DCL | Clonazepam retirado por somnolencia, melatonina |
| 11 | 78 | Hombre | DCB | Clonazepam |
| 12 | 20 | Hombre | Idiopático | Clonazepam |
| 13 | 58 | Hombre | Idiopático | Clonazepam, gabapentina |
| 14 | 85 | Hombre | DCL | No tratamiento (escasa clínica) |
| 15 | 76 | Hombre | Alzheimer | Clonazepam |
| 16 | 45 | Hombre | Idiopático | Clonazepam |
| 17 | 40 | Mujer | Idiopático | Trazodona (no toleró clonazepam) |
| 18 | 69 | Hombre | Idiopático | Clonazepam |
| 19 | 75 | Hombre | DCL | Clonazepam, gabapentina |
| 20 | 73 | Hombre | Idiopático | Clonazepam, trazodona |
| 21 | 75 | Mujer | Idiopático | Clonazepam |
| 22 | 76 | Hombre | DCL | Clonazepam |
| 23 | 65 | Mujer | Idiopático | Clonazepam |
| 24 | 82 | Hombre | DCL | No tratamiento (escasa clínica) |
| 25 | 68 | Hombre | Idiopático | Clonazepam |
| 26 | 29 | Hombre | Idiopático | No tratamiento (escasa clínica) |
| 27 | 72 | Hombre | DCL | Clonazepam |
| 28 | 61 | Hombre | Idiopático | Clonazepam |
| 29 | 75 | Mujer | Idiopático | Clonazepam |
| 30 | 75 | Mujer | DCL | Clonazepam |
| 31 | 33 | Hombre | Idiopático | No tratamiento (escasa clínica) |
| 32 | 91 | Mujer | Alzheimer | Clonazepam |
| 33 | 75 | Mujer | DCL | Clonazepam |
En nuestra serie, el porcentaje de varones es discretamente mayor (60%), con una edad media de inicio de la enfermedad por encima de los 60 años. En este grupo de edad, el porcentaje de pacientes idiopáticos es mucho menor que en el de los pacientes más jóvenes (32% frente al 100% del segundo sector).
Los pacientes son derivados principalmente desde la consulta de Neurología (29 de ellos, 88%), 2 de ellos desde la consulta de Psiquiatría (6%) y otros 2 (6%) desde la consulta de Neumología. De los pacientes derivados desde Neurología, 12 (36%) han sido remitidos desde las consultas monográficas de trastornos del movimiento y trastornos cognitivos, con un diagnóstico previo concreto.
Descripción de la patología asociadaDel total de pacientes, 17 (52%) son catalogados como idiopáticos, al no reunir criterios de otras patologías, ni haberse podido identificar una causa o desencadenante concreto. En 16 pacientes (48%) hemos podido identificar una patología asociada: la más frecuente es el DCL (11 casos, 69%), seguido de 2 pacientes (6%) con EA, 2 pacientes con EP (6%), y uno con DCB (3%).
En los pacientes mayores de 60 años, el porcentaje de casos en los que se asocia otra patología es del 68%23. Sin embargo, ninguno de los 8 pacientes menores de 60 años asocia otra patología hasta el momento.
Descripción de los tratamientos empleadosDe los 33 pacientes, 27 (82%) ha requerido tratamiento por la intensidad del trastorno. El más utilizado ha sido el clonazepam (25 pacientes, 76%), siendo retirado en 3 de ellos por somnolencia diurna excesiva. También se ha empleado melatonina en 7 pacientes, manteniéndolo en 3 de ellos (9%), y siendo retirado en 4 pacientes por baja eficacia, no por efectos secundarios ni por interacciones. En 3 pacientes (9%) se ha necesitado un segundo fármaco coadyuvante al clonazepam (uno con insomnio, al que se añadió trazodona, y 2 con movimientos periódicos de las piernas [MPP] asociados, a los que se añadió gabapentina). Se obtuvo un buen control sintomático de ambos procesos en todos los casos. Por escasa sintomatología, 6 pacientes no precisaron tratamiento (18%).
DiscusiónEn nuestra serie, observamos que el 88% de los pacientes han sido derivados desde el servicio de Neurología, habitualmente procedentes de las consultas de Neurología General (42%), y el 36% de las consultas monográficas de trastornos de movimiento y trastornos cognitivos. Desde estas 2 consultas se derivan solo aquellos pacientes con dudas clínicas, que ya están diagnosticados de otro trastorno. En la práctica diaria, muchos pacientes seguidos por patologías neurodegenerativas bien establecidas, como EP o EA, refieren trastornos del sueño, como el TCSR. Dado que es conocida su relación con estas enfermedades, o por el grado de enfermedad del paciente (episodios de agitación nocturna, insomnio, cambios de ciclo sueño-vigilia, agresividad, dificultad por parte de sus cuidadores para traer al paciente al hospital), habitualmente no se derivan de rutina para realizar pruebas específicas como la PSG nocturna7-16. En nuestro caso, esto provoca un sesgo de selección, dado que la posibilidad de realización de PSG se ofrece a los pacientes de estas consultas monográficas cuyo nivel cognitivo-conductual, y apoyo social de sus cuidadores, a priori permitan realizar la prueba correctamente (considerando como tal la realización de PSG en nuestro laboratorio, con al menos 6h de sueño)4,23.
Como en las series previamente descritas, las patologías que más se asocian al TCSR en nuestro caso son la EP, EA, DCB y DCL, aunque tenemos menos casos de EP y EA que en otras series, como ya hemos comentado. Sin embargo, y aunque es conocida su relación como taupatía asociada a TCSR, tenemos un caso de DCB asociado a TCSR, cuando apenas se encuentran casos en la literatura (solo 3 más publicados)12,13. El TCSR se asocia también a otras causas no neurológicas, como fármacos (los más frecuentes son los antidepresivos), tóxicos (alcohol), encefalitis (infecciosas, paraneoplásicas), o alteraciones hormonales24,25. Solo en 2 casos de nuestra serie se sospechó la etiología farmacológica, retirando el tratamiento con antidepresivos (inhibidores de la recaptación de serotonina), pero no se obtuvo clara mejoría.
Como era esperable, en esta serie también es más frecuente en varones que en mujeres, pero la edad media de nuestros pacientes es menor que en otras series (edad media: 62,72 años). En la serie de Iranzo et al.6,7, valoraron retrospectivamente 44 pacientes consecutivos (39 hombres, 5 mujeres) con una edad media mayor que la nuestra (74 años frente a 62,72 años), describiendo la patología asociada (no los tratamientos empleados). Interpretamos que la edad media es menor que en esta serie porque, en la actualidad, y comparado con los datos del año 2006, el grado de conocimiento de la enfermedad hace que se busque precozmente esta patología en consulta.
Aquellos que han sido diagnosticados finalmente (con clínica sugestiva y PSG nocturna confirmatoria) son tratados específicamente para este problema, independientemente de la enfermedad neurodegenerativa existente (en los casos en los que se presenta). En la literatura, la primera opción es el clonazepam a dosis de 2-4mg (mejoría en el 80-90% de casos), y la melatonina a dosis de entre 3 y 12mg, cuando la sintomatología afecta al paciente26-29. También se ha descrito en casos aislados o series pequeñas de pacientes respuesta a pramipexol o a donepezilo30-32. Los fármacos que se emplean habitualmente no evitan ni modifican la evolución en los casos en que preceden a enfermedades neurodegenerativas.
En cuanto a los 2 pacientes con EP asociada de nuestra serie, la respuesta a levodopa-carbidopa es buena para su enfermedad de base, estando, con dosis bajas, asociados a pramipexol. Sin embargo, este tratamiento tiene escaso efecto para la patología nocturna, por lo que en ambos casos se ha asociado clonazepam a dosis bajas (0,5-1mg nocturno), específicamente para la corrección del TCSR33,34. En el paciente con DCB, se probó tratamiento con levodopa-carbidopa a dosis bajas, con escasa respuesta tanto a su enfermedad de base como para el TCSR, por lo que se empleó también clonazepam.
La gran mayoría de los pacientes de nuestra serie han precisado tratamiento farmacológico (82%) por la severidad de los síntomas26. Principalmente, el motivo de solicitud de tratamiento ha sido más la intensidad de los gritos y movimientos bruscos (que alarman a las parejas) (60%), que la excesiva somnolencia diurna (20%), o la preocupación por el diagnóstico (20%). Aunque los más empleados habitualmente son clonazepam y melatonina, la melatonina ha sido poco utilizada26-29. Existe en este caso un factor que influye directamente (expresado por los pacientes) en la baja utilización de la melatonina, y es el coste del tratamiento. Dado que las dosis efectivas son mayores de 3mg diarios, el coste medio actual es superior a los 20-25 euros mensuales, y no está financiado por nuestro sistema sanitario en la actualidad, por lo que algunos pacientes han tenido dificultades para costearlo, abandonándolo voluntariamente (independientemente de la eficacia). En la actualidad lo mantienen 3 de los 33 pacientes (9%). Con respecto a los otros 2 fármacos empleados (gabapentina y trazodona)35, se eligieron por la comorbilidad (insomnio y MPP), siendo efectivos tanto para estos 2 problemas como para la intensidad del TCSR.
Al igual que en nuestra serie, hay más publicaciones que asocian el TCSR con MPP: Fantini et al. publicaron en 2002 una serie de 40 pacientes con TCSR asociado a MPP36, y muy recientemente, en 2016, Lo Coco et al. han publicado una serie de 41 pacientes con MPP y TCSR en pacientes con esclerosis lateral amiotrófica (ELA)37. En estos pacientes, se observan MPP asociados al TCSR en un número mayor del comparado con el encontrado en controles sanos. Sin embargo, en estas series no se comentan los tratamientos empleados.
En nuestro caso, vemos una relación directa entre la posibilidad de diagnosticar una patología asociada al TCSR en pacientes con mayor edad (mayores de 60 años), siendo el DCL el trastorno más relacionado en nuestro caso con el TCSR, sin olvidar el riesgo de EP17,38,39. La gran mayoría de los pacientes han precisado tratamiento farmacológico, siendo el clonazepam (76%) el fármaco más eficaz en monoterapia, y utilizando como segunda línea la melatonina. En el 9% hemos empleado otros tratamientos (gabapentina y trazodona), con buen control sintomático en todos los casos.
Conflicto de interesesLos autores declaran ausencia de conflicto de intereses. Así mismo, ningún autor ha recibido financiación ni parcial ni total por ningún laboratorio farmacéutico en relación con este artículo.
Este trabajo ha sido presentado parcialmente en la Reunión Anual de la Sociedad Española de Neurología en 2015.