La escala Relevant Outcome Scale for Alzheimer's Disease (ROSA) es una herramienta útil para la evaluación y seguimiento de pacientes con demencia. Nuestro objetivo es evaluar la validez y fiabilidad de una versión española de la escala ROSA.
Pacientes y métodosEstudio multicéntrico nacional en el que 39 investigadores han incluido 237 sujetos con enfermedad de Alzheimer (78 en estadio leve, 79 moderado y 80 grave) a los que se les ha aplicado Mini-Mental, Fototest, Neuropsychiatric Inventory (NPI), escala de Blessed y una versión adaptada al español de la escala ROSA. En una submuestra de 40 sujetos se realizó un retest en los 14 días siguientes a la evaluación inicial. La validez de constructo se ha evaluado mediante el coeficiente correlación de Spearman (r), la consistencia interna con el coeficiente alfa de Cronbach (alfa) y la fiabilidad test-retest con el coeficiente correlación intraclase (CCI).
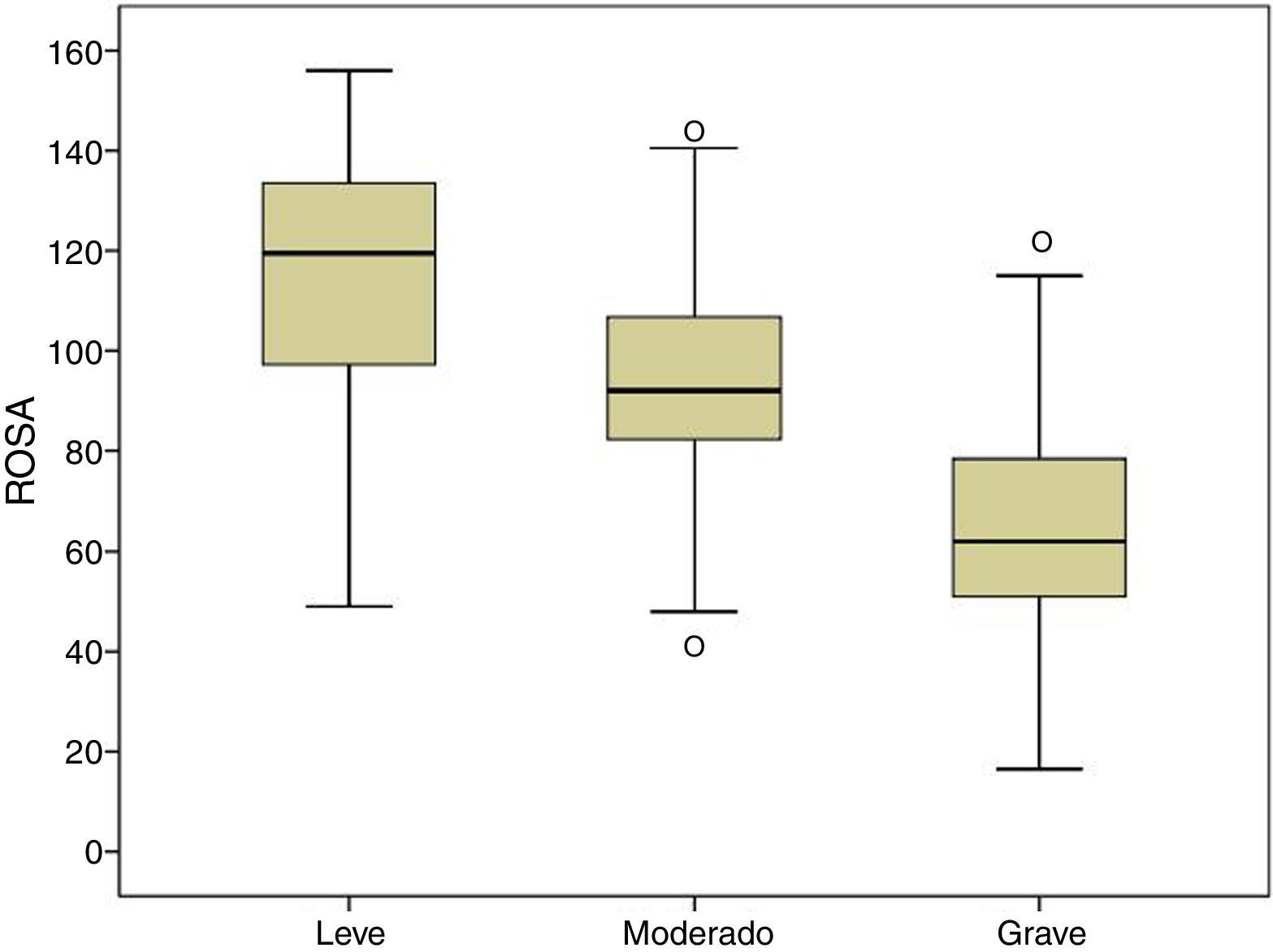
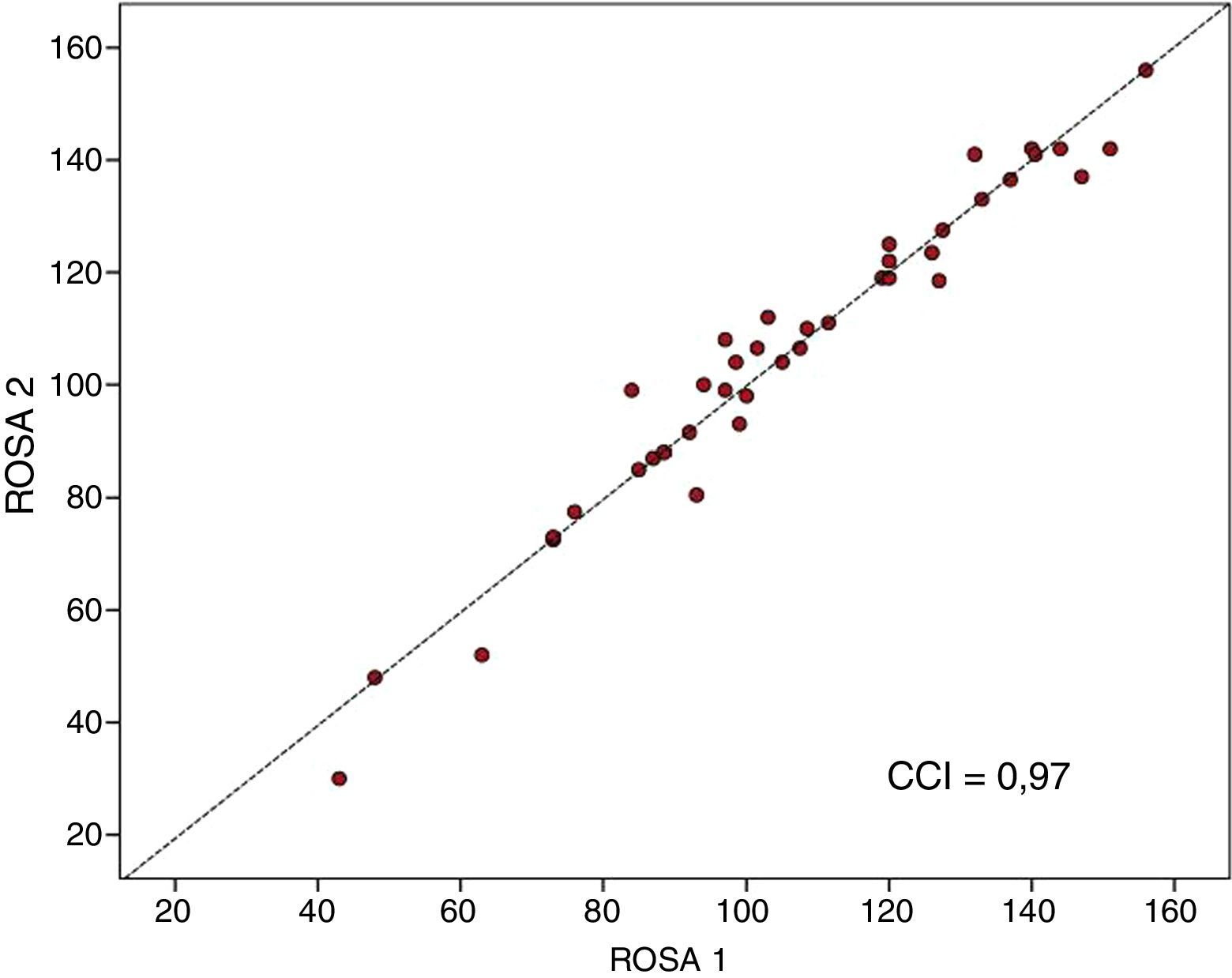
ResultadosLa escala ROSA se aplica en 13,8 ± 7,4 min y sus resultados están asociados de forma significativa al estadio clínico (leve 116,7 ± 23,1, moderado 92,9 ± 19,8 y grave 64,3 ± 22,6), Mini-Mental (r = 0,68), Fototest (r = 0,63), NPI (r = 0,53) y escala de Blessed (r = –0,80). La escala ROSA muestra una alta consistencia interna (alfa = 0,90) y una excelente fiabilidad test-retest (CCI = 0,97).
ConclusiónLa versión española de la escala ROSA es un instrumento breve, válido y fiable para la evaluación global de pacientes con demencia.
The Relevant Outcome Scale for Alzheimer's Disease (ROSA) is a useful tool for evaluating and monitoring dementia patients. This study aims to evaluate the validity and reliability of the Spanish version of ROSA.
Patients and methodsSpanish multicentre study involving 39 researchers and including 237 patients with Alzheimer disease (78 mild, 79 moderate, and 80 severe). The patients were tested with the following: Mini–Mental State Examination (MMSE), Fototest, Neuropsychiatric Inventory (NPI), Blessed dementia scale, and a Spanish-language version of ROSA. A subsample of 40 subjects was retested in the 14 days following the initial evaluation. The construct validity was evaluated with the Spearman correlation coefficient (r), internal consistency with Cronbach's alpha (alpha), and test-retest reliability with the intraclass correlation coefficient (ICC).
ResultsROSA requires 13.8±7.4minutes to administer and its results show a significant association with the clinical stage of AD (mild, 116.7±23.1; moderate, 92.9±19.8; and severe, 64.3±22.6), and with results on the MMSE (r=0.68), Fototest (r=0.63), NPI (r=0.53), and Blessed dementia scale (r=–0.80). ROSA shows high internal consistency (alpha=0.90) and excellent test-retest reliability (ICC0.97).
ConclusionThe Spanish version of ROSA is a brief, valid, and reliable tool permitting overall evaluation of patients with dementia.
La enfermedad de Alzheimer (EA) es un trastorno neurodegenerativo asociado patológicamente a la presencia de depósitos extracelulares de betaamiloide en forma de placas seniles y depósitos intraneuronales de proteína tau hiperfosforilada que constituyen los ovillos neurofibrilares; estas alteraciones inducen disfunciones mitocondriales y sinápticas que se siguen de pérdida neuronal y atrofia que se traducen clínicamente en una afectación progresiva de múltiples funciones cognitivas (fundamentalmente la memoria) y alteraciones conductuales que determinan un menoscabo funcional creciente1,2. Son muchas las evidencias actuales que indican que en la EA el proceso patológico se pone en marcha décadas antes de que aparezcan los primeros síntomas y que la afectación tiene lugar de una forma progresiva y ordenada, lo que explica el carácter progresivo y secuencial de los síntomas y las deficiencias que produce3.
El uso de escalas es necesario y habitual en el diagnóstico, el seguimiento y la evaluación de la respuesta al tratamiento en la EA. Sería deseable que existiese una escala única que fuese capaz de valorar esta enfermedad de forma global y a lo largo de todo su curso evolutivo, facilitando la comparación intra e interpacientes. No obstante, el carácter progresivo y poliédrico de la EA explica que lo habitual sea el uso de múltiples escalas que miden aspectos concretos y específicos como cognición (p. ej., ADAS-Cog4), conducta (p. ej., Neuropsychiatric Inventory5 [NPI]), repercusión funcional (p. ej., Pfeffer6) o calidad de vida del paciente y del cuidador (p. ej., Zarit7). Sin embargo, persiste la necesidad de una escala global que permita valorar todos esos aspectos de manera breve y sencilla, que sea aplicable en todos los estadios de la enfermedad y que fuera sensible a los cambios evolutivos o derivados del tratamiento8.
Existen algunas escalas que evalúan múltiples aspectos de la EA (cognitivos, conductuales, funcionales y calidad de vida), pero ninguna de ellas da respuesta a todos y cada uno de los requisitos anteriores, sea por su duración y complejidad (p. ej., la Sandoz Clinical Assessment Geriatric9 y la Gottfries-Brane-Steen10 requieren una formación específica y unos 30 min de aplicación), por ser específicas para determinados estadios evolutivos (p. ej., Vienna List11 para estadios avanzados), por requerir la observación directa para ser cumplimentada, lo que es más propio de instituciones cerradas y no de la práctica clínica habitual (p. ej., el Nurses's Observation Scale for Geriatric Patients12), o por hacer un especial énfasis en solo algún aspecto de la enfermedad (p. ej., la Behavioral Rating Scale for Geriatric Patients13 en los aspectos conductuales o la Clinical Dementia Rating14 en aspectos cognitivos y funcionales).
La escala Relevant Outcome Scale for Alzheimer's Disease (ROSA)15 es un nuevo instrumento que puede ser aplicado en cualquier estadio de la enfermedad, requiere poco tiempo de administración y permite la evaluación de aspectos cognitivos, conductuales, funcionales, de calidad de vida y sobrecarga del cuidador. Esta escala ha sido validada en población alemana15, donde ha mostrado ser válida, fiable y muy sensible a la detección de cambios evolutivos. El hecho de tratarse de una escala que evalúa los distintos aspectos de la enfermedad, junto con sus propiedades psicométricas, la convierten en una herramienta de gran utilidad en el seguimiento a largo plazo de pacientes, sea en la práctica clínica, estudios observacionales o ensayos clínicos.
Nuestro objetivo es evaluar la validez, la fiabilidad y la estructura factorial de una versión española de la escala ROSA que permita su aplicación a más de 500 millones de personas que tienen al español como primera lengua.
Pacientes y métodosDiseñoEstudio observacional prospectivo, multicéntrico, nacional, en el que participaron 39 profesionales españoles de Neurología, Psiquiatría y Geriatría con experiencia en manejo de pacientes con EA.
SujetosCada profesional incluyó de forma prospectiva y según su conveniencia a 6 pacientes con EA diagnosticados según los criterios DSM-IV16 y NINCDS-ADRDA17, 2 en cada una de las fases leve, moderada y grave; la estadificación se dejó a criterio de cada uno de los investigadores sobre la base de su experiencia y práctica clínica habitual. Uno de los profesionales incluyó 2 grupos independientes de pacientes procedentes de consultas distintas. Todos los pacientes incluidos contaban con un cuidador principal que actuó como informador; se definió como cuidador principal a aquella persona que convivía habitualmente con el paciente y que estaba implicado directamente en su cuidado o padecía el impacto de su problema de salud, sin ser profesional o pertenecer a una red social de apoyo.
Escala ROSAConsta de 16 ítems relativos a 6 dimensiones (cognición [3 ítems], comunicación [3 ítems], conducta [5 ítems], función [3 ítems], calidad de vida [un ítem] y sobrecarga del cuidador [un ítem]) con una alta validez de contenido y que se representan por medio de escenarios (eventos o situaciones) cotidianos (material suplementario). Se cumplimenta con ayuda de un informador que valora en una escala de 0 a 10 puntos el funcionamiento o la situación del paciente en cada uno de estos escenarios, una mayor puntuación significa un mejor funcionamiento o rendimiento en el teórico escenario o una mejor calidad de vida.
Se ha llevado a cabo una adaptación cultural para preservar el contenido semántico y la equivalencia conceptual entre la cultura original y la española18, además de un proceso de traducción/retrotraducción de la misma. En este proceso han participado 2 traductores profesionales, uno de lengua materna alemana y otro española, con la colaboración del investigador principal.
ProcedimientoEl estudio principal se llevó a cabo en una única visita en la que se recogieron las variables demográficas (sexo, edad, nivel educativo) y los datos clínicos (tiempo desde inicio de los síntomas y desde el diagnóstico, estadio Global Deterioration Scale19), y se aplicaron las distintas escalas de valoración (Mini-Mental20, Fototest21, NPI5, escala de Blessed22 [solo parte A y B] y escala ROSA); se controló el tiempo de aplicación de la escala ROSA. El estudio se llevó a cabo en condiciones de práctica clínica habitual, por lo que las condiciones de aplicación de la escala ROSA variaron en función de esta, siendo aplicada en algunos casos por el propio investigador y en otros por otros profesionales colaboradores (neuropsicólogos, etc.), según disponibilidad.
Para el estudio de fiabilidad test-retest, cada investigador seleccionó según conveniencia y disponibilidad a un único sujeto que fue vuelto a evaluar entre 1 y 14 días después para llevar a cabo una segunda aplicación de la escala ROSA.
Tamaño muestralBasándose en los datos del estudio de validación de la escala ROSA original15 y en las recomendaciones de Fleiss23, se estimó que era preciso incluir un mínimo de 200 pacientes para el estudio de validez y 38 para evaluar la fiabilidad test/retest.
Métodos estadísticosLas variables cuantitativas se describieron mediante media ± desviación estándar y las cualitativas mediante número de sujetos y porcentajes. Las comparaciones entre cuantitativas se realizaron mediante ANOVA en aquellas con distribución normal y test de Kruskal-Wallis en caso contrario, y entre cualitativas con el test de la chi al cuadrado.
La validez de constructo se evaluó mediante el coeficiente de correlación de Spearman de los resultados de la escala ROSA con los de las escalas cognitivas (Mini-Mental, Fototest), conductual (NPI) y funcional (Blessed).
La estructura dimensional de la escala ROSA se analizó mediante un análisis factorial de componentes principales con rotación Varimax ortogonal utilizando el criterio de Kaiser (Eigenvalue ≥ 1) y excluyendo los ítems con puntuaciones < 0,4 en cada factor.
La consistencia interna se calculó mediante el uso del coeficiente alfa de Cronbach y la fiabilidad test/retest mediante el coeficiente de correlación intraclase (CCI).
Aspectos éticos y formalesEl estudio se llevó a cabo de acuerdo con los requerimientos de la Declaración de Helsinki (revisión de Seúl, octubre del 2008), y de la legislación vigente en España relativa a la realización de estudios observacionales (Orden Ministerial SAS/3470/2009). El protocolo fue aprobado por el Comité de Ética e Investigación del Hospital Universitario Virgen de las Nieves de Granada y notificado a la Agencia Española del Medicamento y Productos Sanitarios. Se obtuvo el consentimiento informado por escrito de todos los pacientes (o de sus representantes legales) incluidos en el estudio.
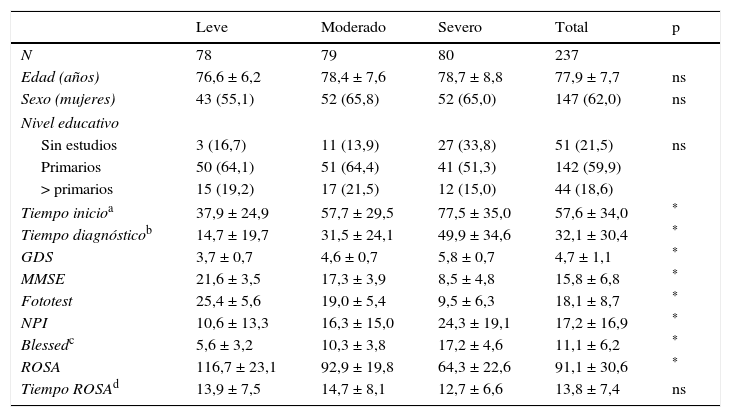
ResultadosLa muestra final constaba de 237 sujetos por falta de datos en 3 casos. La tabla 1 resume las características sociodemográficas de la muestra, así como los resultados en las distintas escalas e instrumentos utilizados. Como era de esperar, los sujetos tienen más tiempo de evolución y peores puntuaciones en los distintos instrumentos utilizados conforme progresa el estadio clínico. En cambio, no hubo diferencia significativa entre grupos en edad (77,9 ± 7,7 años), distribución del sexo, con un claro predominio de mujeres (62%), nivel educativo (59,9% con estudios primarios) ni tiempo requerido para aplicar la escala ROSA (13,8 ± 7,4 min). Todos los sujetos seguían algún tratamiento farmacológico; los fármacos más utilizados eran donepezilo (38,0% pacientes), memantina (34,6%), rivastigmina (27,0%), galantamina (7,6%), quetiapina (5,9%) y trazodona (3,4%).
Caracteres sociodemográficos y clínicos de la muestra
| Leve | Moderado | Severo | Total | p | |
|---|---|---|---|---|---|
| N | 78 | 79 | 80 | 237 | |
| Edad (años) | 76,6 ± 6,2 | 78,4 ± 7,6 | 78,7 ± 8,8 | 77,9 ± 7,7 | ns |
| Sexo (mujeres) | 43 (55,1) | 52 (65,8) | 52 (65,0) | 147 (62,0) | ns |
| Nivel educativo | |||||
| Sin estudios | 3 (16,7) | 11 (13,9) | 27 (33,8) | 51 (21,5) | ns |
| Primarios | 50 (64,1) | 51 (64,4) | 41 (51,3) | 142 (59,9) | |
| > primarios | 15 (19,2) | 17 (21,5) | 12 (15,0) | 44 (18,6) | |
| Tiempo inicioa | 37,9 ± 24,9 | 57,7 ± 29,5 | 77,5 ± 35,0 | 57,6 ± 34,0 | * |
| Tiempo diagnósticob | 14,7 ± 19,7 | 31,5 ± 24,1 | 49,9 ± 34,6 | 32,1 ± 30,4 | * |
| GDS | 3,7 ± 0,7 | 4,6 ± 0,7 | 5,8 ± 0,7 | 4,7 ± 1,1 | * |
| MMSE | 21,6 ± 3,5 | 17,3 ± 3,9 | 8,5 ± 4,8 | 15,8 ± 6,8 | * |
| Fototest | 25,4 ± 5,6 | 19,0 ± 5,4 | 9,5 ± 6,3 | 18,1 ± 8,7 | * |
| NPI | 10,6 ± 13,3 | 16,3 ± 15,0 | 24,3 ± 19,1 | 17,2 ± 16,9 | * |
| Blessedc | 5,6 ± 3,2 | 10,3 ± 3,8 | 17,2 ± 4,6 | 11,1 ± 6,2 | * |
| ROSA | 116,7 ± 23,1 | 92,9 ± 19,8 | 64,3 ± 22,6 | 91,1 ± 30,6 | * |
| Tiempo ROSAd | 13,9 ± 7,5 | 14,7 ± 8,1 | 12,7 ± 6,6 | 13,8 ± 7,4 | ns |
Los datos se muestran como media ± desviación estándar o número casos (%).
GDS: Global Deterioration Scale; MMSE: MiniMental State Examination; NPI: Neurosychiatric Inventory; ns: no significativo.
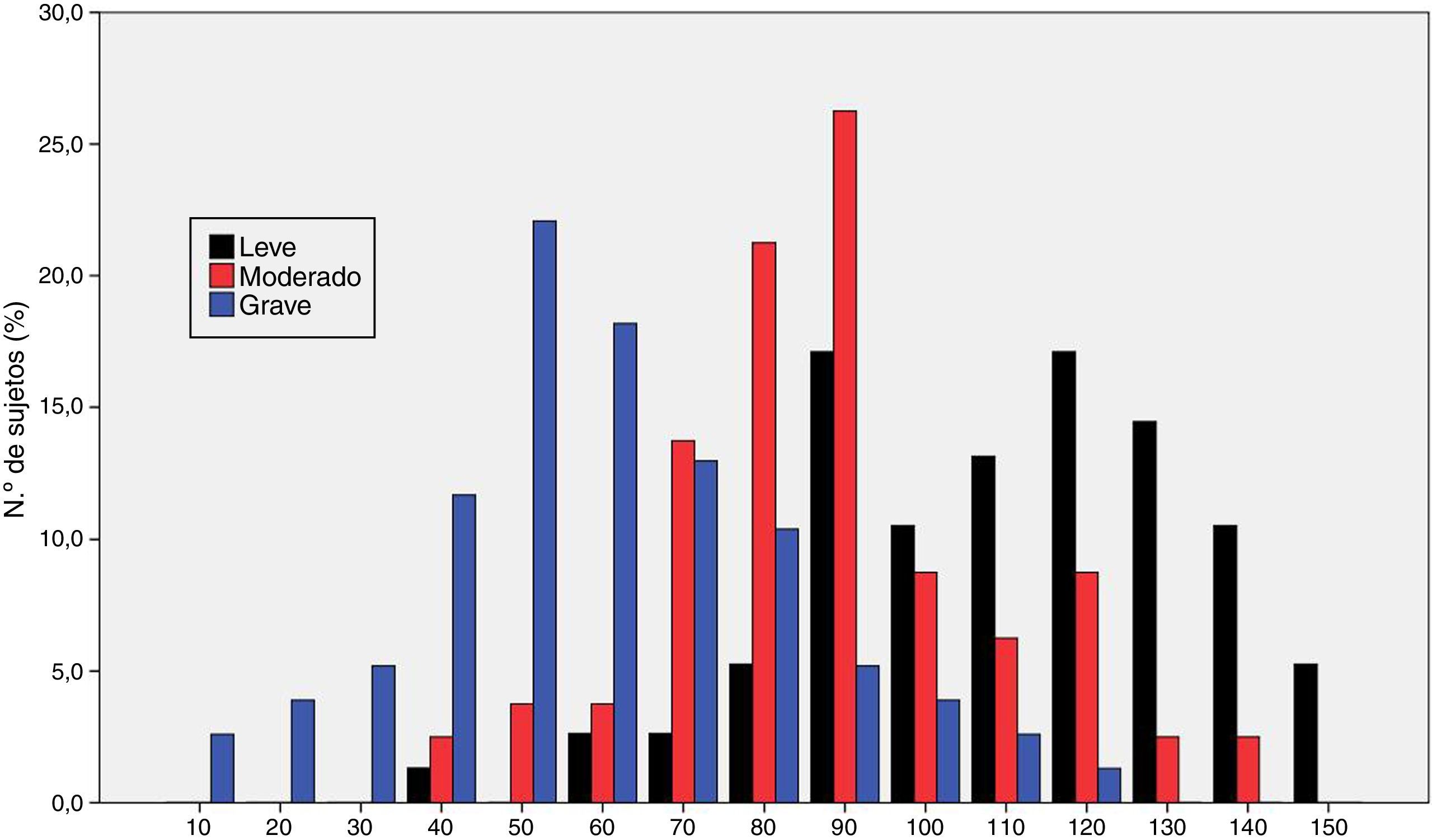
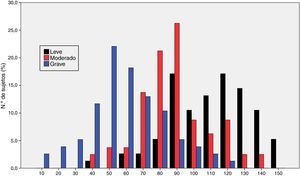
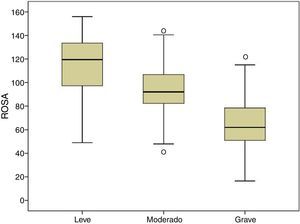
La figura 1 muestra la distribución de los resultados en la escala ROSA según los distintos estadios de severidad de demencia. Los resultados muestran una diferencia significativa entre estos estadios tanto a nivel global (fig. 2) como en todos y cada uno de los dominios (tabla 2), que traduce el lógico empeoramiento en todos los dominios conforme progresa la enfermedad así como el deterioro progresivo de la calidad de vida del paciente y la sobrecarga del cuidador.
Distribución de las puntuaciones parciales y total de la escala ROSA por dominio
| Dominio | Fase leve (N = 78) | Fase moderada (N = 79) | Fase grave (N = 80) | Total (N = 237) | p |
|---|---|---|---|---|---|
| Cognitivo (3 ítems) | 19,1 ± 5,8 | 13,1 ± 5,3 | 6,3 ± 4,8 | 12,8 ± 7,4 | * |
| Comunicación (3 ítems) | 22,3 ± 5,3 | 18,4 ± 5,6 | 11,9 ± 7,2 | 17,5 ± 7,4 | * |
| Conducta (5 ítems) | 39,7 ± 9,1 | 34,4 ± 8,9 | 30,1 ± 10,9 | 34,7 ± 10,4 | * |
| Capacidad funcional (3 ítems) | 21,4 ± 6,9 | 15,4 ± 5,8 | 7,1 ± 5,9 | 14,6 ± 8,6 | * |
| Calidad de vida (un ítem) | 7,6 ± 2,0 | 6,8 ± 1,9 | 5,8 ± 3,0 | 6,7 ± 2,5 | * |
| Carga del cuidador (un ítem) | 6,5 ± 2,8 | 4,8 ± 2,6 | 3,1 ± 2,9 | 4,8 ± 3,1 | * |
| Puntuación total (16 ítems) | 116,7 ± 23,1 | 92,9 ± 19,8 | 64,3 ± 22,6 | 91,1 ± 30,6 | * |
Los datos se presentan en forma de media ± desviación estándar.
El análisis factorial de la escala ROSA (tabla 3) dio lugar a la extracción de 2 factores que explican un 52.3% de la variabilidad total; todos los ítems de la escala mostraron un autovalor > 0,4 en el procedimiento de rotación de Varimax. El primer factor agrupa a los ítems relativos a cognición, comunicación, capacidad funcional y carga del cuidador; en el segundo, se agrupan los ítems de conducta y calidad de vida.
Análisis factorial de la escala ROSA
| Número y descripción del ítem | Dominio | Factor 1a | Factor 2a |
|---|---|---|---|
| 1. El paciente puede recordar acontecimientos que sucedieron hace mucho tiempo | Cognitivo | 0,71941 | |
| 2. El paciente puede recordar acontecimientos que sucedieron en un pasado cercano | Cognitivo | 0,74855 | |
| 3. El paciente puede planear y llevar a cabo procesos complejos | Cognitivo | 0,80784 | |
| 4. El paciente puede hacerse entender | Comunicación | 0,68579 | |
| 5. El paciente puede comunicarse | Comunicación | 0,72205 | |
| 6. El paciente muestra competencias sociales | Comunicación | 0,73873 | |
| 7. El paciente se comporta agresivamente | Conducta | 0,72587 | |
| 8. El paciente se muestra inquieto | Conducta | 0,70439 | |
| 9. El paciente muestra alteraciones del comportamiento motivadas por alucinaciones | Conducta | 0,70794 | |
| 10. El paciente se muestra inseguro | Conducta | 0,63603 | |
| 11. El paciente se comporta cooperativamente | Conducta | 0,41758 | |
| 12. El paciente es competente en la vida cotidiana | Funcional | 0,77966 | |
| 13. El paciente presta atención, muestra interés por su entorno | Funcional | 0,72524 | |
| 14. El paciente es independiente | Funcional | 0,75014 | |
| 15. La calidad de vida del paciente es (muy buena/muy mala) | Calidad de vida | 0,42139 | |
| 16. La carga para la persona a su cuidado es (muy baja/muy alta) | Carga del cuidador | 0,42256 |
Los resultados en la escala ROSA mostraron una significativa correlación con los resultados del Mini-Mental (r = 0,68, p < 0,01), Fototest (r = 0,63, p < 0,01), escala de Blessed (r = –0,80, p < 0,01) y puntuación global en la escala NPI (r = –0,53, p < 0,05).
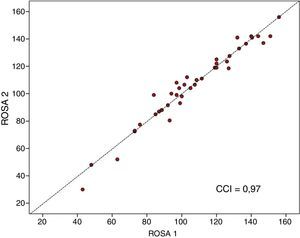
La escala ROSA mostró una alta consistencia interna, con un alfa de Cronbach de 0,90 en la visita basal. En los 40 pacientes (19 en fase temprana, 15 en fase media y 6 en la fase tardía de la EA) en los que se aplicó la escala ROSA en una segunda visita realizada entre 1 y 14 días de la visita basal (mediana 13 días) no hubo diferencia significativa en los resultados entre ambas aplicaciones (106,8 ± 27,3 vs. 106,5 ± 28,1, ns) y ambos resultados mostraron un alto CCI ente ellos (CCI = 0,97, p < 0,01) (fig. 3).
DiscusiónNuestros resultados muestran que la versión española de escala ROSA, al igual que la original, es un instrumento breve, válido y fiable para evaluar a pacientes con EA a lo largo de todo el proceso de la enfermedad, desde estadios leves a graves.
La validez de contenido está asegurada por la propia estructura de la escala y la forma en que se elaboró15. La validez de constructo y convergente se demuestra por la significativa asociación con el estadio de la EA (fig. 2) y con los resultados del resto de escalas utilizadas que evalúan de forma específica cada uno de los aspectos de la EA. A diferencia del estudio original, que empleó la escala ADAS-Cog4 para la evaluación cognitiva, nosotros hemos utilizados el Mini-Mental20, el instrumento cognitivo más ampliamente utilizado a pesar de sus no pocos inconveniente24 y el Fototest21, un nuevo test cognitivo muy breve aplicable a analfabetos y de amplia difusión en nuestro medio por ser más adecuado en poblaciones con bajo nivel educativo25 y haber demostrado un coste efectividad superior al del Mini-Mental26; en ambos casos, la correlación ha sido muy significativa (Mini-Mental r = 0,68; Fototest r = 0,63) y de mayor magnitud que la encontrada en el estudio original con el ADAS-Cog (r = –0,47); el distinto signo de la asociación es explicable porque en las escalas ROSA, Mini-Mental y Fototest, una mayor puntuación significa una menor afectación, a diferencia que en la escala ADAS-Cog, en la que una mayor puntuación es indicativa de mayor afectación. La evaluación funcional a diferencia también del estudio original que usó el Disability Assessment for Demencia27 (DAD), la hemos realizado con la escala de Blessed (parte A + B), un instrumento de validez demostrada y uso más habitual en nuestro medio; la asociación encontrada en nuestro caso también es altamente significativa (r = –0,80), también de mayor magnitud que la encontrada en el estudio original con respecto a la escala DAD (r = 0,70); el cambio de signo de nuevo se explica por la distinta direccionalidad de la escala de Blessed con respecto a la escala ROSA. En ambos estudios se utilizó la escala NPI como medida conductual y en ambos los resultados han mostrado una asociación similar (r = 0,53 en ambos estudios).
Nuestros resultados también han mostrado una alta consistencia interna y una elevada fiabilidad test-retest (fig. 3), replicando los resultados obtenidos con la escala original. Igualmente, nuestros datos reproducen casi especularmente los resultados del análisis factorial del estudio original, con la definición de 2 factores independientes, el primero que incluye los ítems relacionados con los aspectos cognitivos, funcionales y carga del cuidador, y un segundo que agrupa los datos relativos a conducta y calidad de vida.
El tiempo medio de administración de la escala ROSA fue inferior a 15 min (13,8 ± 7,4), sin que hubiera diferencia significativa entre los distintos estadios de la enfermedad. Estos resultados son similares a los requeridos por la versión original (14,3 ± 6,8) y claramente inferior al que requiere la administración de diferentes escalas para la valoración de los distintos dominios de la EA cubiertos por la escala ROSA.
La Dementia Severity Scale28 y la HABC Monitor29 son también nuevas escalas multidimensionales que se cumplimentan con ayuda de un informador; ambas han demostrado una adecuada consistencia interna, fiabilidad y validez de constructo; ambas, sin embargo, cuentan con un mayor número de ítems que la escala ROSA (47 y 31 ítems, respectivamente). Quedaría por evaluar en una misma muestra la utilidad y aplicabilidad comparativa de estos 3 instrumentos.
El principal inconveniente de este estudio es la forma en que se constituyó la muestra, tanto por su reclutamiento por conveniencia, que limita su representatividad, como por no incluir sujetos sin demencia, tuvieran o no deterioro cognitivo, lo que impide valorar en qué medida esta escala mantiene las cualidades en estos sujetos, en especial en los sujetos con deterioro cognitivo sin demencia. Son aspectos muy positivos, en cambio, el tamaño de la muestra y su carácter multicéntrico y naturalístico, lo cual avala la validez externa de nuestros resultados y su potencial aplicabilidad en la práctica cotidiana.
En definitiva, la versión española de la escala ROSA, al igual que la versión original, es un instrumento breve, válido y fiable que permite la evaluación global de pacientes con demencia.
FinanciaciónEl estudio ROSA fue financiado por laboratorios Grünenthal Pharma S.A.
Conflicto de interesesC. Carnero Pardo es el creador del Fototest. Isabel Sánchez Magro es empleada de Laboratorio Grunenthal Pharma S.A.
Alberto Villarejo Galende, Hospital Doce de Octubre, Madrid; Amaya López Sierra, Hospital Meixoeiro, Vigo; Carmen Antúnez Almagro, Hospital Universitario Virgen de la Arrixaca, Murcia; Carmen Pérez Vieitez, Hospital de Gran Canaria Dr. Negrín, Las Palmas de Gran Canarias; Dolores Alonso Salvador, Hospital La Magdalena, Castellón; Eduardo Agüero Morales, Hospital Reina Sofía, Córdoba; Eloy Rodríguez Rodríguez, Hospital Universitario Marqués de Valdecilla, Santander; Esperanza Martín Correa, Hospital Geriátrico Virgen del Valle, Toledo; Eugenia Marta Moreno, Hospital Miguel Servet, Zaragoza; Javier Olazarán Rodríguez, Hospital Gregorio Marañón, Madrid; Félix Viñuela Fernández, Hospital NISA Aljaraje, Sevilla; Fernando Castellanos Pinedos, Hospital Virgen del Puerto, Plasencia; Francesc Pujades Navines, Hospital Vall d¿Hebron, Barcelona; Gerard Piñol Ripoll, Hospital Santa María, Lleida; Gerardo Soriano Hernández, Hospital de Navarra, Pamplona; Guillermo Amer Ferrer, Hospital Universitario Son Espases, Palma de Mallorca; Isabel Hernández Ruiz, Fundación ACE, Barcelona; Jesús Cacho Gutiérrez, Hospital Universitario Salamanca; Jesús M. López Arrieta, Hospital Cantoblanco-La Paz, Madrid; Joaquín Escudero Torrella, Hospital General Universitario de Valencia; José Bueno Perdomo, Hospital Universitario Nuestra Señora de Candelaria, Santa Cruz de Tenerife; José M. Aldrey Vázquez, Hospital Clínico Universitario Santiago de Compostela; José M. Ramírez Moreno, Complejo Hospitalario Infanta Cristina, Badajoz; José Ramón Martínez Calvo, Hospital Universitario Lucus Augusti, Lugo; M. Teresa Carreras Rodríguez, Hospital Universitario de la Princesa, Madrid; M. José Sáenz San Juan, Hospital San Vicente del Raspeig, Alicante; M. Teresa García López, Hospital Torrecárdenas, Almería; Miguel Aguilar Barberá, Hospital Mutua de Terrassa; Miguel Ángel Moya Molina, Hospital Universitario Puerta del Mar, Cádiz; Miguel Ángel Tola Arribas, Hospital Universitario del Río Hortega, Valladolid; Miguel Baquero Tolero, Hospital Universitario La Fe, Valencia; Miguel Goñi Imizcoz, Hospital General Yagüe, Burgos; Pedro Gil Gregorio, Hospital Clínico San Carlos, Madrid; Ramón Reñe Ramírez, Hospital de Bellvitge, Barcelona; Teresa Calatayud Noguera, Hospital Universitario Central de Asturias, Oviedo; Tomás Ojea Ortega, Hospital Carlos Haya, Málaga; Vicente Serrano Castro, Hospital Virgen de la Victoria, Málaga.