La esclerosis múltiple (EM) es una enfermedad autoinmune que afecta preferentemente a mujeres en edad fértil. Durante el embarazo y puerperio, cambia la tasa anual de brotes (TAB) de EM, sin modificar la evolución a largo plazo. Analizamos la repercusión del embarazo en pacientes con EM, y comparamos sus resultados obstétricos con embarazos de mujeres sanas.
MétodosEstudio unicéntrico, observacional descriptivo, de diseño longitudinal prospectivo. Se analizan los datos globales de una cohorte de pacientes con EM que han dado a luz entre enero de 2007 y julio de 2012, con un seguimiento de 2 años posparto. Los resultados obstétricos se compararon con un grupo control de 58 embarazadas sanas, elegidas al azar de nuestro centro durante el mismo período de tiempo.
ResultadosUn total de 35 pacientes con EM, 40 partos. Grupo control: 58 mujeres, 60 partos. EDSS preembarazo: 0,7. TAB 2 años preembarazo: 0,5. Durante el embarazo: 0,3, a los 2 años posparto: 0,4. Doce pacientes recibían FME previo al embarazo, 4 iniciaron la gestación con FME. No hubo diferencias estadísticamente significativas en la TAB ni en la EDSS entre períodos preembarazo, embarazo y posparto. Al comparar con grupo control, no hubo diferencias en edad materna, semanas de gestación, peso al nacer, porcentaje de cesáreas, ni complicaciones obstétricas. En pacientes con EM hubo mayor porcentaje de tratamientos por infertilidad y menor porcentaje de lactancia, ambos estadísticamente significativos.
ConclusionesNuestro trabajo confirma que el embarazo no repercute negativamente en el curso de la EM y que no existe mayor morbilidad obstétrica comparado con mujeres sanas.
Multiple sclerosis (MS) is a autoimmune disorder which preferentially affects young women of childbearing age. During pregnancy, the annualized relapse rate (AAR) is modified, but pregnancy has no harm effect on the long-term course of the disease. We aimed to study the clinical course of our MS patients during pregnancy, and compare their obstetrics outcomes with a control group of non-MS patients.
MethodsA single centre prospective observational study was conducted. We assessed the reproductive history, MS history, pregnancy course and new-born outcome of a cohort of MS patients who had had a pregnancy between january 2007 and july 2012. We compared the global outcomes with a control cohort of 58 age-matched healthy pregnancies.
ResultsComplete data from 35 consecutive women were analyzed, 40 deliveries. Control groups: 58 patients, 60 deliveries. EDSS at pregnancy 0,7. ARR before pregnancy 0,5. During pregnancy 0,3, after pregnancy 0,4. Twelve patients were on disease-modifying drugs (DMD) before pregnancy, 4 prenatal exposure occurs. The comparison between relapse rate and EDSS before, during and after delivery showed no statistically significant difference. In addition, compared to control group, there were also no differences in the obstetric outcomes. In MS cohort, we found a higher incidence of assisted reproductive treatments and lower breastfeeding rate, both statistically significant.
ConclusionsOur series confirms that pregnancy has no negative long term impact on the progression of MS and also suggest that there is no additional morbidity in the pregnancy, comparing to the rest of the population.
La esclerosis múltiple (EM) es una enfermedad autoinmune crónica del sistema nervioso central, que afecta predominantemente a mujeres en edad fértil1. Se considera que la susceptibilidad de padecer EM depende de factores medioambientales en sujetos con un perfil genético predisponente2–6.
Cuando una mujer con EM se embaraza, se modifica su tasa anual de brotes (TAB) habitual, observándose una disminución en la incidencia de brotes durante el tercer trimestre del embarazo, con un aumento posterior durante el primer trimestre posparto7. A largo plazo, la TAB y la discapacidad global no parecen estar afectadas por las modificaciones en la incidencia de brotes producidos durante el embarazo. Con respecto a otros parámetros analizados en embarazadas con EM o sus recién nacidos, tales como la duración del período gestacional, el porcentaje de cesáreas realizadas, el peso del recién nacido y la incidencia de complicaciones obstétricas, los resultados de los diferentes estudios realizados al respecto no siempre son comparables, con resultados a veces contradictorios8.
Actualmente, no se dispone de un consenso internacional que guíe el proceder clínico cuando una paciente con EM planea concebir, por lo que se suelen encontrar diferencias según distintos países. La planificación del embarazo y un adecuado control de la EM son de gran importancia para este grupo de pacientes. El uso de fármacos modificadores de la enfermedad (FME) durante el embarazo está desaconsejado, debido al desconocimiento de los efectos que estos fármacos puedan tener sobre el feto1. No obstante, a menudo ocurren exposiciones prenatales involuntarias a FME, sobre todo en los casos de embarazos no planificados, de modo que cada vez se dispone de más evidencia en este contexto9,10.
El objetivo del presente trabajo es analizar la experiencia clínica de nuestro centro en el manejo de pacientes con EM cuando se produce un embarazo, y comparar los resultados ginecológicos y obstétricos con embarazos de mujeres sanas.
Material y métodosEstudio observacional descriptivo realizado en el Hospital General Universitario Gregorio Marañón de Madrid (HGUGM), diseñado con un seguimiento longitudinal prospectivo. El HGUGM es un hospital público perteneciente al Servicio Madrileño de Salud, con 1.671 camas instaladas para pacientes hospitalizados y una población asignada de 317.940 personas11. Se analizan los datos globales de una cohorte de pacientes diagnosticadas de EM, que dieron a luz entre enero de 2007 y julio de 2012. Para el diagnóstico de EM se utilizaron los criterios de McDonald, actualizados según la fecha en la que se realizó12.
Todas las pacientes, una vez confirmado el embarazo y tras obtener su consentimiento, fueron valoradas prospectivamente en consulta, analizando las distintas variables clínicas de manera estandarizada. Las valoraciones han sido trimestrales durante el embarazo, y semestrales tras el parto, hasta completar los 2 años.
En el estudio de las pacientes con EM se incluyó edad, historial reproductivo, forma clínica de EM, años de evolución de la enfermedad, TAB desde el inicio de la enfermedad, grado de discapacidad mediante escala EDSS de Kurtzke y el historial de tratamiento farmacológico recibido13. Se utilizaron las características previas de la cohorte de pacientes con EM bajo estudio como autocontrol del número de brotes y grado de discapacidad entre los períodos preembarazo, embarazo y posparto. Se consideró como brote la aparición, reaparición o empeoramiento de signos de disfunción neurológica focal, de más de 24 h de duración, en ausencia de fiebre.
Con respecto al embarazo y parto, los resultados globales de las pacientes con EM se compararon con un grupo control de 58 embarazadas sanas, elegidas al azar de nuestro centro durante el mismo período de tiempo. Todas las pacientes del presente estudio fueron asistidas en el Servicio de Ginecología de nuestro centro hospitalario, con los cuidados prenatales, gestacionales y posparto pertinentes.
Finalmente, se realizaron entrevistas personalizadas a la cohorte de pacientes con EM, utilizando cuestionarios semiestructurados, con el fin de completar la información que pudiera faltar.
Análisis estadísticoLos resultados de las variables continuas se presentaron mediante su media y desviación típica, o bien mediante media y rango mínimo-máximo. El análisis de normalidad se estudió con la prueba de Kolmogorov-Smirnov. Para comparar medias entre 2 grupos, se utilizaron pruebas paramétricas (t de Student) o pruebas no paramétricas (Mann-Whitney), eligiendo la más adecuada en cada caso en función de la normalidad de los datos y del número total de pacientes de cada grupo. Para estudiar TAB a lo largo del tiempo en las comparaciones previas al embarazo, durante el mismo y tras el parto, se han utilizado la prueba de Wilcoxon, la prueba de McNemar, y la prueba t de Student de medidas repetidas. La asociación entre variables cualitativas se estudió mediante la prueba ji-cuadrado de Pearson o exacta de Fisher. El análisis estadístico se realizó con el programa SPSS versión 21.0. Se consideraron como estadísticamente significativos aquellos resultados con una p < 0,05.
ResultadosSe obtuvieron 39 embarazos en mujeres con EM durante el período de tiempo analizado, con el último parto ocurrido en mayo de 2012. Hubo una pérdida de seguimiento en 4 pacientes. De las 35 mujeres con EM analizadas, se obtuvieron 40 partos: 4 (11,4%) pacientes dieron a luz en 2 ocasiones durante el estudio, y una (2, 8%) tuvo un embarazo gemelar. Del grupo control, se obtuvieron 60 partos de 58 mujeres (2 gemelares).
Características epidemiológicas de las mujeres con esclerosis múltipleLa totalidad de la cohorte de pacientes con EM había experimentado brotes por su enfermedad, con la forma remitente-recurrente en 32 (91,4%) pacientes, forma progresiva con brotes 2 (5,7%) pacientes y forma secundaria progresiva una (2,8%) paciente. La media de tiempo de evolución de la enfermedad fue de 8,55 años (2-22). El grado de discapacidad global de la cohorte al momento del embarazo era de 0,7 en la EDSS (0-5), 23 (65,8%) pacientes con EDSS = 0; 6 (17,1%) pacientes con EDSS = 1, y las restantes 6 (17,1%) con EDSS entre 2 y 5. La TAB global desde el inicio de la enfermedad fue de 0,7 (0,1-2,5), la TAB en los 2 años previos al embarazo fue 0,5 (0,3-0,6). Diez (28,5%) pacientes no habían tenido brotes en los 2 años previos al embarazo.
Al momento de iniciar la gestación, 23 (65,8%) pacientes no recibían tratamiento inmunomodulador para EM. Las otras 12 (34,2%) pacientes recibían tratamiento con FME: 4 con Rebif® (interferón beta-1a), 2 con Avonex® (interferón beta-1a), 4 con Betaferon® (interferón beta 1b) y 2 con Copaxone® (acetato de glatirámero). La duración media del tratamiento con FME fue de 43,4 meses (1-120). Ocho pacientes suspendieron los FME al planificar el embarazo, permaneciendo sin medicación una media de 25,5 semanas (8-64) antes de la fecha de última menstruación. Cuatro pacientes quedaron embarazadas mientras tomaban FME: una con Avonex®, otra con Copaxone®, otra con Rebif® y otra con Betaferon®. En estas 4 pacientes, los FME se suspendieron inmediatamente al diagnosticar el embarazo, y en todos los casos la suspensión se realizó durante el primer trimestre, con una media de 6,5 semanas (3-10) tras la fecha de la última menstruación. Recibieron tratamiento por infertilidad 5 (14,2%) pacientes con EM.
Situación funcional de la cohorte con esclerosis múltiple durante el embarazo (tabla 1)La TAB durante el período de 2 años previos al embarazo fue de 0,5 (0,3-0,6). Durante el embarazo fue de 0,3 (0,07-0,52), y en el período de 2 años de seguimiento posparto de 0,4 (0,24-0,56). El análisis mediante pruebas paramétricas de Wilcoxon no encontró diferencias estadísticamente significativas en las TAB entre los períodos preembarazo, embarazo y posparto. Al analizar la TAB previa al embarazo y la TAB durante el embarazo, la prueba paramétrica t de Student mostró que la TAB disminuye durante el embarazo, pero sin alcanzar significación estadística (p = 0,23). No se encontraron diferencias estadísticamente significativas entre la TAB preembarazo y postembarazo. tabla 1.
Incidencia de brotes por EM en período preembarazo, embarazo y posparto
| Brotes 2 años preembarazo (n: 35) | Brotes durante embarazo | Brotes 2 años posparto |
|---|---|---|
| Sí: 25 pacientes | Sí: 6 pacientes | Sí: 13 pacientes |
| No: 19 pacientes | No: 12 pacientes | |
| No: 10 pacientes | Sí: 1 paciente | Sí: 5 pacientes |
| No: 9 pacientes | No: 5 pacientes | |
| TAB 0,5 (0,3-0,6) | TAB 0,3 (0,07-0,52) | TAB 0,4 (0,24-0,56) |
| 25 pacientes con brotes en los 2 años previos | 7 pacientes con brotes durante el embarazo | 18 pacientes con brotes en el posparto |
De las 35 mujeres analizadas, 25 (71,4%) tuvieron brotes en los 2 años previos al embarazo, 7 (20%) tuvieron brotes durante el embarazo y 18 (51,4%) tuvieron al menos un brote en el período de seguimiento de 2 años tras el parto. En los casos de brotes posparto, el primer brote ocurrió dentro del primer trimestre posparto en el 94,4% de las pacientes.
Según la incidencia de brotes previos al embarazo, se analizó la posibilidad de tener brotes en el período posparto. La prueba de McNemar mostró que no hay diferencias estadísticamente significativas entre la incidencia de brotes previos y posteriores al embarazo (p=0,14), si se toma en cuenta un período de 2 años. La comparación de la EDSS preembarazo con la EDSS a los 2 años posparto no mostró diferencias estadísticamente significativas.
Características del parto en la cohorte con esclerosis múltipleDe los 40 partos producidos, 35 (87,5%) fueron por vía natural y 5 (12,5%) por cesárea. La paciente con embarazo gemelar tuvo un parto por vía natural y otro por cesárea. El sexo del recién nacido fue masculino en 23 (57,5%) casos. El peso medio al nacer fue de 3.012,8 g (1.200-3.800). Solo un recién nacido fue prematuro y requirió reanimación. Se observaron las siguientes complicaciones médicas: un caso de oligoamnios, 2 casos de anemia gestacional, un caso de diabetes gestacional, un caso de placenta previa y un caso de trisomía XXY. En el caso de oligoamnios, la madre recibió Betaferón® hasta la séptima semana de embarazo. En el resto de complicaciones, ninguna madre había recibido FME previamente al embarazo.
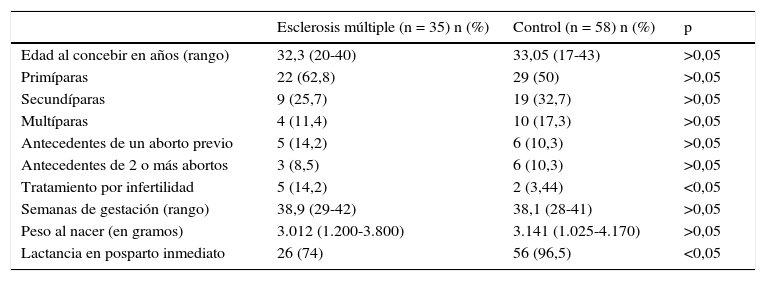
Comparación de embarazos entre mujeres con esclerosis múltiple y mujeres sanas (tabla 2)Al comparar las características del embarazo y parto de la cohorte de mujeres con EM y el grupo control de 58 mujeres sanas, no se encontraron diferencias estadísticamente significativas entre la edad materna al concebir, historial reproductivo, presencia de abortos previos, semanas de gestación, peso al nacer, porcentaje de cesáreas ni complicaciones obstétricas. tabla 2.
Datos generales y obstétricos comparativos entre pacientes con EM y grupo control mujeres sanas
| Esclerosis múltiple (n = 35) n (%) | Control (n = 58) n (%) | p | |
|---|---|---|---|
| Edad al concebir en años (rango) | 32,3 (20-40) | 33,05 (17-43) | >0,05 |
| Primíparas | 22 (62,8) | 29 (50) | >0,05 |
| Secundíparas | 9 (25,7) | 19 (32,7) | >0,05 |
| Multíparas | 4 (11,4) | 10 (17,3) | >0,05 |
| Antecedentes de un aborto previo | 5 (14,2) | 6 (10,3) | >0,05 |
| Antecedentes de 2 o más abortos | 3 (8,5) | 6 (10,3) | >0,05 |
| Tratamiento por infertilidad | 5 (14,2) | 2 (3,44) | <0,05 |
| Semanas de gestación (rango) | 38,9 (29-42) | 38,1 (28-41) | >0,05 |
| Peso al nacer (en gramos) | 3.012 (1.200-3.800) | 3.141 (1.025-4.170) | >0,05 |
| Lactancia en posparto inmediato | 26 (74) | 56 (96,5) | <0,05 |
Se encontraron diferencias estadísticamente significativas en el porcentaje de mujeres que recibieron tratamiento por infertilidad (p < 0,05). De las 5 (13,5%) mujeres con EM que recibieron tratamiento, en 4 se usó fecundación in vitro (FIV) y una recibió inseminación artificial. En el grupo control, 2 (3,3%) pacientes recibieron tratamiento mediante FIV en ambos casos.
También se encontraron diferencias estadísticamente significativas en la lactancia. En el período posnatal inmediato, iniciaron lactancia 26 (74%) mujeres del grupo con EM. De las 9 (26%) mujeres que no iniciaron lactancia, en 5 casos se debió al inicio inmediato de FME en el período posparto. Del grupo control, iniciaron lactancia en período posparto inmediato 56 (96,5%) mujeres.
DiscusiónLas enfermedades autoinmunes son más frecuentes en el sexo femenino, y las razones de esta diferencia en la prevalencia entre ambos sexos aún no están aclaradas14. Las hormonas sexuales femeninas y la expresión de los distintos genes ligados a estas hormonas podrían ser responsables del aumento en la susceptibilidad. Durante el embarazo, se producen modificaciones hormonales que pueden influir en el curso de distintas enfermedades autoinmunes, como es el caso de EM, artritis reumatoide y psoriasis, cuyas pacientes experimentan una mejoría durante el embarazo, con un empeoramiento en los primeros meses posparto15. Desde un punto de vista inmunológico, el feto se comporta en el útero como un aloinjerto, ya que alberga antígenos heredados del padre. Por lo tanto, se piensa que un cambio en la respuesta inmune es necesario para evitar el rechazo del feto16–18. Esto se logra mediante un cambio en la secreción de citocinas por los linfocitos T activados, con una disminución del perfil inmunológico TH1 (inmunidad celular) y un aumento relativo del perfil TH2 (inmunidad humoral). Se cree que este cambio en la respuesta inmune podría ser la base de la mejoría vista en la EM durante el embarazo.
Tradicionalmente, se ha pensado que los anticonceptivos orales y el número de embarazos podrían tener un papel en el desarrollo de un primer episodio sugestivo de enfermedad desmielinizante, mostrando los diferentes estudios realizados al respecto resultados contradictorios, según la época de publicación y la metodología de estudio empleada19,20. El uso de anticonceptivos orales o la gestación previa no tienen un efecto protector en el desarrollo de EM21,22.
La fertilidad parece no verse mayormente afectada en las mujeres con EM. Sin embargo, infertilidad y EM pueden coincidir y, por lo tanto, los pacientes con EM pueden verse en la necesidad de seguir tratamientos de reproducción asistida. En este contexto, al realizar los distintos procedimientos de preparación para la fertilización, existe un mayor riesgo de brotes de EM, y esto parece ser independiente de la estrategia hormonal utilizada para favorecer la ovulación y de su intervalo de aplicación23. Los supuestos mecanismos implicados en el aumento de la tasa de brotes incluyen fundamentalmente la interrupción temporal de FME y los cambios inmunológicos inducidos por las hormonas sexuales usadas como tratamiento, que pueden producir un aumento en las citocinas proinflamatorias y un aumento en la migración de las células inmunológicas a través de la barrera hematoencefálica24,25.
Para una mujer con EM, la decisión de quedarse embarazada está muy influida por la actividad de su enfermedad y su grado de discapacidad7. El embarazo a término modifica el riesgo de padecer brotes, pero no tiene influencia en la evolución de la enfermedad a largo plazo, ni favorece una mayor discapacidad7,26–28. El desarrollo de brotes posparto no depende de la lactancia materna, anestesia epidural, edad de inicio de EM, duración de la enfermedad, número total de brotes previo al embarazo, número de embarazos o del sexo del recién nacido26,29. A pesar del reconocido aumento en la incidencia de brotes durante el primer trimestre posparto, en la cohorte del estudio PRIMS hasta el 72% de los pacientes no experimentaron ningún brote en dicho período26. Las posibilidades de tener un brote posparto aumentan cuanto mayor es la TAB previamente al embarazo, si hay brotes durante el embarazo, y posiblemente en los casos donde hay una mayor EDSS preembarazo. Si se analiza conjuntamente la disminución en la incidencia de brotes ocurrida durante los 9 meses del embarazo más el aumento posterior durante el primer trimestre posparto, se encuentra que la incidencia de brotes en esos 12 meses no difiere de la TAB habitual de los años previos al embarazo26. Siguiendo esta línea, un estudio mostró que, de 33 pacientes que tuvieron al menos un brote en el año preembarazo o durante el embarazo, solo 13 (39%) experimentaron un brote en el primer trimestre posparto. Según este estudio, el riesgo de padecer un brote posparto en una paciente en concreto no puede predecirse mediante un algoritmo matemático, lo que dificulta la elección de pacientes para un eventual tratamiento empírico26. Una vez superado el primer trimestre posparto, la TAB no difiere significativamente del período anual preembarazo. En nuestra serie, destacó el alto porcentaje de pacientes con EM asintomáticas o levemente sintomáticas al momento de iniciar la gestación: 65,8% de las pacientes tenían EDSS = 0 y 17,1% tenían EDSS = 1. Respecto a los brotes, se observó una disminución en la TAB durante el embarazo, pero sin alcanzar significación estadística. Este hallazgo puede atribuirse tanto a la EDSS como a la TAB previa al embarazo, aunque no se puede descartar que el bajo número de pacientes de nuestra serie haya producido un sesgo. En el puerperio, se apreció un aumento en la TAB, ocurriendo el primer brote durante el primer trimestre posparto en el 94,4% de los casos. Analizando la incidencia de brotes producidos, nuestra serie no mostró diferencias estadísticamente significativas en la TAB entre los 2 años preembarazo y los 2 años posparto. Además, en nuestros casos, no se encontró ningún factor en particular que ayude a predecir la incidencia de brotes en el período posparto.
FME durante el embarazoA las mujeres con EM se les recomienda interrumpir el tratamiento con FME previamente a concebir para minimizar el riesgo potencial de daño fetal. Suspender el tratamiento puede tener consecuencias en el curso de la EM, con la posibilidad de modificar la estabilidad alcanzada hasta entonces. Un estudio analiza retrospectivamente 152 embarazos de 132 mujeres con EM, en donde 61 (40,1%) de ellos ocurrieron con al menos 8 semanas de exposición a FME. La tasa de complicaciones obstétricas y neonatales resultó similar en ambos grupos, excepto por peso al nacer y estatura, que fueron menores en los casos donde la madre recibió FME. Por contrapartida, la tasa de brotes posparto y la EDSS fue mayor en las pacientes que no recibieron FME previamente al inicio de la gestación30.
Según la Administración de Drogas y Alimentos de los Estados Unidos de América (FDA por sus siglas en inglés) los FME tienen la siguiente categoría de seguridad: acetato de glatirámero categoría B, ya que los estudios indican que no existe riesgo para el feto animal, pero no se dispone de estudios en humanos. Interferón beta, natalizumab y fingolimod categoría C: se notificaron efectos adversos en fetos animales, sin información sobre estudios en humanos. Mitoxantrona categoría D, ya que se ha informado posible riesgo fetal en seres humanos. En este sentido, recientemente se realizó un análisis sistemático sobre el uso de FME durante el embarazo, utilizando los resultados de 15 estudios publicados10. Se obtuvieron 761 casos de mujeres expuestas a interferones beta, 97 a acetato de glatirámero y 35 a natalizumab. Tras analizar los resultados, se propuso la siguiente clasificación: interferón beta y mitoxantrona en clase III ya que hay evidencia de algunos estudios que sugieren riesgo potencial, específicamente bajo peso al nacer y mayor porcentaje de partos pretérmino. Al acetato de glatirámero, natalizumab y Fingolimod les asignaron clase indeterminada, al mostrar los estudios analizados resultados no convincentes. A pesar de esto, se mantiene la recomendación de evitar los FME en las mujeres con EM que deseen concebir10. En nuestros casos, hemos seguido la recomendación de suspender los FME al planificar el embarazo. No obstante, hemos tenido 4 casos de embarazos durante el tratamiento con FME, en los cuales no se ha visto una mayor morbilidad.
Prevención de brotes en período pospartoEl aumento de la incidencia de brotes posparto es uno de los principales riesgos tras el embarazo de una mujer con EM, por lo cual interesa determinar la mejor manera de prevenirlos y tratarlos. Un estudio analizó la efectividad de utilizar glucocorticoides (GC) intravenosos posparto para reducir la incidencia de brotes. En 20 mujeres se administró un gramo de metilprednisolona intravenosa mensual, durante 6 meses tras el parto, y se las comparó con 22 controles históricos de mujeres que no habían recibido dicho tratamiento. En ambos grupos aumentó la tasa de brotes posparto, siendo menor en el grupo tratado con GC, lo que sugiere un posible efecto beneficioso de los GC mensuales empíricos posparto31. Sin embargo, los GC posparto pueden asociar un mayor riesgo de infecciones, e interferir con la cicatrización de las heridas32,33. Una alternativa en la prevención de los brotes posparto pueden ser las inmunoglobulinas intravenosas (IGIV). Un estudio retrospectivo comparó la eficacia de IGIV para prevenir los brotes posparto. El grupo 1 eran pacientes no tratadas, el grupo 2 eran pacientes que recibieron IGIV 0,4g/kg peso por 5 días consecutivos durante la primer semana posparto, con una dosis adicional a las 6 y a las 12 semanas posparto. Un grupo 3 recibió tratamiento con IGIV durante el embarazo y en el período posparto (dosis en la primeras 8 semanas de gestación, con nuevas dosis cada 6 semanas hasta la semana 12 posparto). Se encontró una reducción significativa en la tasa de brotes durante el embarazo y posparto, sin mayor evidencia de comorbilidad asociada al uso de IGIV34. Otra opción en la prevención puede ser el inicio precoz de FME, en los casos donde la madre no desee lactancia35. En nuestra serie, iniciamos FME inmediatamente tras el parto en 5 mujeres, recomendando evitar la lactancia. Esta puede ser la explicación del menor porcentaje de lactancia visto en la cohorte con EM.
Como limitaciones de nuestro estudio se encuentra el haber sido realizado en un único centro universitario de referencia para EM y con un número limitado de pacientes, lo que puede dar lugar a sesgos y limitar la capacidad de generalización de resultados a otras poblaciones.
ConclusionesEn nuestra experiencia, destaca el gran porcentaje de mujeres con EM asintomáticas o levemente sintomáticas al momento de planificar el embarazo. Nuestra serie confirma que la TAB disminuye durante el embarazo y aumenta en el primer trimestre del puerperio, pero no hay diferencias estadísticamente significativas en la TAB si se considera un período de 2 años previo y posterior al embarazo. Por último, nuestro estudio mostró que las mujeres con EM no tienen una mayor morbilidad obstétrica respecto a mujeres sanas.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
A nuestra compañera H. Goicoechea Briceño por su ayuda constante en la gestión asistencial de nuestros pacientes.
Una versión reducida de este trabajo ha sido presentado en formato póster en la LXIV Reunión Anual de la Sociedad Española de Neurología, en Barcelona en 2012 y en la 65th Annual Meeting of the American Academy of Neurology, en San Diego en 2013.