La enfermedad de Parkinson) es un desorden neurodegenerativo caracterizado por problemas de equilibro, rigidez muscular y lentitud para realizar movimiento, debido a la pérdida de neuronas dopaminérgicas de la sustancia nigra pars compacta (SNpc) y la reducción de los niveles de dopamina. Se sabe que el sistema endocannabinoide modula el funcionamiento de la vía nigroestriatal, a través de ligandos endógenos como anandamida (AEA), que es hidrolizado por la hidrolasa amida de ácidos grasos (FAAH). El objetivo de este trabajo consiste en aumentar los niveles de AEA, a través de la inhibición de FAAH por URB-597 y evaluar la modulación que ejerce AEA en la muerte neuronal dopaminérgica inducida por 1-metil-4-fenil-1,2,3,6-tetrahidropiridina (MPTP).
MétodosSe incluyeron 4 grupos experimentales con una n=6, el primero fue el grupo control sin tratamiento, un grupo al cual se le administró (0,2mg/kg) URB-597 cada 3.er día durante 30 días, un grupo tratado con MPTP (30mg/kg) por 5 días y un grupo inyectado con URB-597+MPTP. Tres días después de la última administración de los grupos experimentales, se llevó a cabo la aplicación de los siguientes paradigmas conductuales: prueba de la barra vertical, barra inclinada y longitud de la zancada para comparar la coordinación motriz. Posteriormente, se analizó la inmunorreactividad de las células dopaminérgicas y de microglía en SNpc y cuerpo estriado (CE).
ResultadosLos resultados muestran que el grupo tratado con URB-597 previo a la administración de MPTP, presentó un mejor desempeño en la realización de las pruebas conductuales comparados con los ratones que recibieron la administración de MPTP. Los hallazgos del análisis inmunohistoquímico de las células dopaminérgicas muestran que el grupo tratado con MPTP presenta una disminución en el número de células y fibras dopaminérgicas tanto en la SNpc y CE. En los animales tratados con URB-597 previo a la administración de MPTP se observó un aumento en la inmunorreactividad de tirosina hidroxilasa en comparación al grupo tratado con MPTP. Con respecto a la inmunorreactividad de las células de microglía, el grupo tratado con MPTP presentó una mayor inmunorreactividad a Iba-1 en el CE y la SNpc comparado con el grupo tratado con URB-597 previo a la administración de MPTP.
ConclusiónLos resultados obtenidos muestran que el URB-597 genera un efecto protector, al inhibir la muerte neuronal dopaminérgica, y disminución en la inmunorreactividad microglial y una mejora en las alteraciones motoras causadas por MPTP.
Parkinson's disease (PD) is a neurodegenerative disorder characterised by balance problems, muscle rigidity, and slow movement due to low dopamine levels and loss of dopaminergic neurons in the substantia nigra pars compacta (SNpc). The endocannabinoid system is known to modulate the nigrostriatal pathway through endogenous ligands such as anandamide (AEA), which is hydrolysed by fatty acid amide hydrolase (FAAH). The purpose of this study was to increase AEA levels using FAAH inhibitor URB597 to evaluate the modulatory effect of AEA on dopaminergic neuronal death induced by 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP).
MethodsOur study included 4 experimental groups (n = 6 mice per group): a control group receiving no treatment, a group receiving URB597 (0.2mg/kg) every 3 days for 30 days, a group treated with MPTP (30mg/kg) for 5 days, and a group receiving URB597 and subsequently MPTP injections. Three days after the last dose, we conducted a series of behavioural tests (beam test, pole test, and stride length test) to compare motor coordination between groups. We subsequently analysed immunoreactivity of dopaminergic cells and microglia in the SNpc and striatum.
ResultsMice treated with URB597 plus MPTP were found to perform better on behavioural tests than mice receiving MPTP only. According to the immunohistochemistry study, mice receiving MPTP showed fewer dopaminergic cells and fibres in the SNpc and striatum. Animals treated with URB597 plus MPTP displayed increased tyrosine hydroxylase immunoreactivity compared to those treated with MPTP only. Regarding microglial immunoreactivity, the group receiving MPTP showed higher Iba1 immunoreactivity in the striatum and SNpc than did the group treated with URB597 plus MPTP.
ConclusionOur results show that URB597 exerts a protective effect since it inhibits dopaminergic neuronal death, decreases microglial immunoreactivity, and improves MPTP-induced motor alterations.
La enfermedad de Parkinson (EP) es una enfermedad neurodegenerativa caracterizada por una lenta progresión y su rasgo distintivo es la degeneración de las neuronas dopaminérgicas de la sustancia nigra pars compacta (SNpc). La disfunción en la señalización dopaminérgica que esto provoca trae consigo rigidez muscular, bradicinesia e inestabilidad postural, cuadro sintomático característico de la EP1. Un hallazgo pato-fisiológico uniformemente observado, tanto en modelos animales como en pacientes con EP, es que la muerte de las neuronas dopaminérgicas de la SN se encuentra acompañada por un aumento en el número de células de microglía. La microglía, al pasar a su estado activo después de que se presenta un daño neuronal, tiene, además, la capacidad de promover la infiltración y la activación de macrófagos, desde la periferia hacia el sistema nervioso. Los macrófagos infiltrados, al igual que la microglía activada, contribuyen al daño neuronal. Al analizar muestras de pacientes con EP es posible apreciar un aumento significativo del complejo principal de histocompatibilidad clase ii en áreas como el caudado putamen, así como la SNpc. La activación microglial es la principal responsable de la neurodegeneración debida al estrés oxidativo en dichas áreas cerebrales2. Numerosas evidencias científicas asocian la activación de las células microgliales y su participación en los procesos neurodegenerativos. Esta activación microglial se ve acompañada de la presencia de mediadores inflamatorios, como, por ejemplo, citocinas proinflamatorias3-5. Sin embargo, los hallazgos son controvertidos, dado que existen evidencias de que la microglía podría tener efectos neuroprotectores, por ejemplo, a través de la secreción de factores neurotróficos.
Actualmente, la gama de tratamientos farmacológicos para tratar la EP es estrecha y la levodopa no es una opción de tratamiento viable para todos los pacientes con dicha enfermedad, ya que el uso de este fármaco como tratamiento contra la EP no disminuye la progresión de la enfermedad y, además, a largo plazo es un factor de riesgo en la aparición de discinesia en los pacientes6,7.
Por lo anterior, las dificultades emergentes a partir del tratamiento actual sugieren la búsqueda de nuevas estrategias terapéuticas, con el objetivo de buscar nuevos blancos farmacológicos o sistemas de neurotransmisión que participen o modulen el funcionamiento de los ganglios basales. Tal es el caso del sistema endocannabinoide, ya que este puede actuar con eficacia neuroprotectora, sobre los fenómenos relacionados con el daño en el sistema nigroestriado8.
Se sabe que los endocannabinoides son moléculas derivadas de lípidos, sintetizados a demanda en el sistema nervioso central por las células gliales (astrocitos y microglía)9. Los 2 principales endocannabinoides son anandamida (AEA), que es hidrolizado por la hidrolasa amida de ácidos grasos (FAAH), y la 2-araquidonoilglicerol, que es hidrolizado por la FAAH y por la monoacilglicerol lipasa10. Una inhibición en la enzima FAAH a través de la administración de URB-597 provoca una disminución en la hidrólisis de AEA, lo que ocasiona un aumento en la concentración de esta en el cerebro11. La deleción genética de la enzima FAAH contribuye también a un aumento de la concentración de AEA en el medio12. Se sabe que la AEA participa en diferentes procesos patológicos como fisiológicos, por ejemplo: regulación metabólica, modulación del dolor, modulación del estrés y la ansiedad, función cognitiva y memoria, participa de igual manera en procesos inmunológicos como inflamación y progresión tumoral13. Por lo que el objetivo de este trabajo consiste en aumentar el tono endocannabinoide, a través de la inhibición de la enzima FAAH por URB-597 y así evaluar la modulación que ejerce AEA en la muerte neuronal dopaminérgica inducida por 1-metil-4-fenil-1,2,3,6-tetrahidropiridina (MPTP).
Material y métodosEn este estudio experimental se utilizaron 24 ratones macho de la cepa C57BL/6 de 20-25 g de peso corporal, distribuidos en 4 grupos según el esquema de administración; los animales se mantuvieron bajo condiciones de bioterio (libre acceso al agua y alimento, períodos de luz-oscuridad 12×12h; temperatura ambiente de 23 a 25°C).
Los 4 grupos de trabajo fueron los siguientes:
- a.
Grupo control: este grupo de animales no fue administrado con ninguno de los fármacos.
- b.
Grupo URB-597: los animales en este grupo recibieron inyecciones intraperitoneales de URB-597 (Sigma-Aldrich, MO, EE. UU.) a dosis de 0,2mg/kg cada segundo día durante 30 días.
- c.
Grupo MPTP: este grupo se le administró una dosis de 30mg/kg/día de MPTP (sigma-Aldrich, MO, EE. UU.) durante 5 días.
- d.
Grupo URB-597+MPTP: este grupo recibió el mismo tratamiento que el grupo de URB-597, solo que al finalizar el tratamiento se administró MPTP a dosis de 30mg/kg/día por 5 días.
Durante este estudio se siguieron las consideraciones éticas especificadas en NOM-062-ZOO-1999 del uso y manejo de animales de laboratorio, además de la «Guía para el cuidado y uso de animales de laboratorio» del Instituto Nacional de Salud (NIH, publicación N.° 8023, 1978).
Estudios conductualesLas pruebas conductuales se realizaron 3 días después de la última administración de cada grupo de trabajo.
Prueba de la barra inclinadaEsta prueba es un dispositivo que consistió en una barra de acrílico de 1m de largo, colocada con una inclinación de 15° para que los ratones la escalaran. En el extremo superior de la viga se colocó su caja-hogar como estímulo para que los ratones ejecutaran la prueba. Inicialmente, los ratones se entrenaron para trepar sobre una viga de 12 mm de ancho durante 2 días antes de empezar los esquemas de administración; la prueba se inició cambiando el grosor de la viga con un ancho de 6mm. Los ratones se colocaron en la parte baja de la viga y se les permitió caminar hasta alcanzar el extremo superior y se registró el tiempo en el que alcanzó su caja. Se empleó un límite máximo de 120 s, al término del cual si el ratón no alcanzó su caja-hogar se removió manualmente y colocó en su caja recibiendo una calificación de 120 s. Los resultados se expresaron como el promedio del tiempo total (s) que tardaron los ratones bajo cada condición experimental14.
Longitud de la zancadaSe empleó esta técnica para valorar la disminución de la longitud de la zancada, síntoma típico de la EP de una marcha hipocinética. Se realizó a través de un método sencillo que consistió de un corredor iluminado de 7cm de ancho, 12cm de altura y 60cm de largo, terminando en una caja oscura, colocado sobre un papel intercambiable. Para ello las patas tanto posteriores como anteriores del ratón fueron teñidas, se colocó al ratón en el extremo iluminado, el cual conduce hacia la caja oscura, dejando sus huellas pintadas en el papel, posteriormente se midió la longitud de la zancada de cada ratón con una regla milimétrica15.
Prueba de la varilla verticalBradicinesia se trata de la pérdida de movimiento espontáneo y automático que conlleva a la lentitud en todas las acciones. Por medio de esta prueba se mide el tiempo que el animal es capaz de dar la vuelta a la varilla para poder descender por esta y el tiempo que tarda en descender completamente por la varilla, de acuerdo con lo descrito por Matsuura et al., en 199716. Los ratones se aclimataron a la varilla vertical (1cm de diámetro, 50cm de altura) en 5 ensayos, cada uno separado por 60 s. En el primer ensayo los animales se limitaron a 300 s y los ensayos posteriores a 120 s como límite de tiempo máximo. Los 3 mejores puntajes se promediaron para cada ratón.
Determinación inmunohistoquímica de las células dopaminérgicas y de las células de la microglíaTres días después de la última administración, los ratones (n=6 por grupo) fueron previamente anestesiados (100mg/kg ketamina y 15mg/kg xilacina I.P.); enseguida se realizó una perfusión intracardíaca con solución de PBS 0,1M seguida de paraformaldehído al 4%. Al finalizar la perfusión, los cerebros fueron extraídos y se mantuvieron en la solución fijadora por 24h; posteriormente, fueron lavados 3 veces con PBS 0,1M. Se realizaron cortes coronales de 35 micras en un vibratomo (Leica VT1000E; Leica Microsystems, Wetzlar, Alemania) para obtener las regiones de CE (Bregma 1,70 a 0,14 mm) y SNpc (Bregma –2,06 a –2,54), acordado a Paxinos y Franklin's17. De cada cerebro se colectaron 6 tejidos por individuo, con una distancia entre cada rebanada de 175μm. De acuerdo con las coordenadas anteriormente mencionadas, las rebanadas fueron seleccionadas al mismo nivel en todos animales para obtener un análisis uniforme —utilizando el principio básico de fraccionamiento desde la zona rostro-caudal. El análisis de los resultados se realizó al obtener la media de células positivas al marcador por campo (445μm), en una magnificación de 40x (Leica Q5001W; Leica Imaging Systems, Ltd., Cambridge, Reino Unido).
El procedimiento para el análisis morfológico se realizó por flotación. Las rebanadas seleccionadas fueron lavadas 4 veces con PBS 0,1M por 5 min cada lavado; posteriormente, se les agregó buffer citrato de sodio (pH 6,4) por 10 min a 37°C; enseguida se realizaron lavados con PBS 0,1M (4×5min c/u). Los tejidos fueron expuestos a la inactivación de peroxidasas endógenas en una solución de H202 al 3% por 20 min, a temperatura ambiente; posteriormente, los tejidos fueron lavados nuevamente con PBS 0,1M (4×5min) y se incubaron en la solución bloqueadora (PBS 0,1M, tritón-X-100 0,03% y suero de cabra al 10%) por una hora a temperatura ambiente. Posteriormente, se renueva esta solución y se agregan los anticuerpos primarios para el marcaje de las células microgliales (Iba-1: Abcam 5076) y de células dopaminérgicas (TH: Ab152 Merck Millipore), la incubación se realizó por 48h a 4°C. Posteriormente, se retiraron los anticuerpos primarios y se inician 4 lavados con PBS-Tritón X-100 0,1%, se agregó el anticuerpo secundario correspondiente (anti-rabbit IgG, Vector, BA1000) (dilución 1:500) en PBS 0,1M y 5% de suero de cabra; se incubaron por hora y media en oscuridad y a temperatura ambiente. Enseguida se lavaron los tejidos 4×5min en PBS 0,1M y después se incubaron en el complejo ABC (Vector, PK6000) en PBS 0,1M por media hora a temperatura ambiente y en oscuridad. Posteriormente, se realizaron lavados y se revelaron con el kit de diaminobencidina (DAB kit, Vector Labs # SK-4100). Los tejidos fueron montados en portaobjetos y una vez que estuvieron secos se les colocó una gota de Entellan (Merck) y su cubreobjetos. Posteriormente las imágenes de los tejidos inmuno-procesados fueron observadas con un analizador de imágenes (Leica Q5001W; Leica Imaging Systems, Ltd., Cambridge, Reino Unido).
Análisis estadísticoLas diferencias en los grupos de tratamiento se calcularon mediante una prueba de Kruskal-Wallis, con una U de Mann-Whitney, utilizando el programa Graphpad Prism 5. Se consideró como diferencia estadísticamente significativa una p ≤ 0,05.
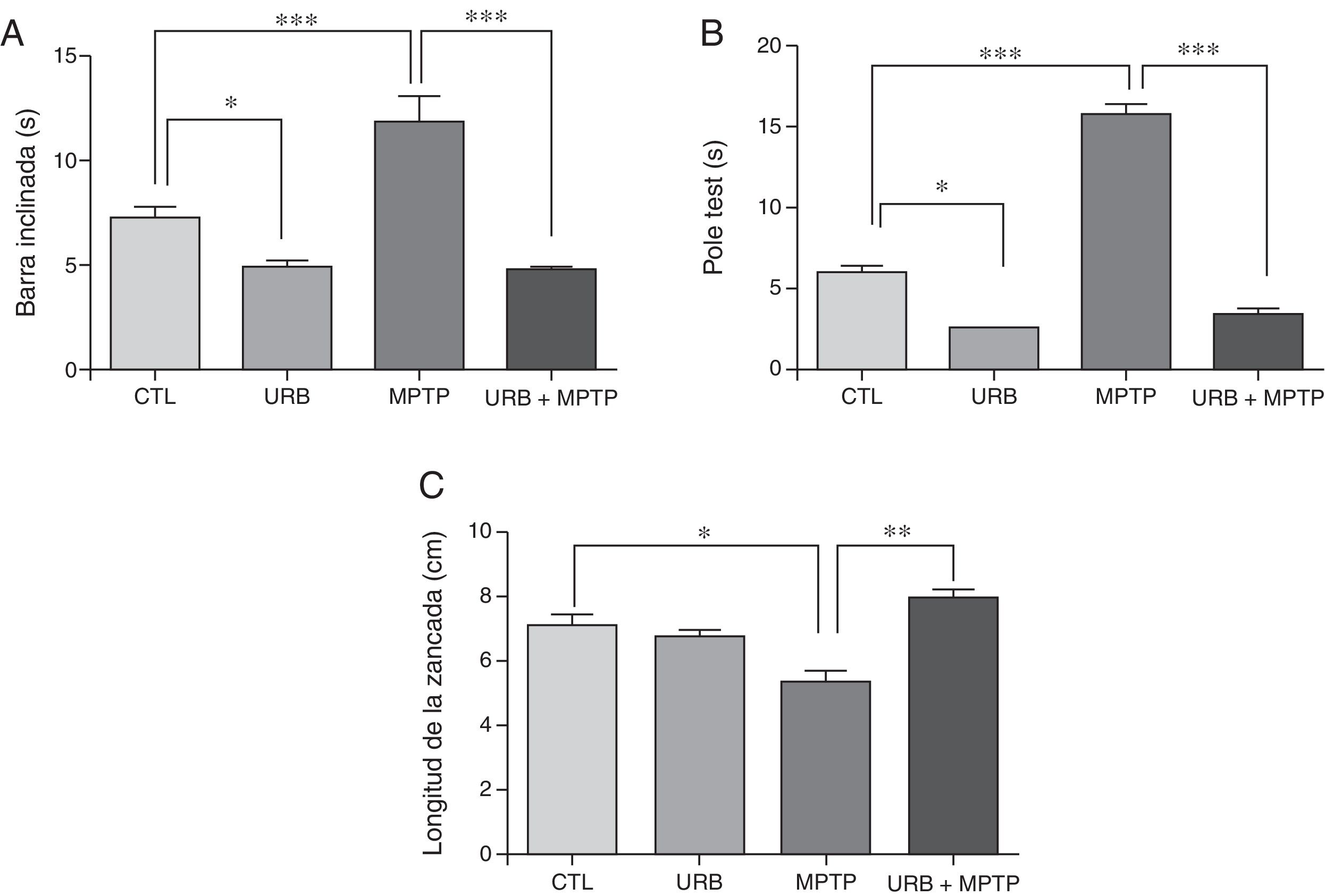
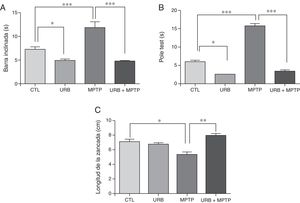
ResultadosPruebas conductualesPrueba de la barra inclinadaDentro de las características de la EP se encuentra el déficit motor, para estudiar este aspecto se evaluó la prueba de la barra inclinada e todos los grupos. Los resultados de esta prueba muestran que el tiempo promedio que tardaron los animales controles en atravesar la viga fue de 7,3 s, mientras que, en comparación con este grupo, el que fue tratado con MPTP presentó un incremento estadísticamente significativo en el tiempo (11,85 s) (fig. 1A). Los resultados del grupo administrado con URB-597 antes de la administración de MPTP muestran una latencia de (4,79 s); el análisis estadístico mostró diferencias significativas en comparación con el grupo tratado con MPTP. En los animales que fueron tratados únicamente con URB-597 también se observó una disminución estadísticamente significativa en el tiempo al cruzar la viga.
Pruebas conductuales. La prueba de la barra inclinada (A) y del pole test (B) expresan el tiempo total (segundos) que tardaron los ratones en ejecutar la prueba. La prueba de la longitud de la zancada (C) expresa en cm la disminución de la longitud de la zancada. Los datos representan la media ± desviación estándar de seis experimentos por duplicado.
Barra inclinada: ***p < 0,001, CTL vs. MPTP. ***p < 0,001, MPTP vs. URB597 + MPTP. *p < 0,05, CTL vs. URB597.
Pole test: ***p < 0,001, CTL vs. MPTP. ***p < 0,001, MPTP vs. URB597 + MPTP. *p < 0,05, CTL vs. URB597.
Longitud de la zancada: *p < 0,05, CTL vs. MPTP. ** p < 0,01, MPTP vs. URB597 + MPTP.
En los animales tratados con MPTP se observa que el tiempo promedio que tardaron los animales en ejecutar esta prueba fue de 15,8 s. Sin embargo, en el grupo control el tiempo promedio que tardaron los animales en ejecutar esta prueba fue de 6 s, lo cual indica que los ratones tratados con MPTP presentaron una dificultad en realizar esta prueba, siendo estadísticamente significativa en comparación con el grupo control. Por otra parte, en los animales tratados con URB-597, previo a la administración de MPTP se observa una disminución considerable en el tiempo de ejecución de esta prueba en comparación con el grupo tratado con MPTP (fig. 1 B). En los animales que fueron tratados únicamente con URB-597 no se observa ninguna diferencia significativa en el tiempo promedio que tardaron los animales en ejecutar esta prueba en comparación con el grupo control.
Prueba de la longitud de la zancadaEn esta prueba la longitud de la zancada promedio de los animales controles fue de 7,13cm. Sin embargo, en los animales tratados con MPTP se observa una disminución en la longitud de la zancada de 5,38cm, la cual es estadísticamente significativa en comparación al grupo control (fig. 1 C). Por otra parte, en la administración de URB-597 previa a la administración de MPTP se observa un aumento en la longitud de la zancada en comparación con el grupo tratado con MPTP, siendo estadísticamente significativa. En los animales que fueron tratados únicamente con URB-597 no se observa ninguna modificación en la longitud de la zancada en comparación con el grupo control (fig. 1 C).
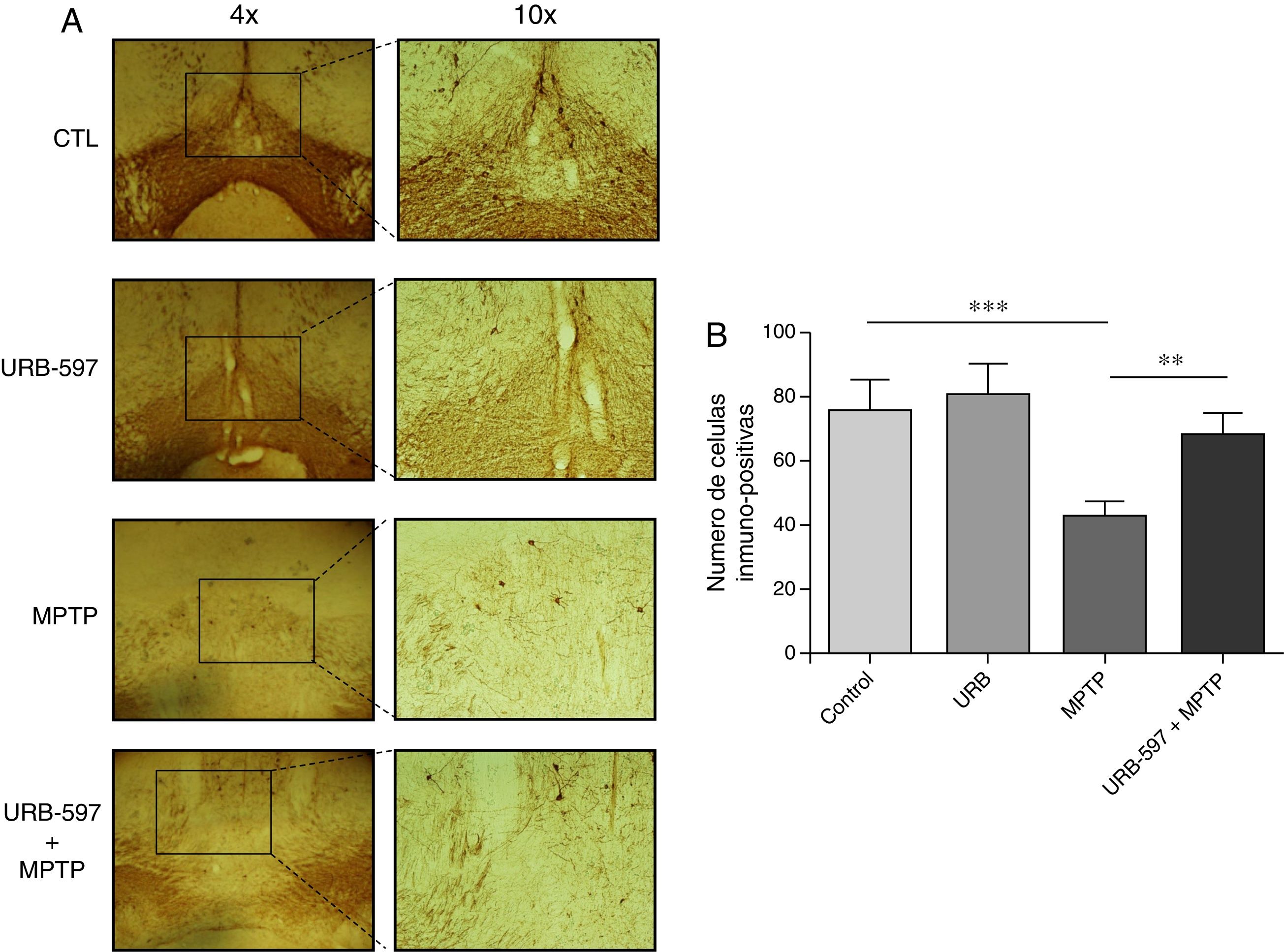
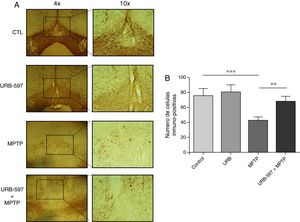
Determinación inmunohistoquímica de tirosina hidroxilasa en la sustancia nigra y cuerpo estriadoEn los resultados de la cuantificación de las células dopaminérgicas inmunopositivas a tirosina hidroxilasa (TH), los ratones tratados con MPTP mostraron una disminución del 69,4% en el número de neuronas inmunopositivas a TH en la SNpc respecto al grupo control (fig. 2).
Análisis cuantitativo de células dopaminérgicas inmunopositivas a TH en la SNpc. El panel A muestra las células dopaminérgicas inmunorreactivas a TH de los diferentes grupos de trabajo. El panel B muestra el análisis cuantitativo, los datos representan la media ± desviación estándar de seis experimentos por duplicado. ***p < 0,001, CTL vs. MPTP. **p < 0,01, MPTP vs. URB597 + MPTP.
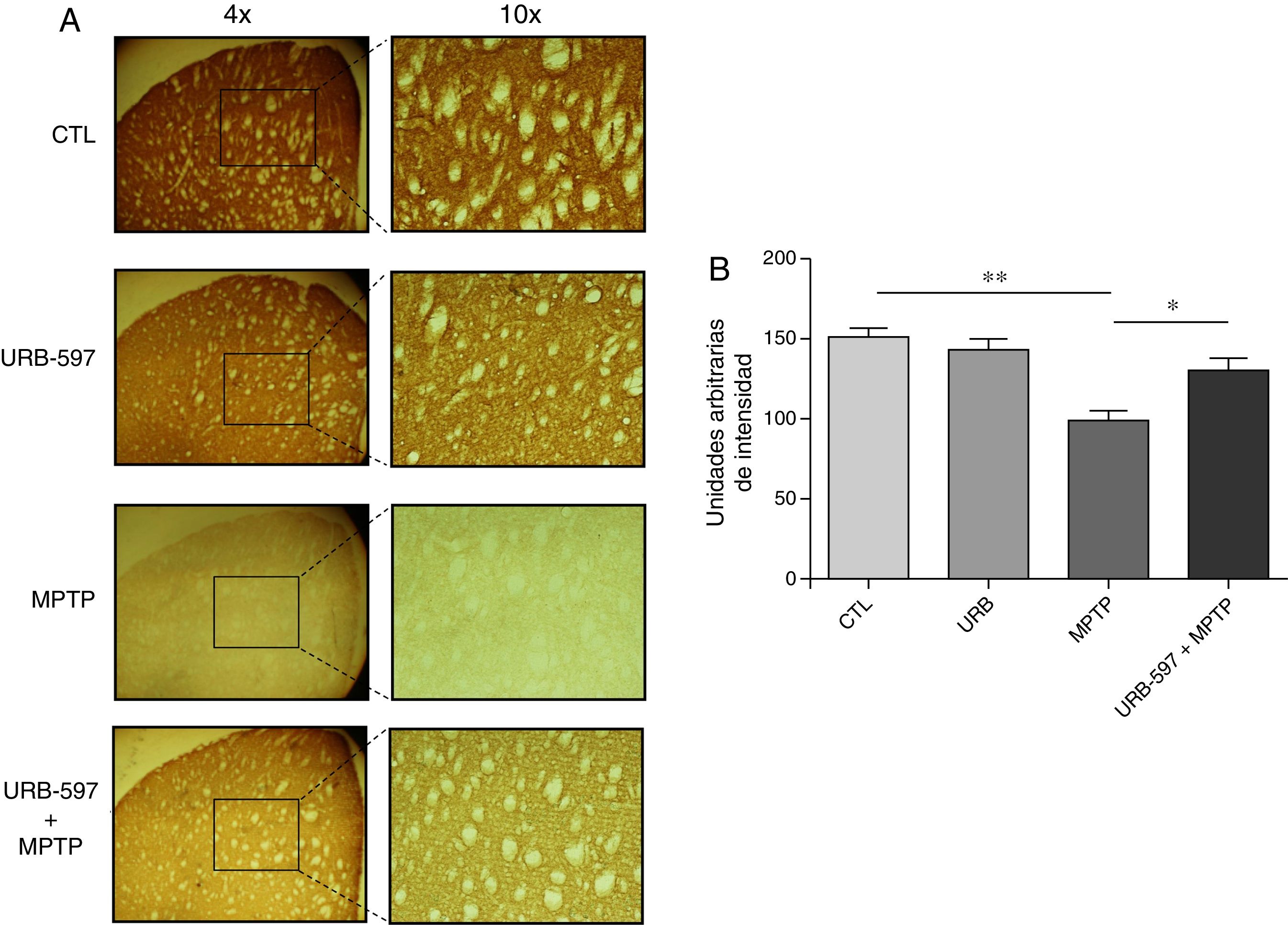
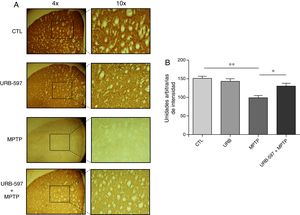
Los hallazgos en CE muestran que el grupo tratado con MPTP presentó una disminución significativa en el número de fibras dopaminérgicas del 63% en CE, en comparación con el grupo control. En contraste, en el grupo tratado con URB-597 y MPTP se observó una disminución del 12% en comparación con el grupo control, sin alcanzar significación estadística. Sin embargo, sí se muestran diferencias significativas respecto al grupo MPTP (fig. 3).
Análisis cuantitativo de fibras dopaminérgicas inmunopositivas a TH en CE. El panel A muestra las fibras dopaminérgicas inmunorreactivas a TH de los diferentes grupos de trabajo. El panel B muestra el análisis cuantitativo, los datos representan la media ± desviación estándar de seis experimentos por duplicado. ** p < 0,01, CTL vs. MPTP. *p < 0,05, MPTP vs. URB597 + MPTP.
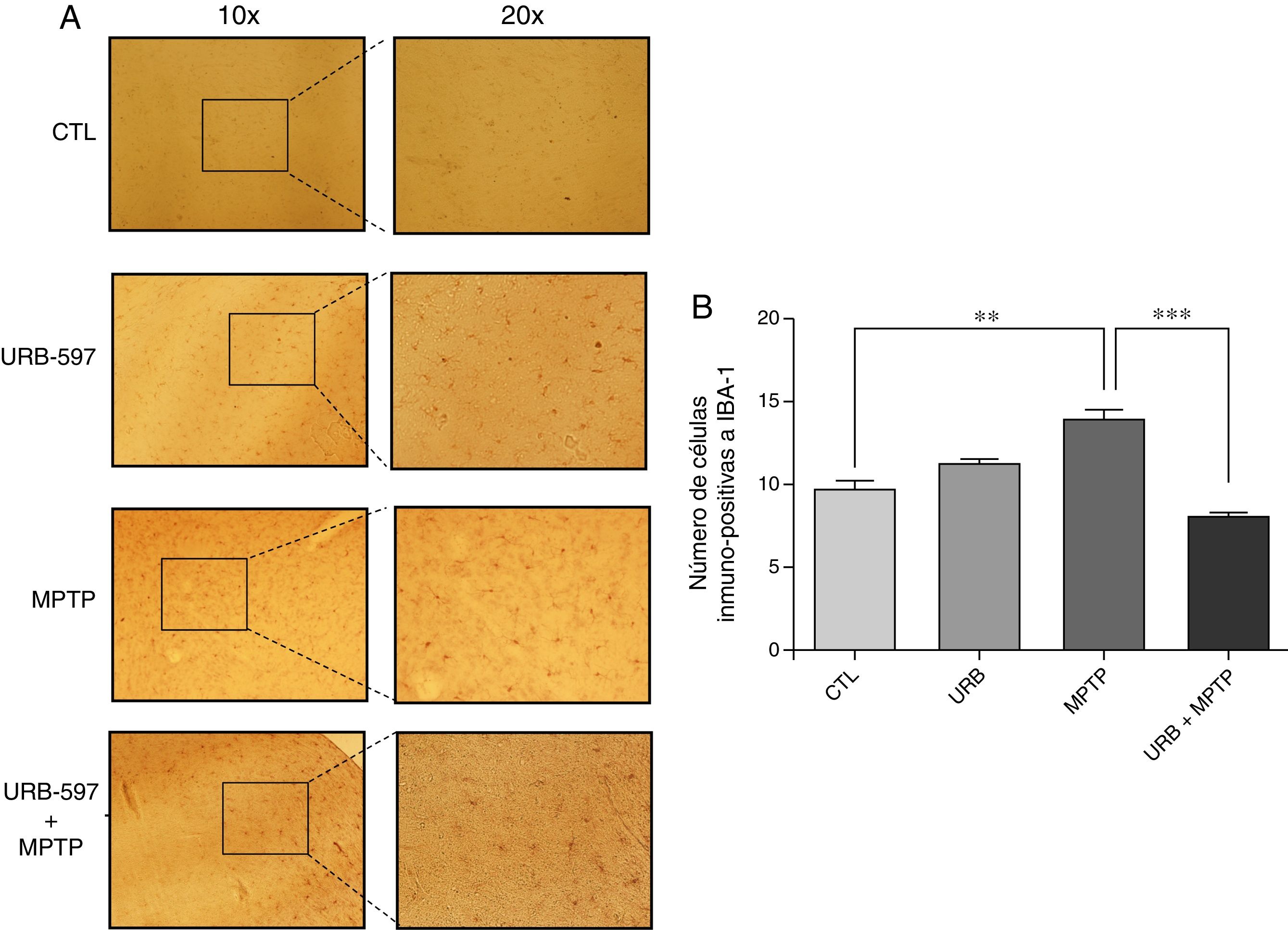
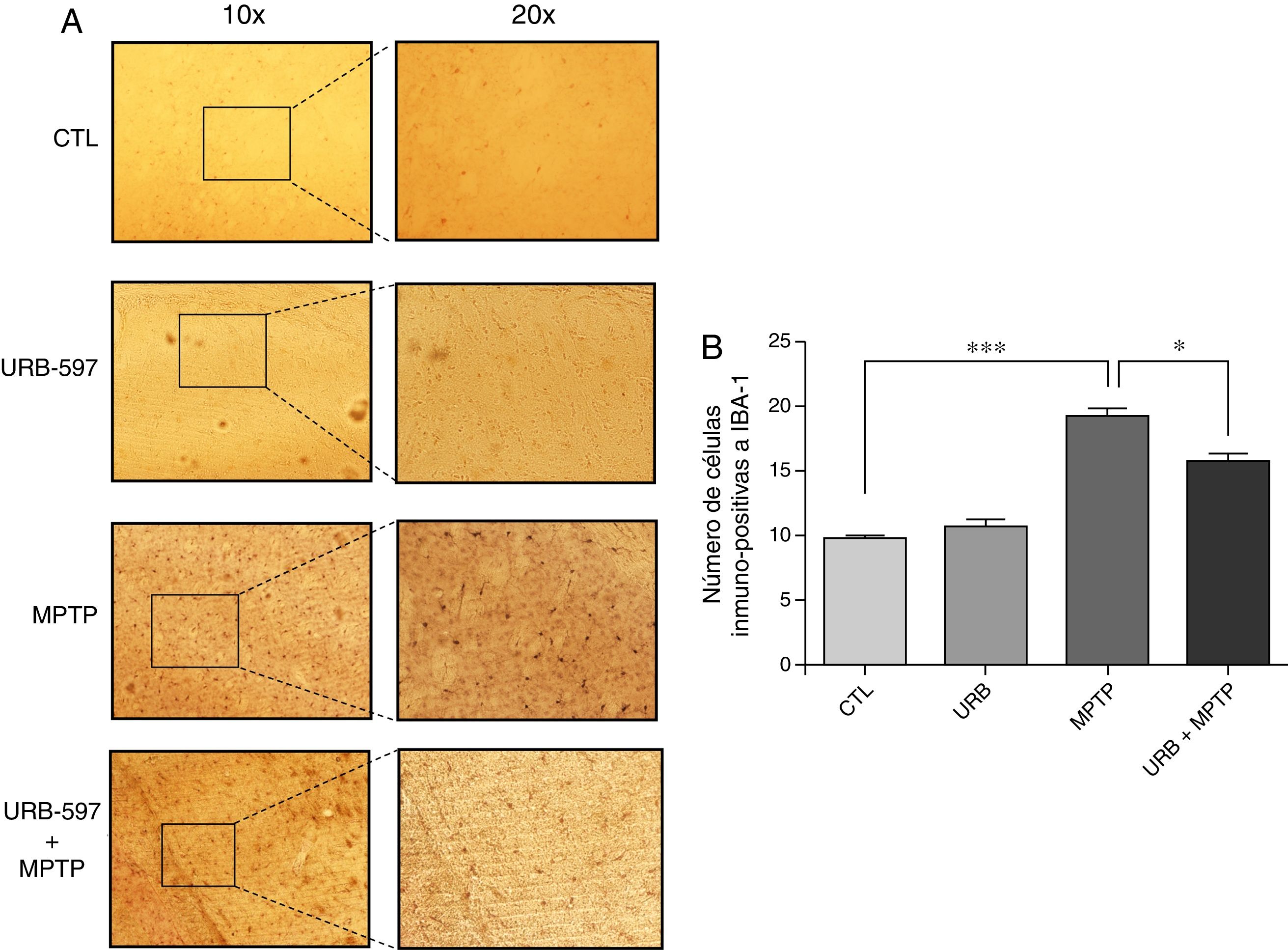
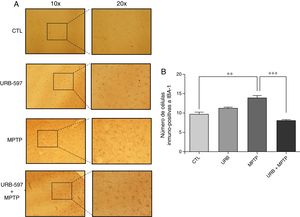
En la figura 4 se observan los cortes histológicos de los diferentes grupos de tratamiento en la SNpc. No se observaron células IBA1+ en los grupos control y URB597. En contraparte, el grupo tratado con MPTP presenta una gran presencia de células de inmunopositivas a Iba-1, la cual se ve disminuida si se administra previamente URB-597, siendo las diferencias estadísticamente significativas (fig. 4).
Análisis cuantitativo de la inmunorreactividad de las células de microglía en la SNpc. El panel A muestra la inmunorreactividad a iba-1 de los diferentes grupos de trabajo. El panel B muestra el análisis cuantitativo, los datos representan la media ± desviación estándar de seis experimentos por duplicado. **p < 0,01, CTL vs. MPTP. *** p < 0,001, MPTP vs. URB597 + MPTP.
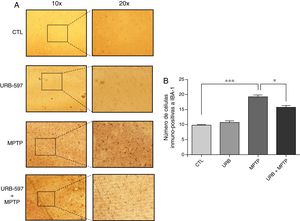
En la figura 5 se observan los cortes histológicos de la región CE de los diferentes grupos analizados. El grupo tratado con MPTP presenta una gran cantidad de células inmunorreactivas a Iba-1 en comparación con el control. En el grupo tratado con URB-597 previo a la administración de MPTP es posible apreciar una menor inmunorreactividad microglial en comparación al grupo tratado con MPTP, presentando una diferencia estadísticamente significativa en ambos grupos; esto afirma que el URB-597 tiene la capacidad de provocar una disminución en la inmunorreactividad producida por MPTP. En el grupo tratado únicamente con URB-597 no se observa ninguna diferencia estadísticamente significativa en la inmunorreactividad de Iba-1 en comparación con el grupo control (fig. 5).
Análisis cuantitativo de la inmunorreactividad de las células de microglía en CE. El panel A muestra la inmunorreactividad a iba-1 de los diferentes grupos de trabajo. El panel B muestra el análisis cuantitativo, los datos representan la media ± desviación estándar de seis experimentos por duplicado. ***p < 0,001, CTL vs. MPTP. *p < 0,05, MPTP vs. URB597 + MPTP.
Una manera efectiva de determinar el daño causado en la vía nigroestriatal por la administración de MPTP es evaluando la funcionalidad de la actividad locomotora y se utilizan diferentes paradigmas cuya finalidad es evaluar diversos indicadores como: el equilibrio, rigidez muscular y la locomoción del animal al someterlo a algún modelo de inducción de parkinsonismo18. Cabe señalar que, previo a la administración de MPTP, los animales tuvieron un periodo de entrenamiento en donde se adaptaron a las tareas que debían realizar en cada prueba. El URB-597 es conocido por ejercer un efecto ansiolítico, antidepresivo, antihipertensivo y analgésico en roedores, y en particular es conocido por reducir el dolor en modelos térmicos, así como inflamatorios. Además de que no presenta el perfil farmacológico característico de los agonistas cannabinoides, específicamente de la activación del receptor cannabinoide de tipo 119. Todas estas acciones ejercidas por URB-597 son debidas a un aumento del tono endocannabinoide, a través de la inhibición a la enzima FAAH.
Se sabe que el receptor CB1 es expresado en áreas cerebrales relacionadas con las emociones, como lo son la corteza prefrontal, el tálamo e hipotálamo, además, estudios realizados por Mclaughlin y Gobbi en 2012 indican que la inhibición de la hidrólisis de AEA produce un efecto ansiolítico en la prueba de suspensión de la cola; esto evidencia el papel de los endocannabinoides en la modulación emotiva20. Como puede observarse en la prueba de la barra inclinada, la administración de URB-597 produjo un efecto ansiolítico en la realización de la prueba; estos datos concuerdan con estudios realizados por Kregiel et al., en 2016, en los cuales se demostró que la administración de URB-597 produce un aprendizaje emocional de los ratones, los cuales recibían estímulos positivos y negativos distribuidos aleatoriamente, y se pudo observar un comportamiento positivo de estos animales para realizar la prueba21. En la prueba del poste o la varilla vertical se puede generar un pensamiento pesimista o de peligro en el animal debido a la altura de la varilla (ansiedad), por lo que los ratones tratados con URB-597 presentaron una disminución considerable al miedo producido por la altura del poste, mostrando mayor seguridad en el momento de realizar la prueba, lo cual produjo una disminución en el tiempo de realización de la prueba. Es conocido que la modulación de AEA induce un comportamiento positivo en ratones y este efecto se puede inhibir si se administran antagonistas al receptor CB121. El efecto ansiolítico que genera el URB-597 fue reproducido en nuestros experimentos debido a que los ratones parecían estar menos ansiosos para concluir la prueba.
Trabajos realizados por Eisenstein en 2010 muestran que los animales a los que se administró únicamente URB-597 presentaron una mayor hiperactividad motora en el momento de realizar las pruebas conductuales; esto puede deberse al efecto ansiolítico que se presenta al aumentarse el tono endocannabinoide22. Por otro lado, se sabe que los endocannabinoides tienen la capacidad de interactuar con diversos sistemas de neurotransmisión que controlan el movimiento; esto provoca que los agonistas cannabinoides tengan efectos motores positivos23.
En este estudio, la administración de URB-597 previo a la administración de MPTP redujo la sintomatología motora; esto se pudo observar en la realización de pruebas motoras. El aumento de los niveles de AEA es conocido por ser un mecanismo compensatorio en la EP. En un estudio realizado con 16 pacientes con EP en el cual se analizó el líquido cefalorraquídeo, se encontraron niveles aumentados de anandamida comparados con muestras control de líquido cefalorraquídeo de pacientes de edad avanzada24.
El efecto antiinflamatorio que presentan los cannabinoides está mediado por la modulación de citocinas como factor de necrosis tumoral alfa, IL-12, IL-1, IL-6 e IL-1023. En condiciones de daño traumático, convulsiones con ácido kaínico y toxicidad con 6-OHDA, es posible observar un aumento en los niveles de AEA, lo que afirma su papel neuroprotector a través de la inhibición en la producción de citocinas proinflamatorias25.
Por otro lado, en este trabajo se pudo observar una disminución en la inmunorreactividad a las células microgliales en ratones tratados previamente con URB-597, así como una disminución en la muerte de las células dopaminérgicas, además de una mejoría en la capacidad motriz de los animales tras la administración de MPTP. La inflamación es un componente que contribuye de manera importante en los procesos patológicos y la modulación de la participación microglial es elemental. Estudios reportan que la microglía se encuentra relacionada con la ausencia de fibras dopaminérgicas, así como con la severidad de la sintomatología motora presente en la EP, por lo que una reducción de las células microgliales puede asociarse a una sintomatología menos marcada, así como mayor cantidad de neuronas o fibras dopaminérgicas26.
Por otra parte, en los grupos tratados con MPTP se observa un mayor marcaje de células Iba-1+ en comparación con el grupo control. Ante una condición patológica existen factores intrínsecos que inducen la proliferación de éstas células27. La formación de procesos y arborizaciones microgliales favorecen una rápida y constante transformación citoplasmática en cuestión de horas28. A pesar de que en la presente investigación no se analizó el grado de activación microglial, nuestros hallazgos muestran que la administración de URB-597 puede ejercer un efecto benéfico en la reactividad de esta estirpe glial; sin embargo, resultaría interesante esclarecer el perfil temporal de activación microglial en futuras investigaciones.
Se sabe que, entre las posibles etiologías de la EP, los procesos inflamatorios mediados por las células gliales en el sistema nervioso central han cobrado mucha importancia como los ejecutores principales de la neurodegeneración de las células dopaminérgicas de la SNpc. Trabajos realizados por McGeer en 1988 demostraron un aumento en la expresión de las células microgliales de la vía nigroestriatal en tejido cerebral post mortem. Se sabe que un aumento en el estado de activación de estas células gliales trae como consecuencia la liberación de varios mediadores inflamatorios responsables del daño y la muerte de las células dopaminérgicas de la vía nigroestriatal29.
Durante el proceso inflamatorio el receptor CB2 parece estar implicado en la inhibición de la inflamación. Algunos estudios demuestran que un aumento en su expresión y su agonismo reduce la neuroinflamación en diferentes modelos de inducción de parkinsonismo y de Huntington, postulándose este receptor como un blanco farmacológico para inhibir este proceso inflamatorio30. En un modelo de lesión dopaminérgica a través de la administración de 6-OHDA y un agonista selectivo a CB2 se observó una correlación positiva, con un aumento en la expresión del receptor CB2 y una disminución en la severidad del daño de la vía nigroestriatal31. Además, en otro estudio se observó un aumento de la expresión de este receptor después de la administración de MPTP y de LPS, por lo que diversos autores proponen que un aumento en la expresión durante un proceso inflamatorio y el agonismo selectivo al mismo podrían deberse a un bloqueo en la diferenciación de la microglía hacia un fenotipo neurotóxico (M1) y la inhibición de los factores inflamatorios cuando la microglía esté activada32. Los resultados de nuestro estudio demuestran que la administración de URB-597 previo a la administración de MPTP es posible apreciar una disminución en la inmunorreactividad microglial menor que en el grupo tratado con MPTP; esto afirma que el URB-597 tiene la capacidad posiblemente de reducir la activación microglial producida por el daño neuronal. Estudios comprueban que las células de la microglía en presencia de mediadores antiinflamatorios, como IL-4 IL-13 o IL-10, cambian su fenotipo M1 a M2 asociado a procesos de reparación celular en el cual se presentan largas ramificaciones y expresión de marcadores antiinflamatorios; esta morfología ramificada también es característica del estado de reposo de la microglía o estado 02. Existen estudios que concuerdan con nuestros resultados y afirman que el URB-597 administrado crónicamente puede reducir la inmunorreactividad y la activación microglial anormal y el ambiente proinflamatorio presente en el envejecimiento33; por otra parte, en estudios realizados en cultivos de células de microglía tratada con LPS, a los cuales se les agregó URB-597, se observó que este tiene la capacidad de reducir la actividad de la iNOS, así como la de ciclooxigenasa 2, provocando una reducción en la producción de especies reactivas de oxígeno, al igual que prostaglandina E234. Estudios in vitro realizados por Murphy et al. demuestran que los cannabinoides y endocannabinoides pueden reducir la activación microglial inducida por IFN-γ y LPS33.
En conclusión, los resultados obtenidos en el laboratorio indican un papel neuroprotector de URB-597, el cual protegió a los animales de la disfunción motora causada por MPTP, además de que su administración previa al daño inhibió la muerte neuronal dopaminérgica y el aumento en la inmunorreactividad microglial.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.