La progresión de la enfermedad de Parkinson (EP) supone una importante reducción de la movilidad y el riesgo de caídas, acompañados de síntomas no motores que comprenden problemas cognitivos y psicóticos, entre otros. Se considera que la EP es avanzada (EPA) cuando La presencia de fluctuaciones motoras, discinesias graves y síntomas motores axiales resistentes a la levodopa y síntomas no motores, como los trastornos cognitivos, representan las principales manifestaciones fenotípicas de una EP avanzada1. Los tratamientos convencionales no proporcionan un control adecuado de los síntomas y suele corresponder a los estadios 4 o 5 de la escala de Hoehn y Yahr. Aproximadamente, el 50% de los pacientes con EP muestran las complicaciones características de la EPA pasados 5 años desde el diagnóstico clínico, incluyendo también fluctuaciones motoras, síntomas no motores y discinesias relacionadas con el tratamiento2. El tratamiento con apomorfina en perfusión continua (APC) ha demostrado ser eficaz para mejorar las complicaciones motoras que experimentan los pacientes con EPA y su funcionalidad global3-5. Sin embargo, en la literatura existe poca información sobre la eficacia de la APC según el grado de afectación funcional de los pacientes con EPA. Por este motivo, se diseñó un estudio observacional para determinar la eficacia de la APC en pacientes con EPA con diferentes grados de afectación funcional, así como su tolerancia a este tratamiento. Creemos interesante publicar los resultados parciales de este estudio.
Pacientes y métodosSe incluyó a pacientes consecutivos con EP Queen Square Brain Bank for Neurological Disorders (QSBB)6 atendidos en la Unidad de Parkinson y Movimientos Anormales del Consorci Sanitari de Terrassa (Barcelona), que se encontraban en estadios avanzados de la enfermedad. Los pacientes con EP incluidos fueron pacientes con fluctuaciones motoras y no motoras, y con periodos OFF incapacitantes. Se les propuso iniciar tratamiento con apomorfina subcutánea mediante bomba de perfusión continua (APC), siguiendo las indicaciones aprobadas en la ficha técnica del producto7. Todos los pacientes firmaron el consentimiento informado para su tratamiento y participación en el estudio, que fue aprobado por el Comité de Ética en Investigación Clínica del Consorci Sanitari de Terrassa.
Valoración de la afectación funcional y clasificación de pacientesLos participantes fueron divididos en 2 grupos: a) pacientes con EPA y moderada afectación funcional, definida por una puntuación en S&E del 60-80% y estadios H&Y de 2 a 3 (grupo A) y b) pacientes con EPA y grave afectación funcional, definida por una puntuación en S&E<60% estadio H&Y>3 (grupo B).
ProcedimientoSe realizó un test o prueba de inicio de perfusión continua de apomorfina (3-4 días). La infusión inicial de apomorfina (Apomorfina Archimedes® 10 mg/ml, solución para perfusión; Archimedes Pharma Ibérica S.L., Madrid) en una dilución de 5mg/ml fue 0,20 ml/h. La velocidad de perfusión se ajustó de acuerdo con la respuesta clínica con incrementos de 0,20 ml/h hasta observar una clara mejoría de acuerdo con el objetivo clínico de control de síntomas o hasta la aparición de efectos secundarios. La perfusión se recomendó en todos los pacientes durante 12 h del día y se realizaron ajustes posteriores de dosis durante las visitas de seguimiento. Los fármacos antiparkinsonianos que recibía el paciente hasta ese momento se mantuvieron después de la fase de inicio y fueron progresivamente ajustados o retirados a lo largo de las visitas de seguimiento, según la respuesta clínica y evaluación del paciente. Estos tratamientos previos incluían levodopa, agonistas dopaminérgicos (pramipexol y rotigotina) y apomorfina en pen o pluma (APO-go PEN® 10 mg/ml Britannia Pharmaceuticals Ltd, Newbury, Reino Unido) que los pacientes utilizaban como medicación de rescate. Los pacientes fueron valorados en la inclusión (valoración previa al inicio de APC) y, durante un seguimiento de un año de duración, al mes, a los 3 meses, a los 6 meses y a los 12 meses.
Variables de resultado1) Diario de fluctuaciones motoras, 2) escala de discinesias Abnormal Involuntary Movement Scale (AIMS), 3) escala de valoración funcional S&E, y 4) la escala hospitalaria de ansiedad y depresión Hospital Anxiety and Depression Scale (HADS).
Análisis estadísticoSe realizó inicialmente un análisis descriptivo. Los resultados de variables continuas se expresan como media ± desviación estándar y las cualitativas como frecuencias y proporciones. Dado el pequeño tamaño muestral, se aplicó la prueba no paramétrica de Friedman, seguida de la prueba de Wilcoxon con comparaciones 2 a 2 para analizar la evolución a distintos tiempos de cada una de las variables de seguimiento. Los porcentajes de cambio entre el estado basal y a los 12 meses se compararon mediante la prueba de U de Mann-Whitney. Se utilizó el paquete estadístico R para el análisis y el nivel de significación estadística se estableció en p<0,05.
ResultadosDoce pacientes con EPA participaron en el estudio, 6 de ellos con moderada afectación funcional (grupo A) y otros 6 con grave afectación funcional (grupo B). Las características clínicas y demográficas se muestran en la tabla 1. Antes del inicio de APC, todos ellos estaban en tratamiento con levodopa con una dosis de 728±100 mg en el grupo A y de 925±100 mg en el grupo B. Adicionalmente, en el grupo A todos recibían pramipexol y en el grupo B 4 usaban rotigotina en parches y uno pramipexol. El uso de agonistas domapinérgicos se redujo a lo largo del seguimiento y dejaron de ser usados por todos los pacientes del grupo A a los 6 meses, solo un paciente del grupo B permaneció en tratamiento con rotigotina, con una dosis de 4 mg.
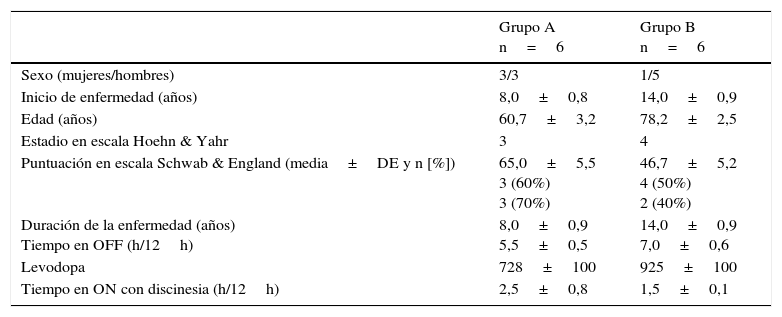
Características demográficas y clínicas basales de los pacientes con enfermedad de Parkinson avanzada según grado de afectación funcional moderado (grupo A) y grave (grupo B)
| Grupo A n=6 | Grupo B n=6 | |
|---|---|---|
| Sexo (mujeres/hombres) | 3/3 | 1/5 |
| Inicio de enfermedad (años) | 8,0±0,8 | 14,0±0,9 |
| Edad (años) | 60,7±3,2 | 78,2±2,5 |
| Estadio en escala Hoehn & Yahr | 3 | 4 |
| Puntuación en escala Schwab & England (media±DE y n [%]) | 65,0±5,5 3 (60%) 3 (70%) | 46,7±5,2 4 (50%) 2 (40%) |
| Duración de la enfermedad (años) Tiempo en OFF (h/12h) | 8,0±0,9 5,5±0,5 | 14,0±0,9 7,0±0,6 |
| Levodopa | 728±100 | 925±100 |
| Tiempo en ON con discinesia (h/12h) | 2,5±0,8 | 1,5±0,1 |
Las dosis de levodopa no sufrieron modificaciones reseñables durante los 12 meses del estudio, pero sí hubo reducción progresiva en el número y el volumen de las inyecciones de rescate de apomorfina en pen en ambos grupos.
La velocidad de perfusio¿n de la apomorfina en el inicio del seguimiento era de 0,4±0,2 ml/h de media en el grupo A y de 0,4±0,2 en el grupo B, la velocidad de perfusio¿n se fue aumentando progresivamente en ambos grupos hasta alcanzar una media de 1,2 ± 0,2 ml/h en los pacientes del grupo A y una media de 0,9 ± 0,1 en los pacientes del grupo B al final del estudio
Respecto a las variables clínicas, los pacientes del grupo A habían experimentado una reducción del 63,9% en sus fluctuaciones motoras en la visita final del estudio, que tenían una duración estimada de 2 h cada 12 h al final, en comparación con las 5,5 h al inicio (tabla 2). La reducción de discinesias según la escala AIMS fue del 85,7% en ese tiempo y también se observaron mejoras significativas en la escala funcional S&E (28,6%) (tabla 2).
Resultados de seguimiento sobre los síntomas motores, no motores y estado emocional de los pacientes del grupo A (afectación funcional moderada)
| Media | Inicio (pre-APC) | 3 meses | 6 meses | 12 meses Final | % de mejora inicio-final | Valor de p | |
|---|---|---|---|---|---|---|---|
| FM en 12h | 5,5±0,5 | 1,0±0,5 | 0,9±0,4 | 2,0±0,6 | 63,9% | 0,001* | |
| AIMS | 14±0,6 | 7±0,6 | 4±1,4 | 2±6,3 | 85,7% | < 0,001* | |
| % en S&E | 70% | 90% | 90% | 90% | 28,6% | < 0,001* | |
| HADS | A | 8,0±0,6 | 6,0±0,6 | 6,0±0,6 | 6,0±0,6 | 24,1% | 0,008* |
| D | 17±0,9 | 13±0,6 | 12,8±1,0 | 10,2±1,0 | 39,9% | 0,001* | |
Análisis realizado con el test de Friedman.
AIMS: escala de movimientos anormales; APC: apomorfina en perfusión continua; FM: fluctuaciones motoras; HADS: escala hospitalaria de ansiedad (A) y depresión (D); S&E: escala de Schwab y England.
Por su parte, los pacientes del grupo B experimentaron igualmente mejorías en todos los aspectos, si bien en menor medida en la mayoría de ellos. Las fluctuaciones motoras se redujeron en un 56,4% a los 12 meses de seguimiento (de 7,0±0,6 h/12 h a 3,0±0,6 h/12 h), la escala AIMS de discinesias había mejorado un 74,0% y su puntuación S&E había mejorado en un 16,7%, con una afectación media del 70% al final del estudio (tabla 3).
Resultados de seguimiento sobre los síntomas motores, no motores y estado emocional de los pacientes del grupo B (afectación funcional grave)
| Media | Inicio (pre-APC) | 3 meses | 6 meses | 12 meses Final | % de mejora inicio-final | Valor de p* | |
|---|---|---|---|---|---|---|---|
| FM en 12h | 7,0±0,6 | 4,1 ± 0,4 | 3,0±0,1 | 3,0 ± 0,6 | 56,4% | 0,001* | |
| AIMS | 16 ± 0,6 | 5,8 ± 0,7 | 6,2 ± 1,0 | 4,2 ± 0,5 | 74,0% | 0,001* | |
| % en S&E | 60% | 70% | 70% | 70% | 16,7% | < 0,001* | |
| HADS | A | 9,0±0,6 | 7,0±1,3 | 7,0±0,6 | 7,0±0,6 | 21,7% | 0,016* |
| D | 19,3±2,4 | 17,2±8 | 14,2±1,2 | 12,9±0,5 | 32,1% | 0,001* | |
Análisis realizado con el test de Friedman.
AIMS, escala de movimientos anormales; AP: apomorfina en perfusión continua; FM: fluctuaciones motoras; HADS: escala hospitalaria de ansiedad (A) y depresión (D); NMSS: escala de síntomas no motores; NPI: escala de síntomas neuropsiquiátricos; S&E: escala de Schwab y England.
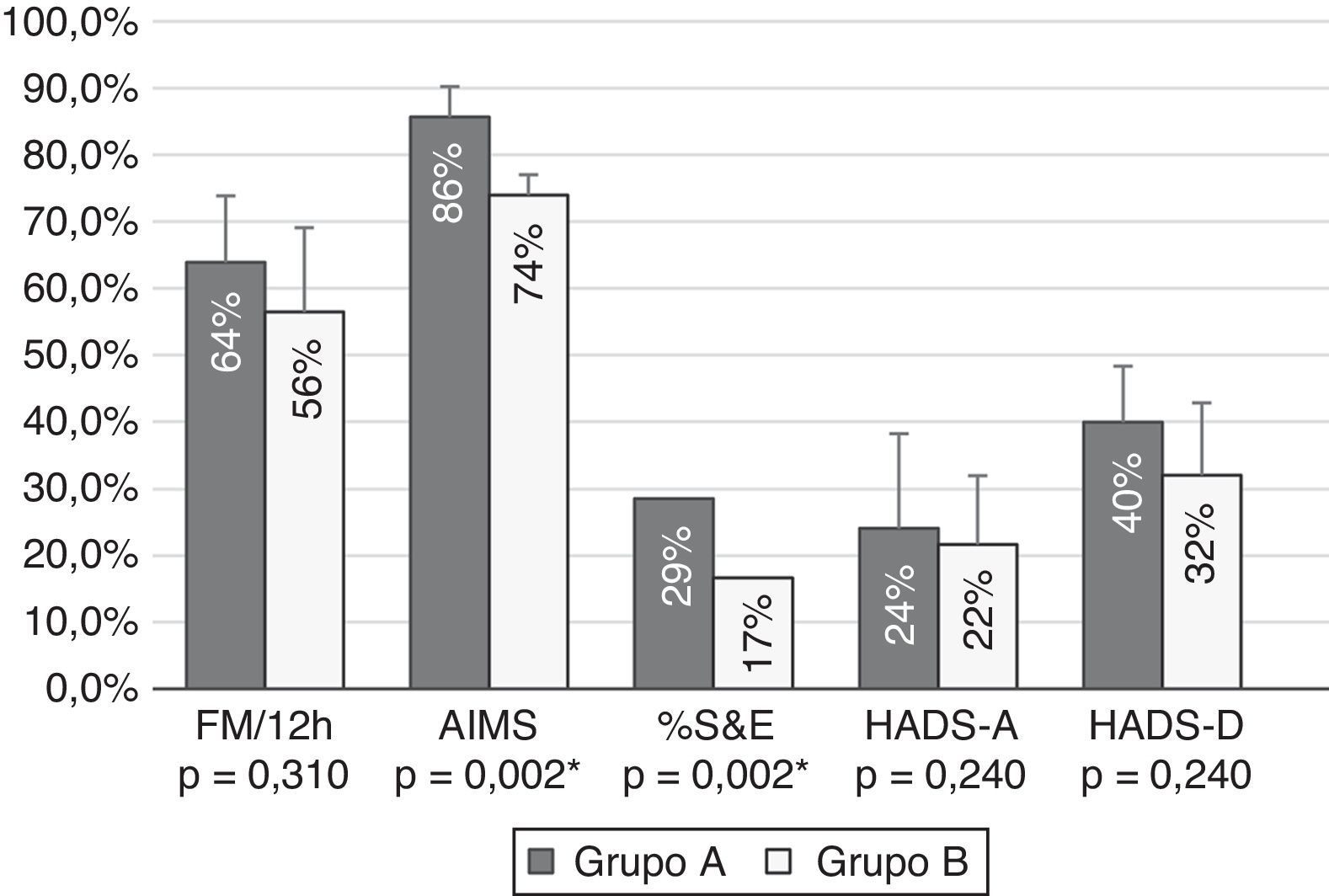
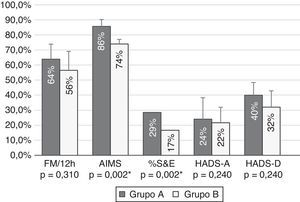
Al comparar la mejoría alcanzada tras 12 meses de tratamiento con APC entre el grupo A y el grupo B, se observó que los pacientes con afectación moderada alcanzaban mayores porcentajes de mejoría en todas las pruebas y la diferencia era estadísticamente significativa respecto al grupo de pacientes con afectación grave en la escala de movimientos anormales AIMS, la escala de Schwab y England (fig. 1).
Comparación de los porcentajes de mejoría en las variables de resultado según un grado de afectación funcional de los pacientes moderados (grupo A) y graves (grupo B). Los pacientes con afectación moderada experimentaron mayores mejorías en todas las escalas, alcanzando diferencia estadísticamente significativa en fluctuaciones motoras (FM), escala de Schwab y England (S&E), escala de movimientos anormales (AIMS), escala hospitalaria (HADS) de ansiedad (A) y depresión (D).
En cuanto a resultados de tolerancia al tratamiento, 4 pacientes del grupo A presentaron náuseas que se controlaron, sin necesidad de reducir la dosis de apomorfina, con 10 mg de domperidona cada 8 h. En el caso de 3 pacientes del grupo B que experimentaron igualmente náuseas, la domperidona produjo solo mejoría parcial, por lo que fue necesario reducir la dosis de APC, tras lo cual desaparecieron. Ningún paciente refirió alucinaciones, pero 2 del grupo B presentaron hipersexualidad y celotipia que mejoraron al reducir la dosis sin necesidad de neurolépticos. Finalmente, 4 pacientes desarrollaron nódulos subcutáneos leves8, con pocas o no visibles marcas cutáneas, menos de 1cm de diámetro, menos de 3 no¿dulos palpables en el área de infusio¿n, no dolorosos, sin signos de infección local, que causaron pocas molestias al paciente y al cuidador, de los cuales solo 2 casos requirieron tratamiento cutáneo con pomadas tópicas antiinflamatorias y hielo local.
DiscusiónEn los últimos años, diversos estudios han mostrado la eficacia de la APC para mejorar los problemas motores y no motores y la calidad de vida de los pacientes con EPA9-11. En los estudios publicados sobre la utilidad de la APC en EPA no se aprecia uniformidad de criterio en cuanto al momento de inicio de este tratamiento en términos de tiempo desde diagnóstico o progresión de los síntomas. Se observa en los estudios recientes que los pacientes incluidos tienen sus funciones gravemente afectadas3-5 y esto parece ir acompañado de altas tasas de efectos secundarios que contribuyen a una breve duración media del tratamiento, unos 26 meses, y a la retirada de este tratamiento por pérdida de eficacia o efectos secundarios12.
En este estudio observamos que los pacientes con EPA y moderada afectación funcional (grupo A) experimentaban una mayor mejoría global que aquellos con función gravemente afectada (grupo B) a lo largo de un año de seguimiento (fig. 1). Esta mejoría más marcada en los pacientes con menor afectación se da tanto en las escalas funcionales como en las fluctuaciones motoras, discinesias y en el estado emocional.
En el inicio del estudio, los pacientes con mayor afectación funcional presentaban no solo mayor deterioro en los aspectos ejecutivos, sino también mayor inestabilidad al caminar y una mayor afectación cognitiva global que suponía un mayor grado de dependencia en general. Muy posiblemente, el conjunto del deterioro de los pacientes del grupo B contribuyó a que la mejoría observada tras el inicio de la APC no pudiera traducirse en una gran mejoría funcional al compararlos con los pacientes con menor afectación. Cabe mencionar que otros autores han propuesto recientemente que este tratamiento se debería considerar antes de lo habitual en la práctica actual, que es con pacientes muy avanzados13-15.
En este estudio no se modificaron significativamente las dosis de levodopa de los pacientes a lo largo del seguimiento, pero sí se fueron retirando otros agonistas dopaminérgicos con éxito. Al final del seguimiento, los pacientes con moderada afectación funcional utilizaban dosis más elevadas de apormorfina para el control de sus síntomas. La explicación radica en que los pacientes con mayor afectación funcional en general no toleraron dosis más elevadas por efectos adversos que eran generalmente leves, pero que obligaron a mantenerlos con dosis más bajas. Es muy probable que la menor dosis contribuyera también a esa mejoría más discreta en este grupo.
Este pequeño estudio presenta las limitaciones propias de un estudio observacional unicéntrico de pequeño tamaño, pero sus resultados ofrecen información inicial sobre un aspecto que sería interesante explorar. Los resultados de esta serie indican nuevas posibilidades terapéuticas para los pacientes con EPA con moderada repercusión funcional y que no mejoran con el tratamiento convencional, los cuales se incluyen en menor medida en los estudios sobre tratamientos alternativos para la EPA. Un mayor deterioro global podría reducir los beneficios de la terapia con APC en la EPA. Estas observaciones indican que los pacientes con EPA candidatos a APC que no presenten un grave deterioro funcional y cognitivo y no sean gravemente dependientes podrían obtener mayor beneficio del tratamiento, y esta es una cuestión que merece estudio en profundidad mediante estudios con un mayor número de pacientes y un seguimiento más prolongado que permitan obtener resultados concluyentes.
FinanciaciónEste estudio ha sido financiado en su totalidad por la fundación Joan Costa Roma. CST. Terrassa, Barcelona.