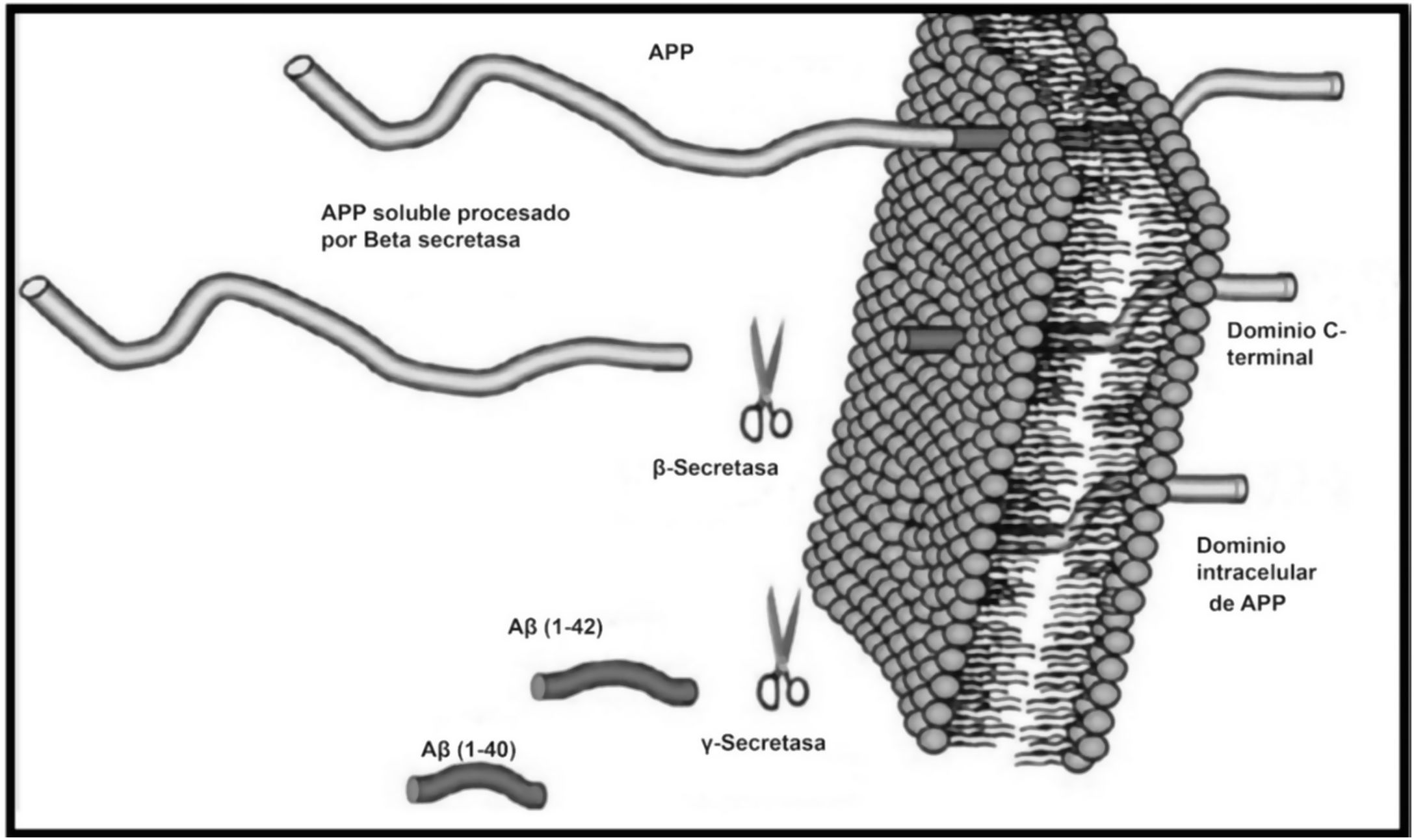
La enfermedad de Alzheimer (EA) se caracteriza por el depósito de placas de β-amiloide (βA) y ovillos neurofibrilares en el cerebro, acompañándose de disfunción sináptica y neurodegeneración1. El péptido βA es el producto de la escisión proteolítica de la proteína precursora amiloide (APP) transmembrana por dos proteasas (β y γ secretasas), generando dos formas principales del péptido, βA1-40 y βA1-422,3 (fig. 1)4. Las fibrillas de βA insolubles forman el núcleo de las placas amiloides que, junto con los ovillos neurofibrilares tau, representan una de las principales características patológicas de la EA2. Las formas que contienen βA1-42 son más neurotóxicas, se agregan más rápido y dominan en las placas de los pacientes con EA. Tanto los oligómeros βA solubles como las fibrillas βA insolubles pueden jugar papeles importantes en la patogénesis y progresión de la enfermedad5. Hasta ahora, la inmunoterapia basada en anticuerpos contra βA para desencadenar su eliminación o mitigar su neurotoxicidad no ha tenido éxito. Aducanumab, es un anticuerpo monoclonal humano IgG1 que se une selectivamente a las oligómeros y fibrillas βA en los aminoácidos 3-76. Aducanumab se derivó de linfocitos sanguíneos recolectados de una población de adultos mayores donantes sanos que carecen de signos de deterioro cognitivo o con un deterioro cognitivo inusualmente lento2. Se administra una vez cada cuatro semanas y, por lo tanto, funciona durante un período prolongado. En un modelo de ratón transgénico de EA, se determinó que aducanumab ingresa al cerebro, se une al βA parenquimatoso y reduce el βA soluble e insoluble de una manera dependiente de la dosis1.
Corte proteolítico de APP.
Fuente: Estrada Rodríguez AE, Zomosa Signoret VC. Papel de la agregación del péptido beta amiloide en la enfermedad de Alzheimer. Revista de Educación Bioquímica. 2017;36:34.
Tras un ensayo prometedor de fase 1B, el patrocinador (Biogen) implementó dos estudios: 221AD301 estudio de fase 3 de aducanumab (BIIB037) en la enfermedad de Alzheimer temprana (ENGAGE) y 221AD302 estudio de fase 3 de aducanumab (BIIB037) en la enfermedad de Alzheimer temprana (EMERGE)6. Según Biogen, los criterios de futilidad fueron que dosis alta y baja de ambos estudios debían tener al menos 20% de poder condicional, es decir, la probabilidad de significación estadística para la calificación clínica de la demencia: suma de recuadros (CDR-SB). En una conferencia el 22 de octubre de 2019, Biogen reveló que el ensayo ENGAGE no mostró significación estadística en el resultado primario de CDR-SB en el grupo de dosis alta, hubo un empeoramiento del 6% en comparación con el placebo (p = 0,627), pero el ensayo EMERGE mostró una mejora del 23% en comparación con el placebo (p = 0,031)7,8. Aproximadamente el 35% de los participantes desarrollaron anomalías identificadas por imagen, principalmente edema cerebral8.
Aducanumab recibió la aprobación condicional del Comité Asesor de la Administración de Drogas y Alimentos de los Estados Unidos (FDA) el 7 de junio de 2021, lo que significa que su aprobación continua dependerá de las confirmaciones de ensayos adicionales. Como era de esperar, el nuevo fármaco para la EA ha generado un entusiasmo considerable entre la población en general, los profesionales de la salud y las organizaciones benéficas para la EA9. En una perspectiva más amplia, pocos podrían argumentar que no es emocionante que haya un renovado interés científico y farmacéutico en el área de la EA, algo que parece haberse reducido en los últimos años, quizás debido a la complejidad de la fisiopatología de la EA. De hecho, aducanumab puede llegar a ser el primer fármaco que elimina las acumulaciones extracelulares de βA, pero podrían seguir otros fármacos, estos incluyen tanto donanemab como gantenerumab, entre otros10. Sin embargo, la realidad ineludible es que la fisiopatología de la EA es muy compleja. Esto se demuestra aún más cuando se considera que la acumulación de βA, el objetivo de aducanumab y otros fármacos candidatos, continúa estando pobremente asociada con los niveles de cognición y que el aclaramiento de amiloide no parece ser proporcional a la mejora de la cognición11.
En resumen, la disponibilidad de nuevos fármacos que pueden reducir las acumulaciones de βA en la EA, es una perspectiva interesante. Este desarrollo de tratamiento potencial es de gran interés para todas las partes interesadas y es probable que se convierta en un tema de discusión en las reuniones médicas que trabajan con personas que viven con EA leve a moderada y sus cuidadores. Sin embargo, los médicos deben saber que la eliminación de βA no necesariamente mejora la cognición en la EA, que la evidencia de la efectividad del aducanumab sigue sin estar clara y que actualmente los mejores enfoques de tratamiento basados en la evidencia involucran a las intervenciones psicosociales centradas en combinación con inhibidores de la acetilcolinesterasa como donepezilo y galantamina, y el antagonista glutamatérgico memantina.
FinanciaciónEste artículo no recibió ninguna subvención específica de agencias de financiamiento en los sectores público, comercial o sin fines de lucro.