El 11C-PIB-PET es un trazador que permite detectar específicamente el depósito de amiloide en vida. Tiene la ventaja de ser mínimamente invasivo, aunque resulta costoso y su utilidad asistencial en el amplio espectro clínico de las enfermedades degenerativas no ha sido estipulada. Nuestro objetivo es determinar la utilidad del 11C-PIB-PET analizando la presencia de amiloide en grupos de pacientes de alta y baja probabilidad pretest.
Materiales y métodosEstudio de análisis observacional transversal.
Ochenta y nueve pacientes se realizaron 11C-PIB-PET en nuestro centro. Los mismos fueron asignados en categorías de alta o baja probabilidad pretest según la presunción clínica de patología de enfermedad de Alzheimer (EA). El grupo de alta probabilidad incluyó: deterioro cognitivo leve (DCL) amnésico, DLC amnésico y otros dominios, demencia tipo Alzheimer, atrofia cortical posterior, angiopatía amiloide y demencia mixta. El de baja presunción incluyó: controles normales, DCL no amnésico, afasia progresiva primaria (APP), demencia frontotemporal (DFT).
ResultadosEl 24,6% de los pacientes con alta probabilidad pretest fue negativo con 11C-PIB-PET y el 31,25% en los de baja probabilidad fue positivo. Las categorías que más discrepancias tuvieron con su diagnóstico sindromático fueron: DCL amnésico; amnésico y otros dominios; no amnésico, y APP. Las categorías de controles normales y DTA fueron las más consistentes entre clínica y diagnóstico molecular. Las implicancias del 11C-PIB-PET fueron distintas para cada categoría sindromática.
ConclusionesEl aporte al diagnóstico del 11C-PIB-PET resulta realmente significativo en los casos de sospecha de EA en menores de 65 años (tanto en etapa prodrómica como clínica), en los casos de presentación atípica que incluyan como diagnóstico diferencial EA (APP, variante conductual de DFT y ACP). La presencia de amiloide en el resto de las categorías mencionadas no permite establecer causa o coexistencia de patología. Sin embargo, la ausencia de amiloide sugiere fuertemente patología no EA.
The 11C-PiB-PET is a tracer that specifically detects amyloid deposition in life. It has the advantage of being non-invasive, but is expensive and its use care in the clinical spectrum of degenerative diseases has not been stipulated. Our goal is to determine the utility of 11C-PiB-PET analyzing the presence of amyloid in patient groups high and low pretest probability.
Materials and methodsObservational cross-sectional study.
Eighty nine patients underwent 11C-PiB-PET in our center. They were assigned into categories of high or low pretest probability according to clinical suspicion of Alzheirmer’ Disease (AD) pathology. The high probability group included: mild cognitive impairment (MCI), amnestic, amnestic and other domains DLC, Alzheimer disease, posterior cortical atrophy (PCA), amyloid angiopathy and mixed dementia. The low assumption included: normal controls, non-amnestic MCI, Primary Progressive Aphasia (PPA), frontotemporal dementia (FTD).
Results24.6% of patients with high pretest probability had 11C-PiB-PET negative, and 31.25% in the low-probability was positive. In the categories that most discrepancies were found were: amnestic MCI, amnestic and other domains, non-amnestic, and PPA. The categories of normal controls and AD were the most consistent across clinical and molecular diagnostics. The implications of 11C-PiB-PET were different for each syndromic category.
ConclussionsThe contribution to the diagnosis of 11C-PiB-PET is really significant in cases of suspected early-onset AD (in under 65 years old) both prodromal and clinical stage, in cases of atypical presentation and differential diagnosis including AD (PPA, behavioral variant FTD and PCA). The presence of amyloid in the rest of the categories mentioned, does not establish cause or coexisting pathology. However, the absence of amyloid pathology strongly suggests non-AD pathology.
El desarrollo de nuevas técnicas de imágenes moleculares ha permitido un gran avance en lo que respecta a las enfermedades degenerativas y particularmente en la enfermedad de Alzheimer (EA), ya que permiten la detección de la acumulación de β-amiloide en vida1. Mediante estas técnicas, junto a la detección de marcadores biológicos detectados con ELISA en el líquido cefalorraquídeo (LCR), ha aumentado el conocimiento de la fisiopatología de la EA y se ha podido documentar que la acumulación de β-amiloide precede entre 10 a 20 años la aparición de los primeros síntomas relacionados a la EA2. Antes de la era de marcadores biológicos, este fenómeno solo era documentado en necropsia. En la actualidad, numerosos trabajos de investigación experimental focalizados en disminuir el depósito de amiloide cerebral se están llevando a cabo a nivel mundial como potencial tratamiento curativo de la EA3.
La acumulación de β-amiloide constituye uno de los eventos iniciales de la EA. Sin embargo, la detección de β-amiloide no es sinónimo de EA4. Numerosos estudios de envejecimiento con autopsia han demostrado la presencia de depósitos de β-amiloide en pacientes ancianos cognitivamente normales y también en pacientes con otros síndromes demenciales de etiología distinta de la EA4-8. La interpretación de este fenómeno en estos pacientes resulta incierta a la fecha.
El diagnóstico de pacientes que acuden a nuestra clínica de memoria puede ser dificultoso. Varias enfermedades distintas se presentan con similar presentación clínica, sobre todo en estadios iniciales y en pacientes menores de 65 años. Por otro lado, hay superposición entre la patología encontrada en la autopsia y los síndromes clínicos definidos. Por ejemplo, aun los síndromes relacionados más frecuentemente con otras enfermedades degenerativas de tipo no Alzheimer (trastorno conductual símil demencia frontotemporal (DFT), afasia primaria progresiva (APP) no fluente o semántica, síndrome de degeneración corticobasal) pueden ser debidos a EA9,10. Por otro lado, pacientes con fenotipos que indican altamente la sospecha de EA (pacientes con deterioro cognitivo leve amnésico [DCLa], presentación típica de EA, con atrofia cortical posterior [ACP] y con afasia progresiva primaria de tipo logopénica) en autopsias pueden no tener patología de EA5,6.
En la actualidad, contamos con ligandos específicos de β-amiloide para ser utilizados en tomografía por emisión de positrones (PET). El primero de ellos en ser desarrollado fue el compuesto Pittsburgh (PiB)1. En nuestro país, desde marzo del 2013 y luego de mucho esfuerzo en su puesta a punto, contamos con la posibilidad de realizar PET utilizando como trazador el PiB. Este análogo de la tioflavina fue el primer trazador desarrollado y el más estudiado en correlación con estudios post mórtem desde hace ya 10 años1. Esta molécula presenta la especial dificultad de durar solo 20 min, por lo cual se requiere de un ciclotrón interno para su fabricación junto a la PET, que permita realizar una inmediata administración del mismo. A diferencia del análisis de biomarcadores en LCR; la PET tiene la ventaja de no ser invasiva, aunque resulta igualmente onerosa.
La utilización de biomarcadores como el PiB como método diagnóstico complementario a la evaluación clínica puede colaborar a la correcta identificación diagnóstica si se utiliza en el contexto clínico adecuado11. Es importante marcar que el primer paso siempre es la correcta evaluación clínica realizada por expertos en estas enfermedades, con lo cual se elabora una probabilidad diagnóstica y, en casos seleccionados y apropiados, se utilizan marcadores como el PiB para complementar el cuadro11.
La mayoría de las publicaciones concernientes al PiB tienen como objetivo la validación de la técnica y ampliar el conocimiento de la fisiopatología de la EA pero no establecen aplicabilidad clínica. Los pacientes analizados en estos trabajos son especialmente seleccionados con cuadros típicos y sin comorbilidades importantes4,7,12. Por lo tanto, existe una dificultad real al trasladar los resultados de trabajos de investigación al contexto clínico de nuestro de centro de memoria, que por ser centro de derivación suele recibir casos complejos y atípicos.
Las recomendaciones diagnósticas del Instituto Nacional del Envejecimiento en EE. UU. y la Asociación de Alzheimer publicadas en el año 2011 estipulan distintas categorías de riesgo dependiendo de la presencia de biomarcadores para EA13. Por su parte, los criterios diagnósticos revisados para DFT variante conductual (DFTbv), publicadas también en el año 2011, promueven como criterios de exclusión de DFT la presencia de biomarcadores de EA9.
De lo dicho se puede concluir que contar con estudios que permitan detectar o descartar la presencia de β-amiloide en vida podría colaborar con la presunción diagnóstica, el tratamiento y el manejo del paciente y la familia por el especialista.
Hasta la fecha, en el Instituto FLENI se han realizado 100 estudios con 11C-PiB-PET, en colaboración con el Instituto Kremer de Córdoba y una parte de ellos en el marco de estudio de Alzheimer’ Disease Neuroimaging Iniciative Argentina (ADNI Arg). ADNI Arg es un estudio internacional multicéntrico de carácter observacional y prospectivo que evalúa la presencia de biomarcadores de EA en: controles, pacientes con DCLa y pacientes demencia tipo Alzheimer (DTA) leve con seguimiento clínico prospectivo. El instituto FLENI es el único centro de Latinoamérica que participa del estudio.
El objetivo del presente trabajo es describir nuestra experiencia inicial con el uso del 11C-PiB-PET en pacientes evaluados en nuestra clínica de memoria con distintas categorías clínicas sindromáticas. Se analizarán los resultados del 11C-PiB-PET según 2 categorías clínicas previamente definidas: pacientes con alta probabilidad clínica de EA y pacientes con baja probabilidad clínica de EA, y se estudiarán los resultados positivos o negativos de 11C-PiB-PET según estas categorías. Se analizarán criterios de utilización del mismo en grupos definidos y se determinará en qué medida colaboró realizar el estudio en pacientes habituales de nuestra clínica de memoria para definir su utilidad clínica.
Material y métodosDescripción de la población y entrevistas de inicioEste es un estudio de análisis observacional transversal.
Se incluyó para este trabajo a los primeros 100 pacientes consecutivos que realizaron 11C-PiB-PET en nuestro centro desde marzo del 2013 hasta julio del 2013. Veintiséis de estos pacientes forman parte del protocolo de estudio ADNI Arg y fueron estudiados por neurólogos del servicio de memoria y 10 pacientes fueron derivados para estudio con 11C-PiB-PET desde el Instituto Kremer de Córdoba; el resto de los pacientes fueron derivados ya sea de consultorios externos del Centro de Memoria y Envejecimiento o de la internación del instituto FLENI. Once pacientes no pudieron ser clasificados debido a que no presentaban algunos de los estudios mencionados o no fueron evaluados por neurólogos especialistas, por lo tanto, fueron excluidos del análisis y se incluyó finalmente a los 89 pacientes restantes.
Los pacientes fueron estudiados con entrevista clínica por neurólogos especializados en memoria, evaluación neurocognitiva, resonancia magnética (RM) de cerebro archivada en servidor Kodak Carestream del FLENI y análisis sanguíneo del laboratorio central del FLENI y externo a la institución, donde se descartaron causas reversibles de deterioro cognitivo. La evaluación neuropsicológica incluyó las siguientes evaluaciones para cada función cognitiva:
- –
Test de Mini Mental de Folstein14.
- –
Memoria: memoria lógica de Weschler15 y Rey Auditory Verbal Learning Test (RAVLT)16.
- –
Lenguaje: Boston Naming Test y fluencia semántica y fonológica17.
- –
Atención: dígitos directo e indirecto, Trail Making Test (TMT) A18.
- –
La RM de cerebro incluyó secuencias de T1, T2, FLAIR, GRE y DWI.
Categorías clínicasLuego de esta evaluación, se caracterizó e incluyó a los pacientes en una de las 9 categorías sindromáticas descriptas a continuación:
0. Controles sanos.
- 1.
DCLa: se consideró a pacientes con reporte o queja cognitiva con alteración en memoria verbal con Z score menor a –1,5, en pruebas de memoria (RAVLT16 y Weschler Logical Memory Test-WMT15 sin otro dominio cognitivo afectado y sin impacto funcional.
- 2.
DCLa asociado a déficit en otros dominios cognitivos afectados con Z score –1,5 (pruebas ejecutivas, atencionales, visuoespaciales y/o lenguaje) (DCLa+).
- 3.
DCL no amnésico (DCLna): paciente sin evidencia de déficit de memoria, pero con alteración significativa (Z score: –1,5) en otro dominio cognitivo.
- 4.
DTA: paciente con EA probable según criterios diagnósticos clínicos de NINCDS-ADRDA13.
- 5.
DFTbv: según criterios de Neary (2007)20 y los criterios revisados por Rascovsky et al. para variante conductual de DFT (2011)9.
- 6.
APP: dentro de esta categoría se identificó, según los criterios de Mesulam (1992)21 y Gorno Tempini (2011)22, a los pacientes con afasia logopénica de los pacientes con APP no fluente y demencia semántica.
- 7.
ACP: según revisión de Crutch et al. (2012)23. Se caracteriza por un trastorno primario en el procesamiento visual superior y/o disfunción parietal predominantes, con evidencia radiológica de degeneración de áreas posteriores.
- 8.
Otros diagnósticos neurodegenerativos: pacientes no incluidos en ninguna de las categorías mencionadas.
- 9.
Demencia mixta: pacientes con EA probable según criterios diagnósticos clínicos de NINCDS-ADRDA con evidencia en RM de cerebro de patología cerebrovascular concomitante, documentada por subespecialista en Neurología Cognitiva.
Posteriormente, en función de la fisiopatología descrita en relación con estas 9 categorías sindromáticas, y teniendo en cuenta como variable principal si eran enfermedades relacionadas o no al depósito de β-amiloide, se clasificó en alta o baja probabilidad preclínica de tener depósito de amiloide.
Se consideró a las categorías con alta probabilidad pretest de tener PET positiva a: DCLa, DCLa+, DTA, ACP, angiopatía amiloide (incluida en la categoría número 8, otros diagnósticos), afasia logopénica y demencia mixta.
Al resto de las categorías se las consideró como baja probabilidad pretest de tener estudio de PET positiva (controles, DCLna, DFTbv, APP, otros diagnósticos, excluyendo el caso de angiopatía amiloide).
Descripción de la tomografía por emisión de positrones y de la síntesis de 11C-PiBLa síntesis se realiza en el módulo Tracer LAB FXC-PRO; el proceso de síntesis, desde la recepción del 11C- CO2, dura aproximadamente 25 min y la purificación, 10 min. La purificación del producto crudo se realiza en el HPLC preparativo con el que cuenta el módulo de síntesis. La purificación se produce por una interacción diferencial entre los componentes del crudo, la fase estacionaria y la fase móvil. El producto final consta de una solución mezcla de fase móvil+solución fisiológica, con un contenido de etanol<10% de 28ml de volumen, con alrededor de 200 mCi de 11C-PiB. El rendimiento final de la reacción es de aproximadamente 10% (corregido por decaimiento).
Calidad del producto obtenidoLos parámetros de calidad que se cumplen para nuestro producto final se detallan a continuación, en la tabla 1. A los 50 min de la administración intravenosa de 10mCi de 11C-PiB se registran imágenes volumétricas de cerebro durante 20 min y tomografía computarizada (TC) multicorte de cerebro en un equipo PET/TC Discovery 690 GE. Las imágenes son procesadas usando el método iterativo MELM y corrección de atenuación no uniforme con tomografía computarizada. Se generan cortes axiales, coronales y sagitales, corregistrados con MRI y/o TC. Para la lectura y el informe, las imágenes son visualizadas en una estación de trabajo dedicada por un médico especialista en Medicina Nuclear, ciego a los datos clínicos del paciente. Se evalúa de manera cualitativa, con escala de colores lineal, la presencia o la ausencia de amiloide en la corteza cerebral, su distribución espacial y el grado de retención (leve, moderada o severa), dependiendo de la concentración de actividad de 11C-PiB
Descripción del 11C-PiB
| Control | Especificación |
| Apariencia | Solución incolora, transparente, libre de impurezas visibles |
| Determinación de pH | 5,0-8,5 |
| Pureza radioquímica | Mayor o igual a 95% de 11C-PiB |
| Identidad radioquímica | Tiempo de ret. del std de 12C-PiB (3-5min) |
| Tiempo de ret. muestra 11C-PiB (3-5min) | |
| % diferencia (rango±15%) | |
| 6OH BTA-0 menor a 2ppm | |
| Pureza química | 6OH BTA-1 menor a 2ppm |
| 6MeO BTA-0 Menor a 2ppm | |
| Pureza radionucleídica | Único fotopico a 511 keV |
| Identidad radionucleídica | T1/2=(18.4–22.4)min |
| Solventes residuales | Metiletilcetona menor a 5.000ppm |
| Etanol menor a 100.000ppm | |
| Conc. de actividad (mCi/ml) | Mayor a 0,4 mCi/ml |
6OH BTA-0: precursor; 6OH BTA-1: PiB; 6MeO BTA-0: coproducto; ppm: partes por millón.
Las variables categóricas se analizaron mediante la χ2 y las variables continuas mediante el test de Student. El análisis estadístico se realizó con el programa SPSS versión 19.0; una p < 0,05 fue considerada significativa.
ResultadosLas características demográficas de la muestra en estudio dividida por categoría diagnóstica se muestran en la tabla 2. Dentro de la categoría otros diagnósticos se incluyó a un paciente con degeneración corticobasal y a un paciente con angiopatía amiloide. En el grupo heterogéneo de afasias primarias se incluyó a 4 pacientes con variante logopénica y a 4 pacientes con afasia primaria fluente y no fluente. De los 89 participantes incluidos en el análisis, el 64% (57/89) fue asignado a la categoría de alta probabilidad pretest (tabla 3) y el 36% (32/89) a la categoría de baja probabilidad pretest (tabla 4) según la presunción clínica de patología de EA subyacente.
Características demográficas basales de la muestra de estudio
| Categoría diagnóstica | n | Mujeres (n) | Edad, media ± DE | MMSE, media ± DE |
| Controles | 12 | 7 | 63,9 ± 8,7 | 29,9 ± 0,3 |
| DCL amnésico | 29 | 13 | 70,0 ± 7,3 | 27,8 ± 2,1 |
| DCL amnésico plus | 7 | 6 | 71,0 ± 8,4 | 27,5 ± 2,1 |
| DCL no amnésico | 10 | 3 | 68,3 ± 4,9 | 28,2 ± 1,9 |
| DTA | 11 | 10 | 70,9 ± 7,3 | 21,7 ± 2,5 |
| DFT | 3 | 1 | 68,0 ± 1,7 | 20,0 ± 11,3 |
| APP | 9 | 8 | 65,8 ± 10,4 | 24,5 ± 2,5 |
| ACP | 3 | 0 | 62,6 ± 14,8 | 22,5 ± 12,7 |
| DCB | 1 | 1 | 70 | 24 |
| Angiopatía amiloide | 1 | 1 | 61 | 26 |
| Demencia mixta | 3 | 1 | 68,3 ± 8,7 | 23 |
ACP: atrofia cortical posterior; APP: afasia primaria progresiva; DCB, degeneración corticobasal; DCL: deterioro cognitivo leve; DFT: demencia frontotemporal; DTA: demencia tipo Alzheimer.
Resultados de la marcación amiloide con 11C-PiB-PET en participantes con alta probabilidad diagnóstica de enfermedad de Alzheimer
| Alta probabilidad pretest | n | PiB + | % positivos | |
| DCL | Amnésico | 29 | 19 | 65,0 |
| Amnésico plus | 7 | 4 | 57,0 | |
| DTA | 11 | 10 | 90,9 | |
| ACP | 3 | 3 | 100,0 | |
| APP logopénica | 4 | 4 | 100,0 | |
| Angiopatía amiloide | 1 | 1 | 100,0 | |
| Demencia mixta | 2 | 2 | 100,0 | |
| Totales | 57 | 43 | 75,40 |
ACP: atrofia cortical posterior; APP: afasia primaria progresiva; DCL: deterioro cognitivo leve; DTA: demencia tipo Alzheimer.
Resultados de la marcación amiloide con 11C-PiB-PET en participantes con baja probabilidad diagnóstica de enfermedad de Alzheimer
| Baja probabilidad pretest | n | PiB + | % positivos |
| Controles | 12 | 1 | 8,3 |
| DCL no amnésico | 10 | 4 | 40,0 |
| DFT | 4 | 1 | 25,0 |
| APP (no fluente o semántica) | 5 | 4 | 80,0 |
| DCB | 1 | 0 | 0,0 |
| Totales | 32 | 10 | 31,2 |
APP: afasia primaria progresiva; DCB, degeneración corticobasal; DCL: deterioro cognitivo leve; DFT: demencia frontotemporal.
En el análisis de los participantes con alta probabilidad pretest, el 24,60% (14/57) presentó ausencia de marcación amiloide según la técnica de inspección visual de las imágenes con 11C-PiB-PET, de los cuales el 71,45% (10/14) cumplía criterios para DCLa puro, el 21,42% (3/14) para DCLa plus y el 7,13% (1/14) para DTA.
El grupo de los participantes de baja probabilidad pretest fue más heterogéneo. El 31,25% (10/32) presentó marcación con 11C-PiB-PET, de los cuales el 40% (4/10) cumplían criterios para DCL multidominio no amnésico, el 40% (4/10) para APP no fluente o semántica, el 10% (1/10) para DFT (1/10) y el 10% (1/10) fue cognitivamente normal.
Las categorías que más difirieron con su diagnóstico sindromático fueron: DCLa, amnésico plus, DCLna y APP. Las categorías de controles normales y DTA fueron las más consistentes entre clínica y diagnóstico molecular.
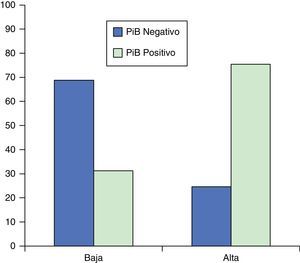
Con propósito descriptivo, la figura 1 resume el porcentaje de participantes con marcación positiva y negativa con 11C-PiB-PET para los grupos de alta y baja probabilidad pretest. Más participantes en el grupo de alta probabilidad pretest presentaron marcación positiva (75,40%) comparado con el grupo de baja probabilidad pretest (31,25%) (χ2=11,963; p=0,001).
La tabla 4 resume las características demográficas y los resultados de la evaluación neuropsicológica según la marcación amiloide con 11C-PiB-PET. Se consideró para el análisis a todos aquellos participantes con evaluación completa (56/89). Como se muestra en la tabla, los grupos no difirieron en edad (t = –0,243; p = 0,808) y sexo (χ2 = 0,535; p = 0,305). El grupo de participantes con marcación amiloide presentó menos años de educación (t = 2,642; p = 0,011). Los participantes con marcación amiloide con 11C-PiB-PET mostraron déficits principalmente en MMSE (t = 3,102; p = 0,009), fluencia verbal semántica (t = 3,102; p = 0,003), TMT A (t = –2,173; p = 0,034), TMT B (t = –2,112; p = 0,041), lista de Rey total (t = 3,724; p = 0,000), lista de Rey diferida (t = 5,101; p = 0,000) y lista de reconocimiento de Rey (t = 4,508; p = 0,000).
DiscusiónEn el presente estudio, se describen los hallazgos de la detección de amiloide mediante 11C-PiB-PET en 89 pacientes agrupados en los síndromes cognitivos más frecuentemente encontrados en una clínica especializada en memoria en Buenos Aires. En este estudio, no se analiza la validez del 11C-PiB-PET como método de detección, sino su aplicabilidad clínica teniendo en cuenta que el hallazgo de amiloide es solo una parte de la compleja fisiopatología de la EA y que, detectado en forma aislada, es insuficiente para establecer diagnóstico11.
En nuestra muestra, hubo una elevada frecuencia de 11PiB-PET positivo en el grupo de alta probabilidad pretest. Sin embargo, más relevante fue que hasta el 24,6% fue 11PiB-PET negativo. Por su parte, los pacientes con baja probabilidad pretest, tuvieron hasta un 31,25% de casos 11PiB-PET positivo. Por lo tanto, para ambos grupos el porcentaje de discrepancia entre el diagnóstico clínico y el molecular fue considerable. Podría decirse entonces que parte de las discrepancias surgen de las capacidades del 11PiB-PET para detectar el amiloide. Sin embargo, en los múltiples ensayos de validez, la sensibilidad del 11PiB-PET para detectar amiloide fue elevada en estudios post mórtem24. Por lo tanto, los porcentajes hallados en nuestra muestra se contraponen en forma significativa a la presunción diagnóstica inicial, modificando en forma sustancial el grado de certeza diagnóstica. De hecho, otros estudios han tenido porcentajes de discrepancias mayores, cercanas al 39%25. Estas discrepancias impactan netamente en el manejo presuntivo de los pacientes. Pueden alterar el inicio de tratamiento con inhibidores de colinesterasa, la cantidad de estudios solicitados, cambios de estilo de vida e información que reciben pacientes y familiares25. Es interesante que las implicancias de estas diferencias no son trasladables a todos los casos de los grupos de alta o baja probabilidad pretest por igual, sino que difieren según la categoría diagnóstica.
En los pacientes con DCLa y amnésico plus, la presencia de amiloide implica, según las nuevas recomendaciones diagnósticas para DCL26, riesgo intermedio a ser debido a EA y mayor riesgo en aquellos pacientes que además presentan indicios de degeneración, ya sea por medición de tau en el LCR, fluordesoxiglucosa o volumetría en RM27. Sin embargo, en estudios de seguimiento longitudinal de pacientes con DCL y 11C-PiB-PET, la mayoría de los casos que se convirtieron a DTA fueron positivos, a pesar de no haberse evaluado marcadores de degeneración7,8. A fines prácticos, estos pacientes serían candidatos a estudios de intervención temprana con nuevos tratamientos, ya que el objetivo de los mismos es la intervención precoz para evitar el proceso de degeneración. Es decir, la presencia de amiloide en DCLa y amnésico plus no solo ha cambiado el grado de certeza diagnóstica, sino que ha modificado su situación de riesgo26; de hecho, según Dubois et al., estos pacientes podrían ser catalogados como Alzheimer prodrómico, lo cual clínicamente impacta en las medidas preventivas, el control de comorbilidades y el estilo de vida de los pacientes25,27.
Más interesante aún resultan los casos negativos. En las mismas recomendaciones diagnósticas, los pacientes con DCLa y ausencia de amiloide corresponden a la categoría de menor riesgo de conversión a EA26,27. Si se tiene en cuenta que los fenómenos de depósito amiloide en la EA, evidenciados en estudios con 11C-PiB-PET, suceden hasta 10 a 20 años antes de iniciado los síntomas2, los pacientes con DCLa y amnésico plus con PiB negativo presentan muy baja probabilidad de ser debido a EA26,27. En nuestra opinión, el escenario de DCL y PiB negativo resulta de suma utilidad clínica, ya que previene al paciente de estudios y tratamientos innecesarios y refuerza la búsqueda hacia otras afecciones. En ese sentido, la Administración Americana de Medicación en EE. UU. recientemente ha aceptado el valor predictivo negativo del florbetapir28, otro trazador amiloideo similar sobre la base de flúor y de mayor vida media, lo cual permite la comercialización. Tanto el PiB como el florbetapir tienen buena correlación neuropatológica28,29, de hecho el PiB fue el más estudiado en ese sentido.
Para la categoría de DCLna y PiB negativo, se aplica lo dicho anteriormente, ya que estos pacientes, al no tener compromiso de memoria, tienen intrínsecamente menores probabilidades de conversión a EA26,27 y la falta de detección amiloidea refuerza la sospecha de etiologías distintas del Alzheimer y el especialista podría dar importancia a otros estudios o tratamientos que estén relacionados con otras enfermedades no EA. Sin embargo, el hallazgo de amiloide en estos pacientes (DCLna con PiB positivo) no mejora la certeza diagnóstica. Si bien se deberá tener en cuenta que el riesgo de EA se encuentra incrementado27, no se pueden descartar otras afecciones concomitantes. La coexistencia de afecciones no Alzheimer con presencia de amiloide es sumamente frecuente11,12. De hecho, en nuestra muestra los 2 pacientes seleccionados con demencia mixta, en los cuales se sospecha combinación de patología por perfil neuropsicológico y presencia de lesiones vasculares en la RM, han presentado PiB positivo.
El 90,9% de los pacientes con DTA presentaron PiB positivo. En esta categoría, existe una alta correlación entre el diagnóstico clínico y el molecular7. Es posible que el nivel de incertidumbre en estas instancias sea esencialmente bajo. Por lo tanto, el hallazgo de depósito amiloide es probablemente redundante. Un solo paciente presentó DTA con PiB negativo (9,1%). En este caso, no se puede descartar la posibilidad de corresponder a un falso negativo1. Sin embargo, la presencia de patología no Alzheimer en casos típicos de DTA tampoco es infrecuente5, incluso se ha documentado DTA de fenotipo clásico con mutaciones en genes causales para DFT (C9orf72)6. En nuestra muestra, los pacientes con DTA tienen bajo promedio de edad y rendimiento promedio alto en el MMSE (21,7 ± 2,5) en comparación con otros estudios. Ello es debido a que la mayoría de los mismos presentaban DTA leve, ya que fueron estudiados en el marco de protocolo ADNI Arg o el 11C-PiB-PET fue pedido para corroborar el diagnóstico en casos de inicio precoz. Hemos observado menores intenciones de solicitar 11C-PiB-PET en pacientes con mayor afectación cognitiva y funcional. Esto resulta comprensible teniendo en cuenta las dificultades del paciente, la irreversibilidad del cuadro y la falta de tratamiento activo. Por lo tanto, la información aportada por el 11C-PiB-PET no cambiaría las proyecciones familiares ni del especialista. En conclusión, en la categoría de DTA existe una alta presunción pretest de acumulación amiloide y la realización del PiB reforzaría el diagnóstico inicial. Sin embargo, el 11C-PiB-PET parece tener poca utilidad y baja aplicabilidad en casos clínicamente avanzados, aunque sería especialmente útil en pacientes de inicio precoz o presentación atípica. En los casos 11C-PiB-PET negativo, la presunción de patología no Alzheimer podría prevenir el uso de inhibidores de la acetilcolinesterasa o antagonistas de glutamato, evitando efectos indeseados, y reforzar el estudio de otros síndromes demenciales.
Para las demás categorías del grupo de alta probabilidad pretest (APP logopénica, ACP y un caso de angiopatía amiloide), se ha reclutado a pocos pacientes, lo cual dificulta establecer conclusiones. De todas formas, en estos pacientes, el promedio de edad fue sustancialmente bajo, correspondiendo todos a casos preseniles. Todos fueron 11-C-PIB-PET positivo. Si bien son variantes atípicas con alta frecuencia de patología de EA30,31, también existe elevada superposición clínica con otras enfermedades degenerativas, de presentación presenil (DFT, enfermedad de cuerpos de Lewy, enfermedad de Creutzfeldt-Jakob, etc.), en donde el grado de incertidumbre diagnóstica es alto y la aproximación diagnóstica podría tener grandes implicancias a nivel terapéutico, pronóstico y hasta genético. Por lo tanto, la presencia o ausencia de amiloide en pacientes jóvenes con variantes atípicas resulta especialmente útil, con especial impacto en la toma de decisiones médicas25.
En cuanto los pacientes con síndromes del espectro de degeneración lobar frontotemporal, de baja probabilidad pretest, los resultados del PiB han sido heterogéneos. En relación con los pacientes con DFTbv, en concordancia con lo reportado en la bibliografía32, un paciente (25%) presentó presencia de amiloide. Este caso puede plantear 2 posibilidades: por un lado, podría ser una variante frontal de EA32,33, o podría deberse a coexistencia de patología (presencia de amiloide en patología de DFT). En el resto de los pacientes con DFT, el resultado del PiB fue negativo. Como fue mencionado anteriormente, en la revisión realizada en el año 2011 de los criterios diagnósticos para variante conductual de DFT se promueve como criterio de exclusión los hallazgos de marcadores biológicos para EA9, por lo cual en estos pacientes se ha mejorado el grado de certeza diagnóstica, lo cual resulta de gran utilidad en cuanto al asesoramiento familiar y permitiría evitar la incorporación innecesaria de medicación para EA. Por su parte, en los pacientes con APP variante no fluente y variante semántica, la presencia de amiloide fue sorpresiva (80%). En los estudios de correlación neuropatológica el porcentaje debido a patología de EA es del 30% para la variante no fluente y de menos del 10% para la variante semántica34, por lo cual existe una superposición patológica entre las variantes de APP. Otro de los problemas habituales son las dificultades en la clasificación de las variantes, especialmente la distinción entre la variante logopénica y la no fluente34,35. De esta forma, el 11C-PiB-PET podría ser requerido, además de las consideraciones lingüísticas, como método de aproximación etiológica en las variantes de APP. Una vez más, se debe considerar la coexistencia de patología, la cual no pudo ser descartada al no contar con histopatología de los pacientes34.
Por último, fueron incorporados al grupo de baja probabilidad pretest los controles normales. Casi la totalidad de los mismos corresponde al mencionado protocolo ADNI Arg. Solo uno de 12 pacientes (8,3%) fue positivo en la detección de amiloide. Según los datos de estudios en voluntarios normales, entre el 10 y el 30% presenta hallazgos de amiloide36,37. La frecuencia de amiloide en este grupo varía según la edad y el estatus en la genotipificación de APO E37. En dicho paciente, no se cuenta con genotipificación de APO E; por otra parte, el promedio de edad de dicha categoría es la más baja de la muestra. El significado de amiloide en voluntarios normales es incierto. Se podría presuponer, por todo lo expuesto hasta aquí, que estos pacientes se encuentran en una etapa preclínica de la EA. Algunos estudios confirman esta hipótesis en estudios prospectivos24,25,37,38, sin embargo, muchos otros no8 y, por lo tanto, más información es requerida de estudios longitudinales. De igual modo, la aplicabilidad clínica de 11C-PiB-PET en controles normales es incierta. En el futuro, tal vez los casos positivos resulten una cohorte que podría ser convocada a participar de estudios longitudinales de intervención terapéutica temprana.
En resumen, el diagnóstico de pacientes con trastornos cognitivos y conductuales puede resultar dificultoso debido a la superposición sindromática que existe entre las distintas enfermedades degenerativas y a la coexistencia de amiloide con otras patologías. Por lo tanto, existe una enorme necesidad de mejorar el diagnóstico clínico. La detección de amiloide mediante 11C-PiB-PET ofrece información adicional acerca de los posibles procesos fisiopatológicos subyacentes, aunque en forma aislada es insuficiente para establecer diagnóstico de EA. Nosotros hemos encontrado que la utilidad de dicho estudio difiere según los distintos síndromes clínicos. Consideramos que el aporte al diagnóstico resulta realmente significativo en los casos de sospecha de EA en menores de 65 años (tanto en la etapa prodrómica como en la clínica) y en la caracterización de los casos de presentación atípica que incluyan como diagnóstico diferencial EA (APP, variante conductual de DFT y ACP). De otra forma, la presencia de amiloide en el resto de las categorías no permite establecer causa o coexistencia de patología. Por lo tanto, la utilidad del 11C-PiB-PET es limitada en pacientes asintomáticos, con deterioro cognitivo no amnésico y demencia mixta. Además, hemos notado falta de utilidad clínica en los casos de EA tardía (mayores de 65 años) o clínicamente avanzada, probablemente debido a escasos recursos terapéuticos o redundancia diagnóstica. De este modo, nuestras conclusiones concuerdan en parte con las recomendaciones de Johnson et al.11, aunque debe recalcarse que la selección de nuestra muestra corresponde a casos consecutivos y no da indicios a escenarios clínicos fuera de la misma, como por ejemplo: síndromes extrapiramidales, genotipo APO-E, otras patologías concomitantes y evolución clínica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Bioing. German Falasco, Bioing. Federico Diaz, Lic. Leandro Urrutia, Bioing. Leandro Leikis, Tec. Carla Mencia, Tec Gonzalo Calero y Tec Luciano Vazquez.