Las modernas técnicas quirúrgicas han demostrado ser un procedimiento efectivo para el control de síntomas parkinsonianos resistentes al tratamiento farmacológico. Las técnicas ablativas por radiofrecuencia representan una opción para casos adecuadamente seleccionados. Se seleccionó a 9 pacientes con diagnóstico de enfermedad de Parkinson (EP) entre 2010 y 2013 con blanco en el núcleo subtalámico bilateral en 2 tiempos quirúrgicos. Los resultados, comparando antes y luego de 6 meses de la segunda subtalamotomía (un año entre ambas evaluaciones), arrojaron los siguientes resultados: UPDRS II «off» 25,2 vs. 12,3 (51,2%); UPDRS III «off» 60,7 vs. 25 (58,89%); UPDRS IV 10,4 vs. 2,3 (77,8%); disminución de dosis total de L-dopa del 60% (1.439 vs. 505mg); reducción del temblor, rigidez y bradicinesia (68, 67 y 60% respectivamente) y significativa mejoría en las escalas que cuantifican calidad de vida como PDQ-39 del 44% (41,37 vs. 23,10). En el plano cognitivo (n=8) ningún dominio mostró cambios significativos a excepción del razonamiento verbal. Los resultados indican un marcado beneficio de síntomas cardinales con reducción de las fluctuaciones motoras y tiempo en «off». También se evidenció un muy bajo índice de complicaciones generales.
Modern surgical techniques have proven to be an effective procedure for control of parkinsonian symptoms resistant to drug treatment. Radiofrequency ablation procedures represent an option for properly selected cases. 9 patients were selected with a diagnosis of Parkinson's disease (PD) between 2010 and 2013 with white bilateral subthalamic nucleus in two-stage. The results, comparing before and after 6 months of the second subthalamotomy (one year between the 2 assessments), yielded the following results: UPDRS II «off» 25.2 vs. 12.3 (51.2%); UPDRS III «off» 60.7 vs. 25 (58.89%); UPDRS IV vs. 10.4 2.3 (77.8%); decreased total dose of L -dopa than 60% (vs. 1439 vs. 505mg); reduction of tremor, rigidity and bradykinesia (68, 67 and 60% respectively) and significant improvement on scales that measure quality of life as PDQ-39 44% (41.37 vs. 23.10). At the cognitive level (n=8) showed no significant changes domain except for verbal reasoning. The results suggest a marked benefit of cardinal symptoms with reduction of motor fluctuations in time and «off». A very low rate of overall complications was also evidenced.
La observación clínica de la historia natural de la enfermedad de Parkinson (EP) indica que la expresión fenotípica es muy variable y que puede asociarse en algún momento de su evolución a severas fluctuaciones de la respuesta motora de muy difícil control, aun con el mejor tratamiento médico. Los factores involucrados son múltiples, incluyendo síntoma y edad de inicio, factores genéticos, tiempo de evolución, etc.1–3. La introducción de la levodopa en la década del sesenta ha conseguido mejorar los síntomas cardinales de la enfermedad, pero luego de un período de tratamiento farmacológico estable, se inicia una progresiva reducción del tiempo en «on» que reduce drásticamente la calidad de vida4–6. Las técnicas quirúrgicas ablativas con gran desarrollo antes de la era L-dopa quedaron solo relegadas hasta el advenimiento de la estimulación cerebral profunda o deep brain stimulation (DBS) hacia finales de los 80, cuando se observa una fuerte tendencia al control de este tipo de desórdenes con el desarrollo de nuevos blancos quirúrgicos, con particular referencia al núcleo subtalámico7. Si bien las técnicas ablativas para el tratamiento de la EP tienen en la actualidad un desarrollo menos reconocido, las nuevas técnicas de imágenes y localización de blancos quirúrgicos por microrregistro nos permiten obtener un abordaje con mayor precisión8. El objetivo de este estudio está dirigido a evaluar resultados de aspectos motores, cognitivos y conductuales en pacientes con diagnóstico de EP avanzada antes y a los 6 meses de subtalamotomía bilateral en 2 tiempos quirúrgicos.
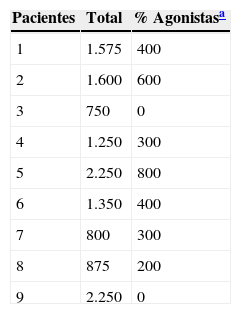
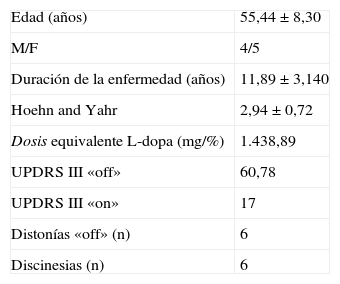
Material y métodosSe selecciona a 10 pacientes que concurren a la Unidad de Trastornos del Movimiento del Hospital Nacional Prof. Alejandro Posadas, Buenos Aires, Argentina con diagnóstico de EP avanzada desde enero de 2012 hasta diciembre de 2013. Los pacientes fueron seleccionados de acuerdo a los criterios de la UK Parkinson's Disease Brain Bank9,10. Este grupo presentaba severas fluctuaciones de su respuesta motora, algunos de ellos con severas discinesias, bajo el mejor tratamiento farmacológico disponible (ver tabla 1). La tabla 2 muestra las características generales del grupo seleccionado.
Dosis equivalentes L-dopa (mg)
| Pacientes | Total | % Agonistasa |
|---|---|---|
| 1 | 1.575 | 400 |
| 2 | 1.600 | 600 |
| 3 | 750 | 0 |
| 4 | 1.250 | 300 |
| 5 | 2.250 | 800 |
| 6 | 1.350 | 400 |
| 7 | 800 | 300 |
| 8 | 875 | 200 |
| 9 | 2.250 | 0 |
El procedimiento se decide según lineamientos del Core Assesment Program for Intracerebal Transplantation (CAPIT)11, interviniendo en primer lugar el lado opuesto al hemicuerpo más afectado y completando el lado contralateral a los 6 meses aproximadamente. Se completa evaluación con Unified Parkinson's Disease Rating Scale (UPDRS) I-IV en condición «off» luego de 12 h de suspender L-dopa y 24 h para los agonistas dopaminérgicos. El test de L-dopa fue efectuado por un neurólogo experto en movimientos anormales debidamente acreditado (MDS-UPDRS Programa de capacitación). Para el test se utiliza L-dopa dispersable a una dosis 50% mayor a la primera dosis, según el siguiente esquema de equivalencias: 100mg L-dopa=1mg pergolide=10mg bromocriptina=6mg ropinirol=50mg piribedilo=10mg apomorfina=0,7mg pramipexol (1mg pramipexol=3mg ropinirol). En casos de retardo en el «on», se incrementa dosis de carga a un tiempo variable según respuesta clínica hasta la adecuada activación. Se completa filmación en ambas condiciones previa solicitud de consentimiento informado. Por razones geográficas solo fue posible completar evaluación cognitiva en 8 pacientes. Para este tipo de evaluaciones, y siempre considerando las dificultades motoras, las pruebas utilizadas fueron destinadas a evaluar las funciones más significativas tales como: 1) Escala de eficiencia cognitiva global de Mattis (MDRS) valor de corte de 129/144; 2) atención y función ejecutiva (FE): Subtest de dígitos WAIS III; 3) aprendizaje y memoria: Test de aprendizaje serial de Signoret; 4) lenguaje: fluencia fonológica (letra p), fluencia semántica (animales), Test de denominación verbal de Boston; 5) visuoespacialidad: Test de orientación de líneas de Benton, 6) razonamiento verbal: Subtest de analogías del WAIS III.
La evaluación psiquiátrica se realizó mediante entrevista semiestructurada utilizando criterios del Manual diagnóstico y estadístico de los trastornos mentales (DSM-IV-TR). Para la evaluación de calidad de vida se utilizó PDQ-39, donde el menor puntaje indica mejor calidad de vida. Se prestó especial atención en la evaluación de conductas suicidas con la escala de riesgo suicida de Plutchik (sensibilidad 74%, especifidad 95%) con punto de corte en 6. El estado de ánimo depresivo se evaluó por la Hamilton depresion rating scale (HDRS) con puntuación de 0 a 52 y los siguientes puntos de corte: No deprimido 0-7, ligera 8-13, moderada 14-18, severa 19-22 y muy severa >23. El Inventario neuropsiquiátrico (NPI) se administró en forma de entrevista semiestructurada, evaluando cualitativamente diferentes síntomas conductuales. Cada ítem fue puntuado de acuerdo con la frecuencia de su presencia (escala desde 0 hasta 4) y la severidad del trastorno (escala desde 0 a 3).
Todas las evaluaciones (motoras y cognitivo-conductuales) han sido realizadas un mes antes del primer procedimiento y a los 6 meses luego de completada la segunda subtalamotomía. Con el objetivo de maximizar el período «on» en el caso de las evaluaciones cognitivo-conductuales se utiliza un rango horario establecido entre las 8 y 10 am.
El tratamiento farmacológico se ajusta según necesidad, sin realizar evaluaciones en el intervalo de ambos procedimientos.
Se trata de un estudio abierto no aleatorizado que cumple con la aprobación del Comité de Ética y el protocolo de Helsinki. Los pacientes fueron debidamente informados, y todos ellos aceptaron un consentimiento firmado.
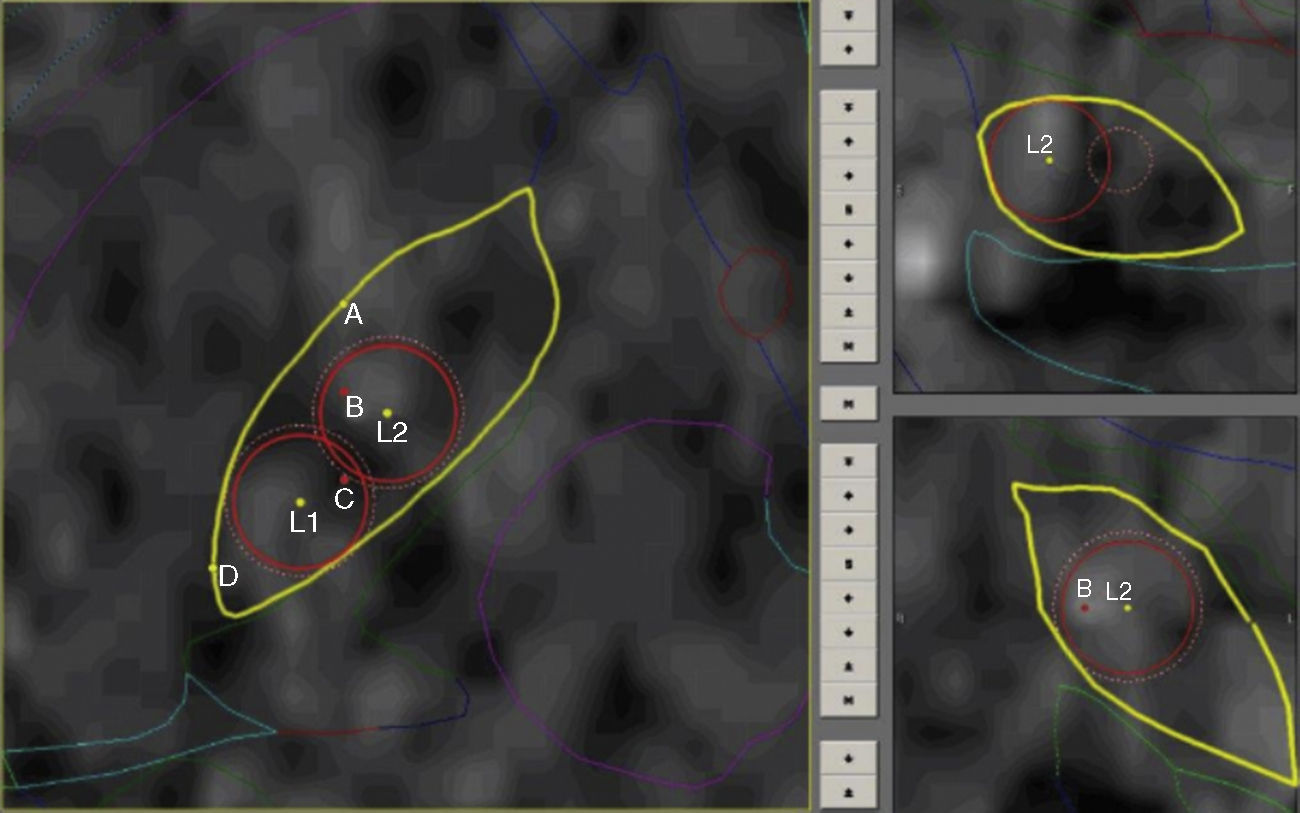
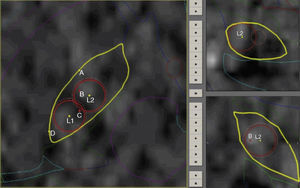
Técnica quirúrgicaBajo anestesia local, se efectúa colocación de marco estereotáxico (Estereoflex, La Habana, Cuba). Se realiza adquisición de imágenes de tomografía axial computarizada (Equipo de Tomografía Axial Computada, Toshiba Aquilon 64, Toshiba America Medical Systems, Inc., Tustin, CA, EE. UU.), según protocolo predeterminado (imágenes volumétricas de 1mm con matriz de 512x512 píxeles y un campo de visión de 240mm). Para la localización del núcleo subtalámico utilizamos el sistema STASSIS como software de planificación quirúrgica (Ciren, La Habana, Cuba). Empleamos referencias anatómicas para determinar la localización de la comisura anterior (AC) y posterior (PC) y poder fusionar una versión digitalizada del atlas de Schaltenbrand y Wahren. Este se ajusta a la anatomía del paciente y se utiliza como guía para mostrar la ubicación y orientación espacial del núcleo (2-3mm posterior al punto intermedio comisural, 4mm inferior al plano intercomisural y entre 11 y 13mm lateral a la línea media), trazándose la trayectoria adecuada para cada paciente.
Se realiza orificio de trépano (14mm) con anestesia local en región precoronal y posteriormente se introduce cánula con semimicroelectrodo bipolar concéntrico (Unique Medical Co. Ltd, Tokyo, Japón) de Ø 0,3-0,4mm, punta de 10-20, distancia interpolar 0,2-0,3mm y 100 KΩ. La actividad neuronal multiunitaria se registra y visualiza con la ayuda del programa informático para registro y procesamiento digital Neurosurgical Deep Recording System (NDRS, CIREN, La Habana, Cuba)10–12. Se avanza cuidadosamente bajo visión y audición de la actividad eléctrica desde un punto (25mm) superior al blanco, intentando reconocer con ayuda del microdriver las diferentes estructuras antes de su arribo al target. A 10mm previos al blanco, el avance continúa cada 1mm finalizando 5mm por debajo. Se realizan subsecuentes trayectos con desplazamientos anteriores de 2mm, buscando el borde anterior para luego, y según los mejores registros, desplazarnos 2mm a 45° hacia el extremo lateral del núcleo.
La identificación del núcleo subtalámico se efectúa a partir de los siguientes parámetros:
- 1.
Detección del blanco como resultado de la marcada actividad eléctrica caracterizada por gran amplitud de descarga, similar a la actividad del núcleo V.I.M del tálamo.
- 2.
Registro secuencial comparativo de las siguientes estructuras según avanza el electrodo: tálamo anterior, zona inserta, NST y sustancia nigra reticulata basado en diferentes patrones de frecuencia.
- 3.
Las variaciones de amplitud de las descargas tanto como la distancia en mm de la actividad eléctrica integrada son factores determinantes del límite de la estructura.
La microestimulación eléctrica del NST no se efectúa de forma rutinaria y solo la reservamos para aquellos pacientes en los que el microrregistro ofrece dudas sobre la ubicación exacta del blanco. El objetivo es reconocer la posición de la cápsula interna así como otras estructuras circundantes, sin interés en la respuesta propia del blanco en lo que se refiere a síntomas cardinales de la enfermedad. Los parámetros de estimulación utilizados fueron pulsos de corriente bipolar por medio del mismo electrodo de registro entre 0,1 y 5mA, con incrementos de 0,1mA, frecuencias de 60-180Hz, con pulsos de 1s (Generador de radio frecuencia, Cosman G4 Versión 2, Cosman Medical, Inc., Burlington, MA, EE. UU.).
MacroestimulaciónEl fin es verificar la posición espacial exacta y su relación con las estructuras adyacentes, sin esperar efectos indeseables significativos, ya que en caso de que ello ocurriera deberíamos replantearnos en primer lugar las coordenadas de lesión. Lo mismo que para la microestimulación no tenemos como objetivo evaluar efectos positivos sobre los síntomas sino definir su relación con la cápsula interna. Nuestros parámetros de estimulación sensorial utilizados fueron de 50Hz, 0,5ms y rangos escalonados de intensidad desde 0mA hasta 4mA. Basados en esto, la región lateral evocaría contracción muscular contralateral derivada de la estimulación del haz corticoespinal, la región medial y posterior movimientos oculares (blefaroptosis y blefarodiastasis por cercanía al III par y síntomas sensoriales ante proximidad del lemnisco medio), la desviación conjugada de la mirada se interpreta por activación de fibras del haz corticoespinal. En algunas ocasiones se obtiene interrupción del temblor en clara relación temporal durante el estímulo.
Protocolo de ablaciónLas coordenadas finales para la definición del área lesional se basan fundamentalmente en los hallazgos neurofisiológicos con mínimas correcciones ante efectos que sugieran proximidad a la cápsula por macroestimulación. Se completan 2 lesiones por radiofrecuencia con electrodo de 1,1mm de diámetro y 2mm de superficie activa (Stereotactic TC Electrodes, Cosman Medical Inc, Burlington, MA, EE. UU.) a fin de cubrir en la medida de lo posible los puntos de mayor actividad eléctrica, permitiendo ajustar el volumen final de la lesión que oscila entre 50 y 80 mm3. Las lesiones se llevan a cabo con una potencia de 8-16W en 4 ciclos que van desde 50° a 70-80° dependiendo del volumen del núcleo, durante 60 s. Este procedimiento se lleva a cabo bajo estricto control clínico con paciente despierto y evaluando permanentemente respuestas positivas, tomando como base la rigidez así como efectos adversos principalmente motores. Durante la primera lesión (la más dorsolateral), observamos respuesta positiva con una distribución somatotópica representada por cara y miembro superior, mientras que en la segunda lesión (más medial) obtenemos efectos sobre el miembro inferior (fig. 1).
Análisis estadísticoLos datos continuos se expresan como media y desvío estándar, los datos categóricos como valores absolutos y porcentajes. Para la comparación se utilizó el test T para datos apareados o test Wilcoxon según corresponda a su distribución. Se asumen como significativos los valores de p menores a 0,05 a 2 lados. Para el análisis se utilizó el software estadístico Infostat (versión 2013, Córdoba, Argentina).
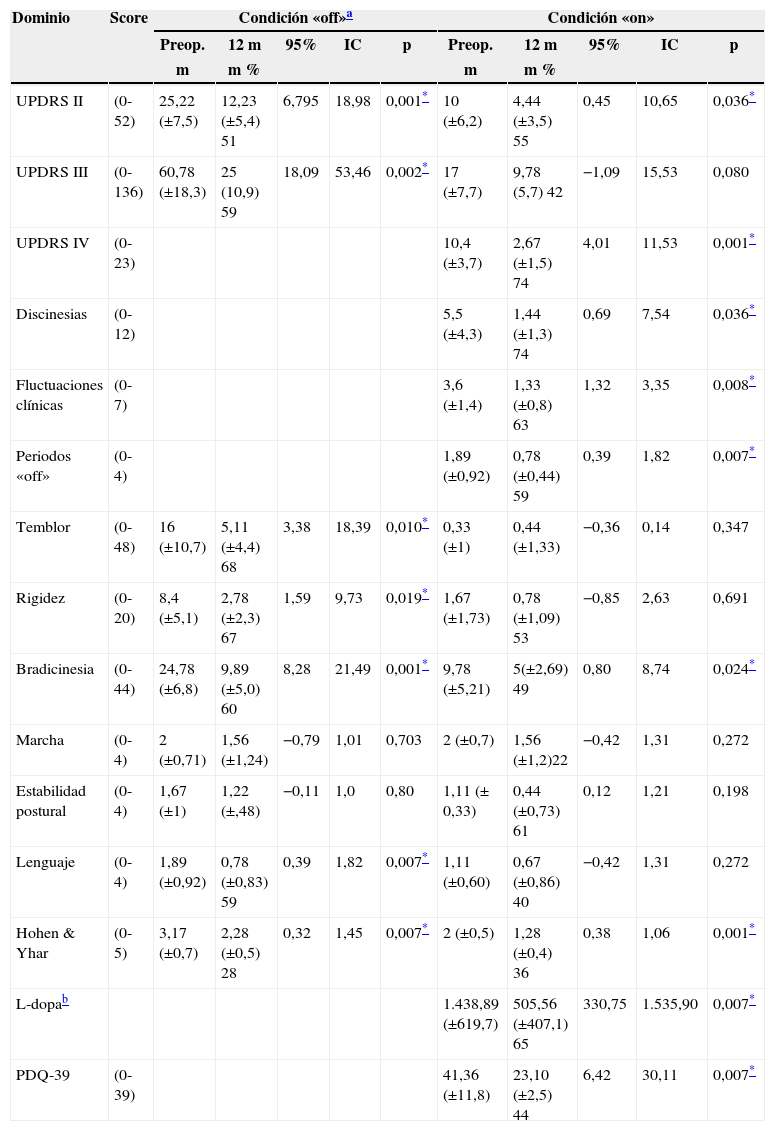
ResultadosAspectos motoresEvaluación en condición «off»La evaluación en esta condición demuestra significativa mejoría, tanto en actividades de la vida diaria UPDRS II (25,2 vs. 12,3; 51,2%; p=0,001), como en los aspectos motores UPDRS III (60,7 vs. 25; 58,89%; p=0,002). Las mismas consideraciones se muestran, para síntomas cardinales tales como temblor, rigidez y bradicinesia 68, 67 y 60% respectivamente (ver tabla 3), con un marcado efecto antidistónico contralateral y axial, incluyendo beneficio transitorio de la marcha y fenómeno de freezing.
Efecto de subtalamotomía bilateral sobre distintos aspectos motores en pacientes parkinsonianos (n=9)
| Dominio | Score | Condición «off»a | Condición «on» | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Preop. | 12 m | 95% | IC | p | Preop. | 12 m | 95% | IC | p | ||
| m | m % | m | m % | ||||||||
| UPDRS II | (0-52) | 25,22 (±7,5) | 12,23 (±5,4) 51 | 6,795 | 18,98 | 0,001* | 10 (±6,2) | 4,44 (±3,5) 55 | 0,45 | 10,65 | 0,036* |
| UPDRS III | (0-136) | 60,78 (±18,3) | 25 (10,9) 59 | 18,09 | 53,46 | 0,002* | 17 (±7,7) | 9,78 (5,7) 42 | −1,09 | 15,53 | 0,080 |
| UPDRS IV | (0-23) | 10,4 (±3,7) | 2,67 (±1,5) 74 | 4,01 | 11,53 | 0,001* | |||||
| Discinesias | (0-12) | 5,5 (±4,3) | 1,44 (±1,3) 74 | 0,69 | 7,54 | 0,036* | |||||
| Fluctuaciones clínicas | (0-7) | 3,6 (±1,4) | 1,33 (±0,8) 63 | 1,32 | 3,35 | 0,008* | |||||
| Periodos «off» | (0-4) | 1,89 (±0,92) | 0,78 (±0,44) 59 | 0,39 | 1,82 | 0,007* | |||||
| Temblor | (0-48) | 16 (±10,7) | 5,11 (±4,4) 68 | 3,38 | 18,39 | 0,010* | 0,33 (±1) | 0,44 (±1,33) | −0,36 | 0,14 | 0,347 |
| Rigidez | (0-20) | 8,4 (±5,1) | 2,78 (±2,3) 67 | 1,59 | 9,73 | 0,019* | 1,67 (±1,73) | 0,78 (±1,09) 53 | −0,85 | 2,63 | 0,691 |
| Bradicinesia | (0-44) | 24,78 (±6,8) | 9,89 (±5,0) 60 | 8,28 | 21,49 | 0,001* | 9,78 (±5,21) | 5(±2,69) 49 | 0,80 | 8,74 | 0,024* |
| Marcha | (0-4) | 2 (±0,71) | 1,56 (±1,24) | −0,79 | 1,01 | 0,703 | 2 (±0,7) | 1,56 (±1,2)22 | −0,42 | 1,31 | 0,272 |
| Estabilidad postural | (0-4) | 1,67 (±1) | 1,22 (±,48) | −0,11 | 1,0 | 0,80 | 1,11 (± 0,33) | 0,44 (±0,73) 61 | 0,12 | 1,21 | 0,198 |
| Lenguaje | (0-4) | 1,89 (±0,92) | 0,78 (±0,83) 59 | 0,39 | 1,82 | 0,007* | 1,11 (±0,60) | 0,67 (±0,86) 40 | −0,42 | 1,31 | 0,272 |
| Hohen & Yhar | (0-5) | 3,17 (±0,7) | 2,28 (±0,5) 28 | 0,32 | 1,45 | 0,007* | 2 (±0,5) | 1,28 (±0,4) 36 | 0,38 | 1,06 | 0,001* |
| L-dopab | 1.438,89 (±619,7) | 505,56 (±407,1) 65 | 330,75 | 1.535,90 | 0,007* | ||||||
| PDQ-39 | (0-39) | 41,36 (±11,8) | 23,10 (±2,5) 44 | 6,42 | 30,11 | 0,007* | |||||
La significanción estadística de la condición «on» también fue observada para las actividades de la vida diaria UPDRS II (10 vs. 4,4; 56%; p=0,036). Se destaca la práctica desaparición del fenómeno hipercinético al igual que bloqueos de la respuesta motora UPDRS IV (10,4 vs. 2,3; 77,8%; p=0,001).
Sintomatología axial: De los síntomas axiales considerados (ítems 1, 19 y 20 de las escalas UPDRS III) solo se obtuvo significación para el lenguaje en condición «off».
Adaptación farmacológicaParalelamente a la mejoría de los resultados motores fue posible disminuir la dosis total equivalente de L-dopa en alrededor del 60% (1.439 vs. 505mg; p=0,007) adaptando el esquema de un modo particular, considerando que el procedimiento se llevó a cabo por etapas. Luego de la primera ablación, en líneas generales, se intenta mantener el esquema previo, lo que permitió la disminución de la dosis total de L-dopa en un porcentaje variable de pacientes. Una vez completado el segundo procedimiento, se modifica el esquema farmacológico, llegando en algunos casos a una marcada reducción de la dosis.
DiscinesiasLuego del primer procedimiento, se observó un incremento en la sensibilidad al tratamiento dopaminérgico en 3 pacientes, manifestado por discinesias leves y transitorias (ausentes en condición de «off») referidas al miembro superior contralateral, grado 2 de Goetz12. Completado el segundo procedimiento, 4 pacientes desarrollaron discinesias, de las cuales 3 fueron grado 2 y una grado 3, en el hemicuerpo contralateral. Todas cedieron de manera espontánea, alrededor de 3 semanas después, de manera gradual.
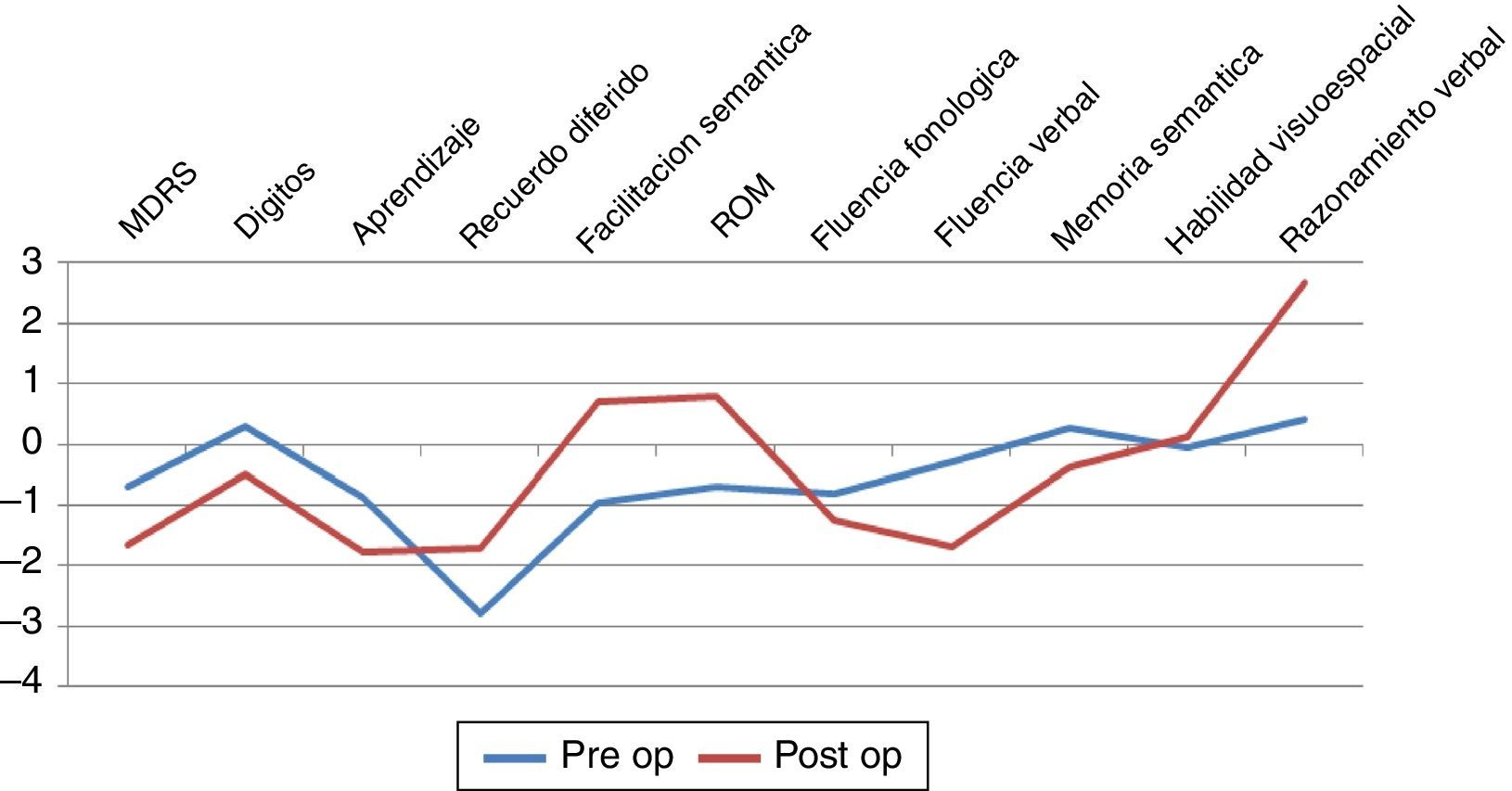
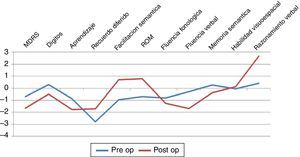
Aspectos cognitivosSolo fue posible observar diferencia significativa entre grupos para la prueba de razonamiento lógico verbal (p=0,0469) con mejor rendimiento en el grupo posquirúrgico (ver fig. 2). Los demás dominios cognitivos evaluados no mostraron diferencias estadísticamente significativas, aunque cabe mencionar que se objetivó un bajo rendimiento en pruebas de atención, función ejecutiva, aprendizaje y memoria en ambos grupos.
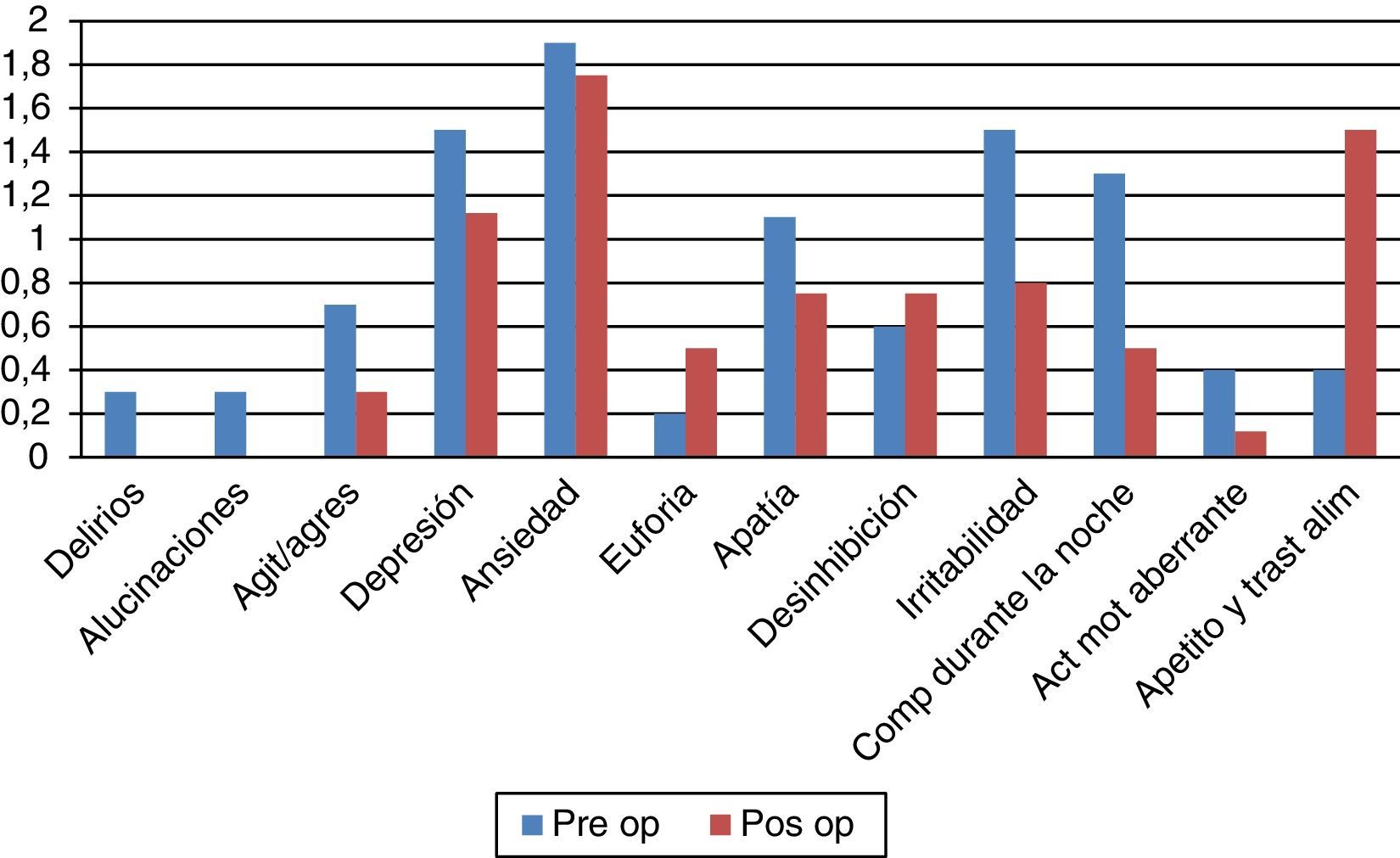
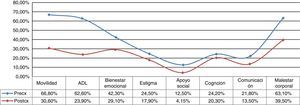
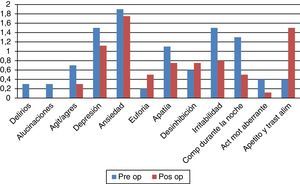
Aspectos conductualesLa escala de calidad de vida PDQ-39 (fig. 3) evidencia una significativa mejoría del 44% (41,37 vs. 23,10; p=0,007). En el plano depresivo ningún paciente mostró cifras comparables con cuadro de depresión grave en el examen basal y solo 2 presentaron depresión ligera/moderada tanto en el pre- como en el posquirúrgico. En el plano neuroconductual evaluados en el NPI los «comportamientos hiperactivos» estuvieron por encima del nivel esperado, con particular referencia a los trastornos alimentarios (ver fig. 4).
No se observaron síntomas ansiosos-depresivos en el postoperatorio. Ningún paciente presentó agresividad.
ComplicacionesCompletando el segundo procedimiento, discinesias transitorias se observaron en 4 pacientes, 3 de ellas de carácter leve que cedieron con readaptación del esquema farmacológico. Un paciente desarrolló discinesias moderadas-severas que cedieron espontáneamente a los 20 días. Un paciente desarrolló absceso corticosubcortical, por lo que debió cumplir tratamiento antibiótico parenteral por 20 días. Lateropulsión ipsilateral al target fue observado en la mayoría de los casos con resolución espontánea en la primer semana del postoperatorio. Sin evidencia de compromiso de la vía piramidal. Ningún paciente presentó disartria.
DiscusiónLa subtalamotomía bilateral por radiofrecuencia ha demostrado un marcado y sostenido efecto antiparkinsoniano sobre síntomas cardinales como rigidez, bradicinesia y temblor, asociado a un importante efecto antidistónico con prácticamente desaparición de hipercinesias inducidas por L-dopa. Se trata de un método bien tolerado con bajo índice de complicaciones con la precaución de proceder un lado a la vez, a partir de la sugerencia del grupo de La Habana13. Como la mayoría de los estudios abiertos, la consideración de un efecto placebo debería considerarse. El beneficio objetivado en los síntomas motores en más del 50% en la condición «off», sostenido en el tiempo, sumado a la disminución de la dosis total de L-dopa en pacientes con diagnóstico de EP avanzada, sugieren que el efecto placebo es poco probable.
El impacto sobre la condición de «off» posquirúrgica es un dato resaltable con una disminución próxima a la condición de «on» prequirúrgica, hallazgos similares a los encontrados en las publicaciones de Alvarez et al.13 (2005). Los beneficios obtenidos son inmediatos, con incremento del tiempo en «on», desaparición del fenómeno distónico doloroso y significativa mejoría de la calidad del sueño nocturno (evaluación UPDRS IV [ítem 4] y UPDRS I [ítem 7] respectivamente). De los síntomas axiales no fue posible demostrar, salvo el efecto sobre el lenguaje, cambios significativos en la marcha y estabilidad postural a pesar del marcado incremento observado en la movilidad y actividades de la vida diaria como lo demuestran las escalas que valoran calidad de vida (ver fig. 3). No obstante, consideramos que el adecuado control del temblor, sumado a la mejoría de síntomas axiales, incluyendo la estabilidad postural entre otros, justificarían la diferencia observada en más del 50% en la escala motora UPDRS III. Los estudios de largo plazo en ablación sugieren que los síntomas cardinales como rigidez, bradicinesia y temblor representan la respuesta más constante y sostenida13,14, si bien es esperable un menor efecto sobre este último a lo largo del tiempo. En nuestro caso, el corto período de seguimiento no permite un análisis en esta etapa.
La condición «on» también demuestra significativa mejoría principalmente por el adecuado control del fenómeno hipercinético, particularmente discinesias inducidas por L-dopa, incluyendo tanto discinesias bifásicas como de pico de dosis. Este fenómeno se cree que estaría en relación directa con la disminución concomitante de L-dopa. No obstante, la ausencia de discinesias del lado contralateral, manteniendo el mismo esquema farmacológico durante la primer etapa, induciría a pensar que un efecto directo podría ser posible. Estos hallazgos fueron ya señalados por Alvarez et al. en 2005 y 200913,14 probablemente como resultado del edema o «supresión» de los campos de forel/zona incerta (H2/ZI), donde discurrirían fibras palidotalámicas, logrando un efecto palidotomía like15,16. Cabe aclarar aquí que, si bien nuestro método posiciona la lesión intranuclear (en la frontera del borde dorso-lateral), no se descartan efectos sobre proyecciones palidotalámicas, dada la complejidad espacial de la estructura17. Otros grupos proponen expresamente ampliar la lesión a H2/ZI18–20. La disminución de fluctuaciones de la respuesta motora sumada al control de discinesias, incrementa ostensiblemente el tiempo en «on», manifestándose como mejoría en las actividades de la vida diaria y calidad de vida particularmente por el incremento en la movilidad (ver fig. 3).
La probabilidad de desarrollar hipercinesias se incrementa luego del segundo procedimiento, pero una vez superado el período de readaptación de los circuitos ganglio-basales, el resultado final culmina en una paradójica respuesta, controlando de manera efectiva tanto el fenómeno hipocinético como el hipercinético, sin que esto implique en teoría liberación de L-dopa21. En ningún caso se observó balismo. No obstante, la presencia de discinesias que persisten aun en ausencia de L-dopa en un paciente con antecedentes de severas discinesias axiales y apendiculares sugerirían cautela. En este caso en particular, dichas discinesias cedieron espontáneamente en 3 semanas, permitiendo reintroducir la L-dopa de manera gradual. En ningún caso se observó pérdida de la dopasensibilidad en el postoperatorio.
Considerando el plano cognitivo conductual, podemos resumir que en coincidencia con otras publicaciones22,23, observamos un patrón de compromiso cognitivo global de tipo fronto subcortical con déficit atencional, FE, y memoria (bajo rendimiento en aprendizaje y recuerdo libre con puntajes relativamente normales en tarea de reconocimiento). El único dominio que mostró diferencias significativas correspondió al razonamiento lógico verbal24-26. Por regla general, los mecanismos de razonamiento se hallan vinculados o asociados a procesos de manipulación mental y aplicación de recursos atencionales en un sistema de capacidad limitada que depende de la eficiencia del funcionamiento del sistema ejecutivo23,24,26–28. Las dificultades conceptuales por patrones de errores perseverativos al momento de seleccionar el modo correcto de hallar una solución, suelen ser vinculadas con lesión de la corteza prefrontal dorsolateral por disfunción de circuitos prefrontocaudados con afectación estriatal primaria. La escasa muestra analizada no permite obtener mayores conclusiones por lo que un análisis que considere otras variables tales como síntoma de inicio, edad, condición social, etc. sería mandatorio.
En el plano afectivo (dentro del postoperatorio inmediato) no se observan mayores cambios más allá de lógicas variaciones que resuelven sin intervención a los pocos días, en referencia a modificaciones del esquema farmacológico, incluyendo edema de área de acceso, trayectoria y blanco quirúrgico. Finalmente, cabe destacar el impacto social en directa relación a la mejoría en la movilidad como lo demuestran las escalas de calidad de vida (ver fig. 2), permitiendo en muchos casos poder continuar desarrollando sus actividades cotidianas.
Los procedimientos quirúrgicos ablativos para la EP significaban una opción antes del advenimiento de la L-dopa. Desde hace más de 2 decenios, existe un renovado interés como resultado del avance tecnológico y el empleo de dispositivos electrónicos. No obstante, los procedimientos ablativos siguen siendo una opción, tal como lo sugieren estudios de validación controlados que comparan ablación unilateral (GPi) versus el mejor tratamiento farmacológico (Vitek 2003)29 donde se demuestra un efecto significativo a 6 meses y 2 años de follow-up, tanto sobre síntomas motores como complicaciones del tratamiento farmacológico. Si bien nuestro método utiliza un target diferente, quedaría pendiente la necesidad de definir la no inferioridad del núcleo subtalámico versus globo pálido.
Como resumen, podemos concluir que los procedimientos ablativos constituyen una alternativa para síntomas parkinsonianos de difícil control farmacológico, en pacientes adecuadamente seleccionados. Que los riesgos de complicaciones motoras en especial referencia a las hipercinesias son de muy baja incidencia. Que desde el punto de vista económico representa una opción en nuestro medio, sumando la ventaja de no necesitar controles especializados en el postoperatorio. Por último, quedaría la necesidad de completar estudios adecuadamente controlados y con mayor número de pacientes con el objetivo de validar la técnica como una opción dentro del arsenal terapéutico.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Trabajo presentado como póster en el Congreso Argentino de Neurología 2013, donde se obtuvo la mención de trabajo destacado.