La esclerosis múltiple (EM) es el trastorno inflamatorio más común del sistema nervioso central (SNC) y la causa principal de discapacidad neurológica en adultos jóvenes. Los factores ambientales e infecciosos han sido fuertemente asociados al incremento de la ocurrencia de la enfermedad, hasta más del doble, en los últimos 10 años. En este artículo de revisión se describen los principales hallazgos reportados sobre la relación entre ciertas infecciones virales y bacterianas con la aparición y progresión de la EM.
MétodosSe realizó un plan metodológico de búsqueda de artículos científicos relacionados con infección y EM, mediante la búsqueda de artículos científicos, principalmente publicados en inglés, en las plataformas virtuales de Pubmed, Medline y Cochrane. Para la búsqueda se utilizaron como palabras claves (términos MeSH): «virus, bacteria, autoimmune disease of the nervous system, multiple sclerosis». Se eligieron artículos publicados en revistas indexadas durante los últimos 15 años.
ResultadosEstudios epidemiológicos sugieren que la EM tiene un componente etiológico infeccioso que origina un proceso inflamatorio que puede contribuir a la iniciación o exacerbación de la enfermedad. Particularmente, la infección viral y los eventos de desmielinización en el SNC puede deberse a la penetración de un virus como el virus Epstein-Barr (EBV), a través del torrente sanguíneo, específicamente hacia el SNC. Por otro lado, las infecciones bacterianas crónicas pueden causar procesos de desmielinización en el SNC que agravan la enfermedad de EM.
ConclusionesEste estudio contribuye a aportar evidencia científica donde se demuestra la multicausalidad implicada en la ocurrencia de la EM. Aún falta desarrollar más estudios epidemiológicos que demuestren y comprueben la relación y la implicación de agentes virales y bacterianos en el origen, el desarrollo y la severidad de la enfermedad.
Multiple sclerosis (MS) is the most common inflammatory disease of the central nervous system (CNS) and the leading cause of neurological disability in young adults. Environmental and infectious factors had been strongly associated and involved in the increased occurrence of MS, to more than twice, in the last 10 years. In this review, we describe the main findings on the relationship between viral and bacterial infections and the onset and progression of MS.
MethodsThe research involved a systematic review of scientific literature regarding infection and MS. Our search was performed using and consulting specialized websites like PubMed, Medline and Cochrane. The keywords (MeSH terms) employed for the digital search were: “virus, bacteria, autoimmune disease of the nervous system, and multiple sclerosis.” Articles published in English indexed journals during the past 15 years were used for the study.
ResultsEpidemiological studies suggest that MS has an infectious etiologic component causing an inflammatory process that may contribute to the initiation and/or exacerbation of the disease. Particularly, viral infections and demyelination events in the CNS may be due to the penetration of viruses such as the Epstein-Barr virus (EBV) through the bloodstream to the CNS, specifically. On the other hand, chronic bacterial infections may cause demyelination processes that trigger or increase the complications of the disease in MS.
ConclusionsThis study shows the multiple factors involved in the occurrence of MS. More epidemiological studies are necessary to support the relationship and involvement of viral and bacterial infections in the onset, development and severity of the disease.
La esclerosis múltiple (EM) es el trastorno inflamatorio desmielinizante más común del sistema nervioso central (SNC) y es la causa principal de discapacidad neurológica no traumática, en adultos jóvenes1. Los últimos adelantos tecnológicos para su diagnóstico, así como los cambios en estilos de vida en la población, han sugerido que la ocurrencia de esa enfermedad, se ha incrementado, más del doble, en los últimos 10 años2.
Por otra parte, diversos estudios epidemiológicos han implicado a agentes infecciosos como posibles factores asociados a la EM, los cuales predisponen a una mayor vulnerabilidad inmunológica, durante la infancia y que, posteriormente, favorece el desarrollo de la enfermedad3-5.
En este artículo de revisión, se describen los principales hallazgos reportados en la literatura nacional e internacional en los años recientes, en relación con diferentes agentes infecciosos, tales como el virus de Epstein-Barr (EBV), el virus del herpes simple (VHS), el citomegalovirus (CMV), así como algunas bacterias, asociados con la aparición y progresión de EM.
Material y métodosPara este artículo de revisión, se realizó una metodología de búsqueda bibliográfica, de artículos científicos publicados, en inglés, en las principales plataformas virtuales de búsqueda en Internet como: Pubmed, Medline y Cochrane. Se eligieron artículos publicados en revistas indexadas, que fueron publicados predominantemente entre el año 2000 y el año 2016, aunque se incluyeron, por su relevancia, algunos artículos publicados previamente.
Se consideraron estudios epidemiológicos como: ensayos clínicos aleatorizados, estudios de casos y controles, estudios de caso, así como diversos artículos de revisión. Para la búsqueda en Internet se utilizaron los términos mesh: «virus, bacteria, autoimmune disease of the nervous system and multiple sclerosis». Los artículos fueron revisados y verificados por su contenido relevante. Se incluyó también información de investigaciones experimentales, realizadas en animales de laboratorio, para el tratamiento de la EM.
Desarrollo de la investigaciónAntecedentes históricosLa EM fue descrita por primera vez hacia la segunda mitad del siglo xix por el médico francés J.M. Charcot, quien propuso la tríada de Charcot: diplopía, disartria y ataxia. Aunque se han propuesto diversas hipótesis sobre los factores etiopatogénicos, su causa, aún permanece desconocida6. Se considera una patología compleja del SNC que incluye aspectos inmunológicos, inflamatorios, genéticos y clínicos, con la consecuente discapacidad neurológica en pacientes adultos jóvenes7.
Así, Mouzaki et al. y Alemany et al. han descrito una gran variedad de eventos, que apuntan a que el sistema inmunitario desempeña un papel importante en la patogenia de la enfermedad. La respuesta inmunitaria de esta enfermedad tiene 2 componentes principales: un proceso inflamatorio y una fase neurodegenerativa (esclerosis)8,9.
Actualmente, existe toda una gama de enfermedades en las cuales se debe pensar como diagnóstico diferencial, que varían dependiendo de cada situación clínica concreta. Para ello se debe realizar un adecuado protocolo de estudio de estas patologías, ya que muchas de ellas se diferencian por su cuadro clínico, cronicidad y severidad, de forma muy sutil, dentro de las cuales podemos encontrar: la mielitis transversa aguda, la encefalomielitis aguda diseminada, la enfermedad de Devic, la mielitis inflamatoria recurrente y la mielopatía crónica progresiva, entre otras10.
Panorama epidemiológico de la esclerosis múltipleActualmente, existe una gran variabilidad epidemiológica de la EM, de acuerdo con la situación geográfica. Así, la mayor prevalencia de la EM ocurre en latitudes más al norte y sur del ecuador (países nórdicos y Estados Unidos), en un rango de 80 a 300 casos por 100.000 habitantes. En otros países europeos, como Portugal y España, se reportan prevalencias en un rango de entre 40 y 80 casos por 100.000 habitantes11. En contraste, hay una baja prevalencia de EM; se observa en países de África, Asia y Sur América, con alrededor de 5 casos por 100.000 habitantes12. Por lo anterior, se ha propuesto que existe una mayor susceptibilidad de riesgo influenciado por factores como el medio ambiente (estilo de vida), base genética (gen predisponente) o agente infeccioso (viral o bacteriano).
Vías de diseminación en el sistema nervioso centralDiversos estudios epidemiológicos indican que la EM tiene un componente etiológico infeccioso, que origina un proceso inflamatorio que puede contribuir al desarrollo y/o la exacerbación de la enfermedad, de forma clínica13. Particularmente, la asociación de la EM e infección viral y los eventos de desmielinización en el SNC pueden deberse a una de las siguientes vías propuestas:
- 1.
Ascenso de los agentes infecciosos a lo largo del SNC, por ejemplo, VHS, el virus de la varicela zóster (VZV).
- 2.
Expresión en el SNC de un virus endógeno codificado en el genoma, por ejemplo, retrovirus (MSRV).
- 3.
Penetración en el SNC por macrófagos infectados (HIV y HHV-6 o 4). Hematógenos extendidos al SNC, por ejemplo, infección de células B por EBV14.
Se ha propuesto una clasificación de 4 subgrupos de la EM, considerando la evolución del padecimiento, desde el inicio de los síntomas inespecíficos hasta la progresión a etapas más definidas, considerado la frecuencia y la severidad de los ataques, discapacidad y déficit neurológico. Y comprende:
- 1.
EM con brote y remisión (EMBR). Fase en donde se encuentra el 85% de los pacientes. Se caracteriza por brotes claramente definidos con completa recuperación o efectos residuales; períodos libres de enfermedad sin progresión de la enfermedad.
- 2.
EM primaria progresiva (EMPP). Fase que afecta aproximadamente a un 15% de los pacientes con EM; se presentan con síntomas neurológicos progresivos y graduales sin remisiones desde el inicio.
- 3.
EM secundaria progresiva (EMSP). Aparece 10-20 años después de la forma EM brote-remisión, seguida por progresión de la enfermedad. Las remisiones se vuelven más infrecuentes, hay mayor incapacidad y suelen quedar secuelas neurológicas.
- 4.
EM progresiva recurrente (EMPR). Es una enfermedad progresiva con ataques agudos, con o sin recuperación de la funcionalidad15.
La mayoría de los casos (85-90%) se diagnostican dentro del primer grupo. Pueden seguir así, por más de 10 años, y cambiar el curso de su evolución a las variantes primaria o secundaria progresiva, según los criterios pronósticos y el tratamiento recibido11.
En los últimos años, se han desarrollado criterios formales para diagnosticar la EM, que han sido de gran utilidad debido a la variabilidad de esta enfermedad. Así, existen criterios que toman en cuenta únicamente aspectos clínicos (Allison et al. y McAlpine et al.); existen criterios que incluyen aspectos paraclínicos y terapéuticos (Schumacher et al.) y finalmente otros criterios, que vinculan la investigación clínica y epidemiológica con el tratamiento. De esta manera, con la introducción de la resonancia magnética (RM), en la década de los años 70, se originó una revolución en el diagnóstico de la EM, incrementando la precisión del mismo (hasta un 95% de sensibilidad). En la actualidad, los nuevos criterios diagnósticos de EM, aportados por el comité de Mac Donald (2010), se apoyan no solo en el cuadro y la evolución clínica, sino también toman como referencia los estudios de potenciales evocados, análisis del líquido cefalorraquídeo (LCR), neuroimágenes como la RM, utilizando en la actualidad esta técnica como un marcador de progresión y actividad de la enfermedad16.
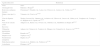
ResultadosPrincipales virus asociados a esclerosis múltiple (tabla 1)El papel de los virus como agentes asociados a la EM se ha relacionado por su tropismo al SNC, a su acción prolongada de permanecer ocultos en el cuerpo durante años y a períodos de reactivación, lo que ocasiona cambios inmunológicos latentes, en el cuerpo, además de ocurrir un proceso de desmielinización autoinmune y la aparición de síntomas de la enfermedad. Por ejemplo, el virus de la encefalomielinización murina de Theiler o coronavirus17, el cual se ha asociado con lisis de oligodendrocitos, así como en la leucoencefalopatía multifocal progresiva18. Por otro lado, la presencia de anticuerpos frente a ciertos virus en pacientes con EM ha sido ampliamente determinada, por ejemplo, para los VHS, EBV y CMV, entre otros19.
Agentes infecciosos asociados a EM
| Agente infeccioso | Referencia |
|---|---|
| Virus | Autor |
| Citomegalovirus | Halenius y Hengel20 |
| Retrovirus endógeno humano | Christensen T, Brudek et al., Laska et al., Perron et al., Antony et al., Curtin et al.22–27 |
| Herpes virus tipo 6 y 7 | Virtanen et al., Ferró et al.28–29 |
| Virus de Epstein-Barr | Thorley-Lawson DA, Littman et al., Ascherio et al., Zhou et al., Lucas et al., Libbey et al., Vaughan et al., Torring et al., Hjalgrim et al., Cepok et al.30–39 |
| Virus de la varicela zóster | Ahlgren et al., Harrer et al., Owens et al., Ordoñez et al., Hambleton S, Shapiro JS40–45 |
| Bacterias | |
| Chlamydia pneumoniae | Aghaei et al., Sriram et al., Contini et al., Munger et al., Fainardi et al., Ivanova et al.47,49–53 |
| Clostridium | Rumah et al.54 |
| Streptococcus | Topkaya et al.55 |
| Pseudomonas aeruginosa | Hughes et al.56 |
| Helicobacter pylori | Gavalas et al., Mohebi et al., Pedrini et al.57–59 |
| Acinobacter | Ebringer et al.60 |
Por otro lado, una de las evidencias más relevantes de la asociación de los virus con la EM está relacionada con el mimetismo molecular. La prevalencia elevada de anticuerpos IgG en el LCR de pacientes con EM se relaciona con una respuesta inmunológica contra un antígeno específico. Además, existe una reactividad cruzada de estos anticuerpos con la proteína básica de la mielina (MBP) que forma parte de la vaina de mielina con proteínas de los microorganismos virales y bacterianos20.
Los agentes infecciosos asociados a la exacerbación de enfermedades autoinmunes como la EM pueden estar involucrados con diferentes mecanismos de acción:
- 1.
daño directo de un tejido blanco tal como axones, mielina u oligodendrocitos en la EM y posteriores respuestas inmunitarias a los autoantígenos, o
- 2.
daño indirecto a través de las células inmunes activadas que secretan citocinas proinflamatorias y radicales, alteración de los requisitos estimulantes de las células inmunes. Ambos tipos de daño puede inducir la activación de la respuesta innata y adaptativa, así también las respuestas inmunitarias específicas a través de mimetismo molecular entre el agente infeccioso y la proteína de mielina21.
Con lo anterior, se describen los principales virus, que se han estudiado, involucrados en la patogénesis de la EM:
Retrovirus endógenos humanoLa asociación de los retrovirus endógenos humanos (HERV) en enfermedades autoinmunes, cada vez es más consistente. Los HERV representan tanto genes de susceptibilidad, como virus patogénicos involucrados en enfermedades neurológicas como en la EM22. Las secuencias de los gammarretrovirus HERV, donde la presencia del genoma está relacionada con la actividad de la enfermedad, se han encontrado en cultivos de células mononucleares, muestras de plasma, suero y LCR, en pacientes con EM23.
Por otro lado, se han reportado al menos 3 tipos de secuencias: HERV-H, HERV-W y HERV-K en pacientes con EM y son raramente encontrados en individuos sanos o en personas con otras enfermedades autoinmunes o inflamatorias56. No obstante, se desconoce el número de copias de los genomas de los retrovirus con marcos de lectura abierta en los tejidos analizados; solo se han detectado varias copias potencialmente codificantes y varias secuencias que se activan específicamente en EM con aparentemente producción de viriones completos24.
Adicionalmente, se ha detectado un aumento de anticuerpos contra epítopes específicos de gammarretrovirus en suero y LCR, acompañado de respuesta inmunitaria específica mediada por células en los pacientes con EM. La expresión de las proteínas Env y Gag de los retrovirus endógenos está incrementadas en individuos con EM25.
La proteína Env está relacionada con efectos neuropatogénicos y recientemente se demostró que la proteína glucosilada, syncytin-1, de HERV-W aumenta su expresión en lesiones de la EM. La sobreexpresión de syncytin-1 en células gliales induce estrés de retículo endoplásmico que conduce a la neuroinflamación y la inducción de radicales libres, que dañan las células próximas. El receptor syncytin-1 (ASCT1) es un transportador de aminoácidos neutros expresado en células gliales y se suprime en la materia blanca de pacientes con EM26.
Por otro lado, los efectos neurológicos la EM pueden ser resultado del efecto de proteínas virales o viriones de la familia de Herpesviridae. Se especula que la EM puede ser causada por la interacción de los HERV y herpesvirus generando interacciones complejas. Varios virus del herpesvirus, tales como VHS-1, VZV y HHV-6, se han asociado a la patogénesis de la EM. La expresión de las proteínas Gag y Env de los HERV-W pueden ser inducidas por VHS-1 y estas proteínas se producen en las lesiones de la EM y particularmente se presenta una acumulación del antígeno Gag en la estructura axonal de la sustancia blanca desmielinizadas y en las células endoteliales de las lesiones en casos agudos o desmielinización activa27.
Herpesvirus 6 y 7La implicación de la familia Herpesviridae humano en la patogénesis de la EM es aún controversial. Se ha relacionado la reactivación de los herpes virus HHV-6 y HHV-7 con la actividad de la enfermedad. El herpesvirus 6 son virus de ADN y miembros de la subfamilia de Herpesviridae. Dos variantes se han estudiado: el HHV-6B representa la mayoría de las infecciones de humanos, mientras que la variante HHV-6A aún no ha sido muy estudiada. Aunque la seroprevalencia en todo el mundo es casi del 100%, hay varios aspectos de HHV-6 que lo hacen un candidato interesante como agente infeccioso en la patogénesis de la EM:
- 1.
la infección inicial típicamente ocurre durante la infancia o la niñez temprana.
- 2.
HHV-6 es muy leucotrópico y neurotrópico por lo que pueden persistir en el SNC en un estado latente para toda la vida y,
- 3.
la reactivación de una infección por HHV-6 puede producirse en el marco de otra infección microbiana28.
Los reportes sobre la prevalencia, la distribución y la especificidad de HHV-6 en pacientes con EM han sido poco consistentes. La detección de anticuerpos en suero y LCR contra HHV-6A se ha relacionado con las exacerbaciones de la EM, por lo cual se establece su potencial asociación en la causalidad de la EM, con implicaciones que pueden mediar en diferentes mecanismos directos o indirectos en el curso de la enfermedad29.
Virus de Epstein-BarrSe ha estudiado la relación de este virus la etiología de diversas patologías que incluyen: el linfoma de Hodgkin y no Hodgkin, y el carcinoma nasofaríngeo30. Además, está relacionado con el 80-90% de los casos de mononucleosis infecciosa, la cual se ha observado que precede a la EM31. Posiblemente, el EBV es el agente viral que más se ha estudiado en la etiología de la EM. Existen evidencias consistentes que indican su relación serológica con mayor riesgo de EM32. Los niveles elevados anticuerpos contra EBV aparecen muchos años antes de la EM33. Existe una correlación positiva entre el riesgo de EM y el título de anticuerpos para el antígeno nuclear de EBV-134. Por otro lado, el análisis del repertorio de anticuerpos de mielina neuroantígenos específicos y su posible reacción cruzada frente a antígenos del virus de EBV puede explicar su relación con la EM. La porción scFv de los anticuerpos presentes en sujetos con EM seleccionados para la MBP muestra reacción cruzada con la proteína de latencia del EBV, lo que indica la posible implicación de este virus en la formación de la red patógena Ig. La asociación de la infección por el EBV y la EM está relacionada con el fenómeno de «mimetismo molecular» y apoya fuertemente la hipótesis de que el medio ambiente es un factor relevante para la EM35.
Adicionalmente, se ha propuesto que el EBV tiene el potencial para mediar la rotura de la tolerancia de autoantígenos, que parece ser un factor clave en el desarrollo de EM. Esta rotura podría ser mediada a través de la inducción de mimetismo molecular o a través de la infección permanente de las células B por el EBV, el cual podría inducir proliferación y aumentar la producción de anticuerpos36. La asociación entre el EBV y la EM es probable que se deba a una reactivación del EBV y actividad de la enfermedad en pacientes con EM a través del tiempo. El EBV podría estar desempeñando un papel indirecto en la EM como un activador de la enfermedad subyacente37.
Por otro lado, el linfoma de Hodgkin, que está etiológicamente relacionado con el EBV, se produce más frecuentemente en familias con EM y en pacientes con EM que en la población general38. Péptidos homólogos de EBV se han extraído de bibliotecas de péptidos aleatorios usando LCR derivado de pacientes con EM y han mostrado síntesis de la proteína G intratecal reactiva para el EBV. Además, clonas de linfocitos T reactivos a la proteína básica de mielina derivadas de pacientes con EM reaccionan de forma cruzada con péptidos no homólogos de EBV presentados por una molécula de CMH clase ii. Estas observaciones apoyan la autoinmunidad como posible mecanismo subyacente en la EM por mimetismo molecular inducido por el EBV39.
Virus de la varicela zósterPor mucho tiempo, se ha postulado que el VZV es un posible candidato en la etiología de la EM. Estudios epidemiológicos y serológicos han mostrado resultados no concluyentes de su participación en la etiología de EM40,41. El VZV es un virus exclusivo de humanos, altamente neurotrópico y la infección durante el período de la infancia es altamente frecuente. Posterior a la infección primaria, puede permanecer en forma latente en su hospedero por largos períodos, en neuronas ganglionares a lo largo del tubo neural, lo cual podría explicar su relación con la EM42. El genoma del VZV se ha detectado en células mononucleares de sangre periférica (PBMC) de pacientes con EM. Se ha asociado con recaídas agudas de la enfermedad y la reactivación del virus debido a alteraciones inmunológicas relacionadas con los episodios de exacerbación de la EM. Estos eventos indican que la infección por el VZV está limitada a un breve período durante la recaída clínica de la EM (período donde la cantidad de ADN viral es más alta en PBMC que en LCR) y su participación en la etiopatogenia de la EM puede deberse a un epifenómeno de la activación viral simultánea a la recaída de la EM43.
Por otro lado, debido a que el VZV tiene la capacidad de permanecer latente hasta por varias décadas, el desarrollo de los trastornos dependería en gran medida la susceptibilidad individual dentro del proceso de latencia y reactivación viral. Notablemente títulos altos de anticuerpos se han detectado en LCR en pacientes con EM en comparación con muestras de individuos sanos. Pese a la detección del ADN viral en PBMC de pacientes con EM, no ha sido determinante la asociación del VZV con la EM44,45.
Principales bacterias asociadas a esclerosis múltiple (tabla 1)Por otro lado, se ha documentado que muchas infecciones bacterianas crónicas pueden residir en el SNC y pueden estar relacionadas con procesos de desmielinización que desencadenan o agravan la enfermedad. Algunas bacterias intestinales residentes no patógenas pueden estar implicadas en la patogénesis de la EM, por mecanismos aparentemente similares a las residentes en el SNC46. El principal argumento que involucra las infecciones bacterianas y EM está relacionado con el fenómeno de mimetismo molecular. La estimulación antigénica cruzada entre antígenos bacterianos y su identidad aparente con la proteínas del huésped pueden desencadenar efectos secundarios autoinmunes. En este contexto, se han descrito péptidos encefalitogénicos con implicaciones autoinmunes en la EM, los cuales presentan ampliamente mimetismo con diversas proteínas de microorganismos (virus y bacterias). Estos hallazgos plantean un nuevo reto para tratar de elucidar la multicausalidad de esta enfermedad considerando ahora también anormalidades del metabolismo intestinal con las implicaciones en la EM47.
A continuación, se presentan resultados de posibles asociaciones entre agentes bacterianos y la patogénesis de la EM.
Chlamydia pneumoniaeLos primeros reportes de su implicación en la patología de la EM fueron los trabajos de Sriram et al., en 1998, donde se sugirió el papel potencial de Chlamydia pneumoniae (C. pneumoniae) como una causa de la EM48. Posteriormente, se aisló en pacientes con EM más que en pacientes con otros trastornos neurológicos o personas sanas49. En un estudio enfocado en detectar su ADN en el LCR en pacientes con EM, se reportó su presencia en el 97% de los casos de EM y un 18% en otras enfermedades neurológicas. Además, se aisló la bacteria del LCR de pacientes con EM, entre un 64 y un 90%, comparado con el 11% del grupo control50. Estos hallazgos aún son inconsistentes, ya que otros estudios no han encontrado asociación entre títulos de anticuerpos anti-C. pneumoniae y el riesgo para desarrollar EM. Por el contrario, reportan un mayor riesgo de desarrollar EM en un subgrupo de pacientes de mayor edad antes del inicio de la infección por esta bacteria51. Otros estudios indican un papel de C. pneumoniae solo como un epifenómeno en el SNC debido a la constante inflamación que favorece la EM y la infiltración selectiva de células mononucleares infectadas dentro del SNC. Otros estudios, con el apoyo de los recientes hallazgos inmunológicos y moleculares, indican un papel de cofactor en el desarrollo y la progresión de la enfermedad52,53.
Por lo tanto, la implicación real de C. pneumoniae en la EM sigue siendo un tema de debate y requiere una mayor comprensión a través de protocolos estandarizados moleculares y ultraestructurales en muestras biológicas procedentes de pacientes con EM.
Clostridium perfringesSolo existe un reporte de aislamiento de Clostridium perfringens (C. perfringens) tipo B, un bacilo que secreta la toxina épsilon, de una mujer con presentación clínica de EM, con la mejora de manera activa de lesiones cerebrales. Este hallazgo representa la primera vez que esta bacteria ha sido detectada en un ser humano. El tropismo de la toxina épsilon por la barrera hematoencefálica y la unión a los oligodendrocitos/mielina hacen que sea una candidata para la formación de lesiones incipientes en la EM. Dicho estudio evaluó la movilidad del transporte de toxinotipos de C. perfringens en el tracto gastrointestinal, en una población bien caracterizada de pacientes con EM comparado con controles sanos. El microorganismo C. perfringens tipo A humano estuvo presente en aproximadamente el 50% de controles sanos humanos en comparación con solo el 23% de los pacientes con EM. También se examinaron sueros y LCR obtenidos a partir de 2 bancos de tejidos y se encontró que hay inmunorreactividad para sus toxinas, 10 veces más frecuente, en las personas con EM que en los controles sanos. La toxina épsilon de C. perfringens se ajusta mecánicamente con una formación de una lesión naciente de EM ya que estas lesiones se caracterizan por la permeabilidad de la barrera hematoencefálica y la muerte celular de oligodendrocitos54.
StreptococcusAunque diversos mecanismos de inducción de autoinmunidad por algunos agentes infecciosos, han sido ya investigados, no existe suficiente evidencia científica sobre infecciones por Streptococcus relacionadas con EM. Solo un estudio, en 2007, reportó el efecto de la infección previa por Streptococcus del grupo A sobre EM. Para ello fueron medidos antiestreptolisina O y antideoxiribonucleasa B en 21 pacientes con EM y 21 donantes de sangre sanos como controles por ensayo de nefelometría. Se reportaron niveles de ADNasa B significativamente mayores en los pacientes con EM comparado con los controles. (p<0,001) y niveles similares de antiestreptolisina O en ambos grupos. Este estudio concluye que la relación entre EM e infecciones por Streptococcus puede existir, pero se requieren más estudios con modelos animales para el entendimiento del papel del Streptococcus del grupo A en la patogénesis de EM55.
Pseudomonas aeruginosaPocos son los estudios que han encontrado una relación de bacteria con EM. Este microorganismo podría mimetizar secuencias similares a la mielina y ser capaz de activar clones de LT específicos para la proteína básica de mielina, activación de células autorreactivas y producción de autoanticuerpos en pacientes con EM. Niveles elevados de IgA, IgM, IgG, tanto para la proteína básica de mielina bovina como los neurofilamentos que actúan como antígenos heteroespecíficos fueron reportados en pacientes con EM al compararlos con los controles. No obstante, se requieren estudios longitudinales para determinar si la exposición a antígenos de esta bacteria puede inducir el desarrollo de EM56.
Helicobacter pyloriAunque los hallazgos se muestran aún muy controversiales, las investigaciones apuntan que el Helicobacter pylori (Hp) tiene propiedades inmunomoduladoras en distintas enfermedades inflamatorias57,58. Un estudio reciente de casos y controles concluyó que los pacientes con infección por Hp tienen baja incidencia de EM; además, muestran complicaciones neurológicas bajas. Por lo que la infección por Hp podría tener una influencia protectora sobre la patogénesis de EM59.
AcinetobacterEste tipo de bacterias se encuentran en la piel humana y en los senos nasales. Inducen títulos estadísticamente significativos de anticuerpos IgA en pacientes con EM, lo que indica que este microorganismo puede estar actuando a través de la mucosa situada en los senos nasales60.
Con los datos disponibles hasta el momento, no se puede afirmar que las bacterias anteriormente descritas puedan ser agentes causales de la EM o simplemente ser patógenos oportunistas. Se requieren más estudios epidemiológicos, clínicos y de biología molecular para evaluar su asociación61.
Epidemiologia de la asociación de agentes infecciosos con esclerosis múltipleDesde que se publicó la posible asociación entre la infección por el EBV con la EM en 1981, han surgido otros estudios que relacionan posibles agentes infecciosos virales, como VHS, CMV y VZV con la EM62-65.
Autores como Sanadgol et al., en un estudio de casos y controles, reportaron una mayor prevalencia del ADN para CMV en casos que en controles (25,5% vs. 3,2%, p<0,001)66. Santón et al., en otro estudio de casos y controles, reportaron que la infección por EBV tipo 1 y 2 se detectó en 90% de los casos y el 37,4% de los controles (p<0,001)67. Ramagopalan et al. encontraron mayor asociación de EM en quienes refirieron antecedente de infección por mononucleosis (OR 2,1, IC del 95%, 1,71-2,48)68. Haahr y Hollsberg reportaron una OR 2,8 veces mayor de desarrollar un brote de EM en el grupo que tenía antecedente de infección por mononucleosis69. Rodríguez-Violante et al. reportaron en un estudio de casos y controles, mayor prevalencia de infección por VZV (66% vs. 42%, p<0,001) y, además, que el riesgo de un brote de EM se incrementaba hasta 4 veces en los casos de EM70.
ConclusionesEste estudio permite conocer algunos aspectos epidemiológicos de la EM y sobre todo el papel que desempeñan los diferentes agentes infecciosos en la etiología de la EM. En años recientes, se han multiplicado los estudios que relacionan marcadores genéticos de distintas infecciones asociadas con la ocurrencia de EM. De ahí que la asociación con el HLA de clase ii continúa siendo la más consistente y firmemente establecida, gracias a nuevas técnicas, que incluso han permitido rastrear todo el genoma. Inicialmente con los microsatélites, en la actualidad con los polimorfismos de un solo nucleótido (single nucleotide polymorphism) y, últimamente, con los chips de micromatrices proteínicas (microarrays)71. Recientemente, estudios de la Asociación Genómica Mundial (Genome Wide Association Studies [GWAS]) han evidenciado la susceptibilidad genética relacionada con la EM con los genes que codifican para el receptor de interleucina 7 (IL-7RA), receptor de IL-2 (IL-2RA) y gen CD58 (CLEC16A)72.
La evidencia presentada orienta a realizar estudios sobre los mecanismos fisiopatológicos implicados y también a la detección de otros posibles agentes infecciosos que podrían estar involucrados, que si bien se ha aproximado mucho a posibles tratamientos eficaces para esta enfermedad, aún falta desarrollar más estudios epidemiológicos que los respalden y comprueben su relación e implicación de agentes virales y bacterianos con en el origen, el desarrollo y la severidad de la enfermedad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.