La leptospirosis humana es una zoonosis causada por espiroquetas patógenas del género Leptospira, ampliamente distribuida a nivel mundial, con predominio en las regiones tropicales y templadas. En Argentina afecta principalmente a la región de la Pampa húmeda, con casos aislados y brotes epidémicos bien descritos en medios rurales y urbanos. La presentación clínica es proteiforme, observándose compromiso neurológico en el 10-20% de los casos. En este trabajo se describen dos casos de leptospirosis humana con afectación del sistema nervioso central en forma de meningitis, arteritis intracraneal e infarto cerebral, y se revisa la literatura con el fin de analizar los aspectos epidemiológicos y clínicos relevantes, haciendo énfasis en la neuroleptospirosis.
Human leptospirosis is a zoonosis caused by pathogenic spirochetes of the genus Leptospira, which is widely distributed worldwide, predominantly in tropical and temperate regions. In Argentina it mainly affects the pampa region, with isolated cases and outbreaks well described in rural and urban areas. The clinical presentation is protean, with neurological involvement in 10-20% of cases. We present 2 cases of human leptospirosis with central nervous system involvement in the form of meningitis, intracranial arteritis and cerebral infarction, and a literature review to discuss the relevant clinical and epidemiological aspects, with emphasis on neuroleptospirosis.
La leptospirosis es una zoonosis causada por espiroquetas patógenas del género Leptospira. Los seres humanos adquieren la infección al entrar en contacto con el agua o el suelo contaminados con la orina de animales infectados. La leptospirosis humana tiene una amplia distribución mundial, con predominio en las regiones tropicales y templadas. En Argentina la mayoría de los casos notificados corresponden a la región de la Pampa húmeda. Desde el punto de vista clínico, la enfermedad se presenta con un espectro amplio e inespecífico de síntomas y signos; el compromiso neurológico se observa en el 10-20% de los casos, principalmente en forma de meningitis aguda. El tratamiento antibiótico y de sostén apropiado reduce la morbimortalidad.
El objetivo de este trabajo es describir dos casos de leptospirosis humana con compromiso del sistema nervioso central, provenientes del medio rural de la Pampa húmeda, y revisar la literatura con el fin de analizar las características epidemiológicas y clínicas relevantes, haciendo énfasis en la neuroleptospirosis.
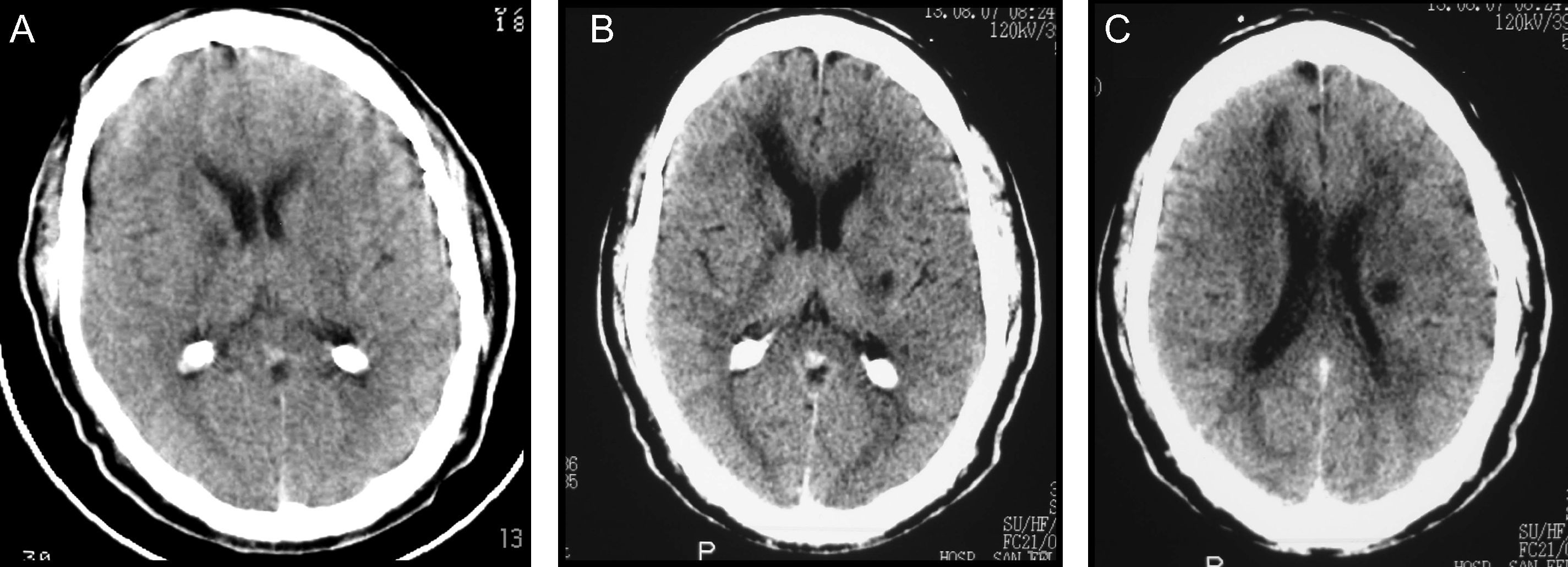
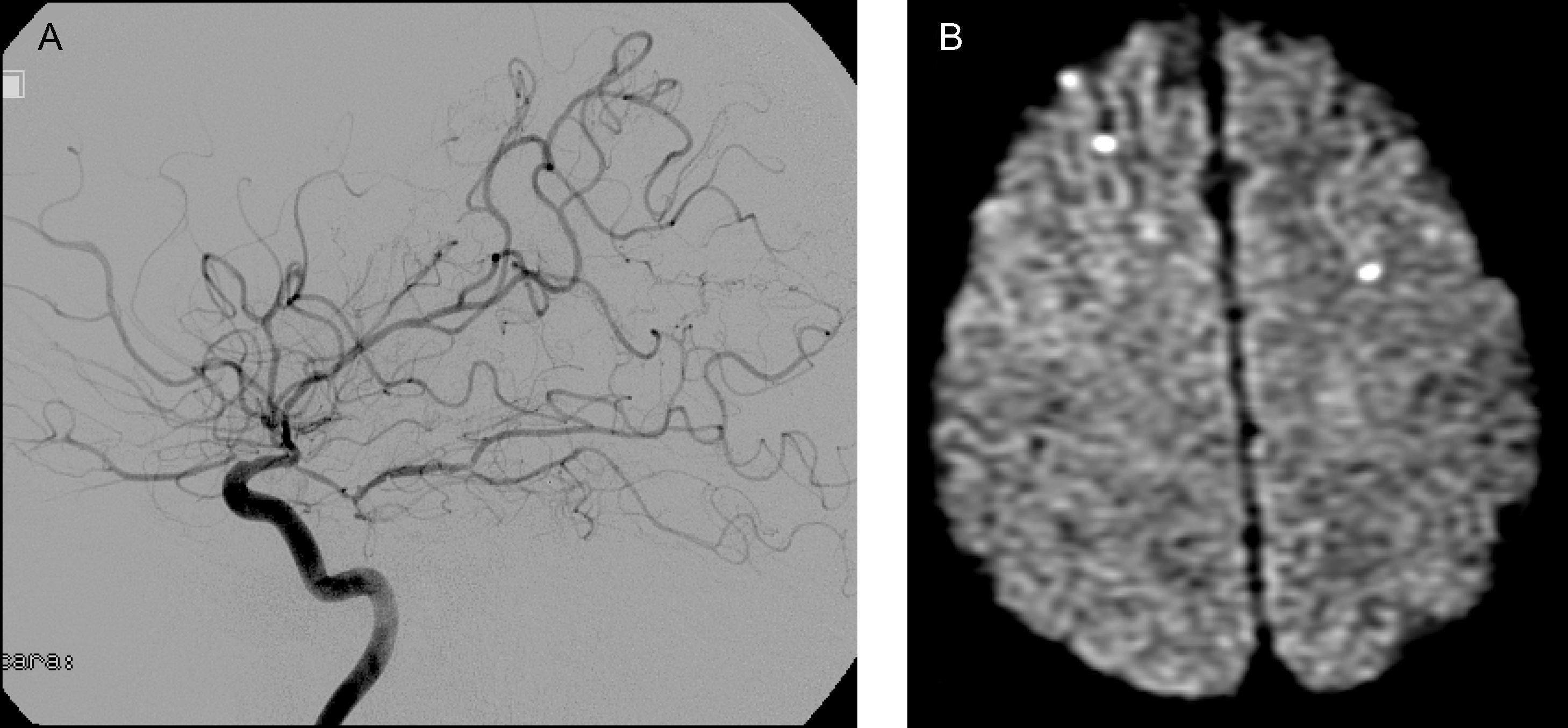
Caso 1Varón de 48 años con antecedentes de hipertensión arterial (HTA), obesidad y apneas del sueño. Residía en Ramallo, una ciudad ubicada en el noreste de la provincia de Buenos Aires, próxima a la costa del río Paraná. En abril y mayo de 2007, durante una crecida del río Paraná, trabajó en el arreo de ganado vacuno en las islas inundadas del Delta del Paraná. En mayo de 2007 presentó un síndrome febril agudo que motivó su ingreso en un hospital local; no se alcanzó un diagnóstico etiológico y no se indicó tratamiento antibiótico. Dos semanas más tarde, a comienzos de junio de 2007, agregó ictericia y cefalea, descrita como holocraneana, intensa, persistente, con fotofobia y sonofobia asociadas; estos síntomas se limitaron espontáneamente en alrededor de 4 semanas. La tomografía computarizada (TC) craneal no evidenció alteraciones relevantes; no se examinó el líquido cefalorraquídeo (LCR). El 26 de junio de 2007 presentó de forma súbita disartria y hemiparesia derecha. La TC mostró una lesión hipodensa en el brazo anterior y la rodilla de la cápsula interna derecha consistente con infarto (fig. 1 A); la ultrasonografía de los vasos del cuello reveló aterosclerosis de ambas arterias carótidas internas, sin estenosis luminal significativa. Se diagnosticó accidente cerebrovascular isquémico, a pesar de la discrepancia clínico-radiológica observada, y se indicó terapia antiplaquetaria con ácido acetilsalicílico 100 mg/ día. El 12 de agosto de 2007 presentó un nuevo evento clínico caracterizado por somnolencia, empeoramiento de la disartria y de la hemiparesia derecha. La TC mostró múltiples lesiones hipodensas consistentes con infartos en los ganglios de la base bilateralmente, la porción anterior del cuerpo calloso y la sustancia blanca subcortical de ambos lóbulos frontales (fig. 1 B y C); se diagnosticó ACV isquémico recurrente y se indicó clopidogrel 75mg/ día. El paciente fue admitido en nuestra institución el 4 de octubre de 2007. El examen físico de ingreso mostró disartria leve, hemiparesia facio-braquio-crural derecha de intensidad leve a moderada, espasticidad e hiperreflexia osteotendinosa en el miembro superior derecho, signos de Hoffmann y de Babinski derechos. La resonancia magnética (RM) craneal mostró múltiples lesiones isquémicas crónicas en la topografía descrita en la TC previa, no observándose infartos recientes en la secuencia ponderada en difusión (DWI). La angiografía por resonancia magnética (ARM) y la angiografía por cateterismo mostraron un estrechamiento generalizado y severo de las arterias de calibre grande y mediano de la circulación cerebral anterior y posterior, consistente con vasculitis (fig. 2 A). No se realizó biopsia cerebral. El laboratorio evidenció eritrocitosis (hematocrito 53%; hemoglobina 17,1g/ dl; hematíes 6.190.000/ mm3) como único hallazgo anormal. El examen de LCR mostró una presión de apertura de 10cm de H2O, aspecto cristal de roca, hiperproteinorraquia (52mg/ dl), hipoglucorraquia (12mg/ dl, relación glucorraquia/ glucemia 0,1) y pleocitosis linfocítica (leucocitos 16/ mm3, linfocitos 100%). Se identificaron anticuerpos antileptospiras en suero mediante el test de microaglutinación, mientras que los cultivos de sangre, orina y LCR fueron negativos. Se excluyeron otras posibles etiologías mediante métodos apropiados (tuberculosis, micosis, brucelosis, sífilis, VIH, hepatitis B y C, dengue, fiebre amarilla, rickettsiosis, enfermedades inmunológicas sistémicas). Se diagnosticó leptospirosis, con evolución clínica trifásica: la fase inicial con síndrome febril agudo, la segunda fase con ictericia y meningitis y la tercera fase con compromiso aislado y severo del sistema nervioso central (SNC) en forma de meningitis, vasculitis de grandes arterias intracraneales e infartos cerebrales múltiples. Se indicó tratamiento con ceftriaxona 2g cada 12 horas por vía intravenosa (IV) y metilprednisolona 1g día durante 5 días consecutivos IV. El día 2 se suspendió la ceftriaxona. El día 5 presentó deterioro del nivel de conciencia. La RM-DWI mostró múltiples lesiones isquémicas agudas localizadas en ambos lóbulos frontales y en el núcleo caudado izquierdo, en distribución de la arteria cerebral anterior (ACA) bilateralmente (fig. 2 B). Se repitió la punción lumbar obteniéndose un LCR normal (incoloro, límpido, proteínas 36mg/ dl, glucosa 105mg/ dl, relación glucorraquia/glucemia 0,73, leucocitos 1/ mm3). El electroencefalograma mostró actividad lenta generalizada, sin descargas epileptiformes. Se suspendió el corticosteroide y se reinició la ceftriaxona, completándose dos semanas de tratamiento. Evolucionó favorablemente, con recuperación del estado neurológico basal. En el seguimiento a tres años no ha presentado nuevos eventos clínicos significativos.
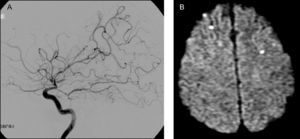
A. Angiografía por cateterismo de la arteria carótida interna (ACI) derecha, perfil. Estenosis de la porción terminal de ACI; estenosis y dilataciones multisegmentarias de las arterias cerebrales anterior (ACA), media (ACM) y posterior. Oclusión de múltiples ramas de ACA y ACM, con áreas avasculares. B. RM-DWI. Infartos recientes, corticales, en ambos lóbulos frontales.
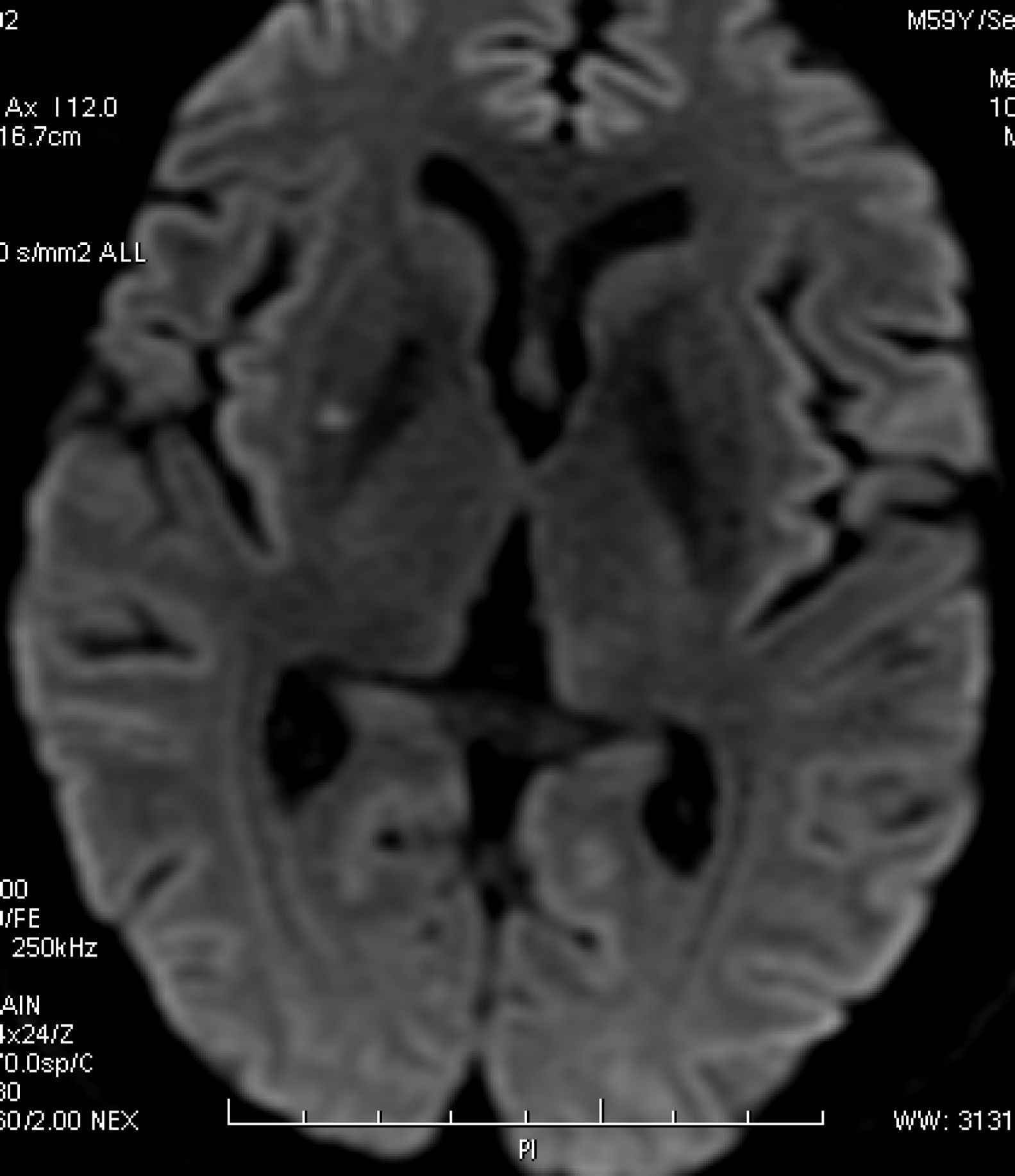
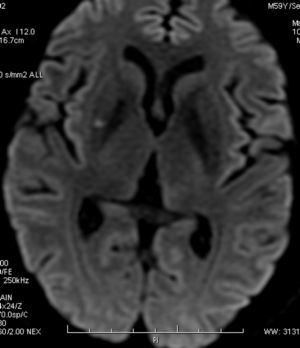
Varón de 59 años con antecedentes de HTA, hipercolesterolemia, tabaquismo, consumo excesivo de alcohol y conducta sexual promiscua. Residía en el área rural de 25 de mayo, una ciudad localizada en el centro de la provincia de Buenos Aires; trabajaba en actividades de agricultura y ganadería bovina. Su hábitat peridomiciliario incluía aves (gallinas, patos, palomas), perros y roedores; consumía ocasionalmente productos lácteos no pasteurizados. La semana previa a la admisión presentó fiebre (38-39°C) y cefalea, de distribución holocraneana, intensa, persistente. Ingresó en nuestra institución el 4 de marzo de 2010. El examen físico mostró rigidez de nuca leve. El laboratorio mostró leucocitosis (13.410/ mm3, neutrófilos 51%, linfocitos 31%, monocitos 15%), trombocitosis (563.000/ mm3), aumento de la eritrosedimentación (81mm) y alteración de la función hepática (aspartatoaminotransferasa 44 UI/ l, alanina-aminotransferasa 142 UI/ l, fosfatasa alcalina 478 UI/ l, gammaglutamil-transpeptidasa 409 UI/ l, bilirrubina total 0,56mg/ dl, bilirrubina directa 0,25mg/ dl). El examen del LCR mostró aumento de la presión de apertura (25cm de H2O), de la concentración de proteínas (90mg/ dl) y del recuento de leucocitos (75/ mm3, neutrófilos 50%, linfocitos 50%), mientras que el aspecto, el color y la concentración de glucosa fueron normales. La RM de encéfalo mostró un infarto en el núcleo lenticular derecho, en distribución de las arterias perforantes lenticuloestriadas laterales (fig. 3). La ARM y la angiografía por cateterismo de las arterias cerebrales fueron normales. La serología para leptospirosis, mediante inmunofluorescencia indirecta, mostró positividad de IgM e IgG. Los cultivos de sangre, orina y LCR fueron negativos. Se excluyeron otras posibles etiologías mediante métodos apropiados (VIH, sífilis, tuberculosis, micosis, brucelosis, listeriosis, Chlamydia psittaci, Coxiella burnetii, rickettsiosis, dengue, hepatitis B y C, herpes virus, enterovirus). Se diagnosticó leptospirosis con compromiso hepático y del SNC: meningitis aguda e infarto cerebral silente, de tipo lacunar, posiblemente debido a vasculitis de pequeñas arterias. Se indicó ceftriaxona 2g cada 12 horas IV durante una semana, seguida de doxiciclina 100mg cada 12 horas hasta completar dos semanas de tratamiento. La evolución clínica fue favorable, con recuperación completa. En el seguimiento a 10 meses no ha presentado nuevos eventos clínicos.
DiscusiónLa leptospirosis es una enfermedad infecciosa causada por espiroquetas del género Leptospira, de amplia distribución mundial, de importancia en medicina humana y veterinaria1,2.
Las leptospiras son bacterias gramnegativas, aerobias, móviles, aislables en medios de cultivo artificiales. Se distinguen dos especies principales: Leptospira biflexa, no patógena, de vida libre acuática, y Leptospira interrogans, patógena, cuyo ciclo biológico comprende diversos huéspedes animales, principalmente mamíferos, y transitoriamente el medio ambiente; en la última especie se han descrito 25 serogrupos y más de 250 serovares2.
La leptospirosis es una infección muy extendida entre diversos animales silvestres, domiciliarios y peridomiciliarios, como roedores, perros, bovinos, porcinos y equinos. Las leptospiras pueden permanecer viables por largo tiempo en los túbulos renales de los animales infectados, en particular de los roedores, su reservorio principal, desde donde son eliminadas con la orina al medio ambiente, pudiendo mantenerse viables en el suelo o en el agua durante semanas a meses. El hombre elimina leptospiras por la orina por un corto plazo, en pequeña cantidad y por lo general muertas, por lo que se considera un huésped accidental sin relevancia en la transmisión de la infección en la naturaleza3.
Los seres humanos adquieren la infección principalmente por el contacto con el agua o el suelo contaminados, aunque también por el contacto directo con los tejidos y órganos de los animales infectados. Las bacterias acceden a través de la piel, y en menor grado de las mucosas conjuntival, del tracto respiratorio y quizás del tracto digestivo4. El riesgo de adquirir la infección es mayor en los grupos expuestos por motivos profesionales como veterinarios, agrónomos, ganaderos, tamberos, peones rurales, matarifes, carniceros, trabajadores de arrozales, de la caña de azúcar y de alcantarillas, recolectores de basura, cirujas, mineros, pescadores de agua dulce y personal militar. Otra situación de exposición son las actividades recreativas en zonas contaminadas como deportes acuáticos y turismo1,3–6 La leptospirosis afecta predominantemente a varones jóvenes y de mediana edad, debido a su mayor participación en las actividades con riesgo profesional y recreativo1,4–6.
La leptospirosis humana es la zoonosis más ampliamente extendida en el mundo1,6. Afecta principalmente las regiones tropicales y subtropicales húmedas y en menor grado las regiones templadas. Se ha estimado una incidencia anual de 10-100/100.000 en las primeras y de 0.1-1/100.000 en las últimas; en situaciones epidémicas y en grupos de alto riesgo puede sobrepasar 100/100.0006. Se han registrado grandes epidemias en asociación con desastres naturales como inundaciones, tormentas tropicales y huracanes en el Caribe, América Central y del Sur y el sudeste de Asia7–10.
A pesar de la magnitud del problema la leptospirosis humana es poco reconocida y subdiagnosticada, lo que puede deberse, entre otros factores, a la escasa difusión de la enfermedad en la comunidad médica, a la heterogeneidad de las manifestaciones clínicas, a la complejidad de las pruebas de laboratorio requeridas para la confirmación diagnóstica, disponibles por lo general solo en laboratorios especializados y centros de referencia, y a la falta de sistemas de vigilancia epidemiológica apropiados en los países más afectados6,11.
En Argentina la leptospirosis humana ha sido descrita en medios urbanos y rurales y en la mayoría de las provincias, aunque afecta principalmente a la región de la Pampa húmeda, en particular a las provincias de Santa Fe, Entre Ríos y Buenos Aires, y al área metropolitana de la ciudad de Buenos Aires12–18. Su incidencia muestra una clara variación estacional, la cual es mayor en los primeros meses del año (verano y otoño), coincidiendo con la mayor intensidad de las lluvias12–18. Los brotes epidémicos más importantes ocurridos en Argentina en los últimos 10 años afectaron a la provincia de Santa Fe, en ambos casos asociados a inundaciones. En abril y mayo de 2003, durante la inundación de la ciudad de Santa Fe debido a la crecida del río Salado, se notificaron 419 casos confirmados, mientras que en abril de 2007, durante la inundación de varios departamentos de la provincia debida a la crecida del río Paraná, se registraron 87 casos confirmados15,16.
Desde el punto de vista clínico la leptospirosis humana se presenta con un espectro amplio e inespecífico de síntomas y signos. Es típico el curso evolutivo bifásico; después de un período de incubación de 5 a 14 días (rango: 2-30 días), la etapa inicial se manifiesta de forma abrupta, con fiebre, escalofríos, cefalea y mialgias. Menos frecuentemente se observan inyección conjuntival, dolor abdominal, náuseas, vómitos y diarrea. En esta fase, denominada temprana, anictérica, seudogripal o bacteriémica, es posible aislar leptospiras de la sangre y el LCR; al cabo de una semana, tras la aparición de los anticuerpos específicos de clase IgM e IgG, la enfermedad suele autolimitarse. Sin embargo, un grupo pequeño de pacientes, 5-15%, progresa a la segunda etapa, de mayor gravedad, caracterizada por la presencia, en combinación variable, de ictericia, insuficiencia renal, neumonía, meningitis, uveítis, miocarditis, trombocitopenia, hemorragias cutáneo-mucosas y viscerales, con una tasa de mortalidad del 5-40%4,5,9. La insuficiencia renal y la hemorragia pulmonar constituyen las dos causas de muerte más comunes17. En la segunda fase, denominada inmune, tardía, bacteriúrica o icterohemorrágica pueden aislarse leptospiras en orina, humor acuoso y muestras de tejido, aunque no en sangre y LCR, y el daño orgánico se considera mediado principalmente por fenómenos inmunológicos, como vasculitis y depósito de inmunocomplejos4,5 y citotóxicos18.
La meningitis aguda se observa en el 10-20% de los casos de leptospirosis humana y constituye la forma más frecuente de compromiso del sistema nervioso; la presentación clínica suele ser clásica, con fiebre, cefalea y rigidez de nuca, sin componente encefalítico asociado. El LCR es claro, con aumento de la concentración de proteínas, en el rango de 50 a 300mg/ dl y pleocitosis linfocítica, usualmente menor de 500 células/μl19. La concentración de glucosa por lo general es normal, aunque puede observarse hipoglucorraquia20. Debe enfatizarse que la meningitis puede ocurrir como la única manifestación de la fase inmune de la enfermedad, sin el compromiso de múltiples órganos típico de la leptospirosis icterohemorrágica grave, por lo que debe considerarse esta etiología en los pacientes con síndrome de meningitis aguda «aséptica» o «viral» en el contexto epidemiológico apropiado21.
Otras formas menos frecuentes de compromiso del sistema nervioso humano incluyen meningitis crónica22, encefalitis aguda20, encefalitis crónica23, ACV isquémico24, ACV hemorrágico25, trombosis venosa cerebral26, mielitis27, neuritis craneal, en particular parálisis facial bilateral28,29, mononeuritis múltiple30,31 y polineuritis símil síndrome de Guillain-Barré32.
Se han publicado muy pocos reportes de arteritis cerebral en humanos y en su totalidad provienen de países de Asia, principalmente de China33–41. En una serie de 12 pacientes con leptospirosis cerebrovascular el examen patológico evidenció inflamación transmural de las arterias intracraneales mayores en la base del encéfalo. En todos los casos las arterias carótidas internas mostraron estenosis u oclusión, y los infartos se localizaron en las áreas irrigadas por las arterias cerebrales medias y en territorios limítrofes40. Desde el punto de vista angiográfico puede observarse una arteriopatía de tipo moyamoya33,35,41.
Las manifestaciones clínicas de la leptospirosis humana son proteiformes e inespecíficas, por lo que el diagnóstico requiere un alto índice de sospecha basado en factores epidemiológicos y la confirmación mediante pruebas de laboratorio. Entre estas últimas, las de mayor utilidad clínica son las técnicas serológicas demostrativas de anticuerpos antileptospiras. El test de aglutinación microscópica (microscopic agglutination test [MAT]) constituye la prueba de referencia estándar, utiliza microorganismos vivos como antígenos y detecta anticuerpos (Ac) de tipo IgG e IgM, habitualmente entre 10 y 12 días del inicio de los síntomas. En sentido estricto la confirmación diagnóstica de leptospirosis aguda requiere dos muestras de suero, una de la fase aguda y otra de la fase de convalecencia, con demostración de la seroconversión o de un aumento significativo del título de Ac (≥ 4 veces), aunque un título elevado de Ac en una única muestra de suero en presencia de síntomas compatibles es una evidencia sólida de infección actual o reciente4,6. Se dispone de otras técnicas serológicas como enzimoinmunoanálisis, fijación de complemento, contrainmunoelectroforesis, aglutinación en látex, inmunofluorescencia indirecta y hemaglutinación indirecta6. Los cultivos son de menor utilidad clínica por la baja sensibilidad y la positividad tardía, debido al crecimiento lento y fastidioso de las leptospiras; los cultivos de sangre y LCR están indicados en la primera semana, mientras que el cultivo de orina debe obtenerse a partir de la segunda semana. En los últimos años se han desarrollados técnicas de reacción en cadena de la polimerasa (PCR), con resultados clínicos promisorios; el examen por PCR de sangre y LCR es muy útil durante la primera semana de la enfermedad, cuando el material genético de las leptospiras puede ser detectado previo al desarrollo de la respuesta inmune humoral del huésped. El examen por PCR de orina y humor acuoso puede ser positivo durante varias semanas en el primer material y durante varios meses en el último4. Un estudio reciente mostró la superioridad de la PCR de LCR en comparación con el MAT y con el cultivo de LCR en el diagnóstico de la meningitis leptospirósica42.
El diagnóstico diferencial de la leptospirosis humana es muy amplio e incluye dengue, fiebre amarilla, infección por hantavirus, otras fiebres hemorrágicas virales (incluyendo fiebre hemorrágica argentina causada por el virus Junín en el área endémica de la Pampa húmeda), rickettsiosis, brucelosis, triquinelosis, paludismo, fiebre tifoidea y otras fiebres entéricas, legionelosis, toxoplasmosis, mononucleosis infecciosa, primoinfección por VIH, influenza, pielonefritis, hepatitis viral, meningitis viral y fiebre de origen desconocido, entre otras condiciones6,16.
El tratamiento de la leptospirosis humana se basa en el uso de antibióticos y medidas de sostén adecuadas al estado clínico, por ejemplo diálisis en caso de insuficiencia renal. El tratamiento antibiótico debe ser iniciado precozmente ante la sospecha clínica, sin esperar la confirmación del laboratorio, preferentemente antes del quinto día de inicio de los síntomas; el beneficio de los antibióticos después del quinto día es controvertido, aunque la mayoría de los médicos los indican independientemente del tiempo de evolución6. Los casos leves pueden tratarse con agentes orales como doxiciclina 100mg/ 12 horas, amoxicilina 500mg/ 6 horas o ampicilina 500-750mg/ 6 horas, mientras que las formas moderadas o graves requieren la administración IV de penicilina G 1,5 millones de unidades/ 6 horas, ampicilina 0,5-1g/ 6 horas o ceftriaxona 1g/ día4–6. Debido a las dificultades conocidas en la penetración de fármacos a través de la barrera hematoencefálica43, los pacientes con meningitis y otras formas de infección del SNC pueden requerir dosis más elevadas de antibióticos, como las recomendadas en meningitis bacterianas, por ejemplo penicilina G 4 millones de unidades/ 4 horas, ampicilina 2g/ 4 horas o ceftriaxona 2g/ 12 horas44. Ocasionalmente puede ocurrir una reacción de Jarisch-Herxheimer asociada al uso de penicilina45.
El valor terapéutico de las intervenciones inmunomoduladoras en la fase inmune de la leptospirosis humana no está establecido46. En base a experiencias anecdóticas se ha propuesto el uso de corticosteroides, ciclofosfamida, plasmaféresis e inmunoglobulina IV en pacientes con uveítis47, hemorragia pulmonar48–50, arteritis cerebral51 y síndrome hepatorrenal con fallo multiorgánico52–54, aunque se carece de evidencias convincentes de eficacia y seguridad provenientes de ensayos clínicos controlados o de estudios observacionales de alta calidad que apoyen el uso generalizado.
En conclusión, la leptospirosis humana es una zoonosis de importancia epidemiológica a nivel global y en nuestro país, presente en medios urbanos y rurales, capaz de manifestarse con un espectro anatomoclínico amplio y variable, por lo que debe considerarse en el diagnóstico diferencial de diversos síndromes, entre ellos meningitis aguda y otras formas de afección del sistema nervioso, sobre todo en pacientes con antecedentes de exposición profesional o recreativa o residentes en áreas endémicas o durante inundaciones, ya que el diagnóstico temprano y el tratamiento antibiótico y de sostén apropiado reduce la morbimortalidad.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.
Al Dr. Marcelo del Castillo y a la Dra. Bibiana Vanasco, por la colaboración en la corrección del manuscrito.