La neuropatía óptica anterior isquémica no arterítica (NOAINA) es una enfermedad multifactorial. La cabeza del nervio óptico (NO) está irrigada por varias arterias terminales. El infarto del NO ocurre en la zona limítrofe entre los diferentes territorios. Esto puede ser precipitado por la disminución de la presión de perfusión, el aumento de la presión ocular o la disminución de la oxigenación de la sangre.
Materiales y métodosBuscar en forma retrospectiva en las historias clínicas la presencia de factores precipitantes en una cohorte de pacientes con diagnóstico de NOAINA desde 2003 hasta 2013.
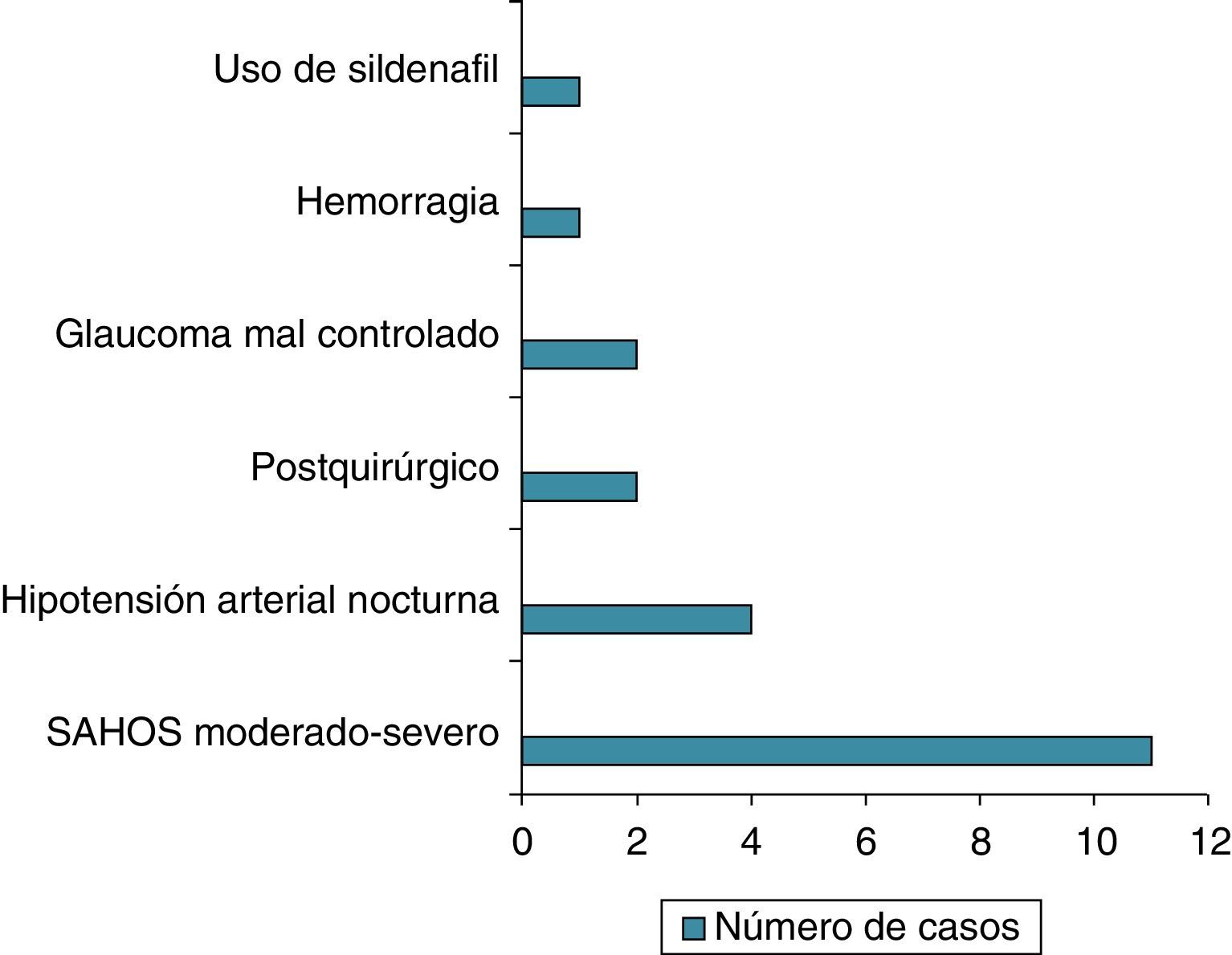
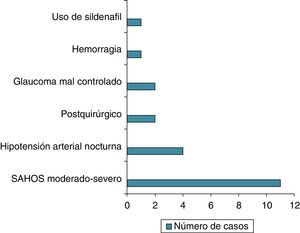
ResultadosCuarenta y seis pacientes cumplieron los criterios de NOAINA. En 21 pacientes se encontró un posible factor precipitante. Once pacientes de 23 que realizaron polisomnografía (48%) presentaron apneas del sueño en grado moderado-severo, 4 pacientes de 28 que realizaron monitorización ambulatoria de presión arterial de 24 h (14%) presentaron hipotensión nocturna sostenida, en 2 casos ocurrió durante la cirugía (columna lumbar y bypass coronario), en 2 pacientes con glaucoma mal controlado, un paciente durante una hemorragia, un caso coincidiendo con el uso de sildenafilo.
En nuestra cohorte, en el 45,6% de los casos se encontró un posible factor precipitante. Dado que nuestra serie fue retrospectiva, no todos los pacientes pudieron estudiarse adecuadamente, por lo que este porcentaje subestima la frecuencia real.
ConclusiónEn casi en la mitad de nuestra serie se halló una posible causa precipitante de NOAINA. Su evaluación sistemática permitirá reducir los riesgos para ambos ojos, en prevención primaria y secundaria.
Non-arteritic anterior ischemic optic neuropathy (NAAION) is a multifactorial disease. The source of the blood supply of the optic nerve head (ON) are terminal arteries so the infarct of the ON occurs in a watershed zone. This can be precipitated by: a decrease in the perfusion pressure, a rise in the intraocular pressure or low level of oxygen in blood.
Materials and methodsWe search in medicals charts precipitating factors in a retrospective cohort of patients with NAAION diagnose since 2003 to 2013.
Results46 patients fulfilled the diagnostic criteria of NAAION. In 21 cases were a precipitating factor. Eleven of 23 patients who underwent polysomnography (48%) present sleeps apneas in a moderate/severe grade, four of 28 who underwent 24-hour ambulatory blood pressure monitoring (14%) showed nocturnal arterial hypotension, two cases were postoperative (lumbar spine surgery and coronary bypass), two patients during a decompensation of glaucoma, one case as a bleeding complication and one case related with the use of sildenafil.
In 45.6% of the cases from our cohort we found a possible precipitating factor. We believe that this value underestimate the real frequency because only a few patients could underwent all the studies.
ConclusionWe found a possible precipitating factor of NAAION in almost a half of our serie. Their systematic evaluation may allow decrease the risk of both eyes in primary and secondary prevention.
Las neuropatías ópticas isquémicas representan una de las principales causas de pérdida visual en la población adulta. Según su localización, puede ser anterior o posterior; comprometiendo la primera la porción preliminar del nervio óptico (NO), mientras que la segunda, la porción retrolaminar. Según su etiología, puede ser secundaria a arteritis de células gigantes (arterítica) o deberse a otras causas (no arterítica). Las entidades se diferencian en la fisiopatogenia, la clínica, el manejo y la evolución1.
La neuropatía óptica anterior isquémica no arterítica (NOAINA) es una enfermedad multifactorial en la cual ciertas condiciones locales y sistémicas pueden actuar como factores precipitantes, sobre un terreno predisponente.
ObjetivoInvestigar en forma retrospectiva la presencia de factores precipitantes en una serie consecutiva de pacientes con NOAINA.
Materiales y métodosSe buscó en nuestra base de datos informatizada a pacientes con diagnóstico de NOAINA. La cohorte fue retrospectiva desde 2003 hasta 2013. Se utilizaron como criterios diagnósticos de NOAINA2 el comienzo brusco de una pérdida visual principalmente altitudinal y el fondo de ojo con edema de papila. A todos los pacientes se les realizó neuroimagen para descartar otras etiologías. Sobre esta población, se investigaron la presencia de factores precipitantes.
El diagnóstico de síndrome de apnea-hipopnea obstructiva de sueño (SAHOS)3 moderado-severo se basó en la presencia de 15 o más apneas/hipopneas por hora en la polisomnografía nocturna; índice de apnea-hipopnea (IAH) ≥ 15.
Se consideró diagnóstico de hipotensión nocturna sostenida cuando en la monitorización ambulatoria de la presión arterial se obtuvo patrón Dipper extremo4 (descenso de la presión arterial nocturna por debajo del 20% de los valores de vigilia).
Se consideró NOAINA asociada a cirugía o hemorragia cuando la pérdida visual ocurrió dentro de las 24 h de las mismas. En el caso de NOAINA relacionada a sildenafilo, cuando fue ingerido dentro de las 12 h de comenzado el cuadro visual.
ResultadosCuarenta y seis pacientes cumplieron los criterios de inclusión, 28 varones y 18 mujeres (rango: 45 a 88 años). En 21 pacientes (45,6%) se encontró un posible factor precipitante. En 11 pacientes de 23 que realizaron polisomnografía (48%) se encontró SAHOS moderado-severo. En 4 pacientes de 28 que realizaron monitorización ambulatoria de presión arterial (14,2%) presentaron hipotensión nocturna sostenida. Dos casos ocurrieron durante una cirugía (columna lumbar y bypass coronario), en 2 pacientes en el contexto de glaucoma mal controlado. En un paciente ocurrió durante una hemorragia y otro caso coincidió con el uso de sildenafilo (fig. 1).
El SAHOS fue el factor precipitante más frecuentemente encontrado en nuestra serie.
En nuestra cohorte, en el 45,6% de los casos se encontró un posible factor precipitante. Dado que nuestra serie fue retrospectiva, no todos los pacientes pudieron estudiarse adecuadamente, por lo que este porcentaje subestima la frecuencia real.
DiscusiónLa NOAINA es la neuropatía óptica aguda más frecuente entre los adultos mayores a 50 años. Más del 80% de los eventos se presentan durante el sueño. Los pacientes notan el defecto al despertar a la mañana o de una siesta. Usualmente cursa sin dolor. El defecto visual usualmente severo e irreversible y puede progresar en días o semanas1. Los hallazgos clínicos incluyen defectos campimétricos típicamente altitudinal inferior a predominio nasal, defecto pupilar aferente relativo y edema papilar.
La NOAINA es una enfermedad multifactorial en la cual ciertas condiciones sistémicas y locales crean un terreno predisponente en el cual, finalmente, actúan factores precipitantes que funcionan como insulto final que provocan el evento isquémico agudo1,5,6.
Dentro de los factores predisponentes, mencionamos a la irrigación terminal y la relación copa/disco pequeña.
La cabeza del NO está irrigada por el anillo anastomótico de Zinn-Haller, que está formado por ramos terminales de la arteria ciliar posterior y por ramos coroideos peripapilares. El infarto del NO ocurre en la zona limítrofe entre los diferentes territorios, cuando se exceden los mecanismos compensatorios de cambios en los calibres de las arteriolas para mantener el flujo sanguíneo constante. A su vez, la edad, la hipertensión arterial, la diabetes mellitus, la ateroesclerosis y la hipercolesterolemia pueden disminuir la eficiencia de la autorregulación del flujo de la cabeza del NO. El infarto de la zona más vulnerable se traduce a nivel campimétrico con el defecto típico altitudinal inferior a predominio nasal1.
La relación copa/disco óptico es normalmente de 1/3. Depende del diámetro del canal escleral. En los nervios ópticos con copa estrecha (llamados «disco en riesgo»), los axones se encuentran apretados en el canal escleral estrecho, lo que los hacen vulnerables a insultos isquémicos.
Los factores precipitantes son aquellas situaciones que produzcan disminución de la oxigenación de la cabeza del NO.
En el ojo, la presión de perfusión es igual a la diferencia entre la presión arterial media (PAM) y la presión intraocular (PIO).
Por ende, se producirá una disminución en la oxigenación de la cabeza del NO cuando ocurra disminución de la presión de perfusión provocadas por disminución de la PAM (hipotensión arterial, hemorragias) o aumento de la PIO (glaucoma agudo, compresión ocular), o disminución del porcentaje de saturación de oxihemoglobina (apneas, anemia)1,6.
Utilizando modelos de primates de NOAINA (que poseen limitaciones anatómicas), se observó que después de la isquemia se genera un edema agudo por la rotura de barrera hematoencefálica y hematorretinal. Existe un traumatismo mecánico axonal como resultado de un síndrome compartimental causado por el edema y existe también reperfusión postinfarto e inflamación7.
Pasamos a detallar la relación de NOAINA con los factores precipitantes mencionados.
En 1998, Mojon et al. fueron los primeros en indicar una asociación entre NOAINA y SAHOS. En 2002 realizaron polisomnografía a 17 pacientes con NOAINA y a 17 pacientes controles apareados. Doce (71%) de 17 pacientes con NOAINA tenía SAHOS comparado con solo 3 (18%) de los controles (p<0,001)8. En este estudio, ellos usaron el índice de disturbio respiratorio (IDR)>10 como criterio diagnóstico de SAHOS. Sin embargo, IDR incluye trastornos respiratorios que no están incluidos en la definición de apnea o hipopnea. Palombi et al. examinaron a 27 pacientes con diagnóstico reciente de NOAINA. En todos se realizó polisomnografía y 24 (89%) presentaron SAHOS definido por un IAH ≥ 15. La risk ratio fue de 4,9 en pacientes con SAHOS comparado con la población general (p<0,001). SAHOS fue 1,5 a 2 más frecuente que hipertensión o diabetes, los factores de riesgo más comúnmente citados9. Más recientemente, Bilgin et al. proponen que el punto de corte para el diagnóstico de SAHOS en relación con NOAINA debe ser IAH ≥ 20 para reducir los falsos positivos y proveer un prevalencia más exacta. En su trabajo, 15 de 27 pacientes (55,6%) con NOAINA y 6 de 27 controles (22,2%) tenía SAHOS (p<0,05)10. Se propone que SAHOS produce patología ocular (NOAINA, glaucoma, papiledema) por hipoxia directa y afectación de los mecanismos regulatorios vasculares oculares por hipertensión, disfunción autonómica e lesión endotelial11,12. Con respecto al tratamiento específico, se considera que no hay evidencia suficiente actualmente para afirmar que el tratamiento con CPAP disminuye el riesgo aumentado que existe en los pacientes con SAHOS de presentar NOAINA13.
Con respecto a la PAM, normalmente existen variaciones circadianas de la misma. Por la noche, disminuye hasta un 10% la PAM de forma fisiológica. En cambio, se considera hipotensión arterial nocturna extrema a una disminución mayor al 20%. Hayreh et al. realizaron monitorización de presión ambulatoria de 166 pacientes con trastornos de la cabeza del NO (NOAINA, glaucoma normotensivo, glaucoma de ángulo abierto y otros). Los pacientes con NOAINA presentaron una diferencia significativa de presión diastólica media14. Esto es particularmente relevante para los pacientes hipertensos que se encuentran medicados con antihipertensivos con dosis nocturna. La hipertensión crónica disminuye la eficiencia de la autorregulación del flujo por hipertrofia de la capa media de las arteriolas de resistencia.
Con respecto a los casos posquirúrgicos, las neuropatías ópticas perioperatorias son raras pero son una complicación devastadora. La mayoría de los casos posquirúrgicos son bilaterales y simultáneos; y, con pobre recuperación15. Battu et al. realizaron un estudio prospectivo de casos asociados a cirugía de bypass coronario sin requerimiento de bomba extracorpórea. Todos los pacientes (4 casos) presentaron un descenso estadísticamente significativo del hematocrito (p<0,039) y de la PAM (p<0,018) intra y postoperatorio comparado con los valores preoperatorios. Ellos proponen una consulta oftalmológica previa a la cirugía en aquellos pacientes en riesgo con el objetivo de encontrar factores de riesgo locales adicionales (relación copa/disco pequeña o cambios arterioescleróticos severos en las arteriolas de la retina). Se debería explicar el riesgo de pérdida visual poscirugía de bypass en este grupo de pacientes16.
En el caso de las cirugías de columna, si bien la neuropatía óptica isquémica posterior es la frecuentemente asociada, la NOAINA puede ocurrir15. La posición en decúbito supino es un factor que aumente la PIO. La sociedad Americana de Anestesiología publicó unas guías para el correcto manejo de la pérdida visual en pacientes que se someten a cirugía de columna17. Se recomiendan optimizar los niveles de hemoglobina, la compensación hemodinámica y la saturación de oxígeno, así como evitar el excesivo reemplazo de fluidos y la presión elevada sobre la órbita17,18.
Asimismo, la cirugía de cataratas es considerada un factor precipitante de NOAINA y en oportunidades en compromiso bilateral19. También la cirugía general puede asociarse a este tipo de manifestaciones oculares20.
En lo que respecta a la NOAINA posterior a glaucoma agudo, se han descrito casos posteriores a una semana de una crisis de glaucoma primario de ángulo cerrado (GPAC)21. Se cree que es el tiempo que lleva que el insulto termine de realizar los cambios fisiopatogénicos descritos por Hayreh1,5,6 hasta la manifestación clínica de NOAINA22. Cuando se produce NOAINA secundaria a GPAC, se recomienda no solo control de factores de riesgo generales, sino también considerar una iridotomía periférica láser en el ojo contralateral, sobre todo si posee relación copa/disco pequeña22.
Existen ciertos fármacos que pueden predisponer a NOAINA. Cabe mencionar, por su uso frecuente, el sildenafilo23. El mecanismo es doble. Por un lado, provoca hipotensión arterial. Kim et al. han demostrado una reducción de la perfusión arterial coroidea en 7 voluntarios sanos a las 2 h de la ingesta24. Por otro lado, inhibe la enzima fosfodiesterasa 5, que se encuentra involucrada en los fenómenos de fototransducción en la retina23,25-28. La última cita, de Campbell et al., corresponde a un extenso trabajo de 102 centros oftalmológicos de EE. UU. y Europa que analizan si el uso intermitente de inhibidores de la enzima fosfodiesterasa 5 facilita la aparición de NOAINA. Sobre la base de los resultados, se estima que el uso semanal de sildenafilo y similares suma 3 casos de NOAINA por cada 100.000 hombres mayores de 50 años en cada año.
Cabe mencionar que las vacunaciones reiteradas contra la influenza y para prevenir la infección por neumococo pueden considerarse factores que predisponen a NOAINA29-31; si bien en nuestra serie no hemos encontrado ningún caso posvacunal.
Hace menos de una década, hay autores que impulsan que los pacientes con NOAINA comienzan con un edema de papila asintomático, pero en esta etapa es difícil de evaluar, a menos que aparezca algún defecto campimétrico leve que lleve a la consulta. A este cuadro se lo ha denominado incipiente32. En estas formas prodrómicas pueden adoptarse prevenciones para evitar la progresión a la forma clásica completa: implementar la cesación de medicaciones que pueden provocar hipotensión nocturna, disminuir la presión ocular si está elevada, corregir el SAHOS, interrumpir la utilización de sildenafilo y otros similares, evitar repeticiones de vacunas y normalizar otros factores de riesgo vascular. Asimismo, como se ha mencionado anteriormente, tomar precauciones intra y posquirúrgicas. Más discutido es el papel de la CPAP en la prevención de NOAINA.
En nuestra cohorte, en el 45,6% de los casos se encontró un posible factor precipitante. Dado que nuestra serie fue retrospectiva, no todos los pacientes pudieron estudiarse adecuadamente, por lo que este porcentaje subestima la frecuencia real.
El SAHOS fue el factor precipitante más frecuentemente encontrado en nuestra serie, seguido de la hipotensión nocturna extrema sostenida.
Como en varios reportes, se estima que el riesgo de desarrollar NOAINA en el ojo contralateral al ojo afectado es de aproximadamente el 25% a los 5 años; consideramos que encontrar factores precipitantes podría permitir modificar ciertas circunstancias negativas, como las descritas en la discusión, lo que permitiría reducir riesgos y evitar la afectación visual bilateral.
ConclusiónCasi en la mitad de nuestra serie se halló una posible causa precipitante de NOAINA. Consideramos que su evaluación sistemática permitirá diagnosticar posibles factores causales y reducir riesgos para ambos ojos, en prevención primaria y secundaria.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores no declaran conflictos de intereses.