El manejo de la esclerosis múltiple (EM) ha evolucionado significativamente con la disponibilidad de terapias de alta eficacia (TAE). En 2023, neurólogos argentinos expertos evaluaron estrategias de tratamiento, y ante nueva evidencia de vida real y cambios en el sistema de salud, se reanalizaron los patrones de uso.
ObjetivoEvaluar cambios en la utilización de TAE durante dos años y ofrecer recomendaciones para distintos escenarios clínicos (actividad, progresión y efectos adversos).
MétodosSe reencuestó a los mismos 18 especialistas del estudio inicial (2023) usando el mismo cuestionario. Se compararon respuestas previas, considerando consenso ≥60% de acuerdo. Las terapias se evaluaron por eficacia y seguridad, sin considerar costos.
ResultadosHubo consenso unánime en clasificar como TAE a alemtuzumab, natalizumab, ocrelizumab, ofatumumab y cladribina, excluyendo moduladores S1P (83%).
Hallazgos principales Mayor preferencia por TAE como primera línea, incluso en pacientes con buen pronóstico (reducción del 67% al 23% en uso de terapias de baja eficacia; p<0,05). Dominancia de anti-CD20 (ocrelizumab/ofatumumab) como opción preferida en escalamiento terapéutico y falla a cladribina. Disminución significativa de alemtuzumab tras falla a otras terapias (72% a 44%; p<0,05). No hubo consenso post-natalizumab, aunque anti-CD20 fue la opción más elegida (56%).
ConclusionesSe evidencia un cambio hacia el uso temprano de TAE en Argentina, impulsado por evidencia clínica y experiencia. Los anti-CD20 son ahora la principal estrategia, mientras que alemtuzumab ha reducido su papel. Estos resultados destacan la necesidad de enfoques personalizados en EM.
The management of multiple sclerosis (MS) has evolved significantly with the availability of high-efficacy therapies (HETs). In 2023, Argentine neurologists evaluated treatment strategies, and given new real-world evidence and healthcare system changes, utilization patterns were reanalyzed.
ObjectiveTo assess changes in HET utilization over two years and provide recommendations for different clinical scenarios (disease activity, progression, and adverse events).
MethodsThe same 18 specialists from the initial 2023 study were re-surveyed using the original questionnaire. Previous responses were compared, with consensus defined as ≥60% agreement. Therapies were evaluated based on efficacy and safety, excluding cost considerations.
ResultsUnanimous consensus classified alemtuzumab, natalizumab, ocrelizumab, ofatumumab, and cladribine as HETs, while excluding S1P modulators (83%).
Key findings Increased preference for HETs as first-line treatment, even in patients with favorable prognosis (67% to 23% reduction in low-efficacy therapy use; P<.05). Dominance of anti-CD20 agents (ocrelizumab/ofatumumab) as preferred options for treatment escalation and cladribine failure. Significant decline in alemtuzumab use following other therapy failures (72% to 44%; P<.05). No consensus on post-natalizumab strategies, though anti-CD20 was most selected (56%).
ConclusionsThe study demonstrates a paradigm shift toward early HET use in Argentina, driven by clinical evidence and expert experience. Anti-CD20 agents have become the primary strategy, while alemtuzumab's role has diminished. These findings highlight the need for personalized treatment approaches in MS.
A principios de 2023, un grupo de neurólogos argentinos con experiencia en el manejo de pacientes con esclerosis múltiple (EM) fue convocado para debatir e intentar responder a algunos de los interrogantes que surgen en la toma de decisiones al momento de indicar terapias de alta eficacia (TAE)1.
En los últimos dos años se ha incrementado notablemente la cantidad de artículos publicados sobre el uso de estas terapias, fundamentalmente a partir de estudios de vida real. Si a esta nueva información se suma la experiencia propia adquirida por los especialistas y los cambios en los modelos de prestación médica por parte de los seguros de salud en Argentina, podría esperarse un cambio en los patrones de utilización de las TAE, aun en un período tan corto como dos años.
Por esta razón, se reunió nuevamente al mismo grupo de profesionales para evaluar eventuales cambios en las estrategias de manejo de las TAE.
Objetivos- 1.
Presentar a los médicos tratantes las opciones que un grupo de expertos en el cuidado de pacientes con EM considera válidas para el uso de TAE en diferentes escenarios, incluyendo la actividad de la enfermedad, la progresión de la discapacidad, la presencia de factores de mal pronóstico o los efectos adversos bajo tratamiento.
- 2.
Identificar los posibles cambios en los modelos de utilización de estas terapias en un período de dos años.
Se convocó a los mismos 18 especialistas que participaron en la primera publicación (Foro Argentino de Líderes de Opinión) y se replicó el cuestionario original1. Los encuestados no tuvieron acceso a sus respuestas previas ni a las de los otros especialistas participantes.
Se realizó una única ronda de preguntas que fueron respondidas de manera individual. Si más del 60% de los participantes coincidía en una respuesta, esta se consideraba una recomendación válida. Considerando este estudio como una continuación del anterior, no se realizó una segunda ronda de discusión ni un encuentro plenario, tomando como referencia la reunión sincrónica para discusión de definiciones realizada en el estudio original.
Las respuestas obtenidas se compararon con las de la primera publicación. Para comparar proporciones entre grupos, se utilizó la prueba de chi cuadrado. Cuando los valores fueron menores a5, se aplicó el test exacto de Fisher, considerándose una diferencia estadísticamente significativa para valores de p<0,05.
Al igual que en la publicación inicial, este documento no pretende constituir un consenso formal ni una guía de práctica clínica, sino proporcionar respuestas a interrogantes frecuentes en la práctica clínica. El nivel de evidencia de estos comentarios corresponde al de opinión de expertos.
Se mantuvieron las definiciones de actividad y progresión de la enfermedad, factores pronósticos y falla terapéutica utilizadas en el primer estudio. En la tabla 1 se presentan las definiciones operativas consideradas.
Definiciones operativas
| Actividad. Recaídas, nuevas lesiones que captan contraste o en T2, o aumento de tamaño de lesiones T2 (definido por Consenso Argentino de Falla Terapéutica)2. |
| Progresión. Empeoramiento sostenido del EDSS (durante al menos 6 meses) en 2 puntos si EDSS menor a 5,5, en 0,5 puntos si EDSS mayor o igual a 5,5 (definido por Consenso Argentino de Falla Terapéutica)2. |
| Factores de mal pronóstico. Edad mayor de 40, sexo masculino, lesiones medulares, bandas oligoclonales en LCR patrón2, ataques multifocales que incluyen afectación motora, cerebelosa, esfinteriana; alta frecuencia de las recaídas en los primeros 2-5años, severidad de las recaídas, déficit residual luego de recaídas, recaídas que requieren internación o esteroides, afroamericanos-afrolatinoamericanos, inicio progresivo, corto tiempo para llegar a EDSS3 (antes de los 5años), alta carga lesional T2 al inicio, más de dos lesiones con realce al inicio, presencia de agujeros negros, atrofia discernible temprana, alta carga lesional infratentorial, comorbilidades (obesidad, tabaquismo, hipovitaminosisD), intervalo corto entre la primera y la segunda recaídas, EDSS alto al momento del diagnóstico, déficit cognitivo temprano, afinamiento de capa de fibras nerviosas de la retina en tomografía de coherencia óptica3-5. |
EDSS: escala de discapacidad expandida; LCR: líquido cefalorraquídeo.
Para la discusión, solo se tuvieron en cuenta los perfiles de eficacia y seguridad de las TAE, sin considerar el costo ni la accesibilidad a los tratamientos. Se destaca la importancia de evaluar individualmente las características de cada paciente al momento de elegir una terapia.
ResultadosEn ausencia de criterios definidos y validados internacionalmente sobre cuáles deben ser consideradas TAE, por votación el 100% de los participantes del panel acordó que alemtuzumab, natalizumab, ocrelizumab, ofatumumab y cladribina pueden considerarse TAE. En cuanto a los moduladores S1P, el 83% del panel consideró que no cumplen con los criterios para ser clasificados como TAE.
Indicaciones de TAELas opciones consideradas por los especialistas del foro se presentan en la figura 1. Se plantearon tres escenarios para sus correspondientes enfoques terapéuticos. El primero, la indicación de TAE como tercera opción luego de haber usado una terapia de baja eficacia seguida de una de moderada eficacia (escalamiento en pirámide clásica); el segundo, la indicación de TAE luego de falla terapéutica a una terapia de baja eficacia (pirámide empinada). El tercer escenario plantea la posibilidad de iniciar el tratamiento con TAE en pacientes naïve, con factores de buen o mal pronóstico y de baja o alta actividad a nivel basal. En el análisis comparativo de los distintos enfoques terapéuticos se encontró un mayor acuerdo en el uso de anticuerpos monoclonales anti-CD20 (ofatumumab y ocrelizumab).
Alemtuzumab dejó de estar en consideración (opción debajo del 60%) como alternativa en las estrategias de escalamiento. En la pirámide clásica, su elección disminuyó del 72% al 44%, y en la pirámide empinada, del 61% al 22% (p<0,05).
En la estrategia de pirámide invertida (inicio con una TAE en pacientes naïve), cladribina fue la opción más consensuada en pacientes con buen pronóstico basal. En comparación con la publicación de 2022, se observó una reducción en el uso de terapias de baja eficacia en pacientes con buen pronóstico y baja actividad de la enfermedad (67% a 23%; p<0,05). También se redujo la consideración de natalizumab en pacientes con factores de mal pronóstico y baja actividad (67% a 39%; p<0,05) y de alemtuzumab en pacientes con mal pronóstico y alta actividad (78% a 33%; p<0,05). Con excepción del escenario de debut con factores de buen pronóstico y baja actividad, en el resto de los escenarios el 100% consideró adecuado comenzar el tratamiento con una TAE.
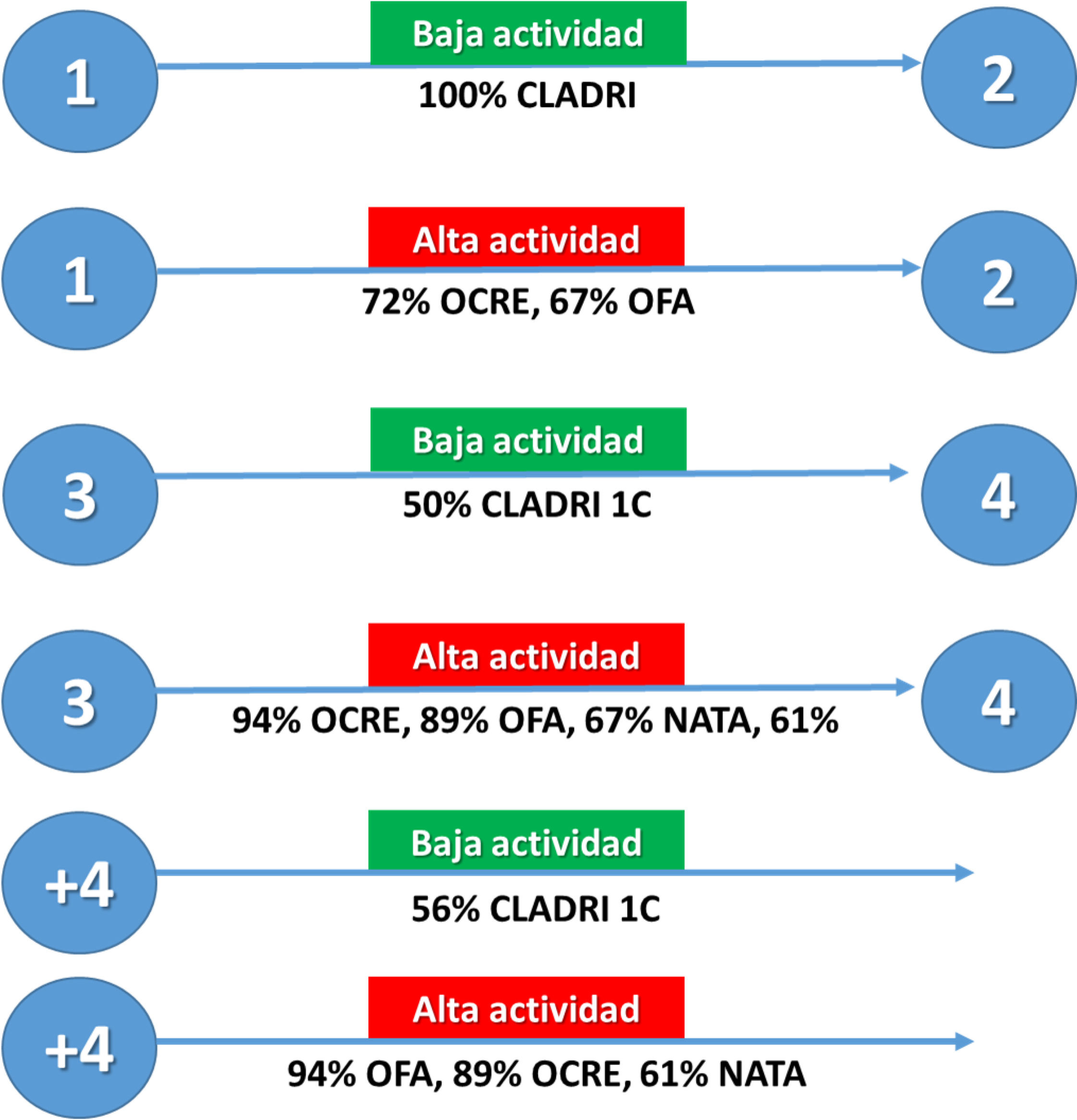
Estrategias en el uso de cladribinaEn pacientes tratados con cladribina, se evaluaron las opciones terapéuticas en caso de actividad entre los ciclos1 y2, entre los años3 y4 postratamiento y luego de cuatro años. En la figura 2 se presentan las alternativas consideradas válidas.
Alternativas de tratamiento en pacientes con actividad de la enfermedad durante y después del tratamiento. Los círculos azules muestran el año de tratamiento. Se muestran las opciones que considerarían los miembros del foro en caso de aparecer actividad en los períodos correspondientes.
ALEM: alemtuzumab; CLADRI: cladribina; NATA: natalizumab; OCRE: ocrelizumab; OFA: ofatumumab; TAE: terapias de alta eficacia; 1C: 1 ciclo.
En cuanto a la estrategia ante actividad baja en los años3 y4, y luego del año4, no se encontró uniformidad de criterios de manejo. Para casos de alta actividad en cualquier momento del tratamiento, los anticuerpos anti-CD20 fueron los preferidos, mientras que alemtuzumab dejó de ser considerado en pacientes con falla a cladribina.
Si el paciente presenta una infección oportunista severa tras el primer ciclo, no hubo concordancia en la terapia a elegir. La opción más votada fue ofatumumab, pero sin acuerdo (50%). Si el paciente presenta progresión de la discapacidad sin actividad tras dos ciclos de cladribina, el 89% consideró válido iniciar tratamiento con ocrelizumab.
Anticuerpos anti-CD20En la tabla 2 se presentan las opciones consideradas válidas en distintos escenarios para ocrelizumab y ofatumumab. No se hallaron diferencias significativas respecto a la edición anterior del foro. Ocrelizumab es percibido con una mayor capacidad para controlar la progresión independiente de recaídas, aunque sin significancia estadística. A pesar de compartir mecanismo de acción, y de haber mostrado eficacia y seguridad similares en los estudios pivotales6,7, ambas terapias no fueron consideradas como idénticas tanto para determinar su lugar en las indicaciones como en las conductas tomadas una vez iniciado el tratamiento.
Comparación en estrategias consideradas como válidas en diferentes escenarios para terapias anti-CD20 aprobadas
| Ocrelizumab | Ofatumumab | |
|---|---|---|
| Actividad menor o similar a pretratamiento | 67% mantener ocrelizumab | 61% mantener ofatumumab |
| Actividad mayor a pretratamiento | 89% cambiar a natalizumab72% cambiar a alemtuzumab | 83% cambiar a natalizumab61% cambiar a alemtuzumab |
| Infección oportunista severa (no LMP) | 61% cambiar a natalizumab | 67% cambiar a natalizumab61% cambiar a cladribina |
| Progresión del EDSS sin actividad | 56% mantener ocrelizumab (sin acuerdo) | 50% cambiar a ocrelizumab (sin acuerdo) |
| No evidencia de actividad de la enfermedad por más de 2años | 67% mantener ocrelizumab | 67% mantener ofatumumab |
| Reacciones severas de infusión | 78% cambiar a ofatumumab | − |
Los porcentajes expresan la proporción de miembros del foro que consideraría válida cada alternativa (solo se incluyen valores mayores a 60%).
EDSS: escala de discapacidad expandida; LMP: leucoencefalopatía multifocal progresiva.
En la actualidad, rituximab no está aprobado por la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) para el tratamiento de la EM. Sin embargo, diversos estudios prospectivos en vida real y ensayos abiertos han mostrado cierto beneficio en fenotipos con recaídas y en formas primarias progresivas8-10. Su uso podría considerarse solo cuando no se dispone de otras alternativas de alta eficacia o mientras se espera la provisión de otra TAE. El 100% de los especialistas lo consideró una opción en formas con recaídas, y el 83% en la forma primaria progresiva.
NatalizumabNo hubo acuerdo respecto a qué terapia indicar en caso de actividad similar o menor a la del pretratamiento en pacientes tratados con natalizumab. La opción más elegida fue ofatumumab u ocrelizumab (56%). En caso de actividad mayor a la del pretratamiento, las opciones consideradas fueron alemtuzumab y ocrelizumab (67%), seguido de ofatumumab (61%). Tampoco hubo acuerdo sobre los criterios para el uso de dosis extendida en cualquier escenario.
El 83% de los especialistas consideraría un cambio de terapia si el riesgo de leucoencefalopatía multifocal progresiva supera 1/1.000 (sin cambios respecto a 2023), siendo ofatumumab (100%) y ocrelizumab (96%) las opciones más elegidas. En caso de progresión sostenida de la escala de discapacidad expandida (EDSS) sin actividad, el 89% consideraría el cambio a ocrelizumab, lo que representaría una indicación off-label.
AlemtuzumabAlemtuzumab es la terapia que sufrió mayores cambios en su consideración dentro de las estrategias terapéuticas, quedando su indicación limitada a la falla terapéutica de anti-CD20 y natalizumab.
En pacientes que recibieron el primer ciclo y persisten con actividad, el 94% continuaría con el segundo ciclo si la actividad es similar o menor a la del pretratamiento, y el 55% si es mayor. Si la actividad persiste tras el segundo ciclo, el 83% optaría por un tercer ciclo si la actividad es similar o menor a la inicial, mientras que el 61% cambiaría a ocrelizumab si la actividad es mayor.
Si el paciente presentara una infección oportunista severa tras el primer ciclo, el 61% consideraría válido rotar a natalizumab u ofatumumab. En caso de reacciones severas de infusión, el 89% optaría por ofatumumab y el 67% por natalizumab. Si el paciente presentara progresión sostenida de la discapacidad sin actividad tras el segundo ciclo, el 78% recomendaría ocrelizumab.
Alemtuzumab requiere monitoreo mensual de laboratorio durante cuatro años tras la infusión11. La discontinuación del monitoreo domiciliario en Argentina en 2023 llevó al 44% de los especialistas a limitar sus indicaciones, y al 22% a no considerarlo como alternativa terapéutica, posiblemente agregado a la descripción de nuevas alertas de seguridad publicadas12.
Comentarios finalesDos años después de la primera publicación, este trabajo destaca el carácter dinámico de la prescripción de TAE en Argentina. Los cambios más relevantes incluyen:
- 1.
Mayor preferencia por cladribina en pacientes con factores de buen pronóstico basal, con marcada reducción en la consideración de terapias de baja eficacia como primera opción de tratamiento independientemente de las características basales del paciente.
- 2.
Preferencia por el uso de TAE como terapia de inicio independientemente de los factores pronósticos y actividad basal de la enfermedad, potencialmente influenciada por la experiencia acumulada en el uso de estas terapias y por la evidencia creciente de los beneficios de la adopción de la estrategia de pirámide invertida13-15.
- 3.
Predominio de los anticuerpos anti-CD20 como estrategia de cambio ante falla terapéutica de cualquier terapia previa.
- 4.
Marcado descenso en la consideración de alemtuzumab en distintos escenarios.
Este trabajo pretende servir como orientación para los médicos tratantes, reflejando las decisiones de 18 neurólogos referentes del ámbito público y privado en Argentina. Se enfatiza la importancia de una terapia individualizada que contemple la actividad de la enfermedad, el sistema de salud y las preferencias del paciente.
FinanciaciónEste estudio no contó con financiación ni apoyo externo.
Conflicto de interesesAB ha recibido honorarios y becas por asesoramiento, capacitación e investigación de Novartis, Sanofi, Roche, Teva, Biogen, Merck, Synthon-Bagó y AstraZeneca. JC en los últimos años ha recibido compensación económica por presentaciones académicas, participación en consejos de asesoramiento, y asistencia para concurrencia a congresos de Biogen, Merck, Novartis, Roche, Bayer, Sanofi-Genzyme, Gador, Raffo, Bristol Myers Squibb, Janssen. RA: retribución económica por el desarrollo de actividades educativas, científicas, asesoría, ensayos clínicos y/o becas de viajes a congresos de las siguientes compañías farmacéuticas: Biogen, Genzyme, Merck, Novartis, Scienza Uruguay, Bristol Myers Squibb, Janssen y Roche, apoyo económico para investigación de LACTRIMS y Gobierno de la Ciudad de Buenos Aires. MB: Biogen, Novartis, Merck, Synthon-Bagó, Osmotica, Sanofi, Roche, Novartis, Teva, Gador. FC ha recibido retribución económica por el desarrollo de actividades educativas, científicas, asesoría, ensayos clínicos y becas de viajes a congresos de Biogen, Sanofi Genzyme, Merck-Serono, Teva, Novartis y Roche. ECC ha recibido retribución económica por el desarrollo de actividades educativas, científicas, asesoría, ensayos clínicos y/o becas de viajes a congresos de las siguientes compañías farmacéuticas: Biogen, Bayer, Genzyme, Merck, Novartis, Raffo (área eculizumab), Teva y Roche, apoyo económico para investigación de LACTRIMS, The Guthy-Jackson Charitable Foundation y Harvard Medical School (Clinical Research Program). EC: Merck, Biogen, Sanofi, Roche, Janssen y Novartis. JIR ha recibido honorarios en conceptos de presentaciones educativas de Biogen, Genzyme, Merck, Novartis. OG: retribución económica por el desarrollo de actividades educativas, científicas, asesoría, ensayos clínicos y/o becas de viajes a congresos de las siguientes companías farmacéuticas: Teva; Biogen; Synthon-Bagó; Merck; Tuteur; Novartis; BioSidus; Raffo, Genzyme; Roche y Bristol Myers Squibb. LP: Merck, Novartis, Sanofi-Genzyme, Roche, Biogen (viajes a congresos, conferencias, advisory board). RP: Sanofi-Genzyme, Roche, Novartis, Teva, Biogen, Merck, Synthon-Bagó, Biosidus. BS: retribución económica por el desarrollo de actividades educativas, científicas, asesoría, ensayos clínicos y/o becas de viajes a congresos de las siguientes compañías farmacéuticas: Biogen, Biosidus, Bristol Myers Squibb, Genzyme, Novartis, Merck, Roche y Teva. VS ha colaborado en asesorías, recibido grants de investigación, becas de viajes a congresos y honorarios por asesoría y como disertante de parte de AstraZeneca, Bagó, Bayer, Biogen, Biosidus, Bristol Myers Squibb, Gador, Genzyme, Merck, Novartis, Raffo, Roche, Tecnofarma/Adium, Teva y Tuteur. MCY: Merck, Biogen, Genzyme Argentina, Bayer Inc, Novartis Argentina, Roche and TEVA Argentina. El resto de los autores no declara conflictos de intereses.