Se ha publicado que los tratamientos de Intervención Cognitiva (IC) resultan eficaces en pacientes con deterioro secundario a daño neurológico focal (DNF), no sucediendo lo mismo en pacientes con enfermedades neurodegenerativas (EN).
ObjetivoEstudiar la efectividad de los tratamientos de IC comparando los resultados entre pacientes con DNF y EN.
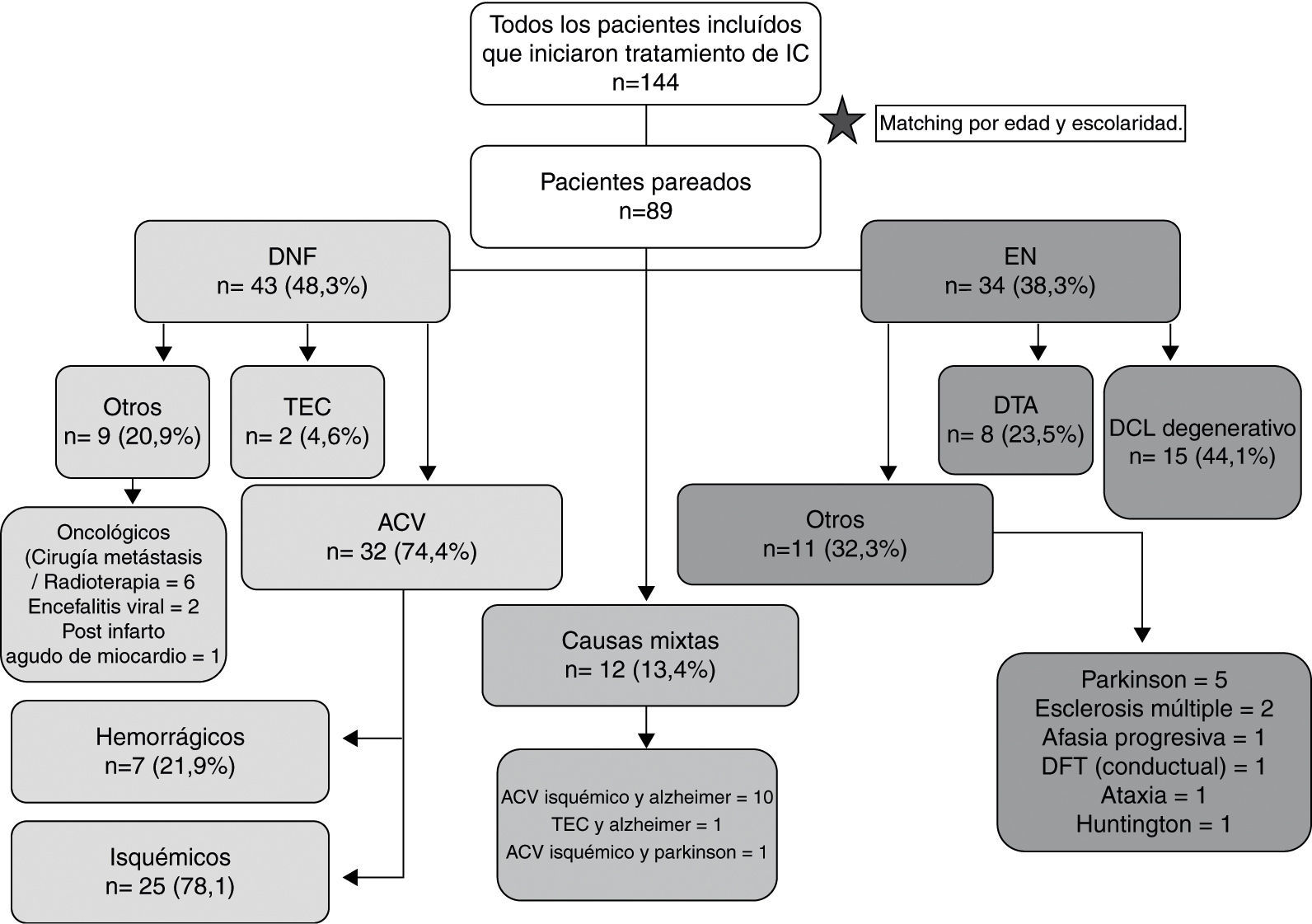
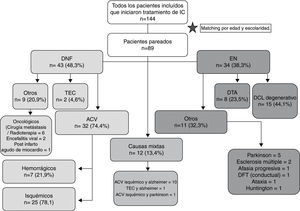
Diseño/métodosSe seleccionaron para el screening un total de 144 pacientes, que fueron divididos en 3 grupos: DNF (G1), EN (G2) y causas mixtas (G3).
En G1 se incluyeron particularmente pacientes con secuelas cognitivas postraumatismo de cráneo y accidente cerebrovascular. En G2 se incluyeron pacientes con demencias y deterioro cognitivo leve de etiología degenerativa. Los grupos fueron pareados según edad/escolaridad. Se compararon variables cognitivas, conductuales, funcionales y calidad de vida al inicio y al final del tratamiento.
ResultadosCon posterioridad al tratamiento se encontraron diferencias significativas entre los grupos en algunos aspectos de calidad de vida y memoria subjetiva. Con respecto a la evolución en G1 (n=43) se produjeron mejorías en actividades básicas (-1,55; p=0,04) e instrumentales (AIVD) (-1,63; p=0,007) de la vida diaria, escala de memoria subjetiva (13,36; p=0,02) e inventario neuropsiquiátrico (7,73; p=0,03).
En G2 (n=34) se encontró una tendencia en mejorar AIVD (-1,3; p=0,08) y aspectos de calidad de vida (-1,591; p=0,06).
En G3 (n=12) no se evidenciaron cambios significativos.
ConclusionesEn nuestra muestra la IC produjo mejorías significativas en algunos aspectos cognitivos, conductuales, funcionales y de calidad de vida. El beneficio fue mayor en pacientes con DNF. Este trabajo representa los resultados preliminares de un estudio a mayor escala poblacional.
In recent years, an increasing number of studies published assessing the effectiveness of CT programs in patients with ABD have shown that these therapies may have beneficial effects on cognitive and functional measures. On the other hand, the efficacy of these type of treatment in patients with ND is still under debate.
ObjectiveTo evaluate and compare the effectiveness of a Cognitive Training (CT) program in patients with Acquired Brain Damage (ABD) and neurodegenerative diseases (ND).
Design/Methods144 patients were assessed with neuropsychological, neurological, neuropsychiatry and functional assessments. The sample was divided in three groups: ABD (G1), ND (G2) and mixed disorders (G3). G1 included mainly patients with Traumatic Brain injury and Stroke. G2 included patients with degenerative dementias and mild cognitive impairment. Groups were matched for age, education and number of CT sessions. The effects on cognition, behavioral, functional and quality of life (QOL) were considered as the primary outcome measures, and evaluated at the beginning and at the end of the CT program.
ResultsWithin G1 patients (n=43) an improvement was found in patient's basic (-1.55;p0.04) and instrumental (-1.63;p0.007) activities of daily living (ADL) scores, subjective memory measures (13.36;p0.02) and in the Neuropsychiatric Inventory (7.73;p0.03). In G2 (n=34) an improving trend was found in instrumental ADL (-1.3;p0.08) and in some aspects of QOL (-1.59;p0.06). No significant differences were observed within G3 patients (n=12).
ConclusionsThese results suggest that persons with ABD and neurodegenerative disease may improve some cognitive, behavioral, functional and QOL measures following a CT program. CT shows greater benefit for ABD patients.
En relación con el envejecimiento progresivo de la población, los trastornos cognitivos y las demencias representarán en los próximos años un problema sanitario cada vez mayor, teniendo esta situación especial relevancia en los países en desarrollo1,2. Dentro de las etiologías responsables se puede hacer una división en enfermedades neurodegenerativas (EN), que incluyen pacientes con deterioro cognitivo leve (DCL) de causa degenerativa, demencia tipo Alzheimer (DTA), enfermedad de Parkinson con demencia–demencia por cuerpos de Lewy y demencia fronto-temporal, y las secundarias a daño neurológico focal (DNF) como accidentes cerebrovasculares (ACV) isquémicos o hemorrágicos, traumatismo encéfalo craneano (TEC) o en relación con antecedentes oncológicos, citando las causas más prevalentes.
Los tratamientos farmacológicos disponibles en la actualidad para este tipo de pacientes constituyen opciones de terapéutica principalmente sintomática, presentando mejorías en escalas cognitivas, funcionales, conductuales y globales de grado modesto, y únicamente en algunas de las patologías mencionadas1,3,4. En este contexto los tratamientos de estimulación y la rehabilitación cognitiva —de aquí en adelante mencionados en conjunto como terapéuticas de intervención cognitiva (IC)— constituyen una opción complementaria de manejo no farmacológico de las diferentes causas de alteraciones en las funciones mentales superiores. Este tipo de terapéutica se fundamenta en una propiedad intrínseca del cerebro: la de adaptarse a las diferentes situaciones que le propone el entorno. La plasticidad cerebral puede definirse como la capacidad del cerebro de evolucionar5, e implica cambios dinámicos a niveles microestructurales, neuronales, sinápticos y en las redes nerviosas del sistema nervioso. Estos ajustes pueden darse en escenarios fisiológicos habituales como en el aprendizaje, en los que todos los sistemas involucrados se encuentran en una situación estable o, por el contrario, pueden ser necesarios en personas que sufrieron algún tipo de daño cerebral o que cursan un cuadro progresivo de tipo neurodegenerativo6,7.
En diferentes revisiones y guías nacionales e internacionales se ha reportado que los tratamientos de IC resultan eficaces en pacientes con deterioro cognitivo secundario a DNF, como los trastornos de causa vascular o traumática, contándose con menos evidencia disponible en pacientes con EN3,8–11. En relación con las variables a considerar para valorar la eficacia de este tipo de terapéutica, las baterías neuropsicológicas habituales pueden no ser idóneas debido a que pueden presentar diferentes sesgos, como el aprendizaje de los tests, o la falta de generalización de las mejorías observadas en la vida cotidiana. Relativo a esto, el análisis de parámetros más ecológicos medidos por escalas funcionales, conductuales o de calidad de vida (CDV) puede reflejar cambios significativos en niveles más vinculados al desempeño cotidiano y a la independencia de los pacientes.
En la práctica clínica en Argentina puede ocurrir que estas prestaciones no sean autorizadas por las Obras Sociales o Prepagas, especialmente en los casos secundarios a EN, como el DCL de etiología degenerativa o en la enfermedad de Alzheimer (EA). Asimismo, son escasas las instituciones públicas que brindan este tipo de terapéuticas. No se han publicado estudios que hayan comparado la eficacia de este tratamiento entre distintas patologías. El objetivo del presente trabajo es evaluar la eficacia de los tratamientos de IC en pacientes con trastornos cognitivos secundarios a DNF y a EN, y comparar los resultados obtenidos entre ambos grupos.
Pacientes y métodosHipótesisLos pacientes con deterioro cognitivo secundario a EN mejoran después de realizar programas de estimulación cognitiva, igual o más que los pacientes con DNF.
ObjetivoEstudiar la eficacia de los tratamientos de IC mediante escalas subjetivas, funcionales, conductuales y de CDV comparando los resultados entre pacientes con DNF y EN.
Tipo de estudioEstudio longitudinal, de intervención, comparativo, realizado en la práctica clínica habitual (modelo naturalístico).
PoblaciónSe seleccionaron para el screening un total de 144 pacientes evaluados en el Instituto Neurociencias de Buenos Aires (INEBA) entre agosto de 2007 y julio de 2011 para realizar tratamientos de estimulación o rehabilitación cognitiva, según fuera la patología de base. Los pacientes fueron divididos en 3 grupos: DNF (G1), EN (G2) y causas mixtas, focales y degenerativas (G3). En G1 se incluyeron pacientes con accidente cerebrovascular (ACV), causas oncológicas de deterioro cognitivo y traumatismo encéfalo-craneano (TEC), entre otras etiologías. En G2 se incluyeron pacientes con demencias y DCL de etiología degenerativa. Los 8 casos con diagnóstico de DTA dentro de este grupo se encontraban en un estadio del Clinical Dementia Rating (CDR) de 1. Los grupos fueron pareados según la edad y escolaridad, permaneciendo para el análisis del presente estudio un total de 89 casos (fig. 1).
Los pacientes y cuidadores firmaron un consentimiento informado previo a la toma de las escalas. El estudio fue aprobado por el Comité de Docencia e Investigación de Fundación INEBA y realizado teniendo en cuenta las buenas prácticas clínicas y la Declaración de Helsinki, respetando la confidencialidad de los datos obtenidos. El tratamiento administrado consistió en sesiones individuales (un neuropsicólogo con un paciente) de 50 minutos de duración cada una, con una frecuencia de 2 o 3 veces a la semana, de ejercicios programados adaptados orientados a los déficits presentes.
Puntos finalesSe compararon variables cognitivas, conductuales, funcionales y de CDV al inicio y al final del tratamiento en cada uno de los grupos. Para ello se aplicó una batería de escalas ya publicada12 que incluyó la evaluación de percepción subjetiva de memoria de Benedet13, CDV de la Organización Mundial de la Salud (WHO-QOL)14, Actividades Instrumentales de la Vida Diaria (AIVD) y Básicas de la Vida Diaria (ABVD)15, Sobrecarga del Cuidador (SC) de Zarit16, Inventarios de depresión de Beck17 y de depresión y ansiedad HAD18 y manifestaciones neuropsiquiátricas (NPI-Q)19. Algunas de las escalas fueron evaluadas por el paciente y por el cuidador (percepción subjetiva de memoria, CDV, AIVD, ABVD, Beck y HAD), mientras que otras solamente por el cuidador (SC y NPI-Q).
EstadísticaSe utilizaron los test de ANOVA 1 vía para las comparaciones basales y finales. Se realizó un análisis de muestras apareadas (pairedT test) para cada grupo en forma individual (G1, G2 y G3) y análisis de correlación con las variables que tuvieron un cambio significativo al final del seguimiento. Con el objetivo de determinar los variables independientes asociadas a ese cambio se realizó un análisis multivariado con las variables basales y la dependiente final. Para los análisis estadísticos se utilizó el programa SPSS versión 12.0.
ResultadosDespués de parear por edad y escolaridad los 3 grupos se incluyeron para el análisis final 89 pacientes. En el grupo DNF un 74,4% de los pacientes había tenido un ACV. En el grupo EN el 32,3% tenía otras enfermedades neurodegenerativas como esclerosis múltiple y enfermedad de Parkinson.
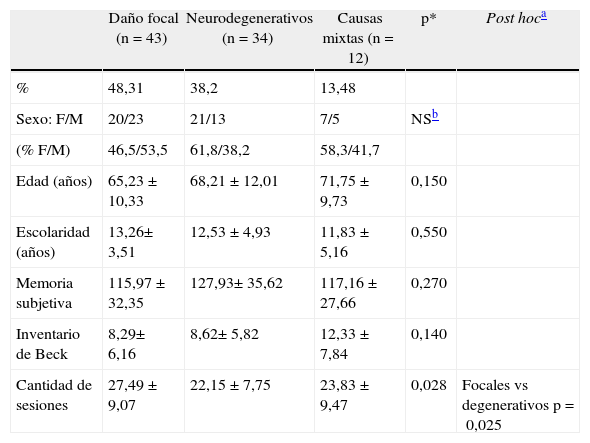
No se encontraron diferencias significativas en las variables demográficas, cognitivas y conductuales consideradas al inicio del tratamiento (tabla 1). En relación con la cantidad de sesiones administradas, los pacientes incluidos en el G2 (EN) realizaron menos sesiones de IC que los integrantes del G1 (DNF) (p=0,025).
Variables demográficas y cognitivas al inicio del tratamiento
| Daño focal (n=43) | Neurodegenerativos (n=34) | Causas mixtas (n=12) | p* | Post hoca | |
| % | 48,31 | 38,2 | 13,48 | ||
| Sexo: F/M | 20/23 | 21/13 | 7/5 | NSb | |
| (% F/M) | 46,5/53,5 | 61,8/38,2 | 58,3/41,7 | ||
| Edad (años) | 65,23±10,33 | 68,21±12,01 | 71,75±9,73 | 0,150 | |
| Escolaridad (años) | 13,26± 3,51 | 12,53±4,93 | 11,83±5,16 | 0,550 | |
| Memoria subjetiva | 115,97±32,35 | 127,93± 35,62 | 117,16±27,66 | 0,270 | |
| Inventario de Beck | 8,29± 6,16 | 8,62± 5,82 | 12,33±7,84 | 0,140 | |
| Cantidad de sesiones | 27,49±9,07 | 22,15±7,75 | 23,83±9,47 | 0,028 | Focales vs degenerativos p=0,025 |
F: femenino; M: masculino; NS: no significativo.
Datos de edad, escolaridad y cantidad de sesiones expresados como media (desviación estándar).
Al final del seguimiento se realizó un análisis de ANOVA con las variables estudiadas, encontrándose diferencias significativas entre los grupos en algunos aspectos de CDV (salud psicofísica del paciente [ANOVA entre los grupos p=0,03/post hoc G1 vs G3 p= 0,035]) y memoria subjetiva (recuerdo de conversaciones [ANOVA entre los grupos p= 0,03/post hoc G1 vs G2 p=0,054). No se encontraron otras diferencias significativas mediante este análisis.
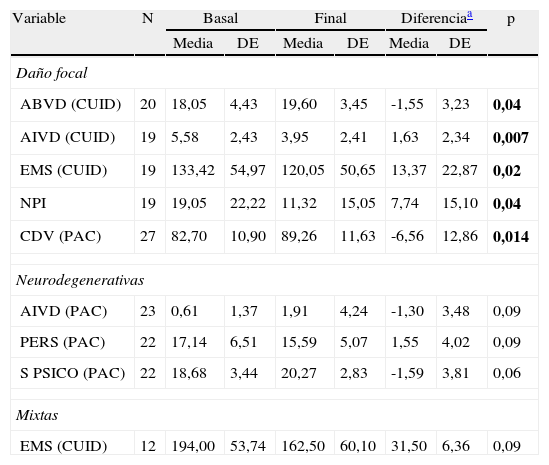
Posteriormente se realizó la estadística según la media de cambio (mdc) en cada grupo al final del seguimiento (tabla 2), encontrándose que en el G1 (DNF) se produjeron mejorías en ABVD del paciente evaluada por el cuidador (mdc -1,55; p=0,04), en AIVD del paciente evaluada por el cuidador (mdc: 1,63;p=0,007), escala de memoria subjetiva del paciente evaluada por el cuidador (mdc: 13,37; p=0,02), síntomas neuropsiquiátricos del paciente evaluados por el cuidador (NPI-Q) (mdc: 7,73; p=0,03) y en la CDV del paciente evaluada por el paciente (mdc: -6,55; p=0,01). En el G2 (EN) (n=34) si bien no se encontraron cambios estadísticamente significativos en ninguna de las variables consideradas, se evidenció una tendencia hacia la mejoría en AIVD evaluada por el paciente y en algunos aspectos de memoria subjetiva y de CDV evaluados por el paciente. En G3 (causas mixtas) (n=12) no se encontraron cambios estadísticamente significativos en ninguna de las escalas, observándose una tendencia a la mejoría en la memoria subjetiva evaluada por el cuidador.
Medias de cambio pre-post intervención cognitiva
| Variable | N | Basal | Final | Diferenciaa | p | |||
| Media | DE | Media | DE | Media | DE | |||
| Daño focal | ||||||||
| ABVD (CUID) | 20 | 18,05 | 4,43 | 19,60 | 3,45 | -1,55 | 3,23 | 0,04 |
| AIVD (CUID) | 19 | 5,58 | 2,43 | 3,95 | 2,41 | 1,63 | 2,34 | 0,007 |
| EMS (CUID) | 19 | 133,42 | 54,97 | 120,05 | 50,65 | 13,37 | 22,87 | 0,02 |
| NPI | 19 | 19,05 | 22,22 | 11,32 | 15,05 | 7,74 | 15,10 | 0,04 |
| CDV (PAC) | 27 | 82,70 | 10,90 | 89,26 | 11,63 | -6,56 | 12,86 | 0,014 |
| Neurodegenerativas | ||||||||
| AIVD (PAC) | 23 | 0,61 | 1,37 | 1,91 | 4,24 | -1,30 | 3,48 | 0,09 |
| PERS (PAC) | 22 | 17,14 | 6,51 | 15,59 | 5,07 | 1,55 | 4,02 | 0,09 |
| S PSICO (PAC) | 22 | 18,68 | 3,44 | 20,27 | 2,83 | -1,59 | 3,81 | 0,06 |
| Mixtas | ||||||||
| EMS (CUID) | 12 | 194,00 | 53,74 | 162,50 | 60,10 | 31,50 | 6,36 | 0,09 |
ABVD: actividades básicas de la vida diaria; AIVD: actividades instrumentales de la vida diaria; CDV: calidad de vida; CUID: según el cuidador. EMS: puntuación global, Escala de Memoria Subjetiva; NPI: inventario neuropsiquiátrico; PAC: según el paciente; PERS: recuerdo de personas, Escala de Memoria Subjetiva; SPSICO: salud psicofísica, Escala de Calidad de Vida. En negrita valores de p <0.05.
Considerando los 3 grupos en conjunto se realizó un análisis de regresión lineal múltiple (escalonado), teniendo en cuenta como variable dependiente la mejoría observada en memoria subjetiva evaluada por el cuidador al final del seguimiento. Se evidenció que la edad al inicio del tratamiento fue el mayor predictor del cambio (r2 0,44/p=0,03), no siendo el número de sesiones un predictor significativo (p=0,44). Las variables excluidas del análisis multivariado se citan en la tabla 3.
Regresión lineal múltiple (escalonado)
| Resumen del modelo | ||||
| Modelo | R | R square | R square ajustado | Error estándar del valor estimado |
| 1 | 0,666 | 0,444 | 0,374 | 46,937 |
| Coeficientesa | ||||||
| Modelo | Coeficientes no estandarizados | Coeficientes estandarizados | t | Sig. | ||
| B | Error Standard. | Beta | ||||
| 1 | Constante | -101,695 | 94,709 | -1,074 | 0,314 | |
| Años | 3,482 | 1,378 | 0,666 | 2,527 | 0,035 | |
| a. Variable dependiente: escala memoria subjetiva final (cuidador) | ||||||
| Variables excluidasb | |||||
| Modelo | Beta In | t | Sig. | Correlación parcial | Estadísticas colinearidad |
| Tolerancia | |||||
| 1 | |||||
| Educación | 0,091 | 0,319 | 0,759 | 0,120 | 0,954 |
| Sesiones | 0,299 | 0,819 | 0,440 | 0,296 | 0,546 |
| CDV paciente | 0,352 | 1,357 | 0,217 | 0,456 | 0,936 |
| AIVD (CUID) | 0,131 | 0,472 | 0,651 | 0,176 | 0,992 |
| NPI inicial | 0,460 | 1,935 | 0,094 | 0,590 | 0,914 |
| Beck | -0,405 | -1,663 | 0,140 | -0,532 | 0,961 |
| HAD-A | -0,449 | -1,945 | 0,093 | -0,592 | 0,967 |
| Zarit | -0,499 | -2,346 | 0,051 | -0,663 | 0,982 |
| ABVD (CUID) | 0,255 | 0,795 | 0,453 | 0,288 | 0,710 |
| AIVD (PAC) | -0,194 | -0,703 | 0,505 | -0,257 | 0,974 |
ABVD: actividades básicas de la vida diaria; AIVD: actividades instrumentales de la vida diaria; CDV: calidad de vida; CUID: según el cuidador; HAD-A. Escala de Ansiedad Hospitalaria; NPI: inventario neuropsiquiátrico; PAC: según el paciente.
Los programas de IC se fundamentan en la posibilidad de lograr compensar los trastornos cognitivos presentes mediante la realización de ejercicios específicos y la adquisición de nuevas pautas de funcionamiento, basándose en las capacidades de las neuronas y de las redes neuronales de reorganizarse mediante la plasticidad sináptica. En el presente estudio se evidenció que después del tratamiento de IC los pacientes con trastornos cognitivos secundarios a DNF presentaron mejorías en escalas de actividades de vida diaria, de memoria sujetiva y de sintomatología neuropsiquiátrica, según la evaluación de su cuidador. Asimismo, los pacientes de este grupo consideraron que su CDV había mejorado tras terminar las sesiones. En los otros grupos analizados si bien se insinuaron tendencias a la mejoría en algunos parámetros, no se evidenciaron mejorías significativas estadísticamente.
Los hallazgos mencionados en el grupo con DNF resultan de importancia, dado que las variables que presentaron mejoría incluyen puntos finales duros, ecológicos y de relevancia en la vida cotidiana como aspectos funcionales, cognitivos y conductuales considerados por la persona que brinda asistencia al individuo. Al ser el cuidador quien evaluó los cambios se disminuyó el peso de un potencial sesgo vinculado a la sensación subjetiva de beneficio en diferentes funciones evaluada por el paciente. También en este grupo la mejoría en la CDV evaluada por el paciente representa un punto final de importancia en pacientes con secuelas neurológicas secundarias a un evento focal. Llama la atención que la mejoría observada en las capacidades funcionales, cognitivas y conductuales del paciente según la evaluación del cuidador no se haya visto reflejada en una disminución en la puntuación de la escala de SC.
Si bien se evidenció una tendencia a la mejoría en escalas funcionales, de memoria subjetiva y de CDV en pacientes con EN, y en la memoria subjetiva en el grupo con trastornos de etiología mixta, la magnitud de la diferencia entre el inicio y el final de tratamiento en estos grupos de pacientes fue menor. Debe resaltarse que el número de casos incluidos en estos grupos fue más bajo, así como que el número de sesiones administrado al grupo con EN en relación con los pacientes con DNF fue menor, hecho posiblemente vinculado a que, de autorizarlos, las Obras sociales y Prepagas suelen aprobar módulos más cortos de tratamiento en estas patologías. En relación con los procesos a nivel celular y de las redes neuronales, los hallazgos positivos en el grupo DNF pueden estar vinculados a que estos pacientes presentan una mayor capacidad potencial de compensación de los déficits en relación con el mejor estado funcional de los tejidos adyacentes al sector dañado, así como de las regiones secundarias más distantes, posibilitando una mayor recuperación postinjuria7.
Dentro de las limitaciones del presente trabajo se menciona que el diseño del mismo es de no inferioridad, ya que el objetivo era demostrar que los grupos de enfermedades al final del seguimiento presentan un beneficio similar. Por otro lado, al incluirse dentro de cada uno de los grupos (G1, G2 y G3) individuos con distintas etiologías específicas de los trastornos cognitivos se aumentó la heterogeneidad interna de cada grupo. Asimismo, si bien se compararon los resultados entre distintas patologías no se contó con un grupo control que no haya recibido el tratamiento. En trabajos que estudian terapéuticas de estimulación y rehabilitación cognitiva la inclusión de un grupo control representa un desafío particular. Esto se debe a las limitaciones éticas y prácticas que representa asignar a un paciente a una rama no activa o no administrarle tratamiento, sumado a la dificultad de realizarlo en la modalidad doble ciego. Si bien en ocasiones se ha comparado un tratamiento de IC ‘«estándar» (grupo control) con una técnica «novedosa», esta decisión también presenta sesgos potenciales y limitaciones prácticas.
Otro posible sesgo del estudio está vinculado a la posibilidad de presentar mejorías en diferentes parámetros relacionada con la actividad social, con la interacción con otras personas y con el menor tiempo que pasa el paciente en su domicilio por concurrir a las sesiones de IC. Por otro lado, no se controló la adición de tratamiento farmacológico para la sintomatología cognitiva o conductual, situación que puede provocar una mejoría en algunas de las variables evaluadas.
En relación con la complejidad de realización de este tipo de estudios es habitual que se analicen muestras pequeñas, con diseños, tipo de intervenciones (grupales o individuales) y medidas de resultados en ocasiones heterogéneas. Por todas las particularidades que presentan los trabajos que analizan la eficacia de los programas de IC algunos autores han sugerido que, para realizar recomendaciones sobre la utilidad de este tipo de intervenciones, además de los ensayos clínicos aleatorizados y controlados deberían incluirse otro tipo de estudios considerados como fuente de evidencia de menor contundencia científica8.
Dentro de las fortalezas del presente trabajo debe mencionarse que se contó en los 2 grupos principales con 43 (DNF) y 34 (EN) pacientes, que todos recibieron sesiones del mismo tipo y que al ser la totalidad de los pacientes de un mismo centro (INEBA) la sistemática de trabajo administrada por los profesionales tratantes puede considerarse homologable. Asimismo, las variables incluidas fueron parámetros poco susceptibles de ser modificados por la administración repetida de las escalas (aprendizaje), lo cual agrega validez a los resultados obtenidos. Por último, en el G2 se incluyeron pacientes con EN menos prevalentes, como afasia progresiva o esclerosis múltiple, demostrando los potenciales beneficios y justificando posteriores estudios a mayor escala en estas poblaciones.
ConclusionesDentro del amplio espectro de causas que pueden generar enfermedades cerebrales es en las de etiología vascular y traumática donde se cuenta con más antecedentes de investigación, mayor respaldo científico y mayores certezas acerca de los mecanismos vinculados a la recuperación funcional cerebral. En la presente muestra el programa de IC produjo mejorías significativas en algunos aspectos cognitivos, conductuales, funcionales y/o de calidad de vida. De acuerdo con la evidencia publicada, el beneficio fue mayor en pacientes con DNF que en aquellos con EN o con deterioro cognitivo de etiología mixta. Es necesario destacar que para la correcta implementación de los tratamientos de IC es necesaria una evaluación y comprensión integral de las habilidades y de los trastornos cognitivos del paciente, así como de sus características conductuales y de sus condiciones funcionales. Será de importancia determinar en el seguimiento si los cambios favorables evidenciados se mantienen en el tiempo. Este trabajo representa los resultados preliminares de un estudio en curso.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.