La encefalomielitis aguda diseminada (EMAD) corresponde a una enfermedad inflamatoria desmielinizante que suele desarrollarse tras procesos infecciosos o vacunaciones. El curso es generalmente monofásico y afecta con mayor frecuencia a niños.
ObjetivoDescribir los hallazgos clínicos, de laboratorio, radiológicos en un grupo de pacientes adultos con diagnóstico de EMAD.
MétodosSe seleccionaron 17 pacientes con diagnóstico de EMAD. Se describieron las características clínicas por métodos complementarios y respuesta al tratamiento.
ResultadosEl 59% eran mujeres, la edad media fue 29 años, el 47% presentaron algún antecedente, mayormente infección de vías aéreas. La primera manifestación clínica fue la alteración del estado de conciencia en el 41%, seguida por el compromiso de vías largas manifestada por déficit motor y/o sensitivo en el 29%. El 88% tuvieron manifestaciones polisintomáticas al ingreso. En el LCR el 35% presentaron hiperproteinorraquia. En 13 pacientes se evaluaron BOC y fueron negativas. En RMN la topografía más frecuentes fueron las supratentoriales subcorticales observadas en el 94%. El 88% tuvieron buena respuesta a corticoides.
ConclusiónLa EMAD sigue siendo un diagnóstico de exclusión, el reconocimiento en la presentación tanto clínica como por los diferentes métodos de diagnóstico como así también, la evolución y seguimiento serán importantes para la identificación de la misma y la implementación del tratamiento apropiado.
Acute disseminated encephalomyelitis (ADEM) is an inflammatory demyelinating disease that usually develops after infectious diseases or vaccinations. The course is usually monophasic and most often affects children.
ObjectiveTo describe the clinical, laboratory, radiological in a group of adult patients with a diagnosis of ADEM.
MethodsWe selected 17 patients with a diagnosis of ADEM. Clinical characteristics, complementary methods and response to treatment were described.
Results59% were women, the mean age was 29 years, 47% presented some medical history, mostly respiratory infection. The first clinical manifestation was the altered state of consciousness in 41%, followed by motor and / or sensitive impairment in 29%. 88% had income polysymptomatic demonstrations. Proteins in CSF was increased in 35% of patients. BOC were negative in the 13 patients evaluated. The topography most frequent in IRM were supratentorial subcortical in 94% of patients. 88% had good response to corticosteroids.
ConclusionADEM remains a diagnosis of exclusion recognition in both clinical presentation by the various diagnostic methods as well as the evolution and follow will be important for identifying the same and implementation of appropriate therapy.
La encefalomielitis aguda diseminada (EMAD) es una enfermedad inflamatoria y desmielinizante del sistema nervioso central (SNC) cuya característica patológica son lesiones de componente inflamatorio y con una clara tendencia a una localización perivenosa1. La presentación clínica es aguda/subaguda generalmente con manifestaciones polisintomáticas (afección de 2 o más sistemas funcionales). La expresión clínica, así como los estudios por imágenes, son muy variados y si bien hay criterios diagnósticos propuestos2, estos fueron descriptos para la presentación en la edad pediátrica. El principal diagnóstico diferencial de la EMAD debe hacerse con la esclerosis múltiple (EM), cuya evolución más frecuente es hacia una forma brotes clínicos con períodos de remisión de la enfermedad. A diferencia de esta última, la EMAD presenta esencialmente un curso monofásico, aunque se describen recidivas hasta en un 30% de los niños3. Un hecho común en ambas es la ausencia de un marcador biológico para su diagnóstico de certeza. La EMAD suele ocurrir con mayor frecuencia en la edad pediátrica, con una asociación temporal a enfermedades virales, vacunas y sueros inmunes2. Si bien es una patología subdiagnosticada la incidencia estimada en niños y adolescentes es de 0,8 por 100.000 habitantes por año4. La incidencia en la población adulta se desconoce con exactitud. Hay pocas series de casos que describen la presentación de esta patología en la población adulta6–8. Poder establecer las características clínicas y de métodos complementarios en la población adulta es esencial, esto permitirá establecer un diagnóstico correcto, realizar diagnósticos diferenciales con otras entidades (por ejemplo EM) y poder seleccionar la estrategia terapéutica más apropiada.
ObjetivoDescribir los hallazgos clínicos, de laboratorio, radiológicos en un grupo de pacientes adultos con diagnóstico de encefalomielitis diseminada aguda.
Pacientes y métodosSe realizó un estudio descriptivo y retrospectivo de una serie de pacientes que han sido evaluados en la División Neurología del Hospital J. M. Ramos Mejía de la ciudad de Buenos Aires, durante el periodo comprendido entre los años 2002-2012. Los pacientes fueron seleccionados de la base de historias clínicas del servicio y fueron identificados a partir del diagnóstico al alta de EMAD (alta hospitalaria, derivación a otro centro, defunción).
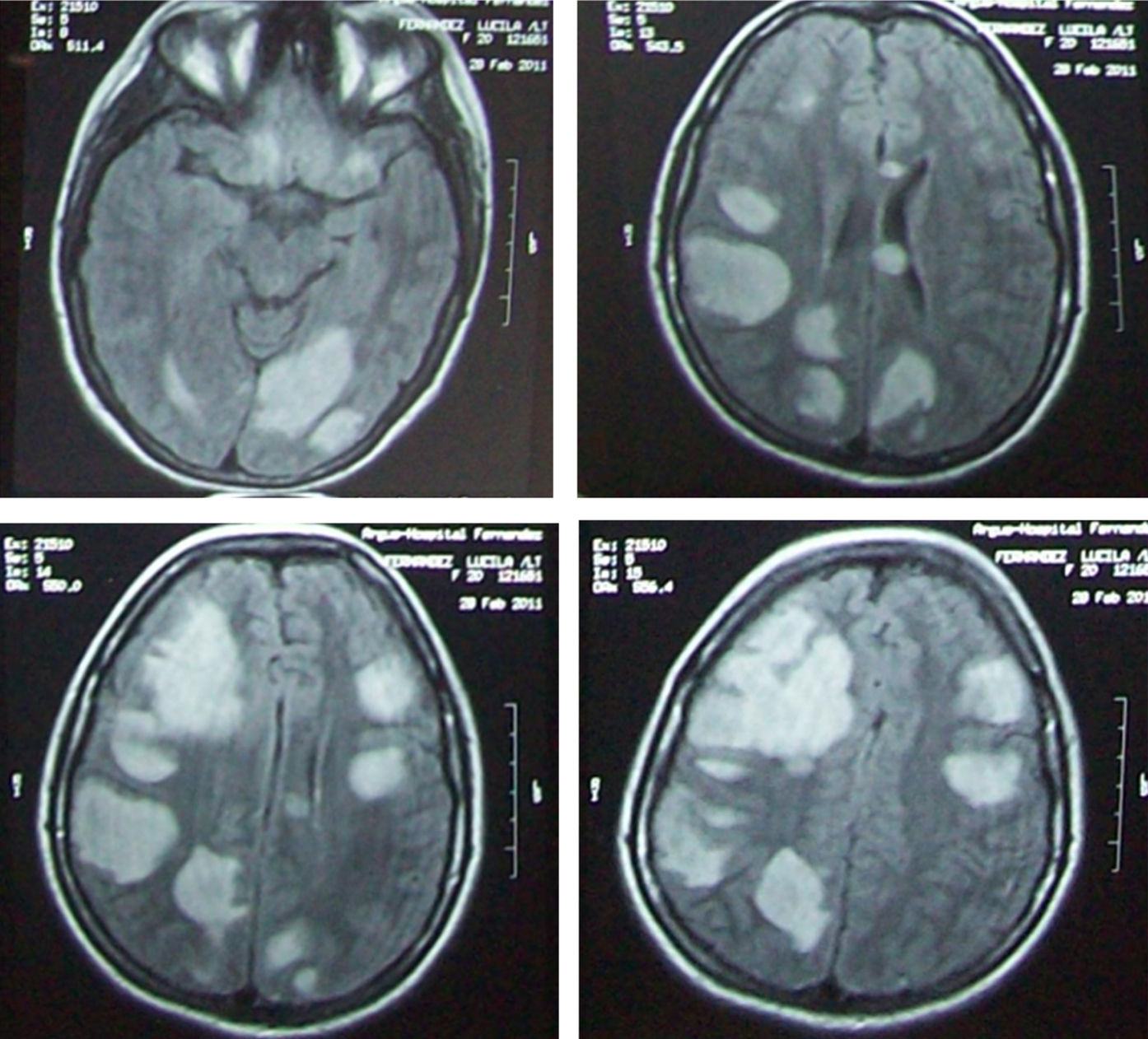
Las historias clínicas fueron revisadas con el fin de asegurar la precisión del diagnóstico. El criterio para incluir al paciente como adulto fue una edad igual o mayor a 16 años. La EMAD se definió de acuerdo con los siguientes criterios: primer evento clínico de una presunta causa inflamatoria o desmielinizante de curso agudo o subagudo con sintomatología neurológica monofocal o polifocal. Resonancia magnética (RM) de encéfalo con la presencia de lesiones de aspecto inflamatorio supra y/o infratentoriales hiperintensas en la sustancia blanca, gris y ganglios basales, en secuencia FLAIR y/o T2, de tamaño mayor o igual a 1cm (fig. 1). RM de médula espinal con lesiones aspecto inflamatorio hiperintensas en T2. Algunos de estos criterios fueron propuestos por The International Paediatric MS Study Group (IPMSSG)9 pero a diferencia de lo propuesto en niños se incluyeron además a pacientes con clínica monosintomática y sin encefalopatía.
Fueron excluidos pacientes con sospecha etiológica de infecciones, causas metabólicas o tóxicas y los pacientes con manifestaciones monosintomáticas de neuritis óptica, oftalmología internuclear aislada o mielitis que puedan evidenciar un evento clínico aislado como parte del inicio de una EM.
Todos los datos disponibles fueron registrados en una base de datos. Estos consistieron en: características demográficas y clínicas donde se evaluó edad, sexo, síntomas iniciales, signos al examen neurológico, tiempo transcurrido a la consulta. Presencia de infección, vacunación o algún otro evento médico en las 4 semanas previas. Se analizaron métodos complementarios de laboratorio de sangre evaluando características en hemograma, colagenograma (ANA, anti-DNA, FR, complemento, PCR, anti-JO, anti-LA), serologías virales (HIV, virus hepatitis B y C). En el líquido cefalorraquídeo (LCR) se realizó un examen físico/químico, de bandas oligoclonales (BOC) mediante electroforesis en acetato de celulosa, con posterior electroinmunofijación con antisuero monoespecífico anti IgG revelada con tinción argéntica y estudio de PCR virales (virus del herpes simplex tipo 1 y 2, citomegalovirus, varicela zoster, Epstein Barr). Las RM se realizaron en diferentes equipos de alto campo (1,5tesla). Se clasificó el sitio anatómico de las lesiones por en RMN: supratentoriales (cortical, subcortical, ganglios de la base), infratentorial (tronco encefálico y cerebelo) y médula espinal. Según el refuerzo con el gadolinio, los hallazgos fueron divididos en: lesiones con captación en anillo completo, captación parcial y lesiones que no captan contraste. Por último se describió el tipo de tratamiento instaurado y respuesta al mismo. Desde el punto de vista terapéutico se consideró una «buena respuesta» para aquellos pacientes que experimentaron una mejoría total o parcial con reversión de sus signos/síntomas o «sin respuesta» para aquellos sin modificaciones en el cuadro neurológico durante el periodo de internación. Se evaluó durante el seguimiento la posibilidad de diagnósticos alternativos con respecto al del ingreso como también, la posibilidad de recurrencias o eventos nuevos.
Se ha procedido a un estudio descriptivo de las variables citadas en forma de porcentajes.
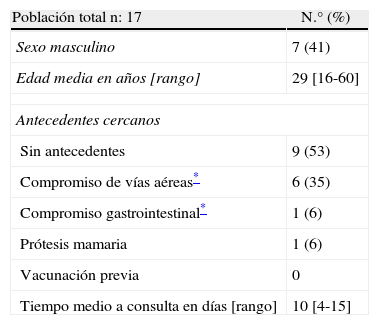
ResultadosCaracterísticas clínicasSe seleccionaron 17 pacientes con diagnóstico de EMAD. Los datos de las características clínicas y demográficas están resumidos en la tabla 1. El 59% de sexo femenino, la edad media de 29 años con un rango de 16-60 años.
Características clínicas y demográficas de la población
En 7 pacientes (41%) se encontró como antecedente infecciones la semana previa al evento, de las cuales 6 pacientes (35%) presentaron infecciones de vías aéreas altas y solo uno con antecedente de gastroenteritis (diarrea y vómitos). En ningún caso pudo identificarse un germen causante. Una paciente fue sometida a cirugía de implante prótesis mamarias el mes previo al inicio de los síntomas. En ningún caso hubo exposición previa a vacunas. El tiempo medio desde la aparición de síntomas a la consulta fue de 10 días con un rango de 4-15 días.
La primera manifestación clínica referida fue la alteración del estado de conciencia en 7 pacientes (41%) (desorientación temporo-espacial, diferentes grados de trastorno del sensorio) seguida por el compromiso de vías largas manifestada por déficit motor y/o sensitivo en 5 pacientes (29%). El resto de los pacientes presentaron alteraciones psiquiátricas (alucinaciones, delirium, trastornos de personalidad) o síntomas de fosa posterior (alteraciones en la coordinación e inestabilidad postural, diplopía, vértigo) como primera manifestación clínica (tabla 2).
Con respecto a las características clínicas al momento del ingreso en el hospital, 15 pacientes (88%) presentaron un cuadro polisintomático y solo 2 pacientes cuadros monosintomático (hemiparesia en uno y hemianopsia homónima en otro). Al analizar las características del examen físico, la manifestación más frecuente fue el déficit motor hemicorporal, junto al signo de Babinski en 13 pacientes (76%). Un solo caso se presentó como déficit motor en forma de paraparesia secundaria a una lesión medular. En 10 pacientes (58%) se objetivó compromiso de pares craneales, en ningún caso se objetivó neuritis óptica. Dentro de las manifestaciones referentes al estado de conciencia y cognición el 58% presentaron desorientación temporo-espacial, el valor medio del mini mental test validado en español10 fue de 14 (para un máximo de 30) con un rango entre 12-30. Tres sujetos desarrollaron afasia de tipo subcortical. La totalidad de los hallazgos están resumidos en la tabla 3.
Características clínica al momento del ingreso al hospital
| Clínica al ingreso (%) | N° (%) |
| Polisintomático | 15 (88) |
| Monosintomático | 2 (12) |
| Examen físico al ingreso | |
| Glasgow media [rango] | 14 [12-15] |
| Alteración de la vigilia | 7 (41) |
| Orientación | 10 (58) |
| Lenguaje | 3 (17) |
| Gnosias | 0 (0) |
| MMT media [rango] | 24 [12-30] |
| Pares craneales | 10 (58) |
| Neuritis óptica | 0 (0) |
| Motor | 13 (76) |
| Sensitivo | 7 (41) |
| Hiperreflexia | 10 (58) |
| Hiporreflexia | 1 (6) |
| Babinsky | 13 (76) |
| Taxia | 9 (52) |
Se realizaron estudios de laboratorio en sangre y LCR. En todos los pacientes se realizó hemograma siendo el mismo normal en 15 (89%), 2 (11%) presentaron leucocitosis (valor al recuento de glóbulos blancos mayor a 11.000 células por mm3). ANA, anti DNA, factor reumatoideo, complemento, PCR, anti-JO y anti LA fueron realizados en 13 sujetos siendo normal en todos los casos. Asimismo, serología para VIH y hepatitis B y C fueron no reactivas en la totalidad de los sujetos.
El examen de LCR se llevó a cabo en todos los pacientes. El estudio físico químico fue normal en 11 de los casos (65%), mientras que en 6 (35%) se encontró hiperproteinorraquia (valor de proteínas en LCR mayor a 40mg%). En los 13 pacientes en los que se midieron BOC fueron negativas (tomando como valor de corte la presencia de 2 o más BOC). En todos los casos se realizó estudios de RM en equipo de 1,5tesla, analizando las secuencias de FLAIR, T2 y T1 con gadolinio (tabla 4). En relación con la topografía de las lesiones las más frecuentes fueron las supratentoriales subcorticales observadas en 16 pacientes (94%), corticales en 6 pacientes (35%), en 10 pacientes (59%) en ganglios de la base, tronco encefálico en 8 pacientes (47%), cerebelo en 8 pacientes (47%), médula espinal en 5 pacientes (29%) y cuerpo calloso en un paciente. El patrón más frecuente fue el de lesiones que no captan contraste en 10 sujetos (59%). Entre las lesiones que reforzaban con el gadolinio el patrón más frecuente fue el de captación parcial en 5 pacientes (30%).
Métodos complementarios realizados durante la internación
| Estudios de laboratorio | Resultados en % |
| Estudios realizados | |
| LCR | 35 hiperproteinorraquia |
| BOC* | 100 negativas |
| Colagenograma* | 100 normal |
| HIV | 100 no reactivo |
| Localizaciones en RM | N.° (%) |
| Supratentorial subcortical | 16 (94) |
| Supratentorial cortical | 6 (35) |
| Ganglios de la base | 10 (59) |
| Tronco del encéfalo | 8 (47) |
| Cerebelo | 8 (47) |
| Médula | 5 (29) |
| Cuerpo calloso | 1 (6) |
| Realce con gadolinio | N.° (%) |
| Negativo | 10 (59) |
| Realce parcial | 5 (30) |
| Anillo completo | 2 (12) |
En un solo caso donde no se pudo llegar a diagnóstico por métodos convencionales se llegó al mismo a través de biopsia de encéfalo la cual fue evaluada en 2 centros diferentes de anatomía patológica.
TratamientoTodos los pacientes recibieron tratamiento (tabla 5). En los 17 pacientes el primer tratamiento instaurado fue metilprednisona (MP) en pulsos (1gr/día durante 3-5 días). Trece pacientes (76%) presentaron «buena respuesta» y no requiriendo de otra terapia. En los 4 pacientes «sin respuesta» a la MP, se instauró tratamiento con gammaglobulina endovenosa (IgEV) dosis de 400mg/kg durante 5 días, obteniéndos «buena respuesta» en uno de ellos. En los restantes 3 pacientes se le realizó tratamiento de recambio plasmático con «buena respuesta» en 2 casos. Un paciente no respondió a ninguna de las terapéuticas aplicadas y óbito en sala de cuidados intensivos.
Doce pacientes (70%) fueron controlados luego del alta con un seguimiento medio de 36 meses. Dos pacientes fueron nuevamente admitidos en el hospital por presentar un nuevo evento. Ambos en un período no mayor a 30 días por lo que no se consideraron recurrencias9.
DiscusiónLa EMAD es una enfermedad inflamatoria y desmielinizante del SNC. Presenta lesiones con una clara tendencia a una localización perivenosa1 y afecta principalmente a la sustancia blanca subcortical, tronco cerebral, cerebelo y de la médula espinal. Las descripciones de esta enfermedad se hicieron principalmente en pacientes en edad pediátrica donde su frecuencia es mayor y su incidencia es mejor conocida4,5. En un estudio clínico en Japón (Fukuoka) en el período de 1998-2003, se informó de que la incidencia en menores de 15 años fue de 0,64 por cada 100.000 personas por año y la relación hombre-mujer de 2,3:15. A pesar de existir criterios para llegar al diagnóstico9, el diagnóstico diferencial con la EM sigue siendo un desafío ya que ambas comparten características comunes y carecen de un marcador biológico que certifique el diagnóstico de certeza. En la patogenia de la EMAD se postulan varias hipótesis17. Se suman mecanismos inflamatorios y respuesta autoinmunitaria secundaria que contribuyen al daño de la mielina en el SNC, lo que determina la desmielinización del SNC. Se ha postulado que un antígeno común compartido por el agente infeccioso y un epítope de la mielina podría desencadenar la respuesta autoinmunitaria, fenómeno conocido como mimetismo molecular15. Los antígenos de origen viral (sarampión, herpes, varicela, paperas, virus de Epstein-Barr o influenza) presentarían una reacción cruzada con componentes de la mielina y secundariamente inducirían una reacción hiperalérgica. Tselis y Lisak16 publicaron una revisión en la que exponen las posibles hipótesis para la EMAD. Una sería la del mecanismo de mimetismo molecular ya mencionado, otra hipótesis asume que el virus activa algunos clones de células T. A pesar de las hipótesis postuladas, actualmente la patogenia real no se conoce completamente.
En este trabajo se mostraron las características clínicas y por métodos complementarios de un grupo de pacientes adultos con diagnóstico de EMAD. Si bien el criterio de diagnóstico de EMAD que utilizamos tiene algunas diferencias con el utilizado para los pacientes pediátricos9, en los diferentes reportes de casos en adultos no existe una uniformidad en los criterios utilizados para la inclusión de pacientes6–8.
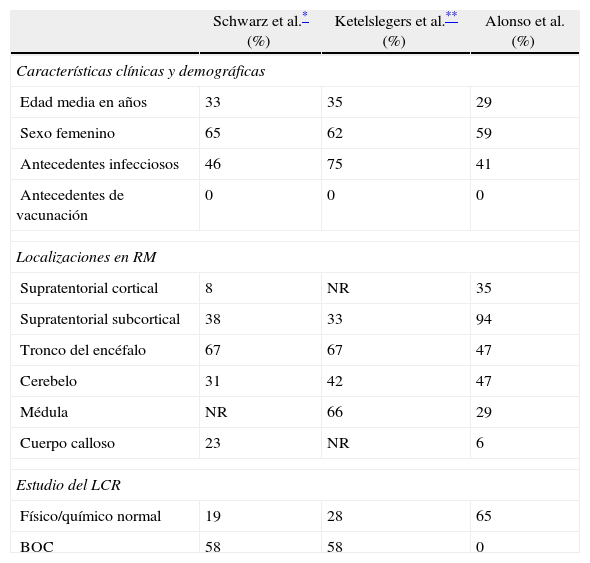
En nuestra serie la edad promedio fue 29 años y el 59% fueron mujeres. Esto coincide con lo reportados por Schwarz et al.6 y Ketelslegers et al.8 quienes encontraron similar predominio femenino y una edad media de presentación que ronda los 35 años. A diferencia de lo que ocurre en la población pediátrica donde la mayoría de los pacientes presentan algún antecedente previo de infección o vacunación11, en nuestra serie solo el 41% presentó un antecedente de infección la semana previa al evento, siendo las de vías aéreas las más frecuentes. Es importante señalar que ningún paciente presentó diagnóstico del agente etiológico de su cuadro infeccioso. Ninguno de los 17 pacientes refirió exposición previa a vacunas. Datos similares fueron reportados por Schwarz et al.6 donde el 46% presentaron infecciones previas, y diferente a lo reportado por Ketelslegers et al.8 donde el 79% de los adultos registraron un antecedente infeccioso. Ambos reportes coinciden en el que ningún paciente recibió vacunas previamente (tabla 5). En la literatura se describen casos de EMAD que siguieron una infección bacteriana (estreptococo betahemolítico), micoplasma, spirocheta o levaduras18. Se han publicado además reportes de casos con asociación a enfermedades infecciosas poco prevalentes como por ejemplo la malaria cerebral13 y toxoplasmosis14. La EMAD en la edad pediátrica presenta una elevada asociación temporal a enfermedades virales, vacunas y sueros inmunes2,11. Estos 2 últimos hallazgos no suelen encontrarse en la edad adulta ya que la exposición a vacunas o sueros inmunes es mucho menos frecuente6–8. Con respecto a la frecuencia de asociación con enfermedades infecciosas las publicaciones reportadas en adultos, como ya lo hemos mencionado, no son uniformes6,8. En muchos casos no es tan fácil de encontrar un factor desencadenante. En nuestra serie una paciente tuvo como antecedente haber sido expuesta a una cirugía de implante de prótesis mamarias el mes previo al inicio de los síntomas, la misma no refirió ningún otro antecedente y se consideró a esta exposición como posible desencadenante de la reacción inmune. Sin bien esta consideración es difícil de aseverar es importante la relación temporal entre los 2 hechos. En la literatura hay pocos reportes sobre eventos inmunológicos asociados a implantes mamarios12.
El tiempo medio de demora a la consulta fue de 10 días, Schwarz et al.6 reportan una demora media a la consulta de 4 días para los pacientes con diagnóstico de EMAD y de 14 días para los pacientes con diagnóstico de EM, teniendo en cuenta que en estos últimos sus síntomas fueron menos severos. En nuestro caso es un hecho que llama la atención ya que la manifestación clínica más frecuente fue la de alteración del estado de conciencia seguida de alteración de vías largas. Ambos signos suficientemente relevantes como para motivar una consulta inmediata. Se observó que el cuadro inicial fue el de alteración del estado de conciencia en 7 pacientes (41%), desde desorientación temporo-espacial hasta somnolencia. Ninguno de los pacientes presentó compromiso más severo del estado de conciencia como estupor o coma. En 3 pacientes (18%) se registró un debut de síntomas psiquiátricos (alucinaciones, delirium, trastornos de personalidad) lo que retrasó el diagnóstico inicial de EMAD. Entre los síntomas focales de inicio, las alteraciones de las vías largas expresadas por déficit motor y/o sensitivo se presentaron en 5 pacientes (29%). Los síntomas de fosa posterior (alteraciones en la coordinación e inestabilidad postural, diplopía, vértigo) en 2 pacientes (12%) (tabla 2). Schwarz et al.6 reportan que los síntomas de inicio más frecuentes fueron déficit motor y sensitivo en 77 y 65% respectivamente, seguidos por alteraciones de fosa posterior 62% compromiso de tronco encefálico y 38% ataxia como manifestación cerebelosa, en tanto solo el 19% presentaron algún grado de alteración de la conciencia. Ketelslegers et al.8 reportaron que el 52% presentaron al inicio signos de encefalopatía, la manifestación más frecuente fue déficit piramidal en el 80%.
En cuanto a los hallazgos al examen físico al ingreso en el hospital, 15 pacientes (88%) presentaron un cuadro polisintomático y solo 2 pacientes cuadros monosintomaticos (hemiparesia en uno y hemianopsia homónima en otro), un paciente de este último grupo desarrollo otras manifestaciones neurológicas durante la internación. La manifestación más frecuente fue el déficit motor manifestado como hemiparesia en 13 pacientes (76%). Solo un paciente presentó déficit motor en forma de paraparesia secundaria a una lesión medular. En 10 pacientes (58%) se objetivó trastorno de pares craneales indicando una topografía de lesión en fosa posterior. Ninguno de ellos presentó clínica de neuritis óptica. Dentro de las manifestaciones referentes al estado de conciencia y cognición el 58% presentaron algún grado de desorientación temporo-espacial, el valor medio del Mini Mental Test fue de 14 (para un valor máximo posible de 30) con un rango entre 12-30. En 3 pacientes se observó afasia de tipo subcortical. Ketelslegers et al.8 reportaron que el síndrome piramidal fue el hallazgo más frecuente al examen físico en el 63% de los pacientes adultos, seguido de las alteraciones sensitivas, ataxia y signos de encefalopatía en el 38%, al igual que nuestra serie ningún paciente adulto presentaron meningismo ni alteraciones extrapiramidales en el examen físico. En cuanto a los reportes en niños, Tenembaum et al.11 reportan que la alteración de vías largas fue el hallazgo más frecuente encontrado en 85% de los pacientes pediátricos seguido de alteraciones de la conciencia (69%) y ataxia (50%), manifestaciones como meningismo, crisis comiciales y signos extrapiramidales fueron reportados. Datos similares también fueron comunicados por Ketelslegers et al.8 en su población infantil. Ninguno de estos hallazgos fue encontrado en nuestra población.
Nuestros pacientes fueron estudiados con laboratorio de sangre, LCR y RM de encéfalo y médula espinal. En 2 pacientes (11%) se encontró en el hemograma como única alteración la presencia de leucocitosis. En 13 pacientes se realizaron estudios para descartar enfermedad del colágeno con resultados normales. En todos los pacientes se realizaron determinaciones para VIH y hepatitis B y C siendo no reactivas en todos los casos. El estudio físico/químico del LCR fue realizado en todos los casos, en 11 pacientes (65%) el estudio del LCR fue normal en todos sus parámetros, en 6 pacientes (35%) se encontró hiperproteinorraquia. La presencia de BOC fue investigada en 13 de los sujetos con resultados negativos (tomando como valor positivo la presencia de 2 o más BOC), en todos los casos estas fueron determinadas durante el tiempo de internación de los mismos. Schwarz et al.6 reportan en estudios del LCR que solo el 19% presentaban un LCR normal, el valor medio de leucocitos en LCR fue de 52 (rango de 3-472 células), el 58% de los pacientes presentaron BOC positivas. Ketelslegers et al.8 reportaron en la población adulta que el 33% presentaron leucocitosis en sangre, en LCR el 68% presentaron aumento de leucocitos, y el 6% BOC positivas, estos no presentan diferencias significativas con lo reportado por estos autores cuando lo comparan con su población pediátrica.
Los estudios de RM fueron realizados en equipo de 1,5tesla. Se analizaron las secuencias de FLAIR, T2 y T1 con gadolinio (tabla 4). Las localizaciones más frecuentes fueron: lesiones supratentoriales subcorticales en 16 pacientes (94%), cortical 6 pacientes (35%), 10 pacientes (59%) en ganglios de la base, tronco encefálico 8 pacientes (47%), cerebelo 8 pacientes (47%), médula en 5 pacientes (29%) y cuerpo calloso en un paciente. Ketelslegers et al.8 reportaron en la población adulta que la localización más frecuente fue la supratentorial en el 92%, infratentorial y tronco encefálico 67% y médula en el 65%, en este trabajo no se encontró diferencia significativa con su población pediátrica. En nuestros pacientes todas las lesiones eran mayor a 1-2cm de tipo tumefactiva ninguna con imágenes sugerentes a EM. Schwarz et al.6 reportan que el 50% de sus pacientes tenían RM sugerentes a EM. En nuestra serie el patrón más frecuente fue el de lesiones que no captan contraste en 10 pacientes (59%). Entre las lesiones que sí captaron gadolinio el patrón más frecuente fue el de captación parcial en 5 pacientes (30%).
En un solo caso donde no se pudo llegar a diagnóstico por los métodos convencionales y se llegó al mismo a través de biopsia de encéfalo. Los hallazgos fueron compatibles con un proceso inflamatorio desmielinizante17.
En todos los casos la primera opción terapéutica considerada fue MP, de los cuales 13 pacientes (76%) presentaron «buena respuesta» sin necesidad de otro tratamiento. Gamaglobulina endovenosa (IgEV) fue implementada en aquellos pacientes que no experimentaron respuesta favorable a la MP. El recambio plasmático se llevó a cabo en 3 pacientes con «buena respuesta» en 2 de ellos. Un paciente no respondió a ninguna de las terapéuticas instrumentadas. La EMAD es una entidad poco prevalente en la población adulta y no existen ensayos clínicos controlados por lo que la estrategia de tratamiento está basada en series de casos17. Los corticoesteroides siguen siendo los fármacos de elección11,21–24. Algunas comunicaciones reportan remisión espontánea en casos de EMAD19,20. En la serie de Tenembaum et al.11 el 95% de los pacientes recibieron tratamiento con pulsos de MP. Ketelslegers et al.8 reportaron que en el 84% de los adultos y el 73% de los niños la MP fue el tratamiento de elección. El 8% de los adultos y 16% de los niños no requirieron tratamiento inmunosupresor.
En nuestra serie un paciente no respondió a ninguna de las terapéuticas aplicadas y murió en sala de cuidados intensivos a causa de complicaciones de la internación prolongada. En la literatura se reportaba una significativa tasa de mortalidad (10-30%) en pacientes con EMAD durante la primera semana de la enfermedad en especial en aquellos cuadros relacionados con sarampión25,26. En la actualidad la mortalidad es muy baja o nula según distintas series de casos24,27. Tenembaum et al.11 no reportan ningún óbito en su serie de 84 niños. Ketelslegers et al.8 reportaron una mortalidad de 12% para su población adulta y del 1% para la pediátrica. En general EMAD es considerada una entidad de que tiene un buen pronóstico, pero se describe un curso clínico más desfavorable en los adultos que en los niños8. Esta conclusión también es apoyada por los resultados de un estudio asiático donde los niños tienen un resultado favorable desde el punto de vista funcional con respecto a los adultos28.
Si bien la limitación de este trabajo es el de ser de tipo descriptivo retrospectivo, ilustra las características de un grupo de pacientes adultos con diagnóstico de EMAD en una población argentina. Según distintas publicaciones, nuestros hallazgos son similares a los reportados en otras series de EMAD en adultos (tabla 6). Un análisis comparativo con la población pediátrica parece indicar una mayor frecuencia de factores desencadenantes en esta última, en especial en relación con inmunizaciones.
Comparación de características clínicas, demográficas y métodos complementarios entre 3 series de EMAD en adultos
| Schwarz et al.* (%) | Ketelslegers et al.** (%) | Alonso et al. (%) | |
| Características clínicas y demográficas | |||
| Edad media en años | 33 | 35 | 29 |
| Sexo femenino | 65 | 62 | 59 |
| Antecedentes infecciosos | 46 | 75 | 41 |
| Antecedentes de vacunación | 0 | 0 | 0 |
| Localizaciones en RM | |||
| Supratentorial cortical | 8 | NR | 35 |
| Supratentorial subcortical | 38 | 33 | 94 |
| Tronco del encéfalo | 67 | 67 | 47 |
| Cerebelo | 31 | 42 | 47 |
| Médula | NR | 66 | 29 |
| Cuerpo calloso | 23 | NR | 6 |
| Estudio del LCR | |||
| Físico/químico normal | 19 | 28 | 65 |
| BOC | 58 | 58 | 0 |
NR: no reportado.
Al ser nuestro servicio un centro de referencia y de derivación, algunos pacientes diagnosticados y tratados son remitidos nuevamente a sus respectivos lugares de atención. En nuestra serie de casos, 12 (70%) de los pacientes tuvieron un seguimiento clínico por un período medio de 36 meses. Dos de los pacientes tuvieron una reagravación de la sintomatología dentro de los 3 meses del primer episodio, lo que no fue considerado una recurrencia9. La EMAD sigue siendo un diagnóstico de exclusión donde es importante aplicar algoritmos para la búsqueda de etiologías alternativas con tratamiento específico (p. ej. encefalitis virales, linfomas etc.). La ausencia de un marcador biológico dificulta el diagnóstico principalmente al inicio de la enfermedad y lo que lleva a realizar rigurosos estudios para arribar al mismo. El reconocimiento de la presentación tanto clínica como por los diferentes métodos de complementarios como así también, la evolución y seguimiento serán importantes para la identificación de la misma y la implementación del tratamiento apropiado.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.