Las epilepsias de la región posterior (ERP) comprenden las que comprometen los lóbulos occipitales, la región parietal por detrás del surco poscentral y los límites temporales posteriores, y corresponden a menos del 10% de epilepsias focales. La cirugía de este tipo de epilepsias es poco frecuente, debido principalmente a la alta proporción de áreas elocuentes de esta región.
ObjetivoEvaluar los resultados y estrategias de la cirugía en ERP en nuestro medio.
Material y métodosSe analizaron retrospectivamente pacientes con epilepsia refractaria sometidos a cirugía de la ERP entre los años 2005 y 2008. La evaluación prequirúrgica fue realizada mediante la semiología ictal, IRM de alta resolución, EEG interictal, V-EEG ictal, evaluación neuropsicológica, EEG invasivo y mapeo funcional por estimulación eléctrica. El pronóstico de crisis fue evaluado con escala de Engel, con un seguimiento mínimo de un año.
ResultadosSeis pacientes fueron incluidos, con un seguimiento medio de 2 años (1 a 3 años). La edad promedio fue de 23 años (1 a 33 años), con una duración media de la epilepsia de 18 años (0 a 33 años). Las etiologías fueron: tumores de bajo grado (2 pacientes), displasias corticales focales (2) y gliosis (2). Durante el seguimiento, 3 pacientes se encontraban libres de crisis, uno continúa con auras y 2 presentaron una reducción mayor del 50% de las crisis. Dos pacientes presentaron exacerbación de un déficit neurológico previo (hemianopsia).
ConclusiónLa cirugía de la ERP es posible realizarla en nuestro medio, presenta un buen pronóstico de crisis y el déficit posquirúrgico es aceptable.
Posterior cortex epilepsy (PCE) includes those that affect the occipital lobes, the posterior parietal cortex, behind the postcentral sulcus and the posterior temporal boundaries. Less than 10% of focal epilepsy affects the posterior cortex. Epilepsy surgery of this region is rarely performed. This is mainly due to the high proportion of eloquent areas in this region.
ObjectiveTo evaluate seizure outcome and strategies of the epilepsy surgery in PCE in our country.
Material and methodsWe retrospectively analyzed patients with medically refractory posterior epilepsy who underwent resective surgery between 2005 to 2008 in Argentine. The preoperative evaluation included ictal semiology, high-resolution magnetic resonance imaging (MRI), interictal EEG, ictal V-EEG, neuropsychological evaluation, invasive EEG and functional mapping by electrical stimulation. The outcome was evaluated with Engel scale, with a minimum of one year follow up.
ResultsSix patients were included, with a median follow up of 2 years (1 to 3 years). The median age was 23 years (1 to 33 years) with a median duration of epilepsy of 18 years (0 to 33 years). Aetiology: Low-grade tumors (2 patients), focal cortical dysplasia (2) and gliosis (2). Seizure outcome: 3 patients are seizures free, one has auras and 2 have a reduction greater than 50% of seizures. Two patients had exacerbation of previous neurological deficits (hemianopsia).
ConclusionPosterior epilepsy surgery is a feasible option in our region. Our results show a seizure outcome comparable to other developed counties and show an acceptable postoperative deficit.
La cirugía de la epilepsia representa actualmente la mejor alternativa terapéutica en pacientes con epilepsia resistente a los fármacos1,2. La epilepsia del lóbulo temporal es la más común de las epilepsias focales (70-80% de las series) susceptible a tratamiento quirúrgico, con un pronóstico favorable, llegando al 60-70% de pacientes libres de crisis luego de la cirugía2,3. Las epilepsias de la región posterior (ERP) representan entre el 4-13% de todas epilepsias focales, debido quizás a la menor superficie cortical que posee esta zona. Dicha región comprende los lóbulos occipitales, las regiones parietales por detrás del surco poscentral y los límites posteriores de ambos lóbulos temporales4. Estas regiones son analizadas en conjunto debido a que los límites anatómicos y funcionales son imprecisos y por mostrar una semiología y pronóstico similar desde el punto de vista quirúrgico5–7. La cirugía de este tipo de epilepsias es aún menos frecuente, y corresponde a menos del 5% en las distintas series quirúrgicas. Ello se debe principalmente a la presencia de áreas elocuentes en esta región (funciones visuales, gnósicas, práxicas y de lenguaje en el hemisferio dominante) y a la dificultad en el análisis para localizar un foco epileptógeno en dicho territorio, debido a la rápida propagación de las descargas epileptógenas hacia regiones vecinas. Distintos trabajos mostraron un pronóstico variable del 25 al 90% de pacientes libres de crisis luego de la cirugía de ERP8–16. El diagnóstico preciso en la evaluación prequirúrgica de casos de ERP requiere una óptima combinación de estudios clínicos, neurofisiológicos (invasivos y no invasivos) y neurorradiológicos17. Éstos son de difícil acceso en nuestro medio por razones económicas y por el limitado número de centros que cuentan con adecuados recursos tecnológicos y humanos especializados en este tipo de tratamientos. Esta situación limita la posibilidad de realización de la cirugía de la ERP en países subdesarrollados como el nuestro.
El objetivo de este trabajo fue evaluar los resultados y las estrategias utilizadas en cirugía de la ERP en dos centros de Argentina.
Materiales y métodosSelección de pacientesSe revisaron 36 historias clínicas de pacientes con epilepsia resistente a los fármacos sometidos a cirugía de la epilepsia en el Hospital Italiano de Buenos Aires y el Instituto Argentino de Investigación Neurológica, entre los años 2005 y 2008. De ellos se incluyeron a 6 pacientes sometidos a cirugía de la epilepsia con ERP con un seguimiento mínimo de un año.
Protocolo de evaluación prequirúrgicaLa evaluación prequirúrgica incluyó en todos los pacientes estudios de fase 1 o no invasivos y de fase 2 o invasivos. Los estudios no invasivos incluyeron la anamnesis y análisis de la semiología ictal, el examen físico neurológico y control prolongado de vídeo-EEG de scalp utilizando el sistema internacional 10–20 de colocación de electrodos, con el agregado de electrodos temporales anteriores basales (FT9 y FT10). Las descargas interictales y el patrón ictal se analizaron por distribución lobar, lateralidad y extensión. A todos se les realizó evaluación neuropsicológica acorde con la edad. A todos los pacientes se les realizaron imágenes por resonancia magnética (IRM) de alta resolución en equipo de 1,5 Tesla con protocolo estandarizado de epilepsia.
Además se utilizaron neuroimágenes funcionales en los casos de incongruencia entre EEG interictal y/o ictal y/o IRM cerebral, o por proximidad de hipótesis de zona epileptógena (ZE) con áreas anatómicas elocuentes o por ausencia de lesión epileptógena en IRM cerebral. A 2 pacientes con sospecha de ZE cercana o en área del lenguaje se les realizó IRM funcional para determinar lateralidad, localización o determinar su relación con la lesión anatómica en un caso. A una paciente con múltiples crisis diarias y discordancia entre EEG interictal/ictal y lesión en IRM cerebral se le realizó un SPECT ictal dentro de los 15s de iniciada la crisis. Y a un paciente con IRM cerebral normal se le realizó PET cerebral interictal con fluorodesoxiglucosa (FDG). A 2 pacientes se les realizó campimetría visual prequirúrgica y posquirúrgica debido a que tenían sospecha de ZE cercana o coincidente con el área visual primaria (área 17 de Brodman) y/o con la vía visual (radiaciones ópticas).
Finalmente, a todos los pacientes se les realizó control invasivo utilizando grillas subdurales (3 pacientes) o grillas subdurales más tiras subdurales (1 paciente) o grillas subdurales más electrodos profundos (2 pacientes), con los siguientes propósitos: confirmar la zona de comienzo ictal si la información de los estudios no invasivos no fueron concordantes, determinar la extensión de la ZE y su relación con áreas funcionales elocuentes, utilizando mapeo funcional por estimulación eléctrica cortical directa. Se utilizaron grillas subdurales o grillas subdurales más tiras subdurales en pacientes con sospecha de ZE exclusivamente neocorticales y/o cercanas a áreas elocuentes del lenguaje o visual que luego fueron mapeadas funcionalmente. Se utilizaron grillas subdurales más electrodos profundos en los casos que existía además sospecha de ZE o propagación precoz del EEG ictal no invasivo a regiones temporales mesiales.
Cirugía y anatomía patológicaLas cirugías se aplicaron en dos tiempos. En el primer tiempo se realizó la colocación de electrodos profundos, grillas y/o tiras subdurales para proceder a la monitorización invasiva, y en un segundo tiempo se realizó la resección quirúrgica propiamente dicha. Esta última se clasificó según el tipo en:
- •
Lesionectomía: cuando sólo se resecaron la lesión y un escaso margen de seguridad.
- •
Lobectomía: cuando la resección fue ampliada a todo el lóbulo circundante a la lesión.
- •
Resección multilobar: cuando se resecaron dos o más regiones de diferentes lóbulos.
Todas las lesiones resecadas fueron analizadas histológicamente.
PronósticoEl pronóstico de crisis fue evaluado mediante la escala de Engel, considerando la información obtenida en la última consulta de los pacientes con un seguimiento mínimo de un año. Se evaluaron los déficit neurológicos posquirúrgicos mediante el examen neurológico en la primera semana, a los 6 meses y al año luego de la cirugía.
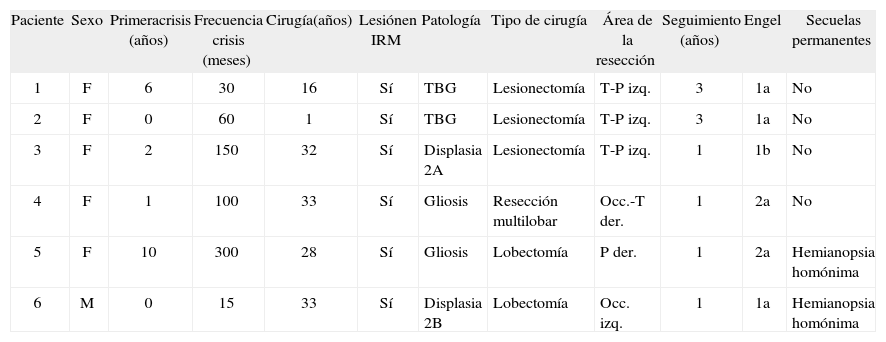
ResultadosA los 6 pacientes incluidos se les realizaron estudios no invasivos tanto como estudios invasivos antes de la cirugía por los motivos mencionados anteriormente. Los datos epidemiológicos y quirúrgicos se resumen en la tabla 1.
- –
Datos epidemiológicos. Cinco pacientes eran de sexo femenino y uno masculino. La media de edad al momento de la cirugía fue de 23 años (de 1 a 33 años). La duración de la epilepsia, previa a la cirugía, tuvo en rango de entre 0 a 33 años (media de 18 años). La frecuencia de crisis preoperatoria tuvo un promedio de 92,5 crisis mensuales.
- –
Datos clínicos y quirúrgicos. Todos los pacientes presentaban lesiones identificables en las IRM, aunque sólo 4 de 6 lesiones tuvieron relación con la ZE. El análisis histopatológico reveló tumor de bajo grado en 2 pacientes (un astrocitoma y un neurocitoma); dos pacientes presentaban malformaciones del desarrollo cortical, siendo éstas displasias corticales focales (una de tipo II A y otra de tipo II B de Taylor), y finalmente gliosis secundarias a secuelas de meningoencefalitis tuberculosa en un paciente y gliosis posquirúrgica en otro. En cuanto al tipo de cirugía, a dos pacientes se les realizó lesionectomía; a otros dos, lobectomía; y a dos, resecciones multilobares. La localización de las resecciones fueron temporoparietales en 3 pacientes, occipitotemporal en un paciente, parietal en un paciente y occipital en otro.
- –
Resultados posquirúrgicos. Durante el seguimiento, que fue de una media de 2 años (1 a 3 años), 3 pacientes se encuentran libres de crisis (Engel 1a), uno continúa sólo con auras visuales simples (Engel 1b) y 2 presentaron una reducción mayor al 50% de las crisis (Engel 2a). En todos los casos, la recurrencia de las crisis se presentó antes de los 4 meses, con un tiempo medio de recurrencia de crisis de 2 meses. En cuanto a las secuelas posquirúrgicas, un paciente presentó hemiparesia derecha y otro, heminegligencia y hemiparesia izquierda. Estas secuelas fueron transitorias, y a los 6 meses de la cirugía habían remitido completamente. Otros 2 pacientes presentaron exacerbación del déficit visual previo (hemianopsia homónima). Sólo estas dos secuelas continuaban en forma permanente al año de la cirugía.
– Datos epidemiológicos y quirúrgicos de los pacientes
| Paciente | Sexo | Primeracrisis (años) | Frecuencia crisis (meses) | Cirugía(años) | Lesiónen IRM | Patología | Tipo de cirugía | Área de la resección | Seguimiento (años) | Engel | Secuelas permanentes |
| 1 | F | 6 | 30 | 16 | Sí | TBG | Lesionectomía | T-P izq. | 3 | 1a | No |
| 2 | F | 0 | 60 | 1 | Sí | TBG | Lesionectomía | T-P izq. | 3 | 1a | No |
| 3 | F | 2 | 150 | 32 | Sí | Displasia 2A | Lesionectomía | T-P izq. | 1 | 1b | No |
| 4 | F | 1 | 100 | 33 | Sí | Gliosis | Resección multilobar | Occ.-T der. | 1 | 2a | No |
| 5 | F | 10 | 300 | 28 | Sí | Gliosis | Lobectomía | P der. | 1 | 2a | Hemianopsia homónima |
| 6 | M | 0 | 15 | 33 | Sí | Displasia 2B | Lobectomía | Occ. izq. | 1 | 1a | Hemianopsia homónima |
T: temporal; P: parietal; occ: occipital; izq: izquierda; der: derecha.
Presentamos nuestra experiencia sobre 6 pacientes con cirugía de ERP en nuestro medio, en un periodo de 3 años. Se trata de la primera publicación de este tipo de cirugía en la Argentina. Nuestros resultados muestran un buen pronóstico de la epilepsia, con un índice de pacientes libre de crisis y pacientes con mejoría de las crisis similares a la de las series más amplias de países desarrollados8–16. No existen protocolos estandarizados para la evaluación prequirúrgica de ERP, pero como en el resto de las cirugías de la epilepsia extratemporales, es necesario optimizar y combinar estudios clínicos, neurofisiológicos (invasivos y no invasivos) y neurorradiológicos de acuerdo con la complejidad clínica de cada caso en particular7. En un interesante trabajo, Sang Kun Lee et al17 observaron que el éxito de la cirugía de la epilepsia de regiones posteriores como la occipital, se relacionaba con la concordancia de al menos tres modalidades de investigación prequirúrgica: EEG interictal e ictal, IRM cerebral, SPECT ictal y PET con FDG. En dicha serie, encontraron que 10 de 12 pacientes con concordancia de 3 o 4 modalidades permanecieron libres de crisis luego del tratamiento quirúrgico. Por otra parte, dicha investigación no encontró relación entre el pronóstico quirúrgico de crisis y una única modalidad en particular.
Nosotros, al igual que otros autores, opinamos que los métodos diagnósticos no invasivos deben ser realizados sistemáticamente a todos los pacientes con ERP, candidatos a cirugía de la epilepsia, refiriéndonos a una anamnesis detallada de la semiología ictal, EEG interictal, vídeo-EEG, IRM cerebral de alta resolución y evaluación neuropsicológica17–20. En nuestra serie todos los pacientes contaron con dichas evaluaciones. En cambio, estudios como el SPECT ictal no son realizados de rutina y se deben considerar en casos de ausencia de lesión epileptógena en la IRM o ausencia de clara concordancia entre los métodos no invasivos (EEG interictal, vídeo-EEG e IRM cerebral); y siempre que la frecuencia de crisis sea lo suficientemente alta, para lograr administrar el contraste intravenoso dentro de los primeros segundos de iniciada la crisis. Sólo a una paciente de nuestra serie que tenía un vídeo-EEG con crisis de probable origen temporal neocortical y una lesión mesial frontoparietal atrófica y con una frecuencia de crisis diarias, se le realizo SPECT ictal que evidenció un hiperflujo ictal temporal neocortical que coincidió con los hallazgos ictales del EEG intracerebral.
El PET cerebral con FDG puede aportar información adicional, también en casos de ausencia de lesión epileptógena en la IRM o ausencia de clara concordancia entre los métodos no invasivos; no es necesaria la presencia de una alta frecuencia de crisis, ya que el mismo se realiza en el periodo interictal. En nuestra casuística se realizó a un solo paciente con IRM cerebral sin lesión identificada, hasta que dicho estudio mostró un hipometabolismo en la región occipital mesial, corroborándose luego por una nueva IRM con cortes finos en dicha región. Tanto el SPECT ictal como el PET cerebral con FDG pueden ayudar a una mejor planificación de la implantación neurofisiológica invasiva en los casos que sea necesario17.
Por otra parte, debe considerarse la realización de IRM funcional o test de Wada en los casos con sospecha de ZE cercana o en área del lenguaje para predecir riesgo de déficit del mismo poscirugía17. En dos de nuestros pacientes con lesiones cercanas al área de Wernicke se realizó IRM funcional, que confirmó en ambas la vecindad del lenguaje con las lesiones. La utilización de monitorización neurofisiológica invasiva debe ser utilizada para confirmar la zona de comienzo ictal si la información de los estudios no invasivos no fue concordante, y para determinar la extensión de la ZE y su relación con áreas funcionales elocuentes a través del mapeo funcional por estimulación eléctrica cortical directa5–7,9,18,19. En nuestra serie fue necesaria la monitorización neurofisiológica invasiva en todos los pacientes: en 2 pacientes para confirmar la ZE, por discordancia entre EEG interictal, el vídeo-EEG y las IRM cerebral, y en los 4 restantes por sospecha de ZE cercana o coincidente con áreas elocuentes: en 2 pacientes con las áreas del lenguaje, en 1 paciente con las áreas del lenguaje y visual primaria, y en otro paciente con el área somatosensitiva primaria.
En cuanto a los factores de riesgo de recurrencia de crisis posquirúrgicas en cirugía de ERP, distintos autores encontraron que la frecuencia de crisis prequirúrgica (> 20/mes), la etiología diferente de TBG o MDC, las resecciones limitadas (lesionectomía) y la persistencia de descargas interictales posquirúrgicas en el EEG fueron los predictores más significativos de falta de eficacia de la cirugía18–20. En nuestra serie, los 3 pacientes con recurrencia fueron los que presentaban mayor número de crisis prequirúrgicas (> 150/mes), y de ellos 2 presentaban lesiones glióticas secundarias.
Por otra parte, Jehi et al18 observaron que la efectividad de la cirugía disminuye en el tiempo. Así, en su análisis de 57 pacientes seguidos luego de la cirugía de ERP, el 73% estaba libre de crisis a los 6 meses de seguimiento, pero esta cifra caía a menos del 50% luego de los 6 años. Esto explicaría en parte la variabilidad en el pronóstico entre las diferentes series. Nosotros también observamos que la mayoría de los pacientes que presentaban recurrencia de crisis lo hacían dentro de los primeros 4 meses19.
En este estudio no analizamos la semiología de las crisis ni los hallazgos electroencefalográficos, así como tampoco su relación con la localización de la lesión ni con los resultados posquirúrgicos debido al escaso número de pacientes de nuestra serie.
En cuanto a las secuelas posquirúrgicas, nuestros datos son comparables con los descritos por otros autores6,7,17,18, correspondiendo a dos casos de exacerbación del déficit del campo visual previo. Este déficit fue previsto, ya que ambos correspondían a lobectomías occipitales completas. Sin embargo, debido a la realización de mapeo funcional en todos los casos, a través de la monitorización invasiva, no se observaron déficit neurológicos permanentes de otros dominios, a pesar de su adyacencia con las zonas corticales resecadas.
ConclusionesEl tratamiento quirúrgico de la ERP es poco frecuente en nuestro medio, pero es posible realizarla con éxito si se utilizan los métodos diagnósticos necesarios, presentando buen pronóstico de crisis y déficit posquirúrgico aceptable, similar a los comunicados en otras series de países desarrollados. La mejora en los recursos tecnológicos y la accesibilidad a ellos, junto con la capacitación del personal de salud implicada en este tipo de tratamiento, podrían facilitar la realización de este tipo de tratamiento en nuestro país y en Latinoamérica.