La fatiga es un síndrome multidimensional, complejo y frecuente en los pacientes con daño cerebral sobrevenido, influyendo negativamente en el proceso de neurorrehabilitación. Aparece desde etapas tempranas luego de la lesión y puede permanecer en el tiempo, recuperadas o no las secuelas del daño. La fatiga depende de circuitos neuronales superiores y se define como una percepción anómala de sobreesfuerzo. Tiene una prevalencia de 29% a 77% tras el ictus, 18% a 75% tras el traumatismo craneoencefálico (TCE) y 47% a 97% tras tumores cerebrales. La fatiga se asocia a factores como sexo femenino, edad avanzada, familia disfuncional, antecedentes patológicos específicos, estado funcional (p. ej. fatiga previa a la lesión), comorbilidades, estado anímico, discapacidad secundaria y uso de ciertos fármacos. Su estudio se realiza sobre todo a partir de escalas como la Escala de severidad de fatiga (Fatigue Severity Scale). Hoy en día existen avances en herramientas de imagen para su diagnóstico como la resonancia magnética funcional. En cuanto a su tratamiento, no existe aún terapia farmacológica definitiva, sin embargo, existen resultados positivos con terapias dentro de la neurorrehabilitación convencional, terapia lumínica y el uso del neurofeedback, estimulación eléctrica y magnética transcraneal. Esta revisión tiene como objetivo ayudar al profesional dedicado a la neurorrehabilitación a reconocer factores asociados modificables, así como terapias a su alcance para disminuir sus efectos nocivos en el paciente.
Fatigue is a complex, multidimensional syndrome that is prevalent in patients with acquired brain damage and has a negative impact on the neurorehabilitation process. It presents from early stages after the injury, and may persist over time, regardless of whether sequelae have resolved. Fatigue is conditioned by upper neuronal circuits, and is defined as an abnormal perception of overexertion. Its prevalence ranges from 29% to 77% after stroke, from 18% to 75% after traumatic brain injury, and from 47% to 97% after brain tumours. Fatigue is associated with factors including female sex, advanced age, dysfunctional families, history of specific health conditions, functional status (eg, fatigue prior to injury), comorbidities, mood, secondary disability, and the use of certain drugs. Assessment of fatigue is fundamentally based on such scales as the Fatigue Severity Scale (FSS). Advances have recently been made in imaging techniques for its diagnosis, such as in functional MRI. Regarding treatment, no specific pharmacological treatment currently exists; however, positive results have been reported for some conventional neurorehabilitation therapies, such as bright light therapy, neurofeedback, electrical stimulation, and transcranial magnetic stimulation. This review aims to assist neurorehabilitation professionals to recognise modifiable factors associated with fatigue and to describe the treatments available to reduce its negative effect on patients.
El daño cerebral sobrevenido (DCS) es reconocido por la Organización Mundial de la Salud como causa de primer orden de discapacidad en todo el mundo1. Dentro del DCS el ictus es la enfermedad más frecuente. En España tiene una incidencia promedio 150 a 200 casos por 100.000 habitantes/año2, similar al traumatismo craneoencefálico (TCE) (200 por 100.000 habitantes/año)3 y seguido por otras afectaciones menos frecuentes como la cirugía de tumores cerebrales, encefalopatías y encefalitis. La fatiga es un proceso frecuente en los pacientes con DCS que influye de manera negativa en los procesos de neurorrehabilitación, ocasionando a largo plazo, y por sí misma, una mayor restricción en la participación del paciente en el tratamiento y en su recuperación. Esta revisión está realizada con la voluntad de reunir el conocimiento científico actual para intentar arrojar luz sobre algunos de los aspectos de la fatiga en el DCS.
DefiniciónLa fatiga se define como la sensación de estar exhausto, con baja energía y con aversión al esfuerzo, que se puede desarrollar durante una actividad física o mental y que, generalmente, no disminuye con el reposo4,5. La diferencia entre los conceptos del estado de fatiga y el de cansancio al esfuerzo radica en que este último es proporcional al esfuerzo llevado a cabo, mientras que en el estado de fatiga existe una percepción exagerada y no proporcional a tal6.
La fatiga es un concepto multidimensional y complejo, con componentes psicológicos, motivacionales, situacionales y físicos7. Similar a otros procesos cerebrales alterados tras un DCS, la fatiga es consecuencia de una percepción anómala de sobreesfuerzo y consecuente disejecución de vías motoras descendentes8,9. A partir de este concepto se han sugerido distintas clasificaciones de fatiga.
Algunos investigadores dividen la fatiga entre central y periférica10–13. Otros autores incluso distinguen entre fatiga primaria y secundaria. La primaria sería el resultado de una alteración del mecanismo neuronal directamente involucrado en el proceso de percepción de la fatiga, mientras que la secundaria sería una manifestación de las secuelas del daño neurológico (p. ej. alteraciones del sueño, dolor o cambios de ánimo)14. Tras la revisión de la literatura podemos considerar que hay 4 definiciones que son las más utilizadas para referir los diferentes conceptos de la fatiga. La fatiga general o rasgo de fatiga (fatigue trait, en inglés) referida por un sujeto en reposo respecto a varios ámbitos de su vida. Una de las escalas más utilizada para medir esta fatiga general es la escala Fatigue severity scale (FSS). También, frecuentemente, se hace referencia al estado de fatiga (fatigue state, en inglés), referido a cuanto se reduce la fuerza muscular después de un tiempo, sobre todo, tras una actividad motora. Usualmente se utilizan tareas motoras máximas o submáximas para su medición. Cuando nos referimos a fatiga mental o cognitiva hacemos alusión a un concepto similar al estado de fatiga motora, pero midiendo los tiempos de reacción en relación con tareas cognitivas. El cuarto tipo sería la fatiga percibida. Aquella percibida subjetivamente por el sujeto después de un esfuerzo muscular o una tarea cognitiva. Una de las escalas más utilizada para este fin es la escala de Borg o similares.
Existen, por supuesto, otras definiciones y valoraciones de fatiga que dependen de los objetivos específicos de cada estudio, por ejemplo, las medidas de fatiga de tipo emocional; sin embargo, consideramos que estas otras valoraciones se alejan de los objetivos de esta revisión.
EpidemiologíaLa prevalencia de fatiga en la población general se encuentra entre un 3% a 23%7,15.
En el ámbito de la neurología existen amplias referencias al respecto en otras enfermedades, como la esclerosis múltiple (80-90%)16. En otro ámbito del daño neurológico sobrevenido existe referencia de una prevalencia del 50-57% desde etapas tempranas y persistiendo en el tiempo, en el daño medular17.
Estudios recientes definen la prevalencia de la fatiga en poblaciones con DCS, pero muchos presentan escasos números de muestra y distintas herramientas metodológicas18,19.
Alrededor del 43% de personas con DCS que refieren fatiga no han sido diagnosticadas de la misma ni han recibido tratamiento específico20, a pesar de que la presencia de fatiga en enfermedades de DCS implica un peor pronóstico9,21–25.
La prevalencia reportada en poblaciones postictus es de un 29-77%5,8,9,13 (a pesar de que los pacientes de ictus reportan fatiga en menor medida26), de entre un 18-75% post TCE14 y de 47-97% tras tumores cerebrales27,28. En población infantil con DCS los estudios indican una prevalencia del 58-76%12.
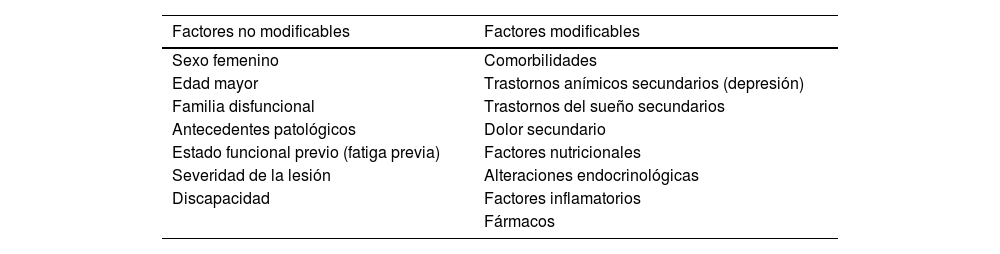
Factores asociados a la fatiga en el daño cerebral sobrevenidoDiversos factores influirían no solo en la presentación de la fatiga, sino también en su permanencia o empeoramiento en el tiempo. Estos se pueden dividir entre modificables y no modificables, como se observa en la tabla 129,30.
Factores asociados a la fatiga en el daño cerebral sobrevenido
| Factores no modificables | Factores modificables |
|---|---|
| Sexo femenino | Comorbilidades |
| Edad mayor | Trastornos anímicos secundarios (depresión) |
| Familia disfuncional | Trastornos del sueño secundarios |
| Antecedentes patológicos | Dolor secundario |
| Estado funcional previo (fatiga previa) | Factores nutricionales |
| Severidad de la lesión | Alteraciones endocrinológicas |
| Discapacidad | Factores inflamatorios |
| Fármacos |
Las comorbilidades más habituales durante los primeros meses del DCS son los trastornos anímicos, del sueño, y el dolor tanto somático como neuropático o mixto (tanto por el dolor en sí mismo como por el tratamiento que esto conlleva). La depresión sería el trastorno anímico frecuente en DCS relacionado con la fatiga26. En cuanto a trastornos del sueño relacionados con la fatiga tras el DCS, el insomnio sería el más frecuente (21-23%), seguido de hipersomnia, SAHS obstructiva, movimiento periódico de piernas nocturno, narcolepsia, además de síntomas relacionados como pesadillas, pobre eficiencia de sueño, latencia prolongada del sueño, despertares tempranos y somnolencia diurna10,19,31,32.
Una mayor discapacidad tras el DCS estaría relacionada con un mayor grado de dependencia y consecuentemente con la presencia de fatiga8,9,15,33–37.
El grado de afectación cognitiva y alteraciones asociadas como negligencias, se han asociado a mayor grado de fatiga, sin embargo una revisión sistemática de Lagogianni et al. en 2018 detectó evidencia insuficiente como para confirmar o refutar dicha relación13. Parece ser que la alteración cognitiva en relación con la fatiga es más de tipo subjetivo con respecto a lo que finalmente demuestran pruebas objetivas que sí sugieren una relación en cuanto a aspectos de atención, memoria y velocidad de procesamiento de la información11,38. Del mismo modo, se ha estudiado la relación entre afectaciones visuales (visión borrosa, diplopía y trastornos del campo visual) secundarias al DCS (50-75%) y la fatiga, debido a su efecto en habilidades cognitivas39.
Algunos parámetros analíticos inflamatorios se han relacionado con una mayor posibilidad de presentar fatiga post ictus, como la IL-1 beta en sangre40. Por otro lado, factores nutricionales como anemia, déficits de vitamina B1, 12 y D se han relacionado, también, con la posibilidad de mayor presentación de fatiga en pacientes tras DCS5,7,9,11, o factores endocrinológicos como el déficit de TSH que sugiere un rol neurohormonal asociado41–43.
La medicación utilizada, tanto en etapas subagudas como posteriores durante el manejo del daño cerebral, como antihipertensivos (bloqueadores beta), antieméticos, ansiolíticos, antidepresivos (tricíclicos), corticoides, neurolépticos, hipnóticos (benzodiacepinas) y antiepilépticos podrían ser causa de fatiga o potenciarla9,28. Un estudio americano de Chen et al. demuestra que la severidad de la lesión y su localización estarían más relacionados con la fatiga posdaño en etapa temprana, mientras que las comorbilidades y el uso de medicaciones referidas estarían más relacionados con la fatiga posdaño en etapas crónicas44.
FisiopatologíaLa fisiopatología de la fatiga en DCS es desconocida. Sin embargo, como síndrome diferenciado y presente en múltiples enfermedades neurológicas, el conocimiento de las bases fisiopatológicas en afecciones no asociadas a DCS podría esclarecer sus mecanismos y posibles tratamientos16.
Se han propuesto diferentes factores como posibles desencadenantes: al nivel neuronal y de neurotransmisión una alteración de la excitabilidad cortical, al nivel neuroanatómico la localización de lesiones específicas y en el genético y epigenético alteraciones en mecanismos metabólicos e inflamatorios.
En el ámbito de la neurofisiopatológía la hipótesis más aceptada para comprender la fatiga post DCS propone que el balance entre la información sensorial aferente y la actividad eferente motora demodulada está afectado, lo que implicaría una percepción de ejecución excesiva y no atenuada, que finalmente desencadenaría en una sensación de fatigabilidad4,10,40,45.
Neuroanatómicamente diversos estudios muestran que el daño neural asociado a la fatiga no tiene que ser exclusivamente encefálico. La lesión de motoneuronas espinales tras un daño medular o las lesiones neuromusculares en el sistema periférico podrían alterar el equilibro de información córtico-subcortical aferente y eferente desencadenando los mecanismos que conllevarían la presencia de la fatiga, entendida para algunos autores como la fatiga periférica6,46.
La lesión de estructuras cerebrales específicas, además, podría estar involucrada con la etiología de la fatiga entendida como central: sustancia reticular ascendente (SRA), tálamo, hipotálamo, núcleos basales, sistema límbico, circunvolución cingulada anterior, corteza parietal y frontomedial. Estas mismas estructuras intervienen en funciones cognitivas superiores como la atención, concentración, tiempo de respuesta y procesamiento de ejecución, y por ello se llega a interpretar el concepto de fatiga mental o cognitiva11,42,47–51.
Desde el punto de vista metabólico e inflamatorio estudios de fatiga post TCE (sobre todo severo), muestran un posible origen neuroendocrinológico involucrando un hipopituitarismo secundario, tanto por lesión directa e inflamatoria del traumatismo, como por una respuesta autoinmune posterior. Esto provocaría alteraciones hormonales que finalmente favorecerían la persistencia de la fatiga en el tiempo11,41.
Por otro lado, se ha propuesto que variaciones en los mecanismos inflamatorios podrían estar implicados en la génesis de la fatiga en el DCS. Pequeños estudios de cohorte han evidenciado aumentos en IL-6 y IL-1 beta, así como disminución de antagonistas del receptor IL-1 y de IL-9 en pacientes con fatiga postictus. Además, se han observado mecanismos por los que citoquinas proinflamatorias alterarían la actividad de neurotransmisores del tipo hipocretina, serotonina, norepinefrina y dopamina con posterior formación de metabolitos neurotóxicos que conllevarían una mayor tendencia a la neurodegeneración52–55. Otros estudios describen una correlación directa del aumento de la proteína C reactiva con el grado de fatiga post ictus.
Finalmente, pequeños estudios evidencian polimorfismos genéticos involucrados en los mecanismos inmunológicos descompensados presentes en los pacientes con fatiga postictus, que podría explicar un mecanismo molecular más complejo5.
Fatiga postictusEl ictus es la primera causa de muerte y discapacidad en muchos países del mundo. La falta de una definición universal de fatiga no ha permitido determinar con exactitud la prevalencia e incidencia que puede presentar.
Desde las primeras 24-48horas de ingreso hospitalario postictus el paciente puede experimentar fatiga con peores resultados de recuperación e incremento de la mortalidad. Su presentación viene, generalmente, acompañada de alteraciones ansioso-depresivas, persistiendo incluso resuelto el trastorno psiquiátrico5,8.
Distintos estudios reportan su mantenimiento en el tiempo o de mínimo aumento de intensidad hasta el primer y segundo año posterior al ictus, siendo más persistente la fatiga mental respecto a la física15,21,29,30,56,57.
Demográficamente la fatiga post ictus sigue el patrón de los factores relacionados con el DCS referidos previamente, y no parece tener relación con el estado civil o el destino al alta. Se correlaciona con un peor desempeño y capacidad cognitiva, sin relación con el nivel de estudios previo y con una menor reinserción laboral5,8,25,56,58,59. Además, la persistencia de la fatiga postictus implicaría una mala adherencia a las terapias rehabilitadoras, y por ende una mayor posibilidad de discapacidad al alta60.
La fatiga es más frecuente en los ictus que en los accidentes isquémicos transitorios61, siendo más frecuente en personas que han sufrido ictus de repetición o ictus hemorrágicos. Sin embargo, el tamaño del ictus no parece influir en la presentación de la fatiga, presentándose con igual frecuencia y prevalencia en los ictus menores (NIHSS≤5)15. Como se ha descrito anteriormente, la localización de una lesión estaría igualmente asociada a la posibilidad de presentar fatiga62–64.
La presencia de leucoaraiosis o encefalopatía de pequeño vaso, así como la presencia de factores de riesgo cardiovascular, otras enfermedades asociadas a DCS (p. ej. crisis epilépticas) y otras comorbilidades (p. ej. descompensaciones infecciosas o metabólicas) podrían estar asociadas a una mayor presencia de fatiga40,65.
Fatiga postraumatismo craneoencefálicoEl TCE es muy frecuente dentro de las unidades de neurorrehabilitación, por eso es la segunda enfermedad más estudiada, con unas prevalencias de fatiga post TCE altas34. Si bien la gran mayoría de TCE son leves (80-95%), con recuperación de síntomas generales en 3 a 6 meses, existen síntomas residuales silentes conocidos como posconmocionales, incluida la fatiga, con influencia negativa en la reinserción social66–71. Un estudio en jugadores de rugby profesional determinó una prevalencia de fatiga del 14,1%, el síntoma más habitual, solo seguido por cervicalgia (11,5%)72. En general, suele ser identificado como el síntoma somático más comúnmente expresado por los pacientes que han sufrido TCE17, y como el peor síntoma secundario73. Además, una revisión en población pediátrica12 concluye que la prevalencia de fatiga post DCS en esta población está en torno a un 61,7-64,2%.
En el TCE de mayor gravedad la queja de fatiga está influida por la falta de consciencia de síntomas del paciente a consecuencia de la afectación cognitiva asociada al daño axonal difuso, pero también dependiente del instrumento de medición utilizado y de la fuente de información (paciente o familiar/cuidador).
Según varios estudios longitudinales7,69,73,74 el 33% de los pacientes post TCE pueden seguir presentando fatiga significativa a los 6 meses (incluso habiéndose recuperado de los síntomas funcionales). Uno de dichos estudios73 indica que hasta un 73% de los pacientes podrían presentar fatiga a los 5 años produciendo un gran impacto en la calidad de vida de las personas. Bushnik et al. realizaron un estudio longitudinal de pacientes con fatiga post TCE observando que muchos mejoraban tras los primeros 6-12 meses cuando los síntomas de la etapa aguda del TCE remitían. Otros pacientes continuaban con la sensación de fatiga llegando a empeorar a los 18-24 meses en asociación con peor calidad de sueño y ausencia de mejoría funcional o cognitiva75. Algún estudio identifica mayor prevalencia de fatiga (mental) en los TCE moderados o severos en población adolescente y joven76. Sin embargo, una revisión sistemática no encuentra relación entre prevalencia y tipo o grado de severidad del traumatismo, identificando como mayor predictor de fatiga post TCE a largo plazo, su presentación inmediata tras el mismo traumatismo34, la discapacidad secundaria y la asociación con depresión o trastornos del sueño73.
Un reciente estudio holandés demostró una presencia de fatiga en pacientes adultos mayores post TCE de alrededor del 50%, solo por detrás de la sensación de mareo (55%) y seguida por la cefalea (44%)68. Por otro lado, un estudio danés demostró que en el caso de población adolescente y adulto joven la presencia es de alrededor del 72% frente al 29% en población general con la misma edad. Con resultados contradictorios la fatiga sería más frecuente en el sexo femenino, en divorciados, separados o viudos, en nivel educacional bajo y discapacidad previa al TCE, sin influir en su prevalencia la edad en particular14,34,35,77. Su prevalencia sería mayor en personas que han presentado TCE de repetición, o en personas que portan el alelo APOE 4 que lo relaciona con otros trastornos neurodegenerativos34,78,79.
Finalmente, es sabido que el paciente que ha sufrido un TCE puede asociar trastorno de estrés postraumático, con disfunción en el eje hipotalámico-pituitario-adrenal que comparte bases neurofisiopatológicas con la fatiga central. Un estudio norteamericano de veteranos de guerra relaciona TCE leves y trastorno de estrés postraumático con una prevalencia importante de fatiga que influiría negativamente, incluso más que los trastornos del sueño, en el área cognitiva53,70.
Fatiga en otros tipos de daño cerebral sobrevenidoLa supervivencia de pacientes con tumores del sistema nervioso central ha crecido hasta un 75%, y con ello la evidencia de una serie de alteraciones producto de la misma enfermedad y sus tratamientos. La prevalencia de fatiga en esta población es del 49% al 97%, mayor que en otros tipos de cáncer80. En el caso de población pediátrica se reporta igualmente alrededor de un 66,3% de fatiga12.
Tanto en tumores cerebrales primarios como en metástasis existe una clara relación entre alteración cognitiva y fatiga con el tamaño de la lesión, la localización (hemisferio izquierdo), la progresión de la enfermedad y otros factores anímicos asociados.
El uso de radioterapia holocraneal se relaciona más frecuentemente con alteración cognitiva secundaria, alteración en actividades básicas de la vida diaria y fatiga que la radioterapia fragmentada. La fatiga posradioterapia se puede observar desde las primeras 24-48horas, con un pico de incidencia a los 30-35 días, persistiendo incluso meses81.
El origen de la fatiga central en este caso podría estar relacionado con factores proinflamatorios liberados por el mismo proceso tumoral, además de los otros factores ya referidos. También se han observado afectaciones neurológicas secundarias a la quimioterapia y radioterapia, presentando habitualmente ototoxicidad, neuropatía periférica, disfunción endocrina y cambios neurocognitivos, que influirían sobre la percepción de fatiga secundaria, siendo esta de predominio mental más que física. Por último, en la población pediátrica la fatiga parece disminuir a medida que pasa el tiempo una vez finalizado el tratamiento, a diferencia de lo sucede en población adulta, donde aumentaría la fatiga (sobre todo mental) con el tiempo80,82.
Los estudios de prevalencia de la fatiga en otras enfermedades con DCS (p. ej. encefalitis infecciosas o autoinmunes y encefalopatías de distinto origen) son escasos y poco representativos. Cabe destacar el estudio de Jonasson et al.83, donde se reportó una prevalencia de fatiga similar entre ictus, TCE y encefalitis/meningitis. Sin embargo, otro estudio en población pediátrica observó mayores proporciones de fatiga en casos de encefalitis y meningitis (alrededor de 3/4 de su población) que en otras etiologías del DCS12.
Instrumentos de estudio diagnósticoLas herramientas más utilizadas para el estudio de la fatiga tras el DCS son escalas clínicas. La más reconocida es la FSS. Esta escala es una de las más utilizadas por su alta consistencia interna, estabilidad en el tiempo, sensibilidad a cambios clínicos y correlato con otras escalas para fatiga. Incluso ha demostrado ser útil para entrevista en línea5,6,8,31,84. Existen alrededor de otras 10 escalas comúnmente utilizadas40, cada una tiene una variabilidad de dimensiones a evaluar en la fatiga, lo cual dificulta la conceptualización y diferenciación con respecto a factores secundarios10.
Existen herramientas para el estudio de componentes específicos de la fatiga como pruebas neuropsicológicas para valoración de la atención, resistencia, velocidad de procesamiento y memoria de trabajo, secundariamente afectados en pacientes con fatiga mental83. Algunos autores han trabajado test específicos de velocidad de procesamiento y memoria de trabajo computarizados, en función de pruebas contrarreloj, con test de repetición y en demanda de dificultad progresiva. Sin embargo, ninguna de estas pruebas ha demostrado gran utilidad en la práctica clínica85.
El uso de otros instrumentos, como por ejemplo un dinamómetro de presión para valorar la fuerza, se limitaría a la cuantificación motora de la fatiga física en relación con las vías piramidales corticoespinales. Este tipo de instrumentos no consideran las funciones cognitivo-afectivas u otras estructurales extrapiramidales16,19,31.
Aplicabilidad de la neurorradiologíaAlgunos hallazgos identificados con técnicas de neuroimagen convencional pueden ayudar a diagnosticar la fatiga. Por ejemplo, se ha referido ya la relación entre la presencia de leucoaraiosis o encefalopatía de pequeño vaso con mayor prevalencia de la fatiga, quizá en relación con un mayor riesgo a sufrir fatiga en pacientes con múltiples factores de riesgo cardiovascular y otras comorbilidades8.
Por otro lado, a nivel experimental, parece existir una relación estadísticamente significativa entre el volumen de lesión de la sustancia gris y blanca en los lóbulos cerebrales del hemisferio derecho (redes fronto-parieto-temporales) con la fatiga post TCE46. De igual modo, una disminución del volumen del tálamo bilateral a nivel anterior y dorsomedial estaría estrechamente relacionado con el grado de fatiga post TCE leve51. Además, la reconstrucción tractográfica demostraría cambios secundarios al daño en la SRA a nivel inferior dorsal (circuitos hacia el núcleo intralaminar talámico) y ventral (circuitos hacia el hipotálamo) en relación con la fatiga y la hipersomnia en pacientes con daño axonal secundario a TCE86.
Existen otros estudios a este nivel con la técnica de Resting State mediante RM, no solo a nivel diagnóstico sino de seguimiento de tratamiento farmacológico87,88.
Mediante el análisis de RM funcional algunos grupos de investigación han identificado relaciones significativas entre patrones específicos de activación cerebral y la fatiga reportada. Por ejemplo, se ha observado una hipoactivación de circuitos anteriores (prefrontales al nivel de la corteza dorso lateral) y de sus conexiones con los núcleos basales (fronto-estriatales) y con el tálamo como consecuencia del desequilibrio generado por la afectación de la SRA y otras áreas subcorticales. En otro estudio se ha observado una disminución de la velocidad de procesamiento cognitivo asociado a un incremento de actividad neuronal en diversas áreas en comparación con los controles. Estos resultados estaban en relación con el incremento del esfuerzo de actividad cerebral que refieren los pacientes con fatiga8,19,46,85.
Tratamientos disponiblesLa fatiga es un síndrome muy persistente en el tiempo, por lo que su detección desde etapas tempranas y el adecuado manejo de factores de riesgo modificables son indispensables. Además, el equipo especialista en neurorrehabilitación debe conocer, así como aplicar, las terapias para el manejo adecuado de la fatiga8,44,89.
A pesar de lo dicho, hoy en día la eficacia de los tratamientos farmacológicos es restringida. Sin embargo, existen resultados positivos con terapias no farmacológicas en el área de la neurorrehabilitación convencional.
Terapia farmacológica y suplementariaEn 2015 una revisión sistemática Cochrane de 12 ensayos clínicos aleatorizados, con una muestra total de 703 pacientes90, identificó intervenciones de distinta índole farmacológica y suplementaria en fatiga post ictus. Un grupo de ellos demostró una mejoría en la severidad de la fatiga, sin embargo, las muestras eran pequeñas y con mucha heterogeneidad entre ensayos, con la necesidad de más estudios. Por otro lado, dentro de la misma revisión otras medidas no demostraron beneficio. En la tabla 2 resumimos aquellos testados en fatiga relacionadas con DCS. A continuación, reportamos los detalles de mayor interés con respecto a alguno de ellos.
Fármacos y suplementos estudiados en el manejo de la fatiga
| Posible acción positiva con requerimiento de mayores estudios |
| Modafinilo |
| Metilfenidato |
| ISRS del tipo fluoxetina |
| Mesilato de tirilazad |
| Citicolina |
| Sulbutiamina (derivado sintético de la vitamina B1) |
| Ciertos antiinflamatorios/inmunomoduladores (p. ej. natalizumab) |
| Vitamina B1 |
| Vitamina B12 |
| Vitamina D |
| Coenzima Q-10 |
| Creatina |
| Hierba medicinal Astragalus membranaceus |
| No han demostrado a la fecha efecto alguno |
| Compuesto OSU6162 |
| Otros antidepresivos ISRS y duales |
| Inhibidores de la acetilcolinesterasa central |
| Hierbas medicinales del tipo Buyang Huanwu Tang |
Como inhibidor débil de la recaptación de dopamina, que produce el incremento en expresión de hipocretina, originalmente ha sido utilizado para pacientes con hipersomnia/narcoplepsia, SAHS y trastornos del ritmo circadiano. Su estudio en fatiga postictus (200mg al día durante 6 semanas) demostró algunos resultados positivos, aunque dependientes de las escalas de evaluación utilizadas5,9,11,31,48,55,88.
MetilfenidatoComo psicoestimulante activo del sistema dopaminérgico y noradrenérgico ha sido utilizado en DCS con fatiga secundaria, donde estudios con baja fuerza metodológica han demostrado resultados positivos. Es el caso de un estudio sueco que en la fatiga post TCE leve y moderado evidenció efectividad dosis dependiente (de 5 a 20mg/8h) en la fatiga mental. Este efecto asociado a la mejora de actividad cognitiva demostró mantenerse en el tiempo (a los 6 y 22 meses)7,69,89,91,92. Utilizado en asociación con antidepresivos inhibidores selectivos de la recaptación de serotonina (ISRS) ha mostrado su utilidad para fatiga igualmente relacionado con alteraciones cognitivas y/o apatía47. Sin embargo, un estudio prospectivo doble ciego probó su utilidad preventiva a dosis de 5 y 15mg en pacientes que iniciaban radioterapia en tumores cerebrales primarios o metastásicos, sin notar beneficios a las 8 semanas28.
Otros tratamientos farmacológicos y suplementariosSe refieren resultados prometedores con el compuesto OSU6162 (agonista parcial del receptor dopaminérgico D2 y de serotonina) a dosis de 15, 30 y 45mg cada 12horas sin beneficio significativo hasta la fecha en la fatiga post DCS50,69,89.
Estudios de bajo peso estadístico reportan el uso de mesilato de tirilazad como agente neuroprotector efectivo en fatiga, pero solo ha sido estudiado en hemorragia subaracnoidea90.
Otros estudios advierten del posible uso de tratamiento antiinflamatorio dirigido. Inmunomoduladores como el natalizumab infundido 9horas post ictus ha mostrado efectos beneficiosos en fatiga, así como en la recuperación funcional y cognitiva55.
Pequeños estudios sin controles aleatorizados, con suplementos frente al déficit de vitamina B1,12 y D, al igual que coenzima Q-10, han dado resultados positivos5,9.
Un estudio prospectivo aleatorizado abierto clase iii del efecto neuroprotector de la creatina oral durante 6 meses en pacientes jóvenes tras TCE severo refirió una clara recuperación de fatiga en el grupo de intervención, pero con varios fallos metodológicos en el estudio7.
En lo que respecta a las terapias alternativas el Astragalus membranaceus (hierba de la medicina tradicional china para tratar el ictus) ha demostrado utilidad en la reducción de la fatiga. Su compuesto, astragalósido, ha sido estudiado como agente neuroprotector por su actividad antinflamatoria y antiapoptósica54. Del mismo modo se estudia la utilidad de un complejo de hierbas utilizada en el este de Asia para la rehabilitación postictus, el Buyang Huanwu Tang (Boyang Hwano Tang)93.
Los antidepresivos ISRS (escitalopram, citalopram, sertralina y fluoxetina) y duales (duloxetina) han sido estudiados en pequeños controles, sin mostrar clara efectividad5,8,29,55.
Finalmente, un estudio en fatiga post TCE no demostró utilidad de los inhibidores de la acetilcolinesterasa central69.
Terapia rehabilitadoraEl diseño ambiental de las unidades hospitalarias de neurorrehabilitación debe garantizar el acceso regular al aire fresco, un ambiente hogareño que permita momentos de descanso sin ruidos estresantes y áreas de entretenimiento8.
La actividad física con el objetivo de la recuperación funcional debe evitar la intensidad extenuante, mientras que la actividad neuropsicológica debe favorecer la adherencia a la rutina de trabajo, reduciendo la percepción de fatiga, así como establecer herramientas que reduzcan el estrés, la ansiedad y depresión asociada. Al programar la rutina de trabajo diario, se recomienda realizar la mayor actividad física y mental a primeras horas del día, dejando las actividades menos extenuantes para la tarde, con descanso siempre en los mismos horarios32,85.
Todos estos factores han demostrado mejoría en la evolución de la fatiga de los pacientes. Para poder trasladar estos logros de la neurorrehabilitación a la vida diaria, posterior al alta, se requerirá la administración de pautas a familiares y cuidadores, así como adaptación del hogar que permitan fomentar la actividad física, una nutrición adecuada y momentos de descanso y relajación8,15,20,60,67,94.
En cuanto a la actividad física para el control de la fatiga, un estudio holandés detectó que hasta un 51% de personas jóvenes post TCE leve presentaban menor actividad física que la media para su edad95, y esta se asociaba con problemas de concentración y fatiga mayor que en población comparativa con otros daños traumatológicos, identificando la falta de actividad física como dianas a trabajar96.
El ejercicio físico ligero y regular a largo plazo se relaciona en DCS con una disminución en la percepción de fatiga a todas las edades7,10,95–97.
Varios estudios refuerzan que el ejercicio físico terapéutico protege la función cerebral, reduce síntomas depresivos, inhibe la apoptosis neuronal, disminuye la neuroinflamación y provee medio adecuado para incrementar la neuroplasticidad. La neuroimagen funcional ha permitido observar cómo el ejercicio físico terapéutico se asocia a la activación de los lóbulos prefrontales, ínsula y corteza cingulada anterior. Esto explicaría el mecanismo por el que mejoraría la capacidad de atención y reduciría de manera indirecta la fatiga mental asociada a la física. El ejercicio físico igualmente aumentaría el flujo vascular cerebral que activaría el sistema simpático vegetativo, modulando a nivel molecular la alteración de neurotransmisores identificada en el desarrollo de la fatiga8.
En el caso de la fatiga postictus distintas guías clínicas recomiendan el ejercicio físico regular, no intenso, evitar el sedentarismo y reforzar rutinas para los pacientes afectados por la fatiga5,9,48.
La Asociación Americana del Cáncer y la Sociedad Americana Clínica Oncológica recomiendan la actividad aeróbica moderada, 30minutos en 5 días/semana, con 2 a 3 sesiones de entrenamiento de fuerza, para prevenir la fatiga poscáncer cerebral28.
Un reciente estudio americano llevado a cabo en una población de 123 pacientes con fatiga post TCE demostró que la actividad física básica de caminar 30minutos 5 días/semana puede ser útil como herramienta eficiente y coste-efectiva para mejorar la fatiga, resistencia, trastornos anímicos, del sueño y del dolor98.
La práctica de actividades como el yoga, tai chi y qigong, facilitaría el adecuado control de la fatiga en personas con DCS de distinto tipo7,28.
Por otro lado, estrategias de conservación de la energía dentro de la neurorrehabilitación interdisciplinaria podrían tener un impacto en la reducción de la fatiga en la vida diaria, si bien un análisis reciente no encontró influencia estadísticamente significativa99.
Por otro lado, desde el punto de vista neuropsicológico el paciente con fatiga post DCS, como hemos visto, suele presentar afectaciones en el plano cognitivo, siendo la heminegligencia una de las más influyentes en la percepción de fatiga, además de trastornos conductuales, anímicos y del sueño, que suelen influir directamente en el proceso de rehabilitación10,38,48.
La resiliencia ha sido estudiada y relacionada de manera inversamente proporcional a la presencia de fatiga, tanto en personas que afrontan enfermedades crónicas como neurodegenerativas y cáncer. Estrategias en la terapia psicológica para mejorar esta capacidad han sido estudiadas con beneficio en otras enfermedades, y podría tener igual utilidad en la fatiga por DCS36.
La terapia cognitivo conductual (TCC) ha demostrado eficacia en el manejo del síndrome de fatiga crónica y la fatiga relacionada con procesos crónicos como el cáncer, o incluso de índole neurológica como en la esclerosis múltiple28,37. De forma global, la TCC consiste en reconocer las deficiencias cognitivas para afrontar cambios conductuales, permitiendo aplicar estrategias de compensación sobre los efectos secundarios al daño y sus consecuencias deletéreas en general10,47,48. Diversos estudios de metodología observacional analizaron el beneficio de la TCC sobre la evolución de la fatiga post TCE, junto a otras alteraciones del sueño y anímico-emocionales, con resultados de beneficio mínimo con respecto a mejoría de la fatiga7,100.
Otra de las herramientas utilizadas frecuentemente en esta área ha sido el mindfulness. La técnica de reducción de estrés basada en mindfulness, basada en el programa de su creador Kabat-Zinn's, ha sido estudiada en fatiga postictus y post TCE con resultados positivos8,10,12,15,67,69.
Otras terapiasA partir del avance de la tecnología en el área de la electrofisiología han aparecido herramientas prometedoras para un mejor desempeño de las personas con DCS en el futuro.
Un pequeño estudio aleatorizado controlado en 10 pacientes post TCE evidenció mejoría significativa, entre otros síntomas, en la fatiga gracias a terapia de estimulación eléctrica transcraneal7.
La estimulación magnética transcraneal repetitiva como herramienta terapéutica es actualmente utilizada para el manejo de la depresión farmacorresistente, y cada vez presenta más evidencia para el tratamiento de la afasia, paresia de miembro superior y dolor neuropático, entre otros. En el caso del síndrome posconmocional tras TCE, existen algunos estudios que han demostrado efectividad tanto con estimulación magnética transcraneal repetitiva como con estimulación eléctrica transcraneal71. Recientes estudios, aún sin evidencia suficiente, están demostrando su utilidad en la fatiga de distintos tipos de DCS28.
Finalmente, la lectura a tiempo real de la actividad cerebral a través de EEG o potenciales evocados con propósito terapéutico (neurofeedback) ha sido sugerida ya en algunos estudios como herramienta para el manejo de la fatiga en pacientes con DCS. En concreto, un estudio valoró el efecto de 25 sesiones de tratamiento con sistema de neuroterapia Flexyx (un tipo de biofeedback por EEG) en los síntomas post TCE, incluida la fatiga, en 12 pacientes con TCE moderado a severo, con una mejoría significativa con respecto al grupo control7.
Por otro lado, a fatiga y las alteraciones del sueño están fuertemente relacionadas en DCS.
La somnolencia diurna secundaria al trastorno de sueño es distinta a la sensación de fatiga que puede presentar el paciente, pero pueden compartir cierta base fisiopatológica con descontrol de procesos homeostáticos y del ritmo circadiano101. Un reciente estudio danés, en una población de 71 pacientes postictus ingresados en régimen de rehabilitación hospitalaria, demostró una reducción significativa de la fatiga y mejora en el estado de ánimo en el grupo que recibió una terapia de luz natural según técnicas específicas (graduación de espectro lumínico según el horario del día)102.
Del mismo modo, un estudio australiano demostró el mismo efecto positivo en reducción de la fatiga y somnolencia diurna en pacientes en etapa subaguda post TCE con el uso de terapia lumínica con ondas de corta amplitud (azul) (45min de exposición diaria durante 4 semanas)103.
Las Guías de la Red Americana Comprensiva contra el Cáncer recomiendan la terapia lumínica para el manejo de fatiga y depresión en pacientes con tumor cerebral28.
Influencia en el ámbito familiar, social y laboralLa fatiga se ha identificado como causa significativa de restricción en la participación en DCS.
Alrededor del 20% de personas que han sufrido un ictus se encuentran en edad laboral. Entre un 50% a 74%, dependiendo de las condiciones de inserción laboral en cada país, y con adaptaciones particulares, suelen regresar a su puesto de trabajo. Un estudio de diseño cualitativo sueco de seguimiento de este tipo de población que retorna al trabajo hasta 7-8 años tras el ictus, evidenció aspectos «invisibles» como los cognitivos (dificultades en la concentración, procesamiento de información y ejecución múltiple) y la fatiga posdaño104. Un estudio de seguimiento de hasta un año en 18 pacientes tras TCE determinaba cómo la fatiga se relacionaba con alteraciones cognitivas subjetivas. Estas personas referían además sensación de cansancio y torpeza, dificultad para tomar decisiones y finalizar las actividades a tiempo, enlentecimiento en el trabajo, así como esfuerzo para seguir la conversación y órdenes en su entorno laboral. Este estudio además destacó la misma percepción de problemas al entrevistar a familiares/cuidadores, identificando problemas de relación en el ámbito familiar y social77.
En otro estudio sueco de seguimiento hasta 5 años después del TCE, donde la mayoría había presentado TCE leve, hasta un 39% reportaban fatiga significativa crónica, del tipo mental, correlacionándose con problemas en el ámbito laboral78. Un estudio australiano reportó, en personas dadas de alta de urgencia tras TCE leve a 3 meses de la lesión, que hasta un 22% refería fatiga laboral y en un 17% había incapacidad para mantener su estándar laboral previo105.
Del mismo modo se han descrito dificultades de la población pediátrica con fatiga post DCS para retornar a una adecuada actividad psicosocial y académica12.
ConclusionesLa fatiga es un síndrome conocido ya en enfermedades neurológicas, con una alta prevalencia, como es el caso de la esclerosis múltiple. La fatiga post DCS es igualmente prevalente, aunque poco conocida. Aparentemente sería más frecuente en el ictus y TCE, aunque cada vez se estudia más en otras enfermedades sobrevenidas (tumores cerebrales neoplásicos, encefalopatías y encefalitis).
Se definiría como la sensación de estar exhausto, con baja energía y aversión al esfuerzo durante el desarrollo de una actividad física o mental sin disminución al descanso, y podría enfocarse desde una perspectiva tanto central como periférica, comprendiendo los aspectos cognitivos y mentales del primero, así como puramente motores y físicos del segundo, pero al mismo tiempo desde el dominio fisiopatológico de la estructura del sistema nervioso, reconociendo distintas áreas centrales y periféricas involucradas. Su origen radica en principios de alteración de la actividad neuronal producto del daño directo, así como de los efectos genéticos y epigenéticos secundarios relacionando conceptos metabólicos e inflamatorios.
La fatiga persistiría en el tiempo, incluso después de la recuperación total o parcial de otras limitaciones en la actividad, con una implicación directa negativa en la calidad de vida de estos pacientes, demostrándose un peor desempeño a largo plazo frente a poblaciones de similares características que no la presentan.
Su estudio se da principalmente en la actualidad a partir de herramientas clínicas del tipo escalas de valoración.
En cuanto a su tratamiento no existe actualmente consenso sobre tratamiento farmacológico y no farmacológico de la fatiga, pero sí una serie de recomendaciones de actividad conjunta dentro de un manejo neurorrehabilitador para intentar actuar sobre factores modificables relacionados.
Se requiere, por tanto, mayor conciencia de su presencia, epidemiología y fisiopatología, para poder realizar un diagnóstico precoz y permitir un uso adecuado de herramientas terapéuticas para limitar o eliminar su efecto negativo a largo plazo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.