Los avances en el desarrollo de medicamentos con mecanismos de acción novedosos no han sido suficientes para modificar de manera significativa el porcentaje de pacientes con epilepsia refractaria. Esa falta de resultados clínicos satisfactorios nos ha llevado a buscar alternativas terapéuticas más eficaces y con mecanismos de acción diferentes a los convencionales.
DesarrolloEl objetivo de este artículo es profundizar en los aspectos epidemiológicos relacionados con el uso de productos a base de cannabis para el tratamiento de la epilepsia, haciendo énfasis en los principales mecanismos de acción, las indicaciones de uso, la eficacia clínica y la seguridad. Para lo anterior, se realizó una revisión narrativa mediante la búsqueda de artículos en PubMed, EMBASE, Google Scholar y a través de la revisión exhaustiva de la bibliografía relevante.
ConclusionesEn los últimos años ha crecido el interés relacionado con el uso de cannabis medicinal para el tratamiento de diferentes enfermedades, incluyendo la epilepsia. En la actualidad, sabemos que las plantas de cannabis contienen más de 100 compuestos terpenofenólicos que se han denominado cannabinoides. Los 2 más abundantes son el delta-9-tetrahidrocannabinol y el cannabidiol. Diferentes modelos preclínicos de epilepsia han demostrado que estos cannabinoides tienen propiedades anticonvulsivas, por ello se ha comenzado a utilizar cannabidiol purificado al 100% y extractos de cannabis enriquecidos con cannabidiol para el tratamiento de la epilepsia en humanos. La eficacia y la seguridad de estos productos han quedado demostradas en diferentes estudios abiertos y ensayos clínicos controlados y aleatorizados.
Advances in the development of drugs with novel mechanisms of action have not been sufficient to significantly reduce the percentage of patients presenting drug-resistant epilepsy. This lack of satisfactory clinical results has led to the search for more effective treatment alternatives with new mechanisms of action.
DevelopmentThe aim of this study is to examine epidemiological aspects of the use of cannabis-based products for the treatment of epilepsy, with particular emphasis on the main mechanisms of action, indications for use, clinical efficacy, and safety. We conducted a narrative review of articles gathered from the PubMed, EMBASE, and Google Scholar databases and from the reference sections of relevant publications.
ConclusionsIn recent years there has been growing interest in the use of cannabis-based products for the treatment of a wide range of diseases, including epilepsy. The cannabis plant is currently known to contain more than 100 terpenophenolic compounds, known as cannabinoids. The 2 most abundant are delta-9-tetrahydrocannabinol and cannabidiol. Studies of preclinical models of epilepsy have shown that these cannabinoids have anticonvulsant properties, and 100% purified cannabidiol and cannabidiol-enriched cannabis extracts are now being used to treat epilepsy in humans. Several open-label studies and randomised controlled clinical trials have demonstrated the efficacy and safety of these products.
La falta de resultados clínicos satisfactorios en el tratamiento de algunas enfermedades neurológicas nos ha llevado a buscar terapias más eficaces y con mecanismos de acción diferentes a los convencionales. En esa búsqueda de nuevos medicamentos surgen los productos a base de cannabis como una alternativa terapéutica eficaz y segura1. En la actualidad, los cannabinoides son considerados una herramienta complementaria para el manejo sintomático de diferentes enfermedades neurológicas crónicas, cuando otras terapias de primera línea han fallado1,2. La evidencia científica actual apoya el uso de productos a base de cannabis para el tratamiento de la epilepsia refractaria, el dolor neuropático crónico, la espasticidad y la disfunción vesical asociada a la esclerosis múltiple, algunos trastornos del movimiento como el temblor, la distonía o el síndrome de Tourette, la cefalea y algunos trastornos del sueño relacionados con enfermedades neurológicas2,3. Durante décadas, la prescripción de cannabinoides con fines terapéuticos ha estado restringida y controlada por marcos regulatorios específicos, lo que ha limitado el desarrollo de la investigación clínica, así como la comercialización de los cannabinoides para uso medicinal4. Sin embargo, en los últimos años se ha observado un avance significativo a nivel mundial que favorece el uso seguro y la prescripción responsable de cannabis medicinal en diferentes condiciones clínicas4. Adicionalmente, las nuevas regulaciones han permitido un crecimiento exponencial en la investigación clínica relacionada con el uso de cannabinoides en diferentes enfermedades neurológicas3–5. El objetivo de este artículo es profundizar en los aspectos epidemiológicos relacionados con el uso de productos a base de cannabis para el tratamiento de la epilepsia, haciendo énfasis en los principales mecanismos de acción, las indicaciones de uso, la eficacia clínica y la seguridad. Para ello se realizó una revisión narrativa sobre el uso de cannabinoides en epilepsia mediante la búsqueda de artículos en PubMed, EMBASE, Google Scholar y a través de la revisión exhaustiva de la bibliografía relevante.
Aspectos epidemiológicosLa epilepsia es una de las enfermedades neurológicas más frecuentes y afecta a cerca de 70 millones de personas en todo el mundo6. Aunque la epilepsia es una enfermedad global, tiene una distribución desigual y cerca del 80% de las personas afectadas viven en poblaciones de bajos recursos económicos6–8. La epilepsia es una enfermedad tratable, con altas tasas de respuesta terapéutica; cerca del 70% de los pacientes se controlan con fármacos antiepilépticos y llevan una vida normal8. En la actualidad, contamos con más de 25 medicamentos para el control de las crisis epilépticas, sin embargo, a pesar de las múltiples alternativas terapéuticas y el desarrollo de nuevos fármacos, cerca del 25-35% de los pacientes no responden a los medicamentos9. Esta situación clínica se conoce como epilepsia refractaria y representa una condición crónica, frecuente y costosa que requiere una aproximación clínica integral y multidisciplinaria9. La epilepsia refractaria predispone a múltiples comorbilidades neuropsiquiátricas, afecta de forma significativa la calidad de vida del paciente y aumenta la morbimortalidad relacionada con la epilepsia9,10. Los avances en el desarrollo de medicamentos con mecanismos de acción novedosos no han sido suficientes para modificar de manera significativa el porcentaje de pacientes con epilepsia refractaria, lo que ha quedado demostrado en diferentes cohortes prospectivas que han evaluado la respuesta terapéutica durante más de 30 años11. En esos estudios se ha encontrado que hasta el 36% de los pacientes persisten con crisis epilépticas a pesar de recibir varios medicamentos adecuados y apropiados para su enfermedad11 (tabla 1). La falta de resultados clínicos satisfactorios nos ha llevado a buscar alternativas terapéuticas más eficaces y con mecanismos de acción diferentes a los convencionales.
Porcentaje de respondedores en tres cohortes de pacientes con epilepsia de reciente diagnóstico
| Periodo de evaluación | Año de análisis | Número de pacientes | Total, % | Estudio |
|---|---|---|---|---|
| 1982-1997 | 1999 | 470 | 64 | Kwan y Brodie (2000) |
| 1982-2001 | 2003 | 780 | 64,4 | Mohanrah y Brodie (2006) |
| 1982-2006 | 2008 | 1.098 | 68,4 | Brodie et al. (2012) |
| 1982-2012 | 2014 | 1.795 | 63,8 | Chen et al. (2018) |
Resumen de las 4 grandes cohortes prospectivas que han evaluado la respuesta terapéutica en pacientes con epilepsia de reciente diagnóstico. A pesar de los múltiples avances en el desarrollo de nuevos fármacos antiepilépticos, el porcentaje de pacientes con epilepsia refractaria no ha cambiado de forma significativa en los últimos años.
Adaptada de Chen et al.11.
En los últimos años, ha crecido el interés relacionado con el uso de cannabis medicinal para el tratamiento de la epilepsia. En la actualidad, sabemos que las plantas de cannabis contienen más de 100 compuestos terpenofenólicos, que se han denominado cannabinoides12. Los 2 más abundantes son el delta-9-tetrahidrocannabinol (Δ9-THC) y el cannabidiol (CBD)12. En diferentes modelos preclínicos de epilepsia se ha planteado que los cannabinoides actúan en sistemas diferentes al endocannabinoide, abriendo la posibilidad a nuevas estrategias terapéuticas y mecanismos de acción novedosos13. Desde hace algunos años se han publicado algunos reportes de caso que han descrito una mejoría significativa en el control de la enfermedad con el uso de diferentes productos a base de cannabis13. La gran expectativa que se ha generado con estos reportes de casos aislados se ha comenzado a confirmar mediante ensayos clínicos controlados y aleatorizados. En la actualidad, contamos con 3 ensayos clínicos que han evaluado la eficacia del CBD en el control de ciertos síndromes epilépticos (síndrome de Dravet y síndrome de Lennox-Gastaut)14. Aunque los resultados son prometedores, varios estudios han demostrado que el CBD tiene una farmacocinética compleja, una biodisponibilidad variable y un alto porcentaje de interacciones medicamentosas, por lo que se han buscado diferentes alternativas terapéuticas y farmacológicas14. En este sentido, algunos estudios han utilizado extractos de cannabis enriquecidos con CBD que suelen tener una proporción de CBD:THC de 20:1, lo que está justificado en diferentes hipótesis preclínicas y farmacológicas que plantean que los efectos asociativos de todos los componentes de la planta son más eficaces que los productos químicos aislados13. En algunos países como Israel se ha evaluado la eficacia de extractos de cannabis enriquecidos con CBD (proporción CBD:THC de 20:1) para el control de la epilepsia refractaria, encontrando que más del 50% de los pacientes logran una mejoría significativa en la frecuencia de las crisis; adicionalmente, se ha reportado una mejoría subjetiva en el comportamiento, el alertamiento, la comunicación y algunas habilidades motoras15.
Mecanismo de acción y aspectos farmacológicosEl mecanismo de acción, la farmacocinética y la farmacodinamia de los cannabinoides es compleja13,14. Las plantas de cannabis contienen más de 100 fitocannabinoides y terpenos que actúan a través de vías moleculares y redes de señalización complejas14. Los 2 compuestos más abundantes en las diferentes plantas de cannabis, y también los que más se han estudiado, son el Δ9-THC y el CBD. Estas moléculas actúan a través de receptores acoplados a la proteína G, que forman parte del sistema endocannabinoide y que se han denominado CB1 (expresado principalmente en neuronas del sistema nervioso central y periférico) y CB2 (expresado principalmente en células del sistema inmune)16. Los receptores CB1 disminuyen la excitabilidad neuronal y la liberación de neurotransmisores modulando la apertura de los canales de potasio y bloqueando los canales de calcio14,16,17. Los receptores CB2 están implicados en la modulación inmune17. El Δ9-THC es un agonista parcial de los receptores CB1/CB2 y tiene un potente efecto antiinflamatorio, sin embargo, es el responsable de la mayoría de los efectos psicotrópicos, cognitivos y comportamentales del cannabis; por esta razón, no se han realizado muchos esfuerzos para desarrollar el THC como un fármaco antiepiléptico. Adicionalmente, en algunos modelos preclínicos, el THC ha demostrado propiedades proconvulsivantes18. La mayoría de los estudios en epilepsia se han centrado en el CBD y su análogo denominado cannabidivarina19. A diferencia del Δ9-THC, el CBD tiene muy baja afinidad por los receptores CB1 y CB2 (lo que explicaría su baja actividad psicotrópica), por lo cual, se ha planteado que el mecanismo antiepiléptico del CBD es independiente del sistema endocannabinoide19. En la actualidad se desconoce el mecanismo de acción exacto en la epilepsia, sin embargo, se han planteado algunas hipótesis: modula el transportador ENT, el receptor GPR55 y el canal TRPM8, los cuales están involucrados en fenómenos de hiperexcitabilidad neuronal18,19. También modula la activación del receptor serotoninérgico 5HT1a, algunos receptores de glicina y el canal TRPA1, los cuales ayudan a regular las concentraciones de calcio intracelular18,19. Adicionalmente, el CBD es un potente inhibidor de ciertas enzimas hepáticas (CYP3A4, CYP2C9 y CYP2C19), por lo que inhibe el metabolismo de algunos fármacos antiepilépticos que utilizan el mismo sistema enzimático, potenciando sus propiedades antiepilépticas; es el caso del clobazam, el topiramato, la zonisamida y la eslicarbazepina20. El CBD tiene una muy baja biodisponibilidad oral (menos del 10%), lo que está explicado, en parte, por un gran metabolismo de primer paso en el intestino y en el hígado14. La vida media de eliminación fluctúa entre 18-32h, permitiendo la administración una o 2 veces por día13,19. Algunos estudios han planteado que los efectos asociativos de todos los componentes de la planta son más eficaces que los productos químicos aislados (CBD y Δ9-THC). Este fenómeno se conoce como el efecto séquito (del inglés, entourage effect)21. Esto evidencia que los efectos clínicos del cannabis son secundarios a interacciones complejas entre los diferentes cannabinoides y no son consecuencia de la acción de un compuesto químico aislado14,21. Para apoyar esta hipótesis, algunos estudios han demostrado que el CBD potencia algunas propiedades benéficas del Δ9-THC y reduce su psicoactividad, mejorando la tolerancia14,22. Al parecer, el CBD tiene la capacidad de contrarrestar algunas consecuencias funcionales de la activación de los receptores CB1 en el sistema nervioso central22. Lo anterior podría ser la explicación del porqué los consumidores de cannabis con una proporción alta de CBD:THC experimentan pocos efectos psicotrópicos en comparación con aquellos que consumen cannabis con una proporción baja de CBD:THC19.
Eficacia clínicaLa evidencia de 34 estudios en 6 especies de animales diferentes ha demostrado que el Δ9-THC es anticonvulsivante en el 61% de los casos, proconvulsivante en el 2,9% de los casos, tiene una respuesta mixta en el 2,9% de los casos y no tiene ningún efecto significativo en el 32,4% de los casos13,23. El CBD y su homólogo, la cannabidivarina, son anticonvulsivantes en el 80,5% de los casos y no tienen ningún efecto significativo en el 19,5% de los casos. A diferencia del Δ9-THC, ningún estudio preclínico demostró que el CBD y la cannabidivarina tuvieran propiedades proconvulsivantes13,23. A partir de estos estudios en modelos animales, se ha comenzado a utilizar CBD purificado al 100% y extractos de cannabis enriquecidos con CBD para el tratamiento de la epilepsia en humanos23.
Eficacia clínica de extractos de cannabis enriquecidos con cannabidiolCon respecto al uso de extractos de cannabis enriquecidos con CBD, los reportes de caso han mostrado resultados contradictorios (efectos anticonvulsivantes y proconvulsivantes); sin embargo, la mayoría suelen describir una mejoría subjetiva en la frecuencia de las crisis24–28. Uno de los casos más conocidos y que generó una gran cobertura mediática fue el de Charlotte Figi, una niña norteamericana con síndrome de Dravet y epilepsia refractaria que tuvo una mejoría significativa en el control de su enfermedad luego de utilizar un extracto de cannabis enriquecido con CBD. También existen algunas encuestas dirigidas a familiares y cuidadores de pacientes con epilepsia. Una de las más importantes fue publicada en el 2015 por Hussain et al.29. Esta encuesta estaba dirigida a padres de niños con epilepsia (espasmos infantiles y síndrome de Lennox-Gastaut) que utilizaban un extracto de cannabis enriquecido con CBD y que tenían entre 3 y 10 años de edad. El 85% reportó una reducción en la frecuencia de las crisis y el 14% reportó una libertad completa de las crisis29. La duración media de la terapia fue de 6,8 meses y la dosis aproximada de CBD fue de 4,3mg/kg/día. Muchos respondieron que los niños también presentaban una mejoría en el patrón de sueño, el alertamiento y el estado de ánimo29. En una encuesta australiana publicada recientemente, se encontró que 137 de 976 personas encuestadas estaban usando o habían utilizado productos de cannabis para el tratamiento de la epilepsia30. Los productos fueron percibidos como eficaces para el control de las crisis epilépticas en el 71% de los niños y en el 89,5% de los adultos; adicionalmente, casi la mitad de los encuestados reportaron una reducción en el uso de los fármacos antiepilépticos concomitantes30. En este estudio, solo el 6,5% de los encuestados mencionaron que consumían cannabis por recomendación de su médico y la mayoría de los productos utilizados fueron obtenidos de proveedores ilegales, sin poder tener un conocimiento claro de su composición química30. Otro estudio realizado en México fue publicado recientemente31. En él se encuestó a 53 padres de niños con epilepsia entre los 9 meses y los 18 años de edad. La mayoría de los pacientes tenía síndrome de Lennox-Gastaut y epilepsia refractaria no especificada. El 81% de los padres reportó una reducción en la frecuencia de crisis con el uso de extractos de cannabis enriquecidos con CBD y el 16% reportó una libertad completa de las crisis31.
La principal limitación de estos estudios es la variabilidad en los tipos de epilepsia evaluados, las diferencias en los compuestos químicos utilizados, las dosis, la vía de administración y la manufactura de los mismos. Adicionalmente, en algunos países, el acceso a productos artesanales es relativamente fácil, y el control de calidad, así como la consistencia química de estos productos, es altamente variable23. Por todo ello, no es sorprendente que muchas preparaciones carezcan de una adecuada validación de calidad, y que se encuentre que algunos productos comercializados tienen contenidos de cannabinoides individuales muy diferentes de los que figuran en su etiqueta; algunos incluso pueden contener contaminantes potencialmente dañinos32. Recientemente, la FDA evaluó 18 productos a base de cannabis que se comercializaban de manera libre para el control de la epilepsia, encontrando que 8 no contenían CBD, 9 contenían menos de un 1% de CBD y uno contenía un 2,6% de CBD33. Un estudio australiano publicado recientemente encontró resultados similares34. En ese estudio se evaluó la composición de los extractos de cannabis que utilizaban 65 pacientes con epilepsia refractaria, encontrando que, al contrario de las expectativas de la familia, la mayoría de las muestras evaluadas tenían bajas concentraciones de CBD34. Por tanto, es importante utilizar productos estandarizados que cumplan con los controles regulatorios, sanitarios y legales de cada país. En Israel, por ejemplo, se comercializa un extracto de cannabis enriquecido con CBD con una proporción de CBD:THC de 2:1, 5:1 y 20:1, siendo este último el que más se utiliza. Este producto está estandarizado y cumple con los requisitos legales y sanitarios de ese país15. Recientemente, se publicó un estudio que evaluó la eficacia de dicho producto en el control de la epilepsia15. Se evaluaron 74 pacientes con epilepsia refractaria que utilizaron el extracto de cannabis enriquecido con CBD en una proporción de CBD:THC de 20:1. La dosis de THC no excedía los 0,5mg/kg/día y la dosis de CBD fluctuaba entre 1 y 20mg/kg/día; sin embargo, el 81% de los pacientes utilizaron dosis menores de 10mg/kg/día, lo que se atribuyó a que la mayoría mantenían el producto de manera sublingual por varios minutos, logrando de esta forma una mayor biodisponibilidad y un menor metabolismo de primer paso. En este estudio, cerca del 50% de los pacientes reportaron una mejoría de más del 50% en la frecuencia de crisis. Adicionalmente, se reportó una mejoría en el comportamiento, el alertamiento, el lenguaje, la comunicación, las habilidades motoras y el patrón de sueño.
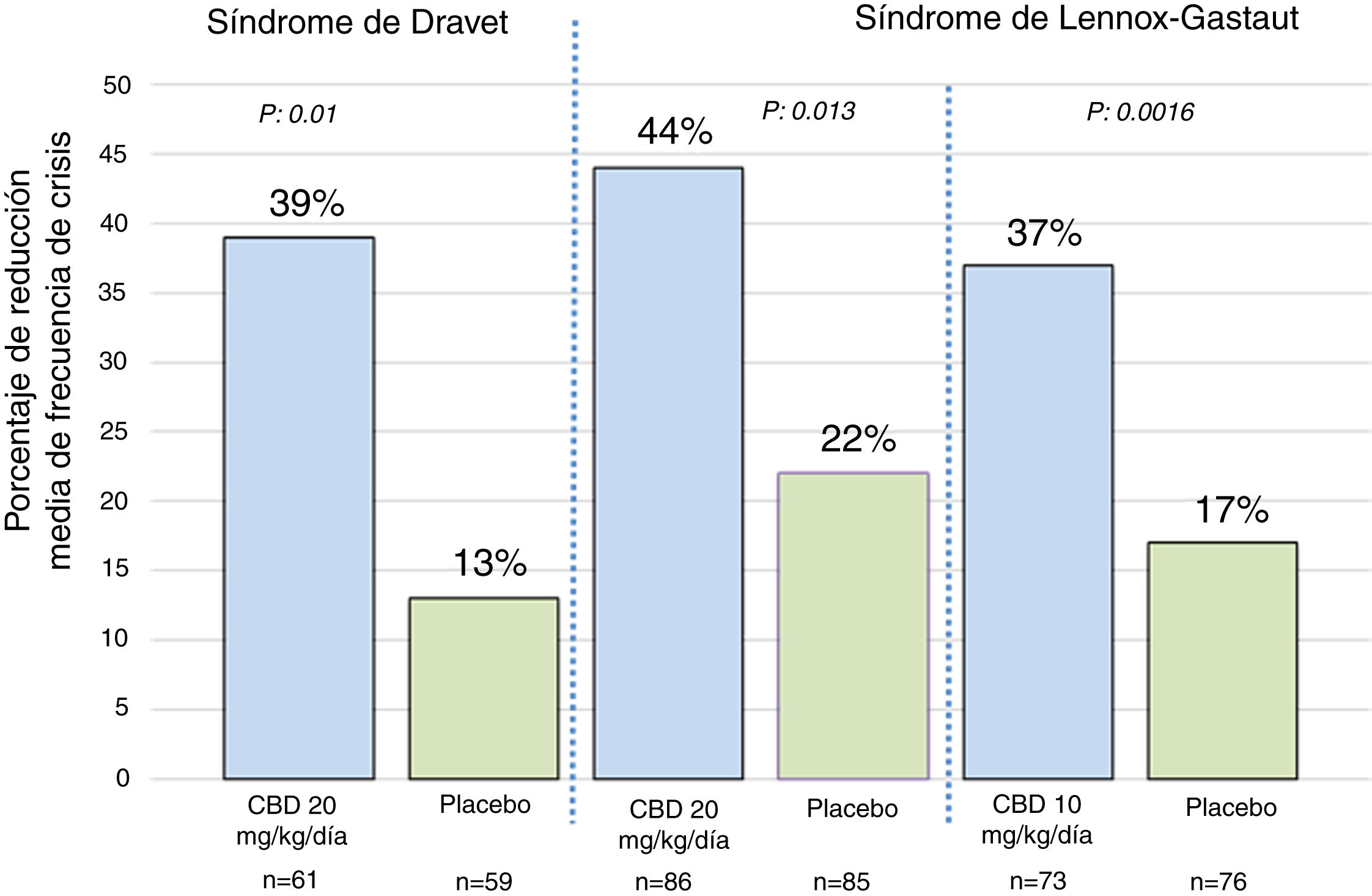
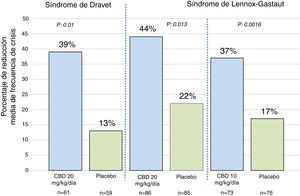
Eficacia clínica de cannabidiol purificado al 100%Con respecto al uso de CBD purificado al 100%, se han publicado 3 ensayos clínicos controlados y aleatorizados23. Uno de ellos se realizó en pacientes con síndrome de Dravet y los otros 2 se realizaron en pacientes con síndrome de Lennox-Gastaut35–37. En el estudio de síndrome de Dravet, los pacientes evaluados tenían entre 2,3 y 18 años de edad, el 43% logró una reducción de más del 50% de las crisis y el 5% logró libertad completa de crisis35. En el estudio de síndrome de Lennox-Gastaut, los pacientes evaluados tenían entre 2 y 55 años de edad, el 46% logró una reducción de más del 50% de las crisis y el 6% logró libertad completa de las crisis36,37. En la figura 1 se resumen los principales hallazgos de estos estudios. Una de las principales limitaciones de estos estudios es que hasta el 66% de los pacientes (en el estudio de síndrome de Dravet) que recibieron CBD también estaban utilizando clobazam35; esta correlación podría tener mucha significación clínica debido a la reciente evidencia que indica que los niveles de n-desmetilclobazam (metabolito activo del clobazam) pueden aumentar hasta un 500% después de utilizar el CBD, por lo tanto, los datos informados en estos ensayos clínicos no permiten determinar si la mejoría en la frecuencia de las crisis es consecuencia de una acción directa del CBD o simplemente es el resultado del aumento en los niveles plasmáticos de los fármacos coadyuvantes, principalmente el clobazam38.
Porcentaje de reducción media de frecuencia de crisis en los 3 ensayos clínicos que evaluaron la eficacia del CBD como terapia coadyuvante en pacientes con síndrome de Dravet y síndrome de Lennox-Gastaut. Para los pacientes con síndrome de Dravet, la frecuencia de crisis se refiere a las crisis convulsivas. Para los pacientes con síndrome de Lennox-Gastaut, la frecuencia de crisis se refiere a las crisis de caída. Los valores de p se refieren a las comparaciones entre cada grupo de CDB y el grupo de placebo correspondiente. Para más información, revisar las referencias 35-37. Adaptada de: Perucca23.
Está por definirse si la eficacia del CBD es independiente del uso concomitante de otros fármacos antiepilépticos. En este sentido, un estudio publicado recientemente demostró un nuevo mecanismo farmacodinámico en el que el CBD y el clobazam aumentan la activación del receptor GABA, contribuyendo al efecto anticonvulsivante de la combinación CBD/clobazam39. Otro estudio reciente también demostró que la respuesta terapéutica de un extracto de cannabis enriquecido con CBD era independiente del uso de clobazam; sin embargo, en ese mismo estudio se encontró que el clobazam contribuía de manera significativa a los efectos sedativos del CBD40.
Efectos adversosEn los estudios que han evaluado la seguridad y la eficacia de extractos de cannabis enriquecidos con CBD, el porcentaje de efectos adversos fluctúa entre un 35 y un 45%15,29–31, siendo menos frecuentes que los efectos adversos reportados en los ensayos clínicos de CBD purificado (hasta el 79% de los pacientes reportaron efectos adversos)35–37. La mayoría de los efectos adversos son leves y transitorios, y dependen en gran medida de las interacciones farmacológicas con otros medicamentos, principalmente el clobazam, el topiramato, la zonisamida y la eslicarbazepina38,39. En la tabla 2 se mencionan los efectos adversos más frecuentes reportados en la literatura.
Efectos adversos más frecuentes de cannabinoides en epilepsia, reportados en la literatura
| Somnolencia y fatiga, principalmente en pacientes que usen clobazam de manera simultánea |
| Cambios en el apetito (aumento o disminución) |
| Cambios en el peso corporal (aumento o disminución) |
| Síntomas gastrointestinales, como: náuseas, vómitos, diarrea o estreñimiento |
| Irritabilidad y cambios en el comportamiento |
| Elevación de las transaminasas y trombocitopenia, principalmente en pacientes que utilicen ácido valproico de manera simultánea. La mayoría de los estudios reportan una mejoría en los niveles de transaminasas luego de la disminución en la dosis del ácido valproico o el extracto de cannabis. En casos aislados se ha reportado hiperamonemia |
| Algunos estudios han descrito un aumento en la frecuencia de las crisis, sin embargo, la mayoría de los autores consideran que este cambio forma parte de la historia natural de la enfermedad y no es consecuencia del uso del producto |
Los cannabinoides son considerados una herramienta complementaria para el manejo sintomático de algunas enfermedades neurológicas, cuando otras terapias de primera línea han fallado. Para la epilepsia refractaria existen 2 alternativas terapéuticas: CBD purificado al 100% y extractos de cannabis enriquecidos con CBD. Aunque los 2 productos contienen el mismo principio activo, no es apropiado extrapolar los resultados de los ensayos clínicos realizados con CBD purificado al 100% a los extractos de cannabis enriquecidos con CBD. Son productos funcionalmente distintos y con propiedades farmacocinéticas específicas para cada uno. Los extractos de cannabis enriquecidos con CBD representan un modelo de sinergia botánica en el cual se cree que el efecto clínico es el resultado de interacciones complejas entre todos los componentes de la planta y no son consecuencia de un producto químico aislado, como sí ocurre con el CBD purificado al 100%. Es importante aclarar que esta diferencia terapéutica es hipotética, porque en ninguno de los 2 casos se tiene conocimiento exacto del mecanismo de acción, aun cuando la mayoría de los modelos preclínicos demuestran propiedades anticonvulsivas. Adicionalmente, la evidencia científica actual de los extractos de cannabis enriquecidos con CBD no es suficiente para tomar decisiones terapéuticas y hacen falta ensayos clínicos controlados que confirmen su eficacia clínica y su seguridad; sin embargo, los reportes de casos, las encuestas dirigidas y los ensayos abiertos publicados hasta el momento evidencian que estos productos pueden ser una alternativa eficaz y segura en el tratamiento de la epilepsia refractaria. A diferencia de los extractos de cannabis enriquecidos con CBD, el CBD purificado al 100% sí tiene una evidencia científica sólida que surge a partir de 3 ensayos clínicos controlados y aleatorizados, los cuales apoyan su uso para el tratamiento de la epilepsia refractaria en el síndrome de Dravet y el síndrome de Lennox-Gastaut. Aún existen muchos interrogantes que deberán aclararse con estudios específicos, por ejemplo, está por definirse si el mecanismo de acción del CBD es independiente de las interacciones farmacológicas con otros fármacos, principalmente el clobazam; también está por definirse su perfil de seguridad a largo plazo, especialmente en el desarrollo cerebral y en el embarazo. Sin embargo, a pesar de los interrogantes, los cannabinoides representan una nueva alternativa para el tratamiento de pacientes con epilepsia refractaria.
Conflicto de interesesEl Dr. Camilo Espinosa-Jovel ha sido asesor médico de los siguientes laboratorios: BIOPAS Laboratoires, Khiron Life Sciences Corp., UCB Pharma y Abbott.