Nuestros objetivos fueron comparar la capacidad de diagnóstico precoz de los biomarcadores (BMC) de enfermedad de Alzheimer (EA) en LCR y RM cerebral, en condiciones posibles de nuestra práctica clínica y, además, conocer la precisión diagnóstica de la combinación de ambas técnicas.
MétodosEntre 2008 y 2009, estudiamos a 30 pacientes con deterioro cognitivo leve (DCL) mediante RM cerebral de 1,5 teslas y análisis de BMC de EA en el LCR. Las RM fueron valoradas por 2 neurorradiólogos, atendiendo a la escala visual de Korf (2004). Los BMC de EA en LCR se analizaron mediante reactivos INNOTEST para proteínas Aβ1-42, total-tau y fosfo-tau. Se evaluó la evolución clínica (según criterios NINCDS-ADRDA) a los 2 años tras la inclusión.
ResultadosEntre los 30 pacientes iniciales, 15 evolucionaron a EA (criterios NINCDS-ADRDA) a los 2 años de la inclusión. La capacidad predictiva de los BMC en LCR (RR 2,7; IC del 95%, 1,1-6,7; p<0,01) es superior a los de RM (RR 1,5; IC del 95%, 0,7-3,4; p<0,2), y la combinación de ambas técnicas alcanza una sensibilidad y valor predictivo negativo del 100%. La normalidad de ambas pruebas complementarias descartó al 100% el desarrollo de EA, en los 2 años siguientes a la realización de las mismas.
ConclusionesSiguiendo nuestra metodología, la precisión diagnóstica de los BMC en LCR es superior a los de la RM para el diagnóstico precoz de EA. La combinación de ambas técnicas consigue una precisión diagnóstica muy alta, tanto para diagnosticar como para excluir precozmente EA, en pacientes con DCL.
The goals of this study were to compare the early diagnostic utility of Alzheimer disease biomarkers in the CSF with those in brain MRI in conditions found in our clinical practice, and to ascertain the diagnostic accuracy of both techniques used together.
MethodsBetween 2008 and 2009, we included 30 patients with mild cognitive impairment (MCI) who were examined using 1.5 Tesla brain MRI and AD biomarker analysis in CSF. MRI studies were evaluated by 2 radiologists according to the Korf¿s visual scale. CSF biomarkers were analysed using INNOTEST reagents for Aβ1-42, total-tau and phospho-tau181p. We evaluated clinical changes 2 years after inclusion.
ResultsBy 2 years after inclusion, 15 of the original 30 patients (50%) had developed AD (NINCDS-ADRA criteria). The predictive utility of AD biomarkers in CSF (RR 2.7; 95% CI, 1.1-6.7; P<.01) was greater than that of MRI (RR 1.5; 95% CI 95%, 0.7-3.4; P<.2); using both techniques together yielded a sensitivity and a negative predictive value of 100%. Normal results on both complementary tests ruled out progression to AD (100%) within 2 years of inclusion.
ConclusionsOur results show that the diagnostic accuracy of biomarkers in CSF is higher than that of biomarkers in MRI. Combined use of both techniques is highly accurate for either early diagnosis or exclusion of AD in patients with MCI.
Debido a la creciente prevalencia de la enfermedad de Alzheimer (EA), la identificación precoz de los pacientes con deterioro cognitivo leve (DCL) que van a desarrollar EA se ha convertido en uno de los objetivos más perseguidos dentro de nuestra especialidad.
Para conseguir dicho diagnóstico precoz, se publicaron los criterios de Dubois et al.1 y, más recientemente, los de Sperling et al.2, con la inclusión del término DCL debido a EA.
En pacientes con DCL, el descenso de los niveles de proteína Aβ1-42 y el aumento de los niveles de proteínas tau en el LCR consiguen una alta capacidad predictiva3 y, actualmente, se consideran relacionados con la fisiopatología de la enfermedad2. Por su parte, la RM cerebral también ha mostrado su capacidad predictiva de EA en pacientes con DCL4,5. Sin embargo, existe controversia acerca de cuál de estos BMC presenta una mayor precisión diagnóstica. Algunos autores consideran mejores predictores los BMC en LCR6-10, mientras otros consideran los de RM11,12.
La ausencia de un BMC óptimo ha llevado a diferentes autores a combinar los resultados de dichas pruebas complementarias para mejorar la capacidad predictiva que muestran por separado6-13.
Nuestros objetivos han sido comparar la capacidad de diagnóstico precoz de los BMC de EA en LCR y RM cerebral, por separado, y conocer la precisión diagnóstica de la combinación de ambas técnicas, en condiciones usuales de nuestra práctica clínica.
Materiales y métodosDiseño del estudioEstudio longitudinal.
Sujetos a estudioEntre 2008 y 2009, se incluyó a 30 pacientes con DCL amnésico diagnosticados según los criterios de Petersen 200614. Todos ellos pertenecientes a la consulta de deterioro cognitivo del Hospital General Universitario de Alicante, algunos de los cuales son seguidos desde hace varios años. Su estudio incluye exploración física y neurológica, estudio neuropsicológico, escala de depresión de Yesavage (15 ítems), analítica sanguínea, RM cerebral y PL. Estos pacientes son seguidos en la consulta externa con revisiones cada 6 meses. En estas, se valora la evolución a EA, según los criterios NINCDS-ADRDA15 y la valoración en la escala GDS. Según la evolución a los 2 años tras la PL, diferenciamos a los pacientes en estables (DCL) o evolucionados a EA (EA).
Criterios de inclusiónPacientes con DCL amnésico, mayores de 55 años, MMSE de Folstein entre 20-27 y valoración en el test del informador menor de 78. Para la inclusión en el estudio y la realización de la PL firmaron consentimiento informado.
Criterios de exclusiónLa presencia de demencia o cualquier otra enfermedad neurológica, psiquiátrica o sistémica que pudiera provocar deterioro cognitivo, el tratamiento anticoagulante y la falta de consentimiento informado. Valoración en la escala de depresión de Yesavage superior a 5 puntos.
ProcedimientosEl neurólogo responsable emitía un diagnóstico de DCL amnésico puro o amnésico multidominio, de acuerdo con los criterios de Petersen14. Posteriormente, se realizó el estudio neuropsicológico que incluía la evaluación de la memoria, el lenguaje, las funciones ejecutivas, la atención y las capacidades visuoconstructivas mediante los test Mini Mental State Examination (MMSE), test auditivo-verbal de Rey, test del trazo (TMT) y test del informador (TIN). La alteración de una función se definió como un resultado Z de –1,5 o menor, lo cual es al menos 1,5 desviaciones estándar por debajo de la media de los sujetos control, en al menos uno de los test usados para estudiar esa función. Los criterios para considerar el paso de DCL a EA fueron cumplir los criterios NINCDS-ADRDA (interferencia en las actividades del sujeto de forma significativa), así como un descenso en el MMSE mayor de 2 puntos y/o un aumento en TIN superior a 7 puntos.
Se realizó RM cerebral en todos los pacientes, para descartar otras lesiones cerebrales responsables del cuadro clínico, y valoración de la atrofia temporal medial (ATM).
Obtención y análisis del líquido cefalorraquídeoSe realizó entre febrero del 2008 y febrero del 2009. Las muestras se obtuvieron entre las 10 y las 14h. La PL la realizó el neurólogo responsable, con una aguja 20×3½. El LCR se recogió en tubos de polipropileno y fue congelado en menos de una hora a −80°C. El LCR era centrifugado antes de realizar la alícuota para congelación. Previamente a la obtención de las muestras para congelar, se recogía un tubo para la realización de bioquímica y recuento celular. En ningún caso, dicho recuento mostró más de 100 hematíes.
Cuantificación de los niveles de proteínas del líquido cefalorraquídeo Aß1-42, T-tau y P-tau181pLos biomarcadores de EA en LCR se analizaron mediante reactivos INNOTEST para proteínas Aβ1-42, T-tau y P-tau181p de Innogenetics (Gante, Bélgica). Además, se obtuvieron los cocientes T-tau/Aβ1-42 y P-tau181p/Aβ1-42. Estos últimos cocientes están siendo muy utilizados por diversos autores, ya que parecen reflejar la relación entre la vía amiloide y la vía tau de la enfermedad16.
Todas las muestras fueron analizadas de forma simultánea, al final del reclutamiento y de forma ciega para los datos clínicos.
Análisis de la resonancia magnética cerebralLa RM cerebral se realizó en un 1,5 teslas (General Electrics) e incluyó un corte coronal en secuencias ponderadas en T1. La ATM se cuantificó visualmente de acuerdo con el método de Korf et al.17. La valoración la realizaron 2 radiólogos experimentados, de forma ciega para los datos clínicos. Se estudió la correlación entre los resultados obtenidos por cada uno de los radiólogos, siendo el coeficiente de correlación intraclase de 0,80 y 0,85. Para la comparación con los resultados de LCR, se consideraron los resultados del radiólogo que tuvo mejor correlación con la clínica.
Análisis estadísticoLos niveles de proteína Aβ1-42 se consideraron anormales si eran menores de 500pg/ml y el resto de las variables se consideraron anormales si los valores eran superiores a 450pg/ml en T-tau, 60pg/ml en P-tau181p, 0,17 en el cociente T-tau/Aβ1-42 y 0,05 en al cociente P-tau181p/Aβ1-42. Consideramos resultado anormal cuando 3 de las variables eran anormales.
La RM cerebral se consideró anormal cuando la suma de ATM derecha e izquierda era 3 o superior.
Para el análisis del tipo de distribución de cada variable se utilizó la prueba de Kolmogorov-Smirnov y para la comparación entre 2 grupos, la U de Mann Whitney.
Para estudiar la existencia de asociación se ha utilizado la prueba de la chi al cuadrado o, en caso necesario, la prueba exacta de Fisher. Para cuantificar la magnitud de la asociación se ha utilizado el riesgo relativo (RR) con un intervalo de confianza (IC) del 95%. Para estudiar la capacidad predictiva se han calculado la sensibilidad, la especificidad, el valor predictivo positivo y el valor predictivo negativo (VPN). Significación estadística: p<0,05. Se utilizó el programa SPSS versión 19.0
Criterios éticosLos laboratorios farmacéuticos que han becado este proyecto no han tenido ningún papel en el diseño, colección o interpretación de datos ni en la redacción de este trabajo.
Todos los pacientes firmaron consentimiento informado para la realización de la PL.
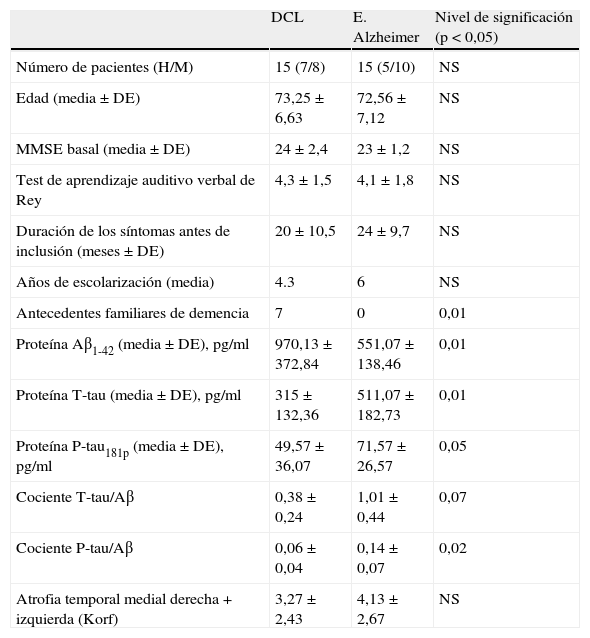
ResultadosLas variables clínico-demográficas y los resultados de cada variable en LCR y RM aparecen reflejadas en la tabla 1. Existen diferencias significativas en la presencia de antecedentes familiares de demencia, claramente superior en el grupo DCL, así como todas las variables obtenidas del análisis del LCR.
Variables clínico-demográficas y resultado de las variables en LCR y RM cerebral de los pacientes incluidos
| DCL | E. Alzheimer | Nivel de significación (p < 0,05) | |
| Número de pacientes (H/M) | 15 (7/8) | 15 (5/10) | NS |
| Edad (media±DE) | 73,25±6,63 | 72,56±7,12 | NS |
| MMSE basal (media±DE) | 24±2,4 | 23±1,2 | NS |
| Test de aprendizaje auditivo verbal de Rey | 4,3±1,5 | 4,1±1,8 | NS |
| Duración de los síntomas antes de inclusión (meses±DE) | 20±10,5 | 24±9,7 | NS |
| Años de escolarización (media) | 4.3 | 6 | NS |
| Antecedentes familiares de demencia | 7 | 0 | 0,01 |
| Proteína Aβ1-42 (media±DE), pg/ml | 970,13±372,84 | 551,07±138,46 | 0,01 |
| Proteína T-tau (media±DE), pg/ml | 315±132,36 | 511,07±182,73 | 0,01 |
| Proteína P-tau181p (media±DE), pg/ml | 49,57±36,07 | 71,57±26,57 | 0,05 |
| Cociente T-tau/Aβ | 0,38±0,24 | 1,01±0,44 | 0,07 |
| Cociente P-tau/Aβ | 0,06±0,04 | 0,14±0,07 | 0,02 |
| Atrofia temporal medial derecha+izquierda (Korf) | 3,27±2,43 | 4,13±2,67 | NS |
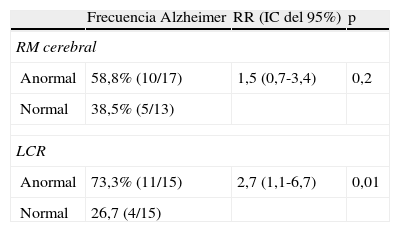
En la tabla 2, podemos observar que el RR (IC del 95%) de desarrollar EA cuando la RM cerebral está alterada es de 1,5 (0,7-3,4), sin que alcance significación estadística. Sin embargo, el RR (IC del 95%) de desarrollar EA cuando los BMC en LCR están alterados es de 2,7 (1,1-6,7), con una significación estadística de 0,01.
Riesgo relativo para un intervalo de confianza del 95% de desarrollar EA
| Frecuencia Alzheimer | RR (IC del 95%) | p | |
| RM cerebral | |||
| Anormal | 58,8% (10/17) | 1,5 (0,7-3,4) | 0,2 |
| Normal | 38,5% (5/13) | ||
| LCR | |||
| Anormal | 73,3% (11/15) | 2,7 (1,1-6,7) | 0,01 |
| Normal | 26,7 (4/15) | ||
IC del 95%: intervalo de confianza; RR: riesgo relativo.
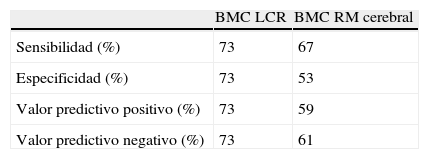
La capacidad predictiva de los BMC de EA en LCR siempre es superior a los de RM cerebral, como podemos comprobar en la tabla 3.
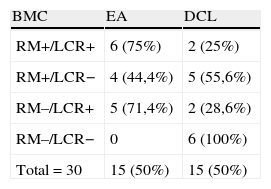
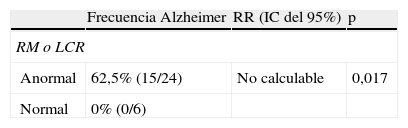
Al combinar los resultados de los BMC de EA en LCR y RM cerebral, llama la atención que cuando ambos son normales ningún paciente desarrolló EA en los 2 años posteriores a la inclusión (tabla 4). Con estos datos, el RR de desarrollar EA, cuando los BMC de LCR o RM cerebral están alterados, presenta una clara significación estadística del 0,01 (tabla 5).
En la tabla 6, encontramos la capacidad predictiva de ambos BMC combinados, donde destacamos la máxima sensibilidad y VPN (100%).
DiscusiónSiguiendo los protocolos de valoración expuestos en este trabajo, nuestros resultados muestran que la capacidad predictiva de los BMC de EA en LCR, para el diagnóstico precoz de la misma, es superior a los de RM cerebral. Estos resultados concuerdan con la mayor parte de los autores que han realizado dicha comparación6-10. Sin embargo, no existe unanimidad en las variables utilizadas para obtener los mejores resultados. Mientras algunos autores consideran las mejores variables los valores absolutos de las proteínas Aβ1-42 y T-tau6-8, otros autores prefieren los cocientes P-tau181p/Aβ1-429 o T-tau/Aβ1-4210. Por nuestra parte, la necesidad de 3 variables alteradas en LCR para ser considerada como prueba anormal, la consideramos suficientemente exigente con la técnica y un buen reflejo de la alteración simultánea de las vías amiloide y tau16.
Estos resultados concuerdan con el reciente modelo hipotético del comportamiento de los BMC en EA18, donde se produciría, en primer lugar, una alteración de los niveles de proteína Aβ1-42, que alcanzaría su máximo ya en la fase preclínica, y posteriormente, de las proteínas tau, también en la fase preclínica; solamente al final de dicha fase, comenzaría la alteración estructural visible en RM cerebral.
Determinados autores consideran los BMC de RM cerebral mejores predictores que los de LCR. Sin embargo, en estos trabajos se utilizan técnicas volumétricas de análisis de RM, que actualmente no tenemos a nuestro alcance11,12.
De nuestros resultados se puede concluir que la capacidad predictiva de cada una de las técnicas aisladamente no es lo suficientemente alta como para considerarla adecuada. Sin embargo, en nuestra opinión, el acercamiento fisiopatológico que proporciona el estudio del LCR en pacientes con DCL resulta actualmente de lo más informativo que podemos tener a nuestro alcance para el diagnóstico precoz de EA.
La mayoría de los autores afirman que la combinación de ambos BMC aumenta la precisión diagnóstica, con respecto a cada uno de ellos por separado6-13. En nuestra experiencia, la sensibilidad y el VPN alcanzan valores máximos. Por su parte, el riesgo relativo de desarrollar EA, cuando cualquiera de los 2 BMC está alterado, no se ha podido calcular por la ausencia de pacientes estables que presentaran alteraciones en alguna de las técnicas. Esto no es óbice para obtener una clara significación estadística, por lo que sumamos nuestra experiencia a las precitadas, siendo estos los primeros datos publicados en la literatura hispana.
Entre nuestros resultados, puede ser llamativa la alta tasa de conversión a EA, a los 2 años de la inclusión. Sin embargo, debemos recordar la media de duración de los síntomas antes de la inclusión en el estudio que, sumada a la duración del mismo, proporciona valores acordes con la literatura (10-15% anual).
Entre las limitaciones de nuestro estudio, contamos con la ausencia de confirmación anatomopatológica y de técnicas volumétricas de análisis de RM. Sin embargo, y como fortaleza, proponemos la utilización de un método y unos medios técnicos que empiezan a estar al alcance de la mayoría de las unidades de deterioro cognitivo de nuestro país.
FinanciaciónEste trabajo ha sido financiado en parte por Novartis España y Grunenthal España.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Novartis España y Grunenthal España, por la financiación de los reactivos. A María de los Angeles Miguelsanz (Laboratorio de Inmunología H.G.U.A.), por la excelente gestión de las muestras.
Presentado como comunicación oral en la LXIV Reunión anual de la SEN.