Gracias a los avances tanto en el diagnóstico como en el tratamiento, las tasas de supervivencia al cáncer han incrementado en los últimos años, y cada vez hay más pacientes en edad reproductiva que se plantean tener descendencia. Por desgracia, los tratamientos oncológicos, como la quimioterapia y la radioterapia, pueden causar una reducción de la fertilidad o la esterilidad en hombres y mujeres.
A pesar de que los pacientes oncológicos pueden beneficiarse del uso de ovocitos y semen de donante, pueden optar también por las estrategias de preservación de la fertilidad. Estas estrategias incluyen la criopreservación de semen y de ovocitos, junto con otras técnicas menos utilizadas o aún en desarrollo.
Preservar la fertilidad de los pacientes a los que se les diagnostica un cáncer debería ser una cuestión a tener en cuenta desde el mismo momento del diagnóstico.
As a result of innovations in cancer diagnosis and treatment, cancer survival rates have increased during last years, and there are increasingly more cancer survivors of reproductive age who want to have children. However, oncological treatment techniques such as chemotherapy or radiotherapy can cause reduced fertility or sterility in both men and women.
Although oncological patients may benefit from oocyte and semen donation, they can also rely on fertility preservation techniques. These techniques include oocyte vitrification and semen cryopreservation, as well as other less used techniques and those still under development.
Fertility preservation in cancer patients should be an option to be taken into account from the day of diagnosis.
El cáncer provoca unos 100.000 fallecimientos en España cada año, siendo los tumores malignos una de las principales causas de muerte en las últimas décadas (Cabanes et al., 2009; SEOM, 2014; Ward et al., 2014). Aunque el cáncer se suele presentar en edades avanzadas, también afecta a niños, adolescentes y jóvenes (Ward et al., 2014; Linkeviciute et al., 2014).
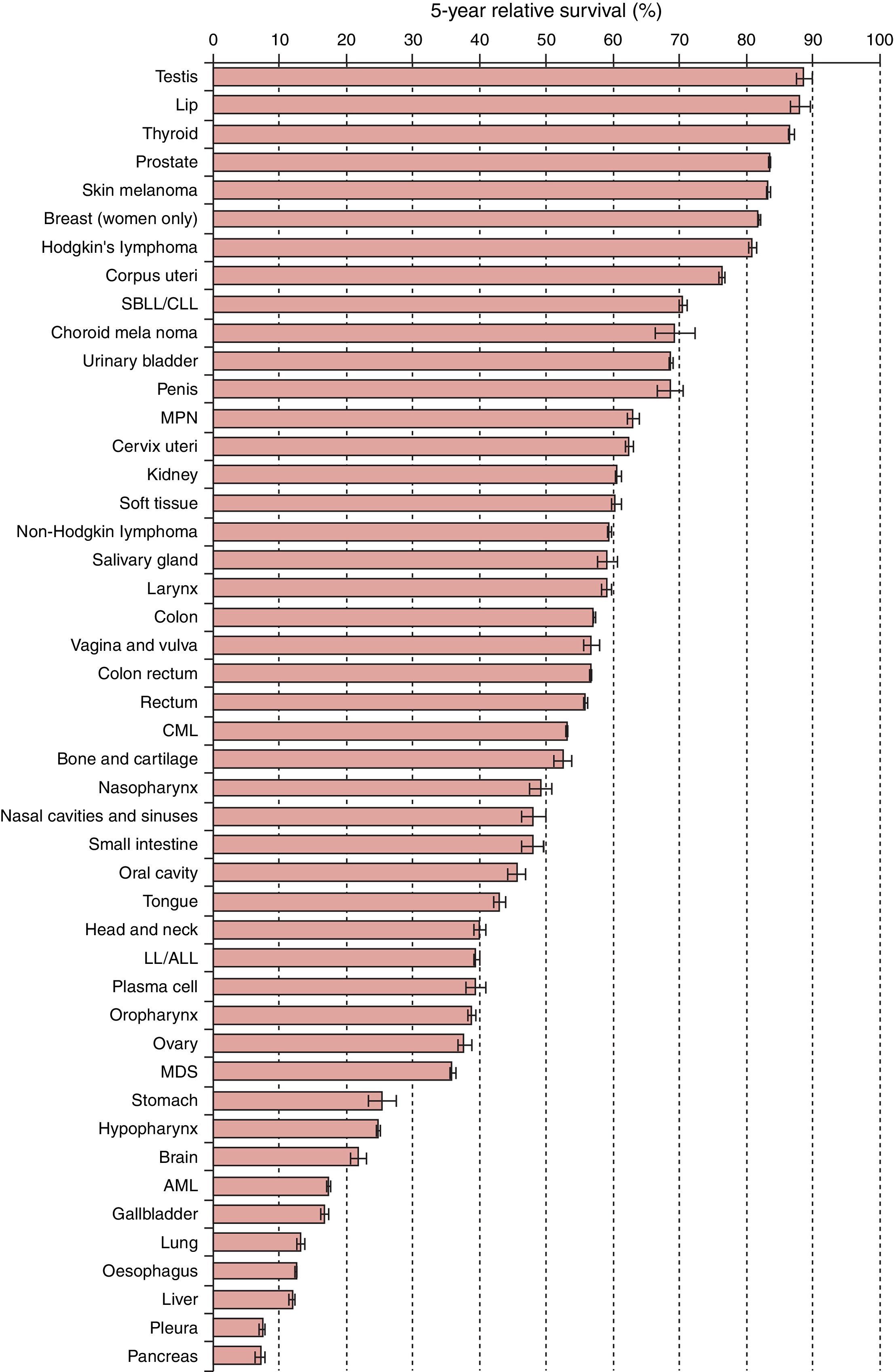
Gracias a los avances e innovaciones en el diagnóstico y el tratamiento, las tasas de supervivencia a los 5 años se han incrementado en Europa hasta un 80% en función del tipo de cáncer, la edad y el país (fig. 1), aumentando sobre todo en pacientes jóvenes (Cabanes et al., 2009; Ward et al., 2014; De Angelis et al., 2014). Teniendo en cuenta todo esto es lógico el elevado número de pacientes diagnosticados de cáncer que lo han superado, que están en edad reproductiva y se plantean tener descendencia (Donnez y Dolmans, 2013).
En España, en el año 2014, los tipos de cáncer con más incidencia en hombres fueron los de próstata (21,7%), de pulmón (16,9%), colorrectal (15,0%) y de vejiga (9,0%); y entre mujeres el de mama (29,0%), el colorrectal (14,9%), el de útero (5,9%) y el de pulmón (5,7%) (SEOM, 2014). Estas frecuencias, sin embargo, pueden variar en pacientes en edad reproductiva, tal y como se puede comprobar en los tipos de cáncer que presentan los hombres que criopreservan semen o las mujeres que vitrifican ovocitos por motivos oncológicos (Meseguer et al., 2006; Garcia-Velasco et al., 2013). En estos hombres el cáncer testicular se presenta como el más frecuente, en mujeres destaca el elevado porcentaje de cáncer de mama (en un 68% de las mujeres que preservan la fertilidad) en concordancia con la alta frecuencia mencionada en otros estudios (Hickey et al., 2009), mientras que los linfomas aparecen como el segundo tipo de cáncer más frecuente en ambos sexos.
Los tratamientos contra el cáncer y la fertilidadEl propio cáncer puede causar disminución o pérdida de fertilidad de manera directa, por ejemplo en casos de linfoma de Hodgkin o tumor testicular (Lee et al., 2006). En este segundo caso, un 13-30% de hombres con cáncer ya son azoospérmicos antes de iniciar el tratamiento, y un 50-75% presentan infertilidad, pese a poder recuperar la función testicular más adelante (Ragni et al., 2005; Meistrich, 2013; Roque et al., 2015).
Sin embargo, son la radioterapia, la quimioterapia y la cirugía las principales causas de pérdida de fertilidad en pacientes con cáncer, tratamientos que pueden producir fallo gonadal y pérdida del potencial reproductivo (Linkeviciute et al., 2014; Muñoz et al., 2015). Los efectos dañinos tras la radioterapia dependen de la localización, el número y la dosis de la fracciones, y en la quimioterapia los efectos gonadotóxicos dependen entre otros factores de la dosis, la edad, el tipo y la combinación de agentes utilizados, siendo los agentes alquilantes los más perjudiciales (Arnon et al., 2001; Wallace et al., 2005; Meistrich, 2013; Gunasheela y Gunasheela, 2014). En hombres la espermatogénesis se puede ver alterada, afectando al número de células espermáticas inmaduras, reduciéndose la cantidad y la calidad de espermatozoides y causando andropausia (Dere et al., 2013; Meistrich, 2013; Gunasheela y Gunasheela, 2014). Por ejemplo, una radiación superior a 6Gy en los testículos puede causar azoospermia u oligozoospermia irreversibles (Katz et al., 2013). A pesar de que los efectos del tratamiento sobre la espermatogénesis son variables y es difícil predecir si esta volverá a niveles normales (Naysmith et al., 1998), algunos estudios determinan que solo un 30% de los pacientes recupera la producción normal de semen, y que un 40% permanece azoospérmico 6 meses después del tratamiento (Meseguer et al., 2006).
En los casos donde la calidad seminal tras el tratamiento oncológico sea baja, pero presente espermatozoides, se podrán inseminar ovocitos mediante ICSI, técnica que requiere bajas concentraciones de espermatozoides. Cuando no se encuentren espermatozoides en el eyaculado se puede intentar recuperar espermatozoides a nivel testicular mediante onco-testicular sperm extraction, y en caso de obtener gametos se puede criopreservar tejido testicular y utilizarlo en un ciclo de FIV con éxito (Meseguer et al., 2003; Roque et al., 2015). Por desgracia, solo un 20-30% de hombres sometidos a tratamiento oncológico tiene una recuperación espermática normal, y muchos casos presentan azoospermia irreversible y no es posible disponer de espermatozoides propios. Actualmente el semen de donante es la única alternativa que tienen estos pacientes si desean tener descendencia.
En mujeres una radiación de 2Gy puede ser suficiente para destruir el 50% de folículos primordiales, afectando la reserva ovárica (Wallace et al., 2003). La radioterapia y la quimioterapia pueden causar fallo ovárico como principal problema, además de amenorrea temporal y menopausia prematuras, problemas en el útero y problemas en el feto si el tratamiento es durante el embarazo (Byrne et al., 1992; Arnon et al., 2001; Green et al., 2009; Mahajan, 2015). Estos efectos pueden estar asociados a otros problemas como osteoporosis, problemas cardiovasculares o depresión (De Vos et al., 2014; Kim et al., 2016). Tanto los efectos gonadotóxicos como la pérdida de fertilidad en mujeres dependen del tipo de cáncer y de la edad en la que se inicia el tratamiento, siendo las de mayor edad las que tienen mayor probabilidad de sufrir fallo ovárico (Wallace et al., 2005). Hay que recordar que la dotación folicular en la mujer es finita, a partir de la semana 20 intraútero el número de folículos empieza a disminuir y la pérdida se acelera 10 años antes de la menopausia (Richardson et al., 1987; Wallace et al., 2003). En este sentido, se ha visto que los niveles de hormona antimulleriana antes y durante la quimioterapia pueden ayudar a predecir la cantidad de daño ovárico (Brougham et al., 2012).
Cabe destacar que un tercio de los adultos sometidos a tratamientos oncológicos durante la infancia o adolescencia presentan infertilidad (Balcerek et al., 2012), que las mujeres pueden presentar menor reserva ovárica después de tratarse con quimioterapia cuando eran niñas o adolescentes (Byrne et al., 1992; El-Shalakany et al., 2013), y que hasta un 42% de las supervivientes en edad reproductiva desarrollará fallo ovárico prematuro (Martinez et al., 2014). Por suerte, también se ha visto que mujeres tratadas de pequeñas consiguen embarazo en un 15-30% de los casos según el tipo de cáncer (Balcerek et al., 2012).
Por último, hay que destacar que la cirugía aplicada en algunos tratamientos contra el cáncer puede originar esterilidad en casos en los que sea necesario extirpar ambos testículos (orquiectomía bilateral) o ambos ovarios (ooforectomía bilateral), eliminación de la próstata (prostatectomía) o cirugía en el área retroperitoneal.
Técnicas de reproducción asistida en los pacientes con cáncerLas técnicas de reproducción asistida (RA) pueden ayudar a pacientes que debido al propio cáncer o al tratamiento oncológico presentan esterilidad. Una de las opciones que tienen es recurrir a semen u ovocitos de donante. Sin embargo, los avances en técnicas de RA han aportado alternativas a los pacientes oncológicos, hecho muy relevante considerando la importancia de tener hijos biológicos para algunas personas. Estas alternativas se basan en la preservación de la fertilidad, es decir, en la preservación de gametos o tejido gonadal. Esta rama de la medicina reproductiva ha evolucionado mucho desde el primer nacimiento a partir de la transferencia de un embrión previamente criopreservado en 1983 (Trounson y Mohr, 1983), o el primer embarazo usando un ovocito descongelado en 1986 (Chen, 1986).
En el año 2013 la Sociedad Americana de Oncología Clínica publicó las directrices de preservación de la fertilidad en pacientes oncológicos, destacando la necesidad de tener un equipo multidisciplinar y de dar una exhaustiva información a los pacientes (Loren et al., 2013). Las técnicas de preservación más utilizadas, y que se establecen como estándar, son la criopreservación de semen y la vitrificación de ovocitos. A pesar de que la criopreservación de preembriones se planteaba como la mejor opción hace algunos años (Lee et al., 2006), este método es menos utilizado hoy en día debido a la necesidad de tener pareja, ser menos económico, presentar más inconvenientes éticos y legales, y porque la vitrificación de ovocitos ha mejorado y se ha extendido desde que ya no se considera una técnica experimental (Loren et al., 2013). De hecho, algunos estudios afirman que los ovocitos vitrificados de donantes dan resultados muy similares a los obtenidos con ovocitos en fresco (Cobo et al., 2008a).
En individuos prepruberales hay otras alternativas menos generalizadas para preservar la fertilidad por motivos oncológicos. En estos casos, aún con pocos estudios al respecto, se puede optar por la protección gonadal previa al tratamiento, criopreservación de tejido testicular u ovárico, o aislamiento y congelación de células germinales inmaduras (Loren et al., 2013; Abir et al., 2016). También se ha realizado con éxito la maduración in vitro y posterior criopreservación de ovocitos inmaduros obtenidos de folículos antrales en niñas y adolescentes (Abir et al., 2016).
Técnicas de reproducción asistidaEstudio de la muestra de semenEl estudio del semen mediante seminograma es esencial en pacientes que preservan la fertilidad antes del tratamiento oncológico, permitiendo predecir la cantidad de muestra a congelar o estimar la calidad que tendrá la muestra de semen en el momento de usarla. Es útil también en pacientes que han superado el cáncer para observar si ha habido pérdida total de la fertilidad, y valorar si es mejor utilizar la muestra en fresco o la muestra congelada antes del tratamiento.
Existen pruebas adicionales como la fluorescent in situ hibridization o el estudio de fragmentación del ADN espermático, que aportan información adicional en varones sometidos a quimioterapia, ya que hay estudios que observan un aumento de espermatozoides aneuploides y mayor fragmentación del ADN poco tiempo después del tratamiento (Dere et al., 2013; Bujan et al., 2013), o incluso mayor fragmentación antes del tratamiento (Meseguer et al., 2008).
Criopreservación de semenActualmente la criopreservación de semen es la opción más eficaz y viable que tienen los hombres diagnosticados de cáncer parar preservar su fertilidad, siendo un método seguro, sencillo y económico. Las tasas de fecundación, implantación y embarazo utilizando muestras de semen criopreservadas de pacientes oncológicos son las mismas que en ciclos de FIV con semen criopreservado por otros motivos, y mejores que en pacientes postratamiento que tienen fertilidad residual, con tasas de recién nacido vivo que pueden llegar al 60% (Meseguer et al., 2006; García et al., 2015). Desde que en 1953 se publicara el primer nacimiento utilizando semen congelado (Bunge y Sherman, 1953) y tras la aparición de la ICSI, el aumento de niños nacidos ha sido exponencial.
Para congelar muestras con un número total de espermatozoides móviles progresivos inferior a 0,1M/ml, o muestras procedentes de biopsias testiculares u onco-testicular sperm extraction, se recomienda utilizar el método de congelación en perlas de nieve carbónica (Nagase y Niwa, 1964). Esta opción mejora el aprovechamiento de la muestra congelada, ya que se pueden descongelar pequeños volúmenes de muestra cada vez que sea necesario.
En la mayoría de casos el paciente tienen tiempo de congelar una sola muestra de semen, pero cuando sea posible es ideal criopreservar más de una (Meseguer et al., 2006), a pesar de que en algunos casos no será necesario usar estas muestras después del tratamiento (Mahajan, 2015). A estas muestras de semen se les otorga una categoría especial por tratarse de muestras de pacientes oncológicos, muestras que de manera muy difícil o imposible se podrán volver a obtener.
La mayoría de hombres diagnosticados de cáncer tienen una calidad seminal suficientemente buena como para ser criopreservada, y hay que tener en cuenta que en general se trata de un grupo de pacientes más joven que el resto de pacientes que visitan una clínica de RA (Meseguer et al., 2006).
Se ha demostrado que el tiempo en que el semen ha estado criopreservado, que suele ser superior en pacientes oncológicos, no tiene efecto en la calidad seminal y se puede utilizar tal y como hacen un 10-15% de hombres que preservan antes del tratamiento (García et al., 2015). En el peor de los casos, los pacientes pueden fallecer durante el tratamiento oncológico. En estos casos la ley española permite a la pareja utilizar la muestra congelada del fallecido, siempre y cuando haya sido autorizado antes de la muerte (BOE, 2006).
Hiperestimulación ovárica controlada y punción folicularEn general, para realizar la estimulación ovárica y obtener el máximo número de ovocitos se administran FSH recombinante y antagonistas de GnRH y hCG cuando hay 2 folículos superiores a 18-20mm (Garcia-Velasco et al., 2013; Domingo et al., 2012). Para que una mujer con un diagnóstico de cáncer se someta a estimulación ovárica para vitrificar ovocitos es imprescindible la aprobación del oncólogo (Domingo et al., 2009; Cobo et al., 2013; Mahajan, 2015), ya que en algunos casos no se dispone del tiempo que requiere el tratamiento, el cual dura unos 8-9 días de media (Martinez et al., 2014). Algún tipo de cáncer es dependiente de hormonas, como el de mama, de ovario o de endometrio (Folkerd y Dowsett, 2010), y en esos casos se debe realizar una estimulación controlada y con administración de inhibidores de aromatasa para que aumenten lo menos posible los niveles de estradiol (Platet et al., 2004; Domingo et al., 2012; Garcia-Velasco et al., 2013, Goldrat et al., 2015). En estos casos, y en aquellos en que no se obtenga una buena respuesta al tratamiento hormonal, se puede plantear la criopreservación de tejido ovárico que podría ser utilizado para un futuro trasplante o para la maduración in vitro de folículos primordiales.
La estimulación y punción folicular se pueden realizar antes de iniciar el tratamiento oncológico para preservar la fertilidad, o después, tras esperar un tiempo prudencial de al menos 2-3 años (Martinez et al., 2014). En relación con el segundo caso se ha visto que en mujeres tratadas con quimioterapia que no habían preservado la fertilidad se obtiene un número más bajo de ovocitos, y el éxito en los tratamientos de FIV es mucho menor, con menores tasas de embarazo y recién nacido vivo (Barton et al., 2012).
Vitrificación de ovocitosLa criopreservación de ovocitos maduros se puede realizar siguiendo diversos protocolos, aunque la vitrificación se postula como una de las opciones más utilizadas, estandarizadas y seguras (Cobo et al., 2013) y que ofrece mejores resultados que la congelación lenta (Smith et al., 2010).
El método Cryotop® descrito por Kuwayama (Kuwayama et al., 2005) es el método normalmente utilizado para la vitrificación, tanto para ovocitos como para preembriones. La ventaja de la vitrificación es que evita la formación de cristales de hielo (Liebermann et al., 2003).
Los resultados obtenidos mediante la vitrificación de ovocitos son muy buenos, dado que la tasa de supervivencia a la descongelación puede alcanzar el 97%, más de un 70% de los ovocitos fecundan correctamente y la tasa de embarazo por transferencia puede alcanzar el 60%, obteniendo resultados clínicos similares a tratamientos con ovocitos frescos u ovocitos de donante criopreservados (Cobo et al., 2008a; Cobo et al., 2008b; Kim et al., 2011; Martinez et al., 2014). En pacientes con cáncer ya se ha observado que la criopreservación ovocitaria es efectiva para preservar la fertilidad (Cobo et al., 2008b; Garcia-Velasco et al., 2013).
Aunque se ha visto que las mujeres con cáncer pueden presentar una respuesta más pobre a la estimulación ovárica (Domingo et al., 2012), la media de ovocitos maduros obtenidos en pacientes oncológicas que vitrifican antes del tratamiento puede llegar a un número medio de 8,5 (Garcia-Velasco et al., 2013). Esta es una cantidad suficientemente elevada como para intentar al menos un ciclo de FIV con buenas expectativas después de superar el cáncer (Martinez et al., 2014). Teniendo en cuenta la elevada eficiencia de la técnica, no hay duda de que las pacientes oncológicas pueden beneficiarse de la vitrificación, técnica que tiene que ser considerada como primera opción (Domingo et al., 2009).
Criopreservación y trasplante de tejido gonadalLa criopreservación de tejido ovárico es una opción para preservar la fertilidad en aquellos casos en que no se disponga de tiempo para estimulación ovárica y posterior obtención de ovocitos antes de iniciar el tratamiento oncológico. Este procedimiento se acompaña de un futuro trasplante del tejido criopreservado para restaurar la fertilidad a la paciente. Es una de las pocas opciones disponibles para preservar la fertilidad en niñas con cáncer (Revel et al., 2009), y aunque aún es considerada una técnica experimental (Loren et al., 2013), se van realizando importantes avances. Como ejemplo de esto, recientemente se publicó la noticia del primer nacimiento en que a la madre se le había trasplantado tejido ovárico criopreservado antes de realizarse quimioterapia cuando aún era una niña (Demeestere et al., 2015). Previamente ya se habían descrito en mujeres adultas embarazos tras trasplante de tejido ovárico al finalizar el tratamiento oncológico, tanto en casos de trasplante heterotópico como ortotópico (Morris y Riley, 2011; Stern et al., 2013), incluso trasplantes entre hermanas gemelas monocigóticas (Silber et al., 2010). Sin embargo, esta técnica presenta inconvenientes como la necesidad de intervención quirúrgica, posible aceleración del fallo ovárico al amputar un gran volumen de tejido ovárico, o riesgo de reintroducir células malignas a la paciente, especialmente en casos de leucemia, linfoma de Burkitt y neuroblastoma (Rosendahl et al., 2010; Kim et al., 2011).
La criopreservación de tejido testicular es una opción que puede plantearse también en pacientes prepuberales, y ya se está aplicando a pesar de ser una técnica experimental que aún no ha obtenido ningún embarazo en humanos (Grinsberg et al., 2014). En diferentes modelos animales se ha visto que el trasplante de células madre espermatogoniales presentes en tejido testicular pueden restaurar la espermatogénesis (Grinsberg et al., 2014), lo cual ofrece un futuro prometedor, por ejemplo para el tratamiento de hombres que han perdido su fertilidad debido a la quimioterapia.
Diagnóstico genético preimplantacional y cáncerEl diagnóstico genético preimplantacional (DGP) es una técnica que se aplica de manera rutinaria en las clínicas de RA, de la cual se podrían beneficiar pacientes con cáncer y sus descendientes. De hecho, en 2008 se reportó el primer nacido vivo después de aplicar DGP para seleccionar embriones libres de predisposición al cáncer en una mujer portadora de una mutación en el gen BRCA1, la cual aumenta el riesgo de padecer cáncer de mama (Jasper et al., 2008). Y en 2012 nació en España el primer niño después de aplicarse DGP en un caso similar (Ramón et al., 2012). Asimismo, padres con un hijo con cáncer podrían hacer uso del DGP para seleccionar preembriones compatibles con el hermano afecto y poder realizar un futuro trasplante.
Según la legislación actual, tal y como se expone en el artículo 12 de la Ley 14/2006, en España la selección de preembriones por DGP solo puede aplicarse en casos de enfermedades graves, de aparición precoz y que no sean susceptibles a tratamiento posnatal (BOE, 2006). Es por eso que en casos de cáncer no se puede aplicar actualmente el DGP de forma rutinaria en casos como los anteriormente comentados, aunque sí se puede en caso de obtener un informe favorable de la Comisión Nacional de Reproducción Humana Asistida.
Aspectos a tener en cuentaEl consejo de fertilidadHay estudios que estiman que solo un 30-50% de pacientes reciben consejo de fertilidad antes de empezar el tratamiento oncológico, pese la importancia de ofrecerlo a los pacientes en edad reproductiva (Loren et al., 2013; De Vos et al., 2014; Kim et al., 2016). Debido al aumento de supervivencia al cáncer, los esfuerzos deben ir dirigidos no solo a curar la enfermedad, sino también a garantizar una buena calidad de vida. Los pacientes deben recibir información acerca del riesgo de pérdida de fertilidad permanente que puede suponer el tratamiento oncológico, además de todos los síntomas, efectos colaterales y enfermedades asociadas: fallo ovárico prematuro, amenorrea, azoospermia, alteraciones hormonales, etc. Los pacientes deberían recibir consejos sobre preservación de la fertilidad cuanto antes siempre que sea posible, y siempre con la autorización del oncólogo, informando de todas las opciones y técnicas disponibles, costes y detalles. Se debería hablar también de opciones como la donación de embriones, donación de gametos o la adopción. En definitiva, son imprescindibles en estos casos una información precisa y detallada, una buena comunicación con el paciente y la participación de un equipo multidisciplinar, desde oncólogos a psicólogos, pasando por ginecólogos y especialistas en RA.
La donación de gametos como alternativa después del cáncerEs evidente que con todos los problemas que los tratamientos oncológicos causan en la fertilidad no siempre es posible utilizar gametos propios. Hay que tener en cuenta que muchos de los pacientes que han superado un cáncer no han preservado la fertilidad antes del tratamiento, y también que hace unos años las técnicas de preservación de la fertilidad no estaban tan generalizadas en las clínicas como lo están actualmente, en especial la técnica de vitrificación de ovocitos (Lee et al., 2006). Además, y en el caso de haber preservado anteriormente la fertilidad, un ciclo de FIV no tiene una eficiencia del 100%. Hay que tener en cuenta también que los pacientes oncológicos pueden tener problemas de fertilidad no relacionados directamente con el cáncer o el tratamiento. Además, cabe recordar el desgaste físico y psicológico que supone pasar por un tratamiento oncológico, motivo por el cual los pacientes podrían rechazar iniciar un ciclo de FIV con gametos propios después del cáncer, a pesar de presentar fertilidad residual. Es por todos estos motivos que en ocasiones la única opción es recurrir a ovocitos de donante o semen de banco.
La donación de ovocitos da buenos resultados y se obtienen buenas tasas de fecundación y desarrollo embrionario (Cobo et al., 2008b; Muñoz et al., 2015), seguidas de buenas tasas de embarazo por transferencia, especialmente para embriones en el día 5 de desarrollo (Cobo et al., 2008b). El semen de banco es también una opción que da excelentes resultados, con tasas de fecundación y embarazo equiparables a hombres sin problemas de fertilidad (Viloria et al., 2011).
Embarazo después del cáncerSe ha visto que la funcionalidad y receptividad endometrial en pacientes sometidas a tratamiento oncológico es igual a la de pacientes sin tumores previos (a excepción de pacientes con cáncer endometrial y casos que requieren radioterapia pélvica), y tampoco se ven modificadas las probabilidades de embarazo, aborto o anomalías en el feto después de la quimioterapia, tanto si el tratamiento oncológico lo recibe la mujer como el hombre (Arnon et al., 2001; Green et al., 2009; Fujimoto et al., 2014; Muñoz et al., 2015). Además, aunque depende del tipo de cáncer, las pacientes acostumbran a esperar entre 3 y 5 años para buscar el embarazo, que es lo aconsejable después de un tratamiento oncológico para asegurarse de que la enfermedad está curada y se puede seguir una vida normal (Domingo et al., 2009; Martinez et al., 2014). El embarazo poscáncer es totalmente seguro, y algunos estudios afirman que pacientes con cáncer de mama que consiguen embarazo al menos 10 meses después del diagnóstico no ven empeorado su pronóstico e incluso ven aumentada su supervivencia (Valachis et al., 2010; Goldrat et al., 2015).
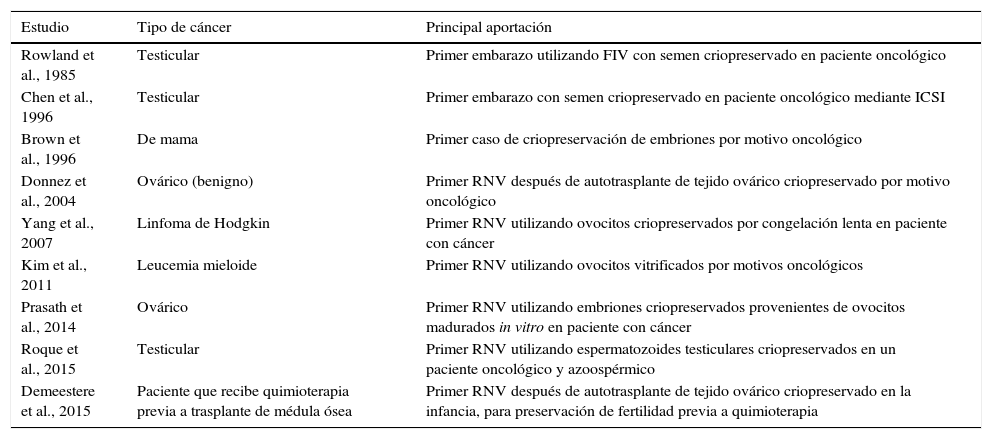
Preservación de la fertilidad y cáncer: qué se ha conseguido y alternativas de futuroEn la tabla 1 se encuentra una recopilación de los primeros hitos conseguidos tras el desarrollo de técnicas de preservación de la fertilidad combinadas con las TRA.
Estudios pioneros en preservación de la fertilidad
| Estudio | Tipo de cáncer | Principal aportación |
|---|---|---|
| Rowland et al., 1985 | Testicular | Primer embarazo utilizando FIV con semen criopreservado en paciente oncológico |
| Chen et al., 1996 | Testicular | Primer embarazo con semen criopreservado en paciente oncológico mediante ICSI |
| Brown et al., 1996 | De mama | Primer caso de criopreservación de embriones por motivo oncológico |
| Donnez et al., 2004 | Ovárico (benigno) | Primer RNV después de autotrasplante de tejido ovárico criopreservado por motivo oncológico |
| Yang et al., 2007 | Linfoma de Hodgkin | Primer RNV utilizando ovocitos criopreservados por congelación lenta en paciente con cáncer |
| Kim et al., 2011 | Leucemia mieloide | Primer RNV utilizando ovocitos vitrificados por motivos oncológicos |
| Prasath et al., 2014 | Ovárico | Primer RNV utilizando embriones criopreservados provenientes de ovocitos madurados in vitro en paciente con cáncer |
| Roque et al., 2015 | Testicular | Primer RNV utilizando espermatozoides testiculares criopreservados en un paciente oncológico y azoospérmico |
| Demeestere et al., 2015 | Paciente que recibe quimioterapia previa a trasplante de médula ósea | Primer RNV después de autotrasplante de tejido ovárico criopreservado en la infancia, para preservación de fertilidad previa a quimioterapia |
FIV: fecundación in vitro; ICSI: intracytoplasmic sperm injection; RNV: recién nacido vivo.
Además de todas las técnicas comentadas, hay otras alternativas para los pacientes oncológicos. Por ejemplo, la transposición de ovarios (ooforopexia), que pese a ser una técnica sencilla ha ofrecido buenos resultados (Bisharah y Tulandi, 2003). También hay que mencionar opciones como la preservación de fertilidad mediante cirugía conservativa en fases iniciales de tumores ginecológicos (Vasconcelos y de Sousa Mendes, 2015; Angarita et al., 2016), o el estudio de agentes en fase experimental para minimizar los efectos de la quimioterapia, por ejemplo AS101, imatinib o esfingosina-1-fosfato (Kalich-Philosoph et al., 2013; Li et al., 2014). También a nivel experimental se están desarrollando métodos de protección gonadal, por ejemplo encapsulando los agentes quimioterapéuticos en nanopartículas específicas para las células cancerígenas (Ahn et al., 2013).
Hay otras técnicas aún lejos de la rutina clínica, como la derivación de ovocitos y espermatozoides a partir de células madre espermatogoniales u oogoniales, o la generación de ovarios artificiales, pero poco a poco se van realizando importantes avances (Krotz et al., 2010; De Vos et al., 2014; Easley et al., 2014). Por ejemplo, en ratón se han obtenido ovocitos a partir de células madre embrionarias (Hayashi et al., 2012) y también espermátides capaces de originar embriones sanos y descendencia fértil (Zhou et al., 2016).
ConclusionesAunque la prioridad debe ser salvar la vida del paciente oncológico, varios estudios recomiendan un consejo de fertilidad por parte de oncólogos que actualmente parece insuficiente.
El propio cáncer puede reducir la fertilidad de manera directa, pero un alto porcentaje de pacientes pierden su potencial reproductivo al someterse a cirugía, y sobre todo a quimioterapia y radioterapia, que tienen como diana las células en división y pueden producir fallo gonadal.
La criopreservación de semen y la vitrificación de ovocitos son actualmente los mejores métodos que tienen los pacientes oncológicos para preservar la fertilidad. Aquellos pacientes supervivientes al cáncer que han preservado la fertilidad tienen más probabilidades de realizar un tratamiento de RA con sus propios gametos en un futuro. Hay la necesidad de recomendar estas técnicas a pacientes que deban someterse a un tratamiento oncológico, especialmente a aquellos con pronóstico de supervivencia a largo plazo aceptable y que aún no tengan descendencia.
Por otro lado, en caso de que los pacientes no dispongan de gametos criopreservados, existe la opción de la donación, alternativa que da excelentes resultados.
Los avances en los tratamientos oncológicos y las mejoras y aparición de nuevas técnicas de reproducción asistida aumentarán aún más las opciones de tratamiento para estos pacientes.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.