La tuberculosis (TB) sigue siendo, en la actualidad, la causa más frecuente de muerte en el mundo entre personas de 15 a 50 años de edad, estimándose unos 2,4-2,9 millones de muertes anuales. Cada año aparecen unos 8 millones de casos nuevos de TB y se calcula que, aproximadamente, 1.700 millones de personas están infectadas por su agente etiológico, Mycobacterium tuberculosis (MT)1. Sin embargo, mientras en los últimos 50 años los países desarrollados han seguido acertados programas de control de la TB para la detección temprana de nuevos casos y la prescripción de tratamientos adecuados, los países en vías de desarrollo sin programas de control de la enfermedad han mantenido un elevado número de casos infectantes. Esto significa que la tuberculosis es una enfermedad que continúa afectando a la humanidad a pesar de que su etiología es bien conocida desde hace más de un siglo y que, desde los últimos 40 años, se disponen de medidas eficaces de tratamiento. El lento crecimiento del agente causal y su capacidad de adaptación a condiciones ambientales adversas han favorecido su persistencia.
No obstante, el declive de la TB empezó mucho tiempo antes de iniciarse los programas de control y prevención de la enfermedad. La instauración del tratamiento específico ha contribuido a acelerar hasta cuatro veces este declive, pero su factor desencadenante reside en la mejora de las condiciones socioeconómicas de la población. Bajo condiciones sociosanitarias favorables, la tuberculosis parece declinar de forma natural y, teóricamente, debería ser una enfermedad erradicable2. Sin embargo, con las herramientas disponibles en la actualidad, sólo se erradicará totalmente cuando fallezca la última generación de casos infectados. El impacto de la epidemia del virus de la inmunodeficiencia humana (VIH), la instauración de regímenes de tratamiento inadecuados junto al aumento en la frecuencia de casos incurables de tuberculosis multirresistente, constituyen serios retrocesos en el camino de la erradicación de la enfermedad3.
Estado actual de la tuberculosis en España
En España se producen cada año entre 16.000 y 18.000 casos nuevos de enfermedad tuberculosa, de los que aproximadamente la mitad son altamente contagiosos. Esto supone unas tasas específicas de alrededor de 40-45 casos por cada 100.000 habitantes y año, de cuatro a ocho veces superiores a las del resto de países desarrollados4. Este elevado número de casos es consecuencia del numeroso reservorio de infectados por M. tuberculosis, dado que alrededor del 25-30% de la población está infectada5. Además, el riesgo anual de infección (RAI), estimado del 0,12% en 1990 es similar al que tenían algunos países desarrollados 30 años atrás. Este retroceso se ha producido porque, probablemente, en los últimos años no se han conseguido disminuciones anuales de la endemia superiores al 6-8%, valores muy alejados del 12-14% obtenidos en países que han seguido medidas de control más acertadas4,6,7.
Todo lo expuesto cobra una especial relevancia con la aparición del síndrome de inmunodeficiencia adquirida (sida), dado que no sólo existe una clara confluencia de edades entre los casos de sida y tuberculosis, sino que además nuestro país tiene la mayor tasa de coinfección por el VIH y M. tuberculosis. Por ello, se estima que alrededor del 15-20% de los nuevos casos anuales de tuberculosis pueden ser imputables al sida, lo que supone de 3.500 a 4.000 nuevos casos al año. Por último, aunque el tratamiento de la tuberculosis pulmonar es altamente efectivo, la necesidad de un régimen de tratamiento prolongado conlleva problemas de cumplimiento que, a su vez, pueden favorecer el incremento de resistencia a los fármacos.
Tratamiento de la tuberculosis pulmonar
En la actualidad, tanto en los EE.UU. como en gran parte del resto del mundo, el tratamiento estándar frente a la TB no resistente consiste en un régimen combinado de isoniacida (INH) y rifampicina (R) durante 6 meses, junto a pirazinamida (PZA) los primeros 2 meses. Este régimen terapéutico convencional es conocido como HRZ8. No se ha podido demostrar un beneficio adicional prolongando el tratamiento con PZA más allá de 2 meses y el etambutol (E) no parece un sustituto adecuado para la PZA9. En pacientes portadores del VIH que siguen tratamiento con fármacos inhibidores de las proteasas, se aconseja la administración de rifabutina, debido a la interacción entre la rifampicina y esta familia de fármacos. Los primeros 2 meses de tratamiento se denominan fase de inducción, y los últimos cuatro, fase de continuación. La fase de inducción está diseñada con el objetivo de reducir rápidamente la gran población de microorganismos que caracteriza la enfermedad no tratada y, asimismo, reducir la posibilidad de desarrollar resistencias. Esta primera etapa es seguida por la fase de continuación o consolidación, en que los fármacos actúan directamente contra los microorganismos persistentes, particularmente aquellos que presentan un crecimiento lento.
Variaciones del régimen HRZ incluyen la introducción de un cuarto fármaco, al menos durante un período del tratamiento y el empleo de una variedad de esquemas terapéuticos intermitentes. En ciertas circunstancias, la R se utiliza sólo durante los primeros 2 meses del tratamiento y la duración global del régimen terapéutico se amplía hasta los 8 meses, con resultados comparables al esquema convencional de 6 meses. Como ya se ha comentado antes, el tratamiento combinado se indica con el fin de incrementar la eficacia antituberculosa y reducir el riesgo de resistencias. El desarrollo de resistencia a múltiples fármacos (TB-MR), caracterizada por una disminución en la susceptibilidad a INH y R, asociada a la presencia de un fracaso terapéutico, es el acontecimiento de mayor relevancia en la evolución de un paciente con TB. La causa más frecuente que provoca el desarrollo de resistencia consiste en la falta de adherencia al régimen terapéutico asignado, por lo que el total cumplimiento es el principal objetivo del tratamiento.
Bases científicas de la quimioterapia antituberculosa
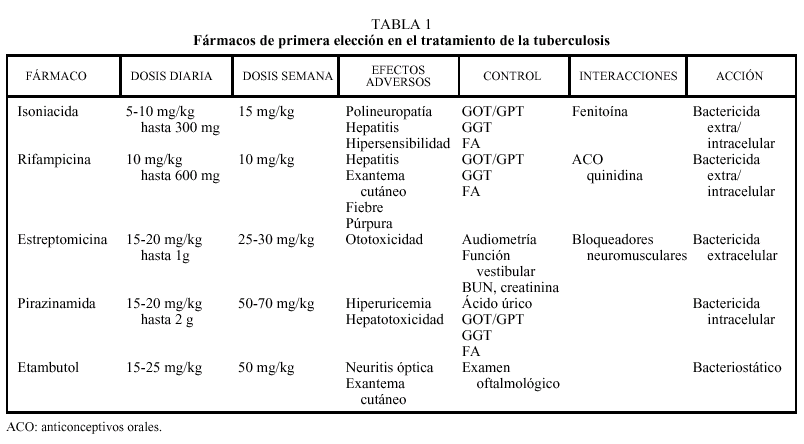
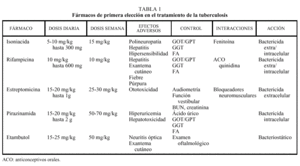
Cada uno de los principales agentes antituberculosos varía en su capacidad de destruir los microorganismos, en prevenir la emergencia de resistencia y en esterilizar las lesiones. La INH es el agente bactericida más potente capaz de destruir más del 90% de los bacilos en los primeros 7 días de tratamiento, actuando sobre la población bacilar metabólicamente activa. Además, es bastante efectivo en prevenir la aparición de resistencias.
La R es, asimismo, un eficaz fármaco bactericida con una potente acción esterilizante¸ y presenta una buena capacidad para prevenir la aparición de resistencias. Al tiempo que actúa sobre aquellos bacilos que se dividen rápidamente, destruye la población bacilar «persistente» que permanece inactiva durante largos períodos, pero que puede presentar actividad metabólica intermitente si es sometida a una corta exposición de fármacos. Esta condición es crucial para alcanzar la esterilización.
La PZA, aunque se trata de un agente bactericida, se utiliza en general por su efecto esterilizante. Este fármaco resulta particularmente efectivo, al destruir los bacilos intracelulares secuestrados dentro de los macrófagos en ambiente ácido10. El etambutol y la estreptomicina son fármacos menos potentes. El primero es bactericida sólo a concentraciones elevadas y presenta menor capacidad que INH y R en prevenir la aparición de cepas resistentes. Además, en presencia de microorganismos sensibles, es muy dudoso que el etambutol pueda añadir efectividad a un régimen terapéutico que combine INH, R y PZA. Tanto el E como la estreptomicina pueden tener un papel en el tratamiento de los pacientes con antecedentes previos de resistencia. En consecuencia, deberían incluirse en la fase inicial del tratamiento en aquellos países con tasas moderadas o elevadas de resistencia a la INH, o bien en ciertos grupos de pacientes con riesgo muy elevado de resistencia a la INH en países con baja prevalencia de resistencias.
Destrucción del bacilo latente
La característica que hace que la tuberculosis sea una enfermedad de difícil control es la capacidad del MT de adaptar su metabolismo a una fase de latencia. Esta particularidad dificulta su erradicación de los tejidos del hospedador mediante fármacos y permite permanecer inadvertido al reconocimiento por parte del sistema inmunitario.
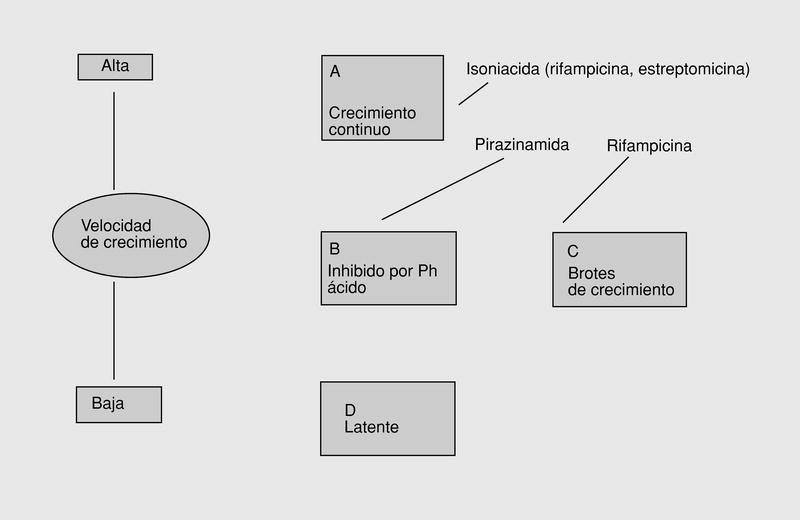
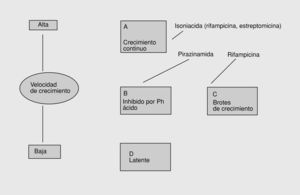
Los estudios llevados a cabo desde 1948 para diseñar una pauta farmacológica adecuada para el tratamiento de la tuberculosis pusieron de manifiesto que uno de los problemas más importantes era la recaída de la enfermedad durante el período posterior al tratamiento, que podía llegar durar de meses a años. Todos los estudios cristalizaron en 1976 con una pauta de tratamiento corta (6 meses) basada esencialmente en la utilización de 3 fármacos: INH, R y PZA11. Dejando aparte los problemas derivados de la adquisición de resistencias a través de la mutación natural de los bacilos, en 1985 Mitchison12 desarrolló una hipótesis en la que explicaba las bases de este tratamiento, a partir de modelos experimentales tanto in vitro como in vivo y de evidencias clínicas. Por otro lado, los estudios sobre actividad bactericida temprana de los fármacos (early bactericidal activity [EBA]), llevados a cabo a través del análisis de las concentraciones bacilares en muestras de esputo, ponían de manifiesto la gran actividad bactericida de los fármacos al iniciarse el tratamiento, debido a la presencia de cuatro poblaciones bacilares y tres fases en el tratamiento de la tuberculosis (fig. 1): a) primera fase de 2-3 días de duración, en la que aproximadamente el 90% de la población bacilar extracelular de los granulomas es destruida rápidamente por la INH; b) segunda fase de 2 meses de duración, en la que el ambiente ácido predominante de las lesiones cavitadas permite la actividad bactericida de la pirazinamida, la mayoría de los bacilos son fagocitados por los macrófagos y pasan a ser intracelulares, y c) tercera fase de 4 meses de duración en que las poblaciones semilatentes de bacilos son destruidas por la rifampicina.
Fig. 1. Hipótesis de las poblaciones bacilares. Se indica la acción de los diferentes fármacos.
La eficacia de los regímenes basados en la R, INH y PZA queda demostrada por su rápido índice de esterilización del esputo y su baja frecuencia de recaídas. Con este tipo de esquema terapéutico, debería ser posible negativizar el cultivo de esputo en alrededor del 90% de los casos a los 2 meses, con un índice de curación mayor del 95% y una frecuencia de recaídas menor del 5%, siguiendo una pauta de 6 meses de duración.
Tuberculosis en pacientes con cultivo para M. tuberculosis positivo
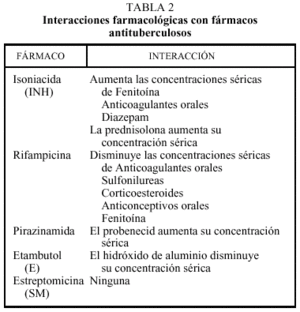
Los resultados de los esquemas terapéuticos de 6 meses de duración se exponen en la tabla 2. Seguidamente, se examinan algunos aspectos del tratamiento.
Duración del tratamiento
Mientras que el esquema terapéutico de corta duración que incluye 6 meses de INH/R puede prescribirse con una tasa de recaídas mínima, otras pautas de duración más cortas no se aceptan en los países desarrollados debido a su frecuencia de recaídas y a tasas de curación más bajas.
Papel de la pirazinamida
Los estudios que compararon el empleo de 2, 4 y 6 meses de PZA del régimen convencional basado en la asociación INH/R (HZ) durante un período de 6 meses, demostraron que la PZA sólo es necesaria en los primeros 2 meses de tratamiento9,13. Sin embargo, si la PZA no se utiliza o no puede ser tolerada, se requiere un régimen terapéutico de 9 meses de duración que incluya etambutol en los 2 meses iniciales14.
Esquemas terapéuticos recomendados
La mayoría de los ensayos clínicos que han evaluado la eficacia del tratamiento antituberculoso incluyen los siguientes esquemas terapéuticos: fase inicial y de mantenimiento con dosis diarias, fase inicial diaria seguida de una fase de continuación intermitente dos o tres veces por semana, o bien tratamiento completo intermitente dos o tres veces por semana. Siguiendo cualquiera de ellos, las tasas de recaída no superan el 5% tras 30 meses de seguimiento. La periodicidad de la dosificación depende de un balance entre el coste, la disponibilidad de los fármacos, la aparición de efectos adversos y de aspectos organizativos.
En España, inicialmente debe recomendarse la utilización del régimen estándar de 6 meses, administrando INH, R y PZA durante los 2 primeros meses de tratamiento, seguidos durante 4 meses de INH y R15. En áreas donde exista una elevada resistencia inicial a INH se debe añadir E durante los primeros 2 meses. Esta pauta de tratamiento tiene alto poder bactericida y esterilizante y presenta escaso número de recidivas
(inferior al 1-2%), tiene pocos efectos secundarios y resulta más económico que el régimen convencional de 9 meses. En caso de intolerancia grave o imposibi lidad de empleo de alguno de estos fármacos, el paciente debe ser remitido a un centro especializado donde se evaluará un tratamiento con agentes de segunda línea.
Los preparados que llevan INH, R y PZA en combinaciones de dosis fijas (Rifater®) y las de INH y R deben emplearse siempre que sea posible para ayudar al cumplimiento del paciente y para reducir el riesgo de dosificación incorrecta. Estas combinaciones de fármacos a dosis fijas no presentan grandes diferencias con las formulaciones de fármacos separadas en cuanto a eficacia y aparición de efectos adversos16. En ciertas ocasiones, fundamentalmente ante pacientes no colaboradores o por razones socioeconómicas, está indicado el empleo del mismo régimen de quimioterapia, pero en administración intermitente dos-tres veces por semana, con corrección de las dosis administradas en cada toma. Este esquema aporta unos resultados similares a los del tratamiento diario con una toxicidad y coste menores y sin incremento de los efectos adversos.
Indicaciones de ingreso hospitalario
Se recomienda hospitalizar a todos los pacientes con baciloscopia positiva. En caso de que el paciente no sea hospitalizado recibirá información escrita acerca de las medidas preventivas de transmisión de la TB en la comunidad. Cuando exista sospecha diagnóstica y sea necesario realizar exploraciones complementarias, la situación clínica del paciente sea grave (meningitis, hemoptisis masiva, insuficiencia respiratoria aguda, etc.) o coexistan enfermedades de base como hepatopatía crónica, diabetes mellitus, enolismo o insuficiencia renal. Otras indicaciones de ingreso hospitalario serán: toxicidad grave a fármacos antituberculosos, inicio de tratamiento con fármacos de segunda línea y tratamiento concomitante con fármacos que puedan interferir en la terapia antituberculosa (p. ej., dicumarínicos, hidantoínas).
Control del tratamiento
Con posterioridad al alta hospitalaria, se realizará un control clínico ambulatorio a los 15 días y, posteriormente, se aconseja un control mensual hasta finalizar el tratamiento. Se practicará baciloscopia y cultivo de esputo mensual hasta obtener la negativización del cultivo y, siempre que sea posible, al finalizar el tratamiento. En los pacientes con alteración previa de la biología hepática, en alcohólicos, en ancianos y en aquellos que sufran algún tipo de hepatopatía crónica, se realizarán análisis mensuales de perfil hepático. En el resto de los pacientes puede efectuarse un control analítico bimensual. En cualquier caso, se solicitarán pruebas hepáticas inmediatas si aparece sospecha clínica de hepatotoxicidad. Ante la elevación asintomática de las transaminasas inferior a cinco veces el valor normal o de fosfatasa alcalina o bilirrubina total inferior a tres veces el valor normal, se realizarán análisis semanales hasta comprobar su normalización o ascenso. Asimismo, se aconseja practicar una radiografía de tórax al inicio del tratamiento, a los 2 meses y al final del mismo.
En los pacientes infectados por MT susceptibles tratados correctamente con una combinación de fármacos que incluya R e INH y cuyo cultivo de esputo persista negativo a los 2 meses de iniciado el tratamiento, no será necesario practicar controles posteriores tras finalizar el tratamiento. Sin embargo, en aquellos pacientes que han demostrado una respuesta bacteriológica más lenta, presentan inmunosupresión o lesiones pulmonares residuales o existen dudas respecto a la cumplimentación del tratamiento, se practicará un control clínico y radiológico a los 6 meses de finalizar el tratamiento estándar.
Tratamiento en situaciones especiales
Insuficiencia renal
Tanto la R como la INH y la PZA pueden prescribirse siguiendo el régimen estándar en pacientes con insuficiencia renal. En el caso de indicarse fármacos nefrotóxicos como la estreptomicina o el E, se requiere una reducción de la dosis y una monitorización de las concentraciones séricas de estos fármacos. En los pacientes con insuficiencia renal terminal, la hemodiálisis tiene un efecto considerable en la depuración de los fármacos y deben modificarse las dosis.
Embarazo
Durante el embarazo no se debería realizar ningún cambio en el régimen estándar. La estreptomicina y otros aminoglucósidos deben evitarse dado el elevado riesgo de ototoxicidad fetal. Tampoco se han demostrado efectos teratogénicos en ningún fármaco de primera línea. Por otra parte, sí debería tenerse en cuenta que los agentes antituberculosos, en particular la R, reducen la eficacia del tratamiento con anticonceptivos orales. Durante el período de lactancia se pueden emplear todos los fármacos antituberculosos con plena seguridad. Las concentraciones de fármacos en la leche materna han de considerarse insuficientes para el tratamiento o la profilaxis de la TB en el lactante.
Enfermedad hepática
Todos los agentes de primera línea (R, INH y PZA) son potencialmente hepatotóxicos, por lo que debe evaluarse la función hepática previa a iniciarse el tratamiento en todos los pacientes. Es imperativo monitorizar la función hepática en los pacientes diagnosticados de hepatopatía crónica (enolismo, hepatitis crónica activa o cirrosis hepática) o aquellos seropositivos para los virus hepatitis B o C. La aparición de toxicidad hepática debe vigilarse con más frecuencia durante los primeros 2 meses de tratamiento, efectuando exámenes semanales de biología hepática en los primeros 15 días17.
Silicosis
En Hong Kong, donde la incidencia de silicosis es elevada, se ha evidenciado que la tuberculosis pulmonar complicada aparece como un grave problema, y se ha demostrado un índice de recaídas superior al 22% a los 3 años de seguimiento y al 33% a los 5 años13 de finalizar un régimen estándar de 6 meses. Este elevado índice de recaídas es debido, en parte, a la difícil penetración de los fármacos en el pulmón fibrótico, y también a una función disminuida de los macrófagos alveolares. El índice de recaídas mejora hasta un 7% después de 3 años de seguimiento si el régimen terapéutico se prolonga hasta 8 meses.
Diabetes mellitus
Los pacientes diabéticos tienen una incidencia elevada de tuberculosis pulmonar y, además, la enfermedad suele ser más extendida. Puede indicarse el régimen estándar teniendo en cuenta que la R puede interactuar con algunos tipos de hipoglucemiantes orales.
Infección por el VIH
Los regímenes de tratamiento estándar indicados en pacientes inmunocompetentes, se aconsejan de la misma manera en pacientes VIH positivos. Incluso existe evidencia de que la respuesta microbiológica tras iniciar el tratamiento es más rápida que en pacientes VIH negativos18. Es bien conocido que en los pacientes VIH positivos es muy común la aparición de reacciones adversas a fármacos, fenómeno que también se observa con la administración de agentes antituberculosos, y son frecuentes las reacciones cutáneas13.
La TB puede, asimismo, acelerar la progresión de una infección por el VIH subyacente, observándose un mayor índice de mortalidad comparado con la población VIH negativa.
Resistencia a fármacos antituberculosos
La resistencia primaria a fármacos antituberculosos es aquella que presentan las cepas aisladas en pacientes que nunca recibieron tratamiento con agentes antituberculosos (cepas vírgenes)19. Este tipo de resistencia aparece como consecuencia del contagio por pacientes que han seleccionado cepas con resistencia adquirida debido a tratamientos previos inadecuados. Existen áereas en el mundo donde el 10-25% de los casos de TB presentan resistencia primaria a la INH. En estas zonas hay que iniciar el tratamiento prescribiendo un mínimo de 3 fármacos en la fase de inducción. En el segundo mes de tratamiento, el número de bacilos es mínimo y se podrá continuar con sólo 2 fármacos. En España no son bien conocidas las tasas de resistencia primaria, pero estudios aislados parecen confirmar que éstas no superan en la actualidad el 4-5% (2-3% a INH), y son prácticamente inexistentes las resistencias a R y E20.
Efectos adversos de los fármacos antituberculosos
Hepatotoxicidad
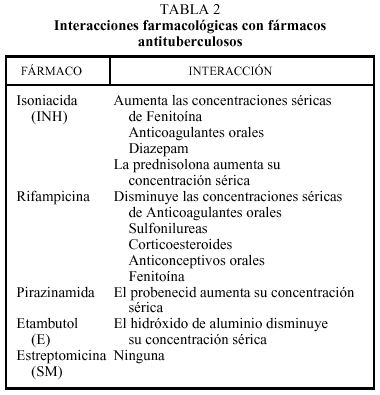
Recientemente, se han caracterizado con detalle las reacciones de toxicidad hepática debidas a la utilización de antituberculosos21. Los fármacos que pueden causar hepatotoxidad son INH (acción citolítica, provoca aumento de las transaminasas), IR (acción inductora, produce colostasis) y PZA (citolítica a dosis altas).
En los casos asintomáticos con aumento de las transaminasas (GOT y GPT) con valores inferiores a cinco veces el rango de normalidad y/o incremento de la fosfatasa alcalina (FA) inferior a tres veces su valor normal, no se modificará el tratamiento pero se practicarán controles estrictos semanales de biología hepática hasta la normalización o estabilización de las cifras alteradas.
A los pacientes con clínica de hepatitis aguda y/o cifras de transaminasas superiores a cinco veces el valor normal, o bien FA superior a tres veces el valor normal, se les deberá suprimir toda la medicación y se indicará ingreso hospitalario, solicitando pruebas de coagulación y marcadores de hepatitis viral. Si, al cabo de una semana, el paciente queda asintomático y se normalizan las alteraciones de la biología hepática, se aconseja reintroducir el mismo tratamiento y realizar una estrecha vigilancia analítica a la semana. En caso de persistencia de la normalidad, se continuará con el mismo esquema terapéutico y se efectuarán controles analíticos cada 2 semanas durante un mes. Si persisten los síntomas o las alteraciones hepáticas en forma de citolisis marcada, se recomienda cambiar definitivamente la INH y PZA por E o estreptomicina (pauta de 12 meses). Si persiste la hepatitis colostática se debe cambiar rifampicina por E o estreptomicina (pauta de 12 meses). De cualquier forma, cada caso debe ser individualizado según el contexto clínico del paciente. Al reintroducir la R, es aconsejable hacerlo durante 3 días de forma progresiva aumentando la dosis a partir de 150 mg hasta 600 mg al cuarto día.
Polineuropatía
Está asociada a la acción de la INH y muy raramente al E22. En el caso de la INH, se debe a la interferencia con el metabolismo de la piridoxina (vitamina B6). Empleando las dosis recomendadas de INH, la aparición de polineuropatía es muy rara y tiende a aparecer en pacientes con enfermedades como la diabetes, la insuficiencia renal crónica, el alcoholismo o la malnutrición. En estos casos está indicada la administración profiláctica de 10 a 50 mg diarios de piridoxina. En caso de sospecha de polineuropatía se deberá suprimir la INH durante 8 días y administrar piridoxina a dosis elevadas (100-200 mg/día). Si se observa mejoría puede reinstaurarse la pauta terapéutica con INH junto a piridoxina; en caso de persitencia de los síntomas, debe suprimirse definitivamente la INH y se introducirá el etambutol a dosis 15-20 mg/kg/día.
Toxicidad ocular
Neuritis óptica
Asociada al empleo de etambutol, resulta una complicación en general reversible tras suprimir el fármaco y aparece raramente si se administran dosis de 15 mg/kg/ día durante períodos inferiores a 2 meses. Se manifiesta fundamentalmente por una pérdida progresiva de la agudeza visual y se caracteriza por imposibilidad para percibir el color verde22,23.
Uveítis
La rifabutina puede causar uveítis y queratitis por depósito corneal tras administración prolongada. Se asocia a concentraciones plasmáticas elevadas de este fármaco, a menudo asociadas a la administración concomitante de otros agentes como la claritromicina y el fluconazol.
Hiperuricemia
Asociada a la administración de PZA, remite siempre al cesar el tratamiento. Sólo si aparece monoartritis gotosa debe suspenderse el fármaco durante una semana y reiniciar el tratamiento. Si se observa recidiva, suspender la PZA y cambiar el esquema terapéutico.
Reacciones cutáneas
Pueden aparecer asociadas a todos los fármacos, por orden de frecuencia: estreptomicina, E, PZA, R e INH24. Remiten generalmente al cesar temporalmente el tratamiento. Tan sólo si el exantema es grave y no responde a la administración de antihistamínicos, debe suprimirse la medicación e identificar el fármaco causante, cambiándolo definitivamente por otro. Si la reacción es moderada y no cede con antihistamínicos, suspender la medicación durante una semana, reintroduciéndola de forma escalonada. Al reaparecer el exantema se sustituye el fármaco responsable.
Otros efectos adversos
Se ha descrito un «síndrome seudogripal» asociado a petequias y trombocitopenia al iniciar el tratamiento intermitente con R. Este cuadro suele remitir al pasar del esquema intermitente al régimen estándar diario. Si persiste tras administración diaria, la R debe suspenderse. Alteraciones hematológicas como leucopenia con neutropenia y trombocitopenia aparecen raramente asociadas a la rifabutina cuando se asocia a inhibidores del CYP 3 A, como la claritromicina, la azitromicina o el fluconazol, y obliga siempre a suspender la medicación.