El exceso de homocisteína plasmática es un factor que predispone a las complicaciones isquémicas de la arterioesclerosis, a la trombosis venosa y el tromboembolismo pulmonar. Esto ha sido demostrado de forma clara en los estudios realizados en los últimos años. El hallazgo de la homocisteína como factor de riesgo cardiovascular es de gran trascendencia clínica, ya que un porcentaje significativo de pacientes con enfermedades isquémicas no presentan los factores de riesgo considerados clásicos y, por tanto, es necesario buscar en ellos otras causas tratables de su enfermedad1. Por otra parte, en los estudios de intervención con fármacos hipolipidemiantes para prevenir las recurrencias isquémicas una elevada proporción de pacientes isquémicos fallecen o sufren recurrencias de la enfermedad a pesar de mantener unas concentraciones de colesterol LDL dentro de la «normalidad» o de haberlas descendido de forma muy acusada. Por ejemplo, en el estudio 4S2 durante un período de cinco años fallecieron de enfermedad coronaria 111 pacientes entre 2.221 (5%) a pesar del tratamiento con dosis de 20-40 mg/día de simvastatina. En estos pacientes la detección y tratamiento de otros factores aterogénicos, entre ellos la homocisteína, podría contribuir a la disminución de esta elevada mortalidad. Este último aspecto se está investigando mediante un ensayo clínico controlado.
Metabolismo de la homocisteína
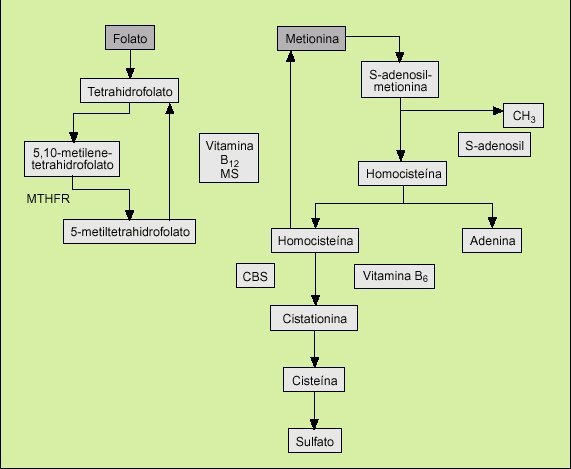
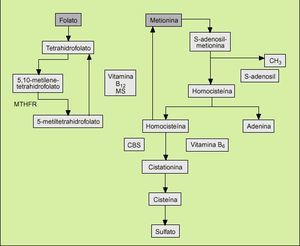
La homocisteína es un aminoácido sulfurado que se origina en el metabolismo de la metionina contenida en las proteínas de la dieta. Su síntesis se realiza a través de la condensación de la metionina con ATP, la cual da lugar a la formación de una molécula donadora de grupos metilo, la S-adenosil-metionina, que tras donar su grupo metilo a un aceptor origina la S-adenosil-homocisteína, la cual a su vez, por acción de la adenosilhomocisteinasa, genera homocisteína liberando adenosina (fig. 1).
Fig. 1. Metabolismo de la homocisteína. MTHFR: metilenetetrahidrofolato reductasa. CBS: cistationina ß-sintetasa. MS: metionina-sintetasa.
La homocisteína es una molécula muy agresiva para el endotelio arterial y en condiciones fisiológicas normales su eliminación se realiza de forma eficiente a través de dos rutas metabólicas principales, las cuales evitan el aumento de sus concentraciones plasmáticas. Estas dos rutas metabólicas son la transulfuración y la remeti lación. En la primera, la homocisteína se condensa con la serina, para dar cistationina y cisteína, proceso en el que intervienen la enzima cistationina-ß-sintetasa (CBS) y la piridoxina como cofactor. En la segunda, la homocisteína es remetilada por un mecanismo íntimamente asociado a los folatos en el que participa la enzima 5-metil-tetrahidrofolato-homocisteína-S-metiltransferasa (MTHFR), la cual es activada por la cobalamina3.
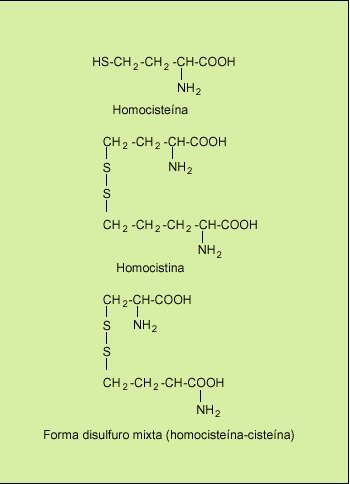
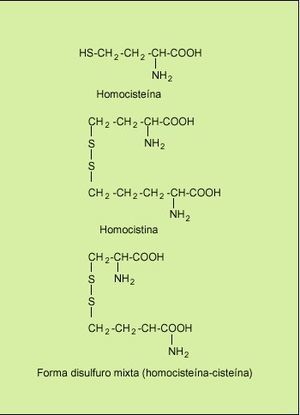
La concentración de la homocisteína plasmática total es la suma de las concentraciones de homocisteína unida a proteínas (el 80% del total) y la libre. La homocisteína libre se encuentra en forma oxidada, la cual se combina en sí misma para formar el dímero homocistina, y también se combina con cisteína para formar la forma disulfuro mixta cisteína-homocisteína (fig. 2). La forma reducida no unida a proteínas constituye sólo el 1% de la concentración plasmática total de homocisteína. En general cuando hablamos de la concentración plasmática de homocisteína nos referimos al conjunto de las moléculas que la contienen. A este conjunto de moléculas de homocisteína se le denomina homocist(e)ina, aunque en la práctica ambos términos se emplean como sinónimos.
Fig. 2. Moléculas que contienen homocisteína en el plasma.
Causas de hiperhomocisteinemia
En la tabla 1 se describen las principales causas de hiperhomocisteinemia. Un primer gran grupo de factores son los nutricionales. La causa más frecuente de exceso de homocisteína plasmática es el déficit de ácido fólico. La relación entre el ácido fólico y la homocisteína es hiperbólica, por lo que en los individuos con concentraciones altas de ácido fólico la hiperhomocisteinemia es rara.
Como se ha descrito en el apartado referente al metabolismo de la homocisteína, tanto el ácido fólico como la vitamina B6 y la B12 funcionan como cofactores y sustratos en el metabolismo de la metionina y de la homocisteína. Por tanto, el déficit de estas vitaminas provoca un aumento de la concentración plasmática de homocisteína. Por tanto, el déficit de estas vitaminas provoca un aumento de la concentración plasmática de homocisteína. En muchos países industrializados, sobre todo los situados fuera del área mediterránea, el consumo de ácido fólico es insuficiente. En Estados Unidos se añaden suplementos de esta vitamina a determinados alimentos, entre ellos las harinas de cereales y los cereales del desayuno.
Otro grupo de factores que causan hiperhomocisteinemia son las mutaciones en los genes de las enzimas que intervienen en el metabolismo de la homocisteína. Entre éstas, la más frecuente es la mutación C677T (Ala222Val) en el gen de la enzima MTHFR. Los individuos homocigotos para la mutación Ala222Val (Val/Val) tienen unas concentraciones de homocisteína significativamente más altas que aquellos con un genotipo Ala/Val o Ala/Ala. Existe una interacción entre la mutación C677T y el déficit de ácido fólico con las concentraciones plasmáticas de homocisteína. Los individuos Val/Val tienen unos mayores requerimientos de ácido fólico y en ellos el déficit de esta vitamina parece influir más intensamente sobre las concentraciones de homocisteína que en los individuos no homocigotos para la mutación. En las poblaciones mediterráneas se observa un mayor porcentaje de individuos Val/Val que en las poblaciones anglosajonas, y en ello puede haber influido el mayor contenido en ácido fólico de la dieta mediterránea. Esta hipótesis se basa en el hecho de que la hiperhomocisteinemia se asocia a trombosis placentarias y a muertes fetales y también a defectos del desarrollo del tubo neural. En las madres homocigotas para la mutación C677T(Val/Val), cuyas dietas son ricas en ácido fólico, la hiperhomocisteinemia no se manifestaría y no se producirían las muertes fetales por trombosis placentaria o por defectos del tubo neural, lo cual permitiría la transmisión de la mutación a sus descendientes. En cambio, en las madres Val/Val con un aporte insuficiente de ácido fólico en la dieta, el exceso de homocisteína se manifestaríay daría lugar a una mayor incidencia de muertes fetales y de defectos del tubo neural, lo cual disminuiría la transmisión de la mutación. Las frutas y verduras que abundan en la dieta mediterránea son el principal aporte de ácido fólico.
En una muestra de 72 pacientes de nuestro medio con enfermedad coronaria prematura observamos una prevalencia de la mutación C677T con carácter homocigoto en el 15% de los casos y en un 14% de los controles4. Esta prevalencia es superior a la de los países nórdicos y similar a la de otros países mediterráneos. También hemos hallado una clara agregación familiar de la hiperhomocisteinemia, de modo que los hijos de los pacientes con enfermedad coronaria muestran unas concentraciones de homocisteína significativamente más altas que los controles de la misma edad.
Se han identificado otras mutaciones menos frecuentes de la MTHFR, de la CBS y de la metionina sintasa, las cuales pueden asociarse a hiperhomocisteinemia5, 6.
Las restantes causas de hiperhomocisteinemia se describen en la tabla 1.
Posibles mecanismos que intervienen en el efecto aterogénico de la hiperhomocisteinemia
Tanto los estudios clínicos como experimentales sugieren que la homocisteína es la responsable de la predisposición a la arterioesclerosis y trombosis que se observa en los pacientes homocistinúricos e hiperhomocistinémicos, pero el mecanismo exacto no es conocido7.
La homocistinuria es una enfermedad autosómica recesiva que cursa con aumentos muy acusados de las concentraciones plasmáticas de homocisteína, los cuales pueden llegar a ser 20 veces superiores a los valores normales, y se produce eliminación de homocisteína por la orina. Entre las manifestaciones clínicas de la enfermedad se encuentran el retraso mental, la luxación del cristalino, alteraciones esqueléticas y una arterioesclerosis prematura8. Si la enfermedad no es detectada y tratada precozmente existe un riesgo de trombosis arteriales y venosas superior al 50% antes de los 30 años de edad. De hecho se han descrito estas complicaciones en los primeros años de la vida9. La arterioesclerosis afecta a las arterias pequeñas, medianas y grandes en cualquier territorio arterial. En el estudio patológico se observa un engrosamiento de la íntima, afectación de las células musculares lisas con aumento del colágeno intersticial, alteración de la lámina elástica interna y proliferación del tejido conectivo perivascular.
La homocisteína tiene un efecto citotóxico directo sobre las células endoteliales en cultivo. Se ha observado una alteración de la función endotelial valorada mediante eco-Doppler en los individuos con hiperhomocisteinemia moderada y una mejoría de ésta al disminuir la concentración de homocisteína mediante el tratamiento con ácido fólico10. La homocisteína puede promover la oxidación de las LDL mediante la producción de especies de oxígeno reactivas, como el peróxido de hidrógeno, y se ha descrito un efecto promotor de la multiplicación de las células musculares lisas y una disminución de la síntesis de ADN en las células endoteliales. La hiperhomocisteinemia se ha asociado a una disminución de la vida media y a un aumento de la adhesividad y agregabilidad de las plaquetas en algunos, pero no en todos los estudios. También se ha observado una alteración en la función de distintos factores que intervienen en la coagulación, entre ellas una disminución de la actividad antitrombina sérica y de los factores V y VII, disminución de la activación de la proteína Cy descenso de la unión del t-PA. Además, la homocisteína puede potenciar la activación del factor Xa, activar el factor V y provocar alteraciones de la unión de la antitrombina III y de la secreción del factor de von Willebrand11.
La homocisteína como factor de riesgo cardiovascular
Existe una clara asociación entre la concentración plasmática de homocisteína y la extensión anatómica de la arterioesclerosis, tanto del territorio coronario como carotídeo y de las extremidades inferiores12. Más de 80 estudios prospectivos y retrospectivos apoyan la hipótesis de que el exceso de homocisteína plasmática se asocia a un riesgo aumentado de enfermedad coronaria, vascular cerebral y periférica13-19. La relación entre la concentración de homocisteína y el riesgo cardiovascular es gradual, continua, y no existe un valor umbral a partir del cual se inicie o desaparezca el riesgo. Según los datos de un metaanálisis, por cada 4 µmol/l de aumento en la concentración de homocisteína se produce un aumento del riesgo relativo de enfermedad coronaria de un 32% (IC 95%: 1,05-2,65)16. En términos generales, las personas con hiperhomocisteinemia moderada tienen un riesgo relativo 1,3-5 veces superior de enfermedad coronaria, de 2,5-5 de enfermedad vascular cerebral y de 2,9-5 de arteriopatía de las extremidades inferiores que las personas con concentraciones normales. En un estudio realizado en nuestro medio observamos que la prevalencia de hiperhomocisteinemia, definida como la concentración de homocisteína > percentil 90 de la población sana, en los pacientes con enfermedad coronaria prematura era del 22%20.
La relación entre la hiperhomocisteinemia y el riesgo cardiovascular es independiente de otros factores de riesgo convencionales21; sin embargo, la homocisteína interactúa de forma muy acusada con otros factores aterogénicos como el tabaco, la hipertensión22 y la diabetes. En el estudio Hoorn se observó que la hiperhomocisteinemia (>14 µmol/l) se asociaba a una mayor mortalidad cardiovascular y por todas las causas en los diabéticos que en los no diabéticos23. En los diabéticos con hiperhomocisteinemia el riesgo relativo de mortalidad a los cinco años, ajustado para otros factores con respecto a la población no hiperhomocisteinémica, era de 2,5 (IC 95%: 1,07-5,91), mientras que en los no diabéticos este riesgo era de 1,34 (IC 95%: 0,87-2,06).
La hiperhomocisteinemia es también un factor de riesgo de trombosis venosa y de tromboembolismo pulmonar24 y, por tanto, debe tenerse en cuenta en los pacientes que padezcan estos trastornos, en particular cuando aparecen sin una causa aparente, son recurrentes o tienen una presentación familiar.
Detección de la hiperhomocisteinemia
Las concentraciones de homocisteína determinadas en distintos laboratorios con distintos métodos han tenido unos resultados similares25. Sin embargo, hay que tener en cuenta que las muestras requieren ser procesadas de forma metódica para evitar errores de medición. Es importante separar rápidamente el plasma o el suero de las células mediante centrifugación y conservar las muestras en frío y protegidas de la luz hasta la determinación de la concentración de homocisteína.
El coste de la determinación de homocisteína y la falta de evidencias concluyentes sobre el beneficio de tratar el exceso de este aminoácido hacen que no sea recomendable hacer cribados de población general. Teniendo en cuenta que la hiperhomocisteinemia es un trastorno que tiene una clara agregación familiar26, la homocisteína debería determinarse en los familiares de primer grado de los pacientes afectos de este trastorno. También en los pacientes con enfermedad isquémica prematura y en aquellos sin otros factores de riesgo aparentes o con alguna de las causas de hiperhomocisteinemia que constan en la tabla 1, como, por ejemplo, el tratamiento con antiepilépticos. En un estudio de familias con enfermedad coronaria prematura observamos que el 36% de los hijos presentaban una hiperhomocisteinemia, definida como una concentración superior al percentil 90 de la población sana de su grupo de edad y sexo20.
Aunque para el estudio de la homocisteína no es necesario el ayuno, en la práctica habitual se determina después de una noche de ayuno (homocisteína basal). El estudio después de una sobrecarga de metionina puede detectar un porcentaje adicional y variable de casos de hiperhomocisteinemia no detectados con la determinación de la homocisteína basal, sobre todo los debidos a trastornos de la vía de la transulfuración27, 28. Sin embargo, la utilidad real de la sobrecarga de metionina no ha sido bien definida, ya que existen datos controvertidos en la literatura, por ello hoy se puede considerar como una prueba reservada a la investigación.
Junto con la determinación de la homocisteína hay que medir la concentración de ácido fólico, de cobalaminas y si es posible de vitamina B6. El ácido fólico es la vitamina que más fuertemente se correlaciona con las concentraciones de homocisteína en plasma y su relación con el riesgo cardiovascular parece deberse a este hecho. La vitamina B6 tiene una relación más débil con la concentración de homocisteína, pero más clara e independiente con el riesgo cardiovascular, lo cual sugiere que influye a través de otros mecanismos sobre la arterioesclerosis. La necesidad de determinar la vitamina B12 se basa en que su déficit es relativamente frecuente, sobre todo en la tercera edad, y si éste no se corrige es difícil normalizar la homocisteína. Por otra parte, la administración de suplementos de ácido fólico a pacientes con déficit de vitamina B12 podría enmascarar las manifestaciones hematológicas de este último y dar lugar a la aparición de las complicaciones neurológicas del déficit de cobalaminas.
Tratamiento del exceso de homocisteína plasmática
Existen datos que sugieren que el tratamiento de la hiperhomocisteinemia afecta de forma favorable a la evolución de la arterioesclerosis. En un estudio con un pequeño tamaño muestral el tratamiento con ácido fólico, vitaminas B6 y B12 se asoció a una disminución de la progresión de las placas de ateroma carotídeas después de un tiempo medio de seguimiento de 4,4 ± 1,5 años29. Recientemente se ha observado el efecto beneficioso del tratamiento de la hiperhomocisteinemia en la prevención de la aterosclerosis subclínica, valorada mediante prueba de esfuerzo. Entre 158 hermanos sanos de 167 pacientes con enfermedad aterotrombótica precoz, 78 fueron randomizados a ser tratados con 5 mg de ácido fólico + 250 mg de vitamina B6 al día y 80 con placebo durante dos años. La homocisteína disminuyó en el grupo de tratamiento con vitaminas desde 14,7 a 7,4 µmol/l y en el grupo placebo de 14,7 a 12,0 µmol/l. La concentración de homocisteína postsobrecarga con metionina también fue significativamente inferior en el grupo tratado con ácido fólico y vitamina B6. Se observó una menor incidencia de positividad en la prueba de esfuerzo a los dos años de seguimiento en el grupo tratado con vitaminas (7/68) que en el grupo placebo (11/66). El tratamiento con vitaminas se asoció a un riesgo de presentar una prueba de esfuerzo positiva de 0,40 (95% IC: 0,17-0,93; p = 0,035)30. Este estudio, aunque adolece de problemas metodológicos y, por tanto, la interpretación de sus resultados debe realizarse con cautela, sugiere que el tratamiento de la hiperhomocisteinemia disminuye el riesgo de enfermedad coronaria.
Criterios terapéuticos
En distintos estudios se ha observado que la concentración de homocisteína a partir de la cual el riesgo cardiovascular aumentaría de forma significativa oscila entre 9 y 10,3 µmol/l31, 32. Por tanto, un objetivo razonable es lograr una concentración de homocisteína basal inferior a 10 µmol/l en aquellos individuos en situación de riesgo. Este objetivo, al igual que ocurre en el caso del colesterol, es más coherente que el basado en la media ± 2 DE de la población general.
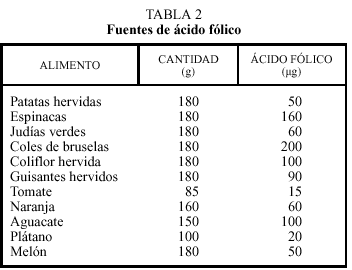
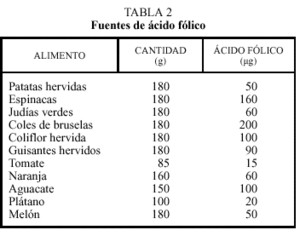
En las personas con una concentración de homocisteína elevada la primera medida terapéutica es una alimentación rica en ácido fólico, vitaminas B12 y B6 que incluya 400 µg, 2,4 µg y 1,7 mg diarios de estas vitaminas, respectivamente. En las mujeres embarazadas o en período de lactancia estas necesidades aumentan33 y también en determinadas patologías, como la insuficiencia renal. Un aporte de ácido fólico de 300 a 450 µg/día asegura una concentración de homocisteína normal/baja en la mayoría de la población. En la población europea el consumo medio diario de folatos en hombres y mujeres es de 291 (197-326) y 247 µg/día (168-320), respectivamente. Ya que un porcentaje significativo de la población no cubre los requerimientos diarios de ácido fólico, una estrategia poblacional razonable es recomendar un aumento en el consumo de alimentos ricos en esta vitamina. Entre ellos se encuentran los que se muestran en la tabla 234, 35. Entre estos alimentos hay que destacar los cereales enriquecidos, los vegetales de hoja verde, las frutas y las legumbres. Como fuentes de vitamina B6 se encuentran las frutas no cítricas, el pollo, la ternera y algunos vegetales como los espárragos, alcachofas, judías, la col y también los cereales enriquecidos en esta vitamina. Las principales fuentes alimentarias de vitamina B12 son la ternera, el pollo, el pescado y también los cereales enriquecidos. Los vegetarianos estrictos suelen tener unas concentraciones de vitamina B12 disminuidas y la concentración de homocisteína suele ser superior a la de la población general. Ya que entre un 10%-30% de los ancianos tienen una malabsorción para la vitamina B12, se recomienda que ya a partir de los 50 años de edad se consuman alimentos enriquecidos en esta vitamina o se administren suplementos.
El ácido fólico se destruye fácilmente mediante el calentamiento excesivo y prolongado, la cocción en hornos de microondas y mediante la ebullición prolongada o con cantidades excesivas de agua, desechando el agua de la cocción.
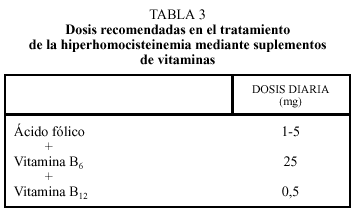
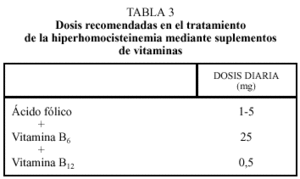
Si la dieta no es suficiente se aconseja administrar suplementos de vitaminas. En el tratamiento de la hiperhomocisteinemia moderada se administran dosis de 1-5 mg/día, las cuales son efectivas en la gran mayoría de los casos, y disminuyen un 25%-50% la concentración de homocisteína. El ácido fólico es un tratamiento inocuo y de bajo coste, cuyo único riesgo potencial es el de enmascarar un posible déficit de vitamina B12, aunque esto es raro con dosis de ácido fólico inferiores a 10 mg al día. La adición de vitamina B6 no tiene efecto sobre la concentración basal de homocisteína, pero sí tras una sobrecarga de metionina. La vitamina B6 es también un tratamiento inocuo cuando se da a dosis bajas (< 100 mg/día), pero a dosis altas puede precipitar una neuropatía periférica cuando se dan a largo plazo36-40. La dosis diarias de vitamina B6 y de vitamina B12 son de 25 mg y 0,5 mg, respectivamente (tabla 3).
Actualmente están en curso diversos ensayos clínicos controlados sobre el efecto de la administración de ácido fólico solo o asociado a otras vitaminas del grupo B o a otras medidas preventivas en la incidencia de mortalidad y morbilidad cardiovascular en los que se han incluido más de 50.000 personas. En los próximos años los resultados de estos estudios nos permitirán conocer la magnitud del efecto preventivo del tratamiento de la hiperhomocisteinemia moderada frente a la enfermedad cardiovascular41.