La indicación general será la presencia de insuficiencia respiratoria crónica con hipoventilación alveolar, situación clínica estable sin respuesta suficiente al tratamiento convencional, con los objetivos de mejorar la calidad de vida y la supervivencia.
La insuficiencia respiratoria se produce cuando el sistema respiratorio no soluciona las demandas metabólicas del organismo, no siendo posible mantener una captación suficiente de oxígeno (O2) por los tejidos o una eliminación del anhídrido carbónico (CO2) por los mismos.
Se considera la presencia de insuficiencia respiratoria cuando la PaO2 es inferior a 60 mmHg o la PaCO2 es superior a 50 mmHg, con el paciente en reposo y a nivel del mar. Si sólo se objetiva un descenso de la PaO2, con PaCO2 en límites normales, estaremos ante una insuficiencia respiratoria hipoxémica, y si a la PaO2 alterada se le añade un incremento de la PaCO2 ante una insuficiencia respiratoria hipoxémica hipercápnica. Por tanto, la gasometría arterial es imprescindible para confirmar el diagnóstico de insuficiencia respiratoria y valorar la gravedad.
Según su instauración, la insuficiencia respiratoria podrá ser aguda o crónica, y encontrarse compensada o no. En la insuficiencia respiratoria aguda hipoxémica, tendremos hipoxemia con PaCO2 normal o disminuida secundaria a la hiperventilación. Podrá existir alcalosis con cifras de ion bicarbonato (HCO3) normales. En la insuficiencia respiratoria aguda global, habrá hipoxemia e hipercapnia, el pH estará descendido (acidosis), y las cifras de HCO3 normales o ligeramente aumentadas.
Cuando la insuficiencia respiratoria se mantiene en el tiempo de forma estable e irreversible se desemboca en la insuficiencia respiratoria crónica. A esta situación se llega por una enfermedad crónica en sí misma, como la obstrucción crónica del flujo aéreo, o por un proceso agudo que deja secuelas definitivas. Sus causas son muy amplias (tabla 1). En fase estable, algunos de estos pacientes pueden beneficiarse del soporte ventilatorio externo, además del tratamiento médico habitual y de la oxigenoterapia domiciliaria.
Soporte ventilatorio domiciliario
Generalidades
Ventilación mecánica es todo aquel procedimiento que utiliza un aparato mecánico para ayudar o suplir la función ventilatoria del paciente. La ventilación mecánica domiciliaria es una modalidad de tratamiento de la insuficiencia respiratoria crónica que, como su nombre indica, se realizará en el domicilio del propio paciente, para aquellos casos que en situación clínica estable precisan soporte ventilatorio a largo plazo total o parcial. Además, dentro de esta asistencia respiratoria, se incluye un conjunto de técnicas y atenciones dirigidas a proporcionar al enfermo respiratorio crónico el mayor bienestar posible desde el punto de vista personal, familiar, social y laboral, así como para optimizar el consumo de recursos sanitarios, habitualmente elevado, en estas enfermedades.
No se trata de un tratamiento nuevo. Podemos considerar su inicio en los años cincuenta, durante la epidemia de polio, donde se comprobó que algunos pacientes que habían precisado soporte ventilatorio durante la fase aguda de la enfermedad no podían prescindir posteriormente del mismo. De aquí surge la idea de organizar el tratamiento en el domicilio del paciente, lo que suponía disponer de aparatos en el domicilio, garantizar su mantenimiento y crear una infraestructura sanitaria capaz de asumirlo.
El posterior desarrollo de los respiradores, la aparición de nuevas indicaciones y técnicas de ventilación y la progresiva mejoría de las modalidades de acceso a la vía aérea, tanto invasiva como no invasiva, con diversos tipos de dispositivos, han facilitado la generalización de este tratamiento en el momento actual, aunque no de forma homogénea. De hecho, el número de pacientes sometidos a este tratamiento varía de unos países a otros, dependiendo del grado de desarrollo de los mismos y también de los diferentes sistemas de salud. La asociación francesa para la asistencia de la insuficiencia respiratoria (ANTADIR) asumía, en enero de 1998, 8.500 pacientes en ventilación mecánica domiciliaria. En España esta forma de tratamiento dio los primeros pasos en los años ochenta, con un total de 1.821 pacientes en ventilación mecánica domiciliaria en enero de 1999, lo que supone una prevalencia de 4,59/100.000.
Método de elección del acceso a la vía aérea
Actualmente, existen dos aproximaciones a este tema: por un lado, el acceso invasivo mediante traqueostomía y, por otro, el uso de distintas mascarillas, o no invasivo. La traqueostomía e implantación de una cánula se realiza esencialmente en pacientes con importante dependencia del ventilador (mayor de 18 h al día), trastornos de la deglución o enfermedad asociada, fundamentalmente de tipo neurológico, que les impida la recolocación de la mascarilla cuando ésta se desplaza, e intolerancia a otro tipo de acceso. Las cánulas traqueales pueden ser de plata o de silicona. Las de plata son de larga duración y fácil mantenimiento. Cuando son fenestradas permiten la fonación siendo mejor toleradas por los pacientes. Las cánulas de silicona son más fáciles de sustituir por el paciente o sus cuidadores, se ajustan más fácilmente al respirador y tienen menos fugas. Se distinguen dos tipos: las que llevan balón y sin balón. Como ocurría con las fenestradas, en algunos enfermos portadores de cánulas de silicona puede deshincharse el balón o utilizarse sin balón para facilitar la deglución y fonación, aunque sea necesario aumentar el volumen por minuto para compensar las fugas alrededor de la cánula. Por otra parte, se debe tener en cuenta que los pacientes ventilados a través de traqueostomía pueden precisar la incorporación de algún dispositivo de humidificación para evitar la sequedad mucosa.
La ventilación mediante traqueostomía goza de algunas ventajas, como la posibilidad de aspiración de secreciones bronquiales y una disminución del espacio muerto. Sus complicaciones se relacionan con el acto quirúrgico de implantación de la traqueostomía o con la evolución posterior. Pueden aparecer hemorragias, fístula traqueoesofágica, enfisema subcutáneo e infección de la herida asociadas con la cirugía de implantación de la cánula. Además, durante la ventilación mecánica domiciliaria pueden aparecer otras complicaciones, como la alteración del aclaramiento mucociliar, que dificulta la eliminación de secreciones y facilita la formación de tapones mucosos, el incremento de las sobreinfecciones respiratorias, y el desarrollo de granulomas y estenosis traqueales (tabla 2). Debido a ello, a comienzo de los ochenta empezó a desarrollarse la ventilación mecánica mediante métodos menos invasivos, utilizando presión positiva intermitente liberada a través de mascarillas, usadas en el tratamiento del síndrome de apnea del sueño. El auge de estos sistemas, portátiles, fáciles de manejar, cómodos, seguros y que permiten la ventilación por vía nasal u oronasal sin necesidad de practicar traqueostomía, ha supuesto un enorme avance en el tratamiento de los pacientes con insuficiencia ventilatoria crónica. Con este abordaje se obtienen resultados similares con un menor número de complicaciones y, habitualmente, con un mayor grado de comodidad y aceptación por parte del paciente (tablas 3 y 4).
Existen dos clases principales de mascarillas, las nasales y las faciales. La máscara nasal suele ser mejor tolerada, de aplicación más fácil y permite al enfermo una mejor relación con el entorno. La máscara facial (nasobucal) es un sistema peor tolerado y suele utilizarse en las situaciones de insuficiencia respiratoria aguda ya que se fija mejor (fig. 1). Normalmente, se utilizan mascarillas estándares que se sujetan a la cabeza mediante un arnés. Se comercializan de distintos tamaños y tipos; en cada paciente se usa la que mejor se adapta a sus necesidades aunque también pueden moldearse a medida.
Fig. 1. Paciente en tratamiento con ventilación mecánica no invasiva utilizando mascarilla oronasal.
Tipos de ventilación mecánica domiciliaria
Ventilación a presión negativa
Estos respiradores usan presión extratorácica negativa como método ventilatorio La primera aproximación a este tratamiento se sitúa en 1832, cuando un médico escocés, John Dalziel, diseñó un cilindro hermético en el que se introducía al paciente, exceptuando la cabeza, y de una forma mecánica se producía una presión negativa intermitente en el interior de este cilindro, que proporcionaba un soporte ventilatorio. Esta presión produce la expansión del tórax, generando presión negativa en el alvéolo y, por tanto, flujo aéreo. Durante la espiración cesa la presión subatmosférica, produciéndose la salida del aire desde los alvéolos, de modo pasivo.
Actualmente, estos equipos tienen una utilización muy limitada. La explicación debe buscarse en los problemas relacionados con el tamaño y su propensión, al generar la presión negativa, a provocar obstrucción de la vía aérea superior. Existen distintos tipos de dispositivos para aplicar esa presión sobre el sistema ventilatorio. Los equipos de coraza sólo incluyen la cara anterior del tórax mediante una cubierta que se ajusta herméticamente. Del mismo modo, se han desarrollado trajes que, ajustados al cuerpo y conectados a una bomba de vacío externa, consiguen el efecto deseado.
Ventilación a presión positiva
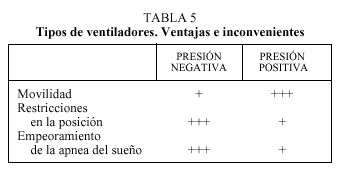
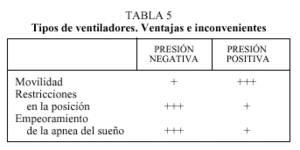
Las complicaciones y los inconvenientes asociados a la ventilación a presión negativa han hecho que durante los últimos años se utilicen prioritariamente los de presión positiva, tanto volumétricos como los de soporte de presión (presión positiva binivel- BIPAP®) (tabla 5). Estos respiradores crean un gradiente de presión transtorácico intermitente que intenta reproducir el ciclo respiratorio, inspiración-espiración, alterando el normal funcionamiento de la cavidad pleural y del diafragma.
Los respiradores volumétricos son aquellos capaces de suministrar un volumen corriente prefijado de aire y ciclan por volumen. Están dotados de alarmas de alta y baja presión, una batería interna y la posibilidad de conexión a batería externa, que los hacen apropiados para la ventilación en pacientes en los que este tratamiento supone un sistema de apoyo vital. Se deben regular los siguientes parámetros:
Volumen corriente. Si la ventilación se aplica a través de una máscara nasal, el volumen corriente que se debe aplicar puede ser muy variable, en función de la tolerancia del paciente y de las fugas que se puedan producir por la boca durante la noche. Si la ventilación se
realiza a través de traqueostomía y cánula con balón inflado, el volumen se ajustará a unos 10-12 ml/kg.
Frecuencia respiratoria. Se dispone de diferentes opciones: a) programar una frecuencia respiratoria fija (modo controlado), donde la misma es gobernada por el respirador (normalmente no se utiliza, ya que puede ser mal tolerada, produciéndose desacoples del paciente con el respirador); b) modo asistido en donde el paciente inicia la ventilación dominando de esta forma la frecuencia respiratoria, y c) en modo asistido/controlado en el que el paciente puede fijar la frecuencia respiratoria pero se asegura un mínimo preestablecido, si la frecuencia determinada por el paciente fuera menor de la prefijada por el médico. Cuando ventilamos a un paciente a través de una traqueostomía, la frecuencia respiratoria suele oscilar entre 12 y 15 ciclos/min.
Relación inspiración/espiración. Es la relación de tiempo que se dedica a cada una de las fases que constituyen cada ciclo respiratorio. El valor empleado habitualmente es entre l:l y 1:2, tanto si se realiza ventilación no invasiva como si ésta se hace a través de traqueostomía.
Sensibilidad o trigger. Regula el esfuerzo inspiratorio que debe realizar el paciente para que el ventilador cicle.
Alarmas:
1. Límite de presión máxima (alta presión): como norma general en adultos un valor de 40-50 cm H2O suele ser adecuado, o en todo caso 15 cm H2O por encima del pico de presión que se observa durante la ventilación normal estable.
2. Límite de presión mínima (baja presión): debe ajustarse entre 5 y 10 cm H2O. Esta alarma es la que avisa en caso de desconexión o fuga en el circuito.
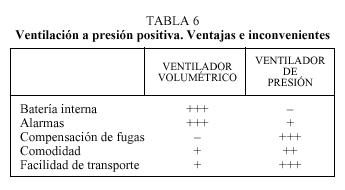
Los ventiladores de presión son más ligeros que los volumétricos (fig. 2). Éstos están limitados por presión y ciclan por flujo o por tiempo, en función de la modalidad ventilatoria utilizada. Los parámetros que hay que programar en estos aparatos, por tanto, son la presión y el modo ventilatorio que modificará el ciclado. Se programarán dos niveles de presión, una inspiratoria, o IPAP (suele utilizarse entre 10 y 20 cm H2O), y otra espiratoria, o EPAP, (entre 0 y 4 cm H2O).
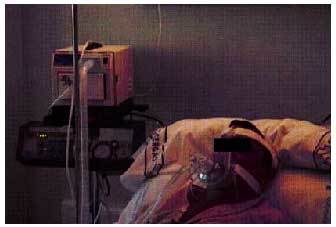
Fig. 2. Paciente en tratamiento con ventilación mecánica no invasiva utilizando un ventilador de presión.
Frecuencia respiratoria. La frecuencia respiratoria puede establecerla el propio paciente (modo espontáneo) o el respirador (modo tiempo), o mediante un sistema mixto (modo espontáneo/tiempo), similar al modo asistido/controlado referido para los volumétricos.
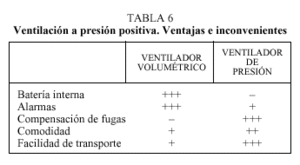
Alarmas. Disponibles en algunos equipos. La falta de alarmas no aconseja su uso en pacientes críticos (tabla 6).
Indicaciones de la ventilación mecánica domiciliaria
Las alteraciones de la bomba ventilatoria, independientemente de su causa, son la principal indicación de la ventilación mecánica domiciliaria, y no está aún tan asentada su indicación en los procesos parenquimatosos pulmonares.
La indicación general es la presencia de insuficiencia respiratoria crónica con hipoventilación alveolar en pacientes con una situación clínica estable y que no responden al tratamiento convencional. Sin embargo, no todas las enfermedades que cursan con hipercapnia pueden ser subsidiarias de ventilación mecánica domiciliaria, por lo que es necesario establecer otros criterios más específicos:
1. Pacientes en los que en fase estable se confirma en la gasometría arterial basal una hipercapnia: PaCO2 > 45 mmHg.
2. Pacientes ingresados por un episodio de insuficiencia respiratoria aguda hipercápnica y en cuyos antecedentes se encuentran datos de que se trata de una afección de larga duración (tabla 1).
3. Pacientes ingresados por un episodio de insuficiencia respiratoria aguda en la UCI y que no pueden dejar de recibir ventilación mecánica, siendo ésta la única razón de su permanencia en la UCI.
Se han propuesto distintas hipótesis para explicar el mecanismo por el que la aplicación de soporte ventilatorio nocturno consigue mejorar los gases sanguíneos y la disnea en pacientes con fallo respiratorio crónico. En primer lugar, la ventilación mecánica se acompaña de un incremento del volumen corriente mientras el paciente se encuentra con asistencia ventilatoria, lo cual evita la presencia de microatelectasias y mejora la distensibilidad pulmonar. Como consecuencia de ello, se optimiza la relación entre ventilación y perfusión pulmonares y mejora el intercambio gaseoso. Otros posibles mecanismos son la descarga de la fatiga muscular crónica o la reversión de la insensibilidad de los quimiorreceptores al CO2, reduciendo la retención diurna de CO2.
Los objetivos fundamentales del soporte ventilatorio domiciliario en pacientes con insuficiencia respiratoria crónica son la mejoría de la calidad de vida, así como de la supervivencia. Hay que tener en cuenta dos situaciones fundamentales: la del paciente que presenta una insuficiencia respiratoria hipercápnica crónica, pero que es capaz de mantener un nivel de ventilación mínimo suficiente la mayor parte del día, y la del paciente dependiente por completo del soporte ventilatorio externo. En este último caso la ventilación mecánica domiciliaria tiene un objetivo fundamental de soporte vital, en cuanto que es esencial para mantener al paciente con vida fuera del hospital.
Hipoventilación alveolar central
En este caso la hipoventilación se desarrolla en ausencia de enfermedad pulmonar, deformidad torácica o neuromuscular subyacente. Se produce en niños o adultos jóvenes y sus síntomas fundamentales son la somnolencia diurna y la cefalea matutina, aunque el problema puede descubrirse accidentalmente cuando se produce un fallo respiratorio agudo.
El diagnóstico de hipoventilación alveolar central se hace cuando las pruebas de función pulmonar no demuestran alteraciones que justifiquen la hipoventilación, las hormonas tiroideas son normales y no hay evidencia de proceso neuromuscular. La gasometría arterial suele demostrar una retención de CO2 que se agrava con el sueño. En esta enfermedad existe un trastorno de la respuesta ventilatoria por alteración de la respuesta o recepción de la información aportada por los quimiorreceptores o por un defecto inherente del centro respiratorio. Puede ser congénita o adquirida en relación con otros problemas neurológicos. Estos enfermos pueden ser tratados mediante ventilación no invasiva o invasiva y/o marcapasos diafragmático.
Enfermedades estructurales de la caja torácica
La ventilación mecánica domiciliaria constituye una forma habitual de tratamiento de los enfermos con insuficiencia respiratoria crónica secundaria a una restricción ventilatoria por enfermedades de la caja torácica, como cifoscoliosis, fibrotórax o toracoplastia. En estos pacientes, cuando se desarrolla la insuficiencia respiratoria, la utilización de esta modalidad de tratamiento permite incrementar las cifras de supervivencia a los 5 años del 32 al 75-90%.
Las enfermedades estructurales de la caja torácica condicionan una reducción de los volúmenes pulmonares junto a una disminución de la distensibilidad del sistema respiratorio. También se observa una reducción de las presiones musculares máximas inspiratoria y espiratoria asociadas a debilidad muscular intrínseca o a la alteración mecánica secundaria a la distorsión estructural.
Durante el sueño, los pacientes pueden presentar alteraciones del intercambio gaseoso, debido a la hipotonía de los músculos accesorios de la ventilación durante la fase REM o asociados a la presencia de obstrucción de vía aérea superior. Todo ello puede complicarse con atelectasia pulmonar, retención de secreciones e infecciones respiratorias con brotes de insuficiencia respiratoria aguda que se superponen a la situación estabilizada de insuficiencia respiratoria crónica, empeorando progresivamente la situación, que precisará un soporte ventilatorio (tabla 7).
Cuando la hipoxemia es persistente y mantenida puede desarrollarse, además, hipertensión pulmonar y cor pulmonale. La utilización de la ventilación nocturna en esta enfermedad reduce el trabajo respiratorio, facilitando el reposo en los músculos respiratorios y mejorando las alteraciones del intercambio de gases durante el día con un aumento de la PaO2 y una disminución de la PCO2. Hemodinámicamente, ello condiciona una reducción de la hipertensión pulmonar y una mejoría de la función ventricular derecha. Además, se normaliza el patrón de sueño, aliviándose la cefalea matutina y la hipersomnia diurna.
La ventilación mecánica domiciliaria mejora el pronóstico de estas enfermedades, prolongando la supervivencia y mejorando la calidad de vida de los pacientes. Además, reduce los ingresos y las estancias hospitalarias.
Enfermedades neuromusculares
En estos pacientes existe debilidad de los músculos inspiratorios que origina hipoventilación alveolar. La afección de los músculos espiratorios origina una debilidad del reflejo de la tos y la retención de secreciones, que puede conducir a la formación de atelectasias e infecciones respiratorias con repercusión sobre el intercambio gaseoso.
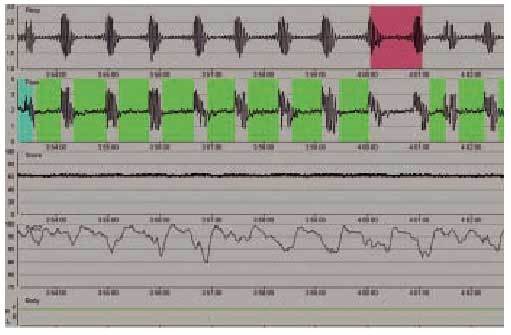
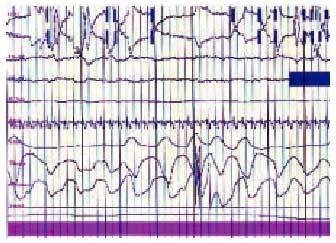
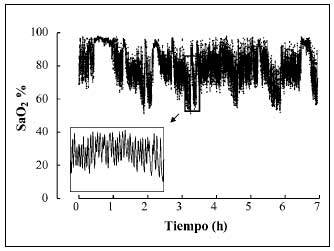
Los enfermos con una afección neuromuscular presentan trastornos del intercambio gaseoso durante el sueño asociados a la reducción de la capacidad vital, sobre todo al adoptar la posición de decúbito, y a la presencia de apneas obstructivas (fig. 3), debidas a la debilidad de los músculos de la vía aérea superior durante la fase REM (figs. 4 y 5). Todo ello se acompaña de desorganización del sueño, con desestructuración y fragmentación del mismo, y otra sintomatología relacionada, como cefalea matutina y somnolencia diurna.
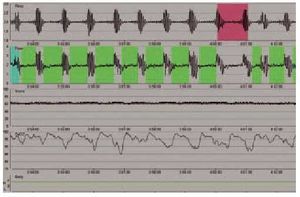
Fig. 3. Registro de poligrafía respiratoria de un paciente con síndrome de apnea del sueño. Se observan, de arriba a bajo, movimientos toracoabdominales, flujo oronasal, saturación de oxígeno, ronquido y posición. Obsérvese la presencia de ciclos de apnea-desaturación característicos del síndrome de apnea del sueño.
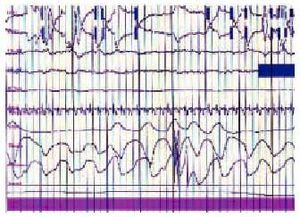
Fig. 4. Registro polisomnográfico de un paciente con alteraciones respiratorias durante la fase REM del sueño. En la parte superior se sitúan el EOG, el EEG y el EMG, seguido de la oximetría y el flujo oronasal. Se detecta la presencia de dos episodios de apnea, seguidos de desaturación.
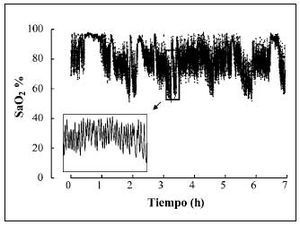
Fig. 5. Oximetría nocturna de un paciente con enfermedad neuromuscular y alteraciones respiratorias durante el sueño. Obsérvese la presencia de desaturaciones de carácter cíclico.
En cada paciente la implicación de cada uno de estos factores varía en intensidad, siendo el resultado final la insuficiencia respiratoria, de origen multifactorial.
Las enfermedades neuromusculares cursan con un patrón funcional caracterizado por una respiración rápida y superficial, con reducción de los parámetros que valoran de forma directa la fuerza muscular (presiones máximas en la boca, presión trasdiafragmática, etc.) y un descenso de la capacidad vital. El resultado es la aparición de una alteración gasométrica, que inicialmente puede ser una hipoxemia sin elevación de la PaCO2 y que, a medida que avanza el proceso, se va observando una reducción del volumen corriente con el consiguiente descenso de la ventilación alveolar y la aparición de fallo ventilatorio, que habitualmente es más precoz y acusado durante el período nocturno (tabla 8).
Muchos de los mecanismos implicados en la aparición y el desarrollo de la insuficiencia respiratoria en los pacientes con enfermedades neuromusculares, tal como hemos comentado anteriormente, pueden mejorar tras la instauración del soporte ventilatorio. El intercambio gaseoso mejora al insuflar los pulmones con volúmenes mayores de los que el paciente utiliza espontáneamente; además, aumenta la distensibilidad pulmonar y torácica, reduciendo así el trabajo respiratorio. Igualmente, mejora la eficiencia de los músculos respiratorios al permitir el reposo de éstos durante la noche y disminuir la fatiga que pudieran presentar. Por último, la corrección de los episodios nocturnos de hipoxemia e hipercapnia facilita la restauración de la sensibilidad de los quimiorreceptores centrales y periféricos, y con ello, se normaliza el control ventilatorio.
Sea cual sea la modalidad ventilatoria elegida, todos los pacientes describen una mejoría importante de su estado clínico en las semanas que siguen a la instauración del soporte ventilatorio. Esta mejoría clínica se mantiene a lo largo del tiempo y se acompaña de la corrección de los valores gasométricos durante el día.
Los resultados de este tratamiento dependen, entre otros muchos factores, de la velocidad de progresión de la enfermedad. Podemos hablar de enfermedades estáticas o muy lentamente progresivas donde la ventilación mecánica domiciliaria consigue excelentes resultados a largo plazo y de enfermedades rápidamente progresivas como es el caso de las enfermedades de motoneurona, donde los resultados sobre la supervivencia en pacientes no seleccionados son más limitados. Entre estos dos polos se sitúan las enfermedades con moderada velocidad de progresión, entre las que destaca la enfermedad de Duchenne, y en la que se obtienen resultados intermedios.
La indicación de ventilación mecánica domiciliaria en la esclerosis lateral amiotrófica es un tema muy debatido, debido a la rápida progresión de la enfermedad, al riesgo de muerte súbita antes de que se inicie el soporte ventilatorio y a que no modifica el curso de la enfermedad. La presentación con fallo respiratorio es infrecuente. En la mayoría de los casos, el deterioro neurológico va progresando con mayor o menor velocidad, hasta que meses o años después comienzan a aparecer complicaciones respiratorias. El fallo respiratorio aparece generalmente después de que el paciente presenta afección neurológica grave, disartria y problemas de deglución. No es excepcional que la primera manifestación de la enfermedad sea un fallo respiratorio agudo como consecuencia de un episodio de aspiración o una infección respiratoria intercurrente.
Pacientes con necesidad de ventilación tras un fallo respiratorio agudo
Numerosos pacientes que sobreviven al episodio de insuficiencia respiratoria aguda, ingresados en unidades de cuidados intensivos, no se recuperan lo suficiente para vivir sin ventilador mecánico y precisan continuar con este soporte en el domicilio.
Otras indicaciones
Aunque durante muchos años las únicas entidades consideradas tributarias de ventilación mecánica domiciliaria han sido las enfermedades neuromusculares y las enfermedades restrictivas de la caja torácica, los buenos resultados obtenidos hacen que las últimas recomendaciones publicadas acepten la hipoventilación alveolar secundaria a obesidad como subsidiaria de ventilación mecánica domiciliaria. En cuanto a su utilización en la EPOC, ésta continúa siendo motivo de controversia, pero existen datos que permiten valorar su indicación en casos concretos. Los resultados obtenidos no son equiparables a los referidos en pacientes restrictivos y no existe un consenso sobre los criterios de indicación, el tipo de ventilador o para establecer cuál es el mejor momento en la evolución de la enfermedad para iniciar la ventilación mecánica domiciliaria en la EPOC. Sin embargo, con la incorporación de las técnicas de ventilación no invasivas, se ha observado un cambio reciente respecto al apoyo ventilatorio domiciliario en la EPOC, siendo razonable pensar que existe un subgrupo de pacientes que se podría beneficiar de este tratamiento. En todo caso, lo que parece más probable es que la ventilación mecánica domiciliaria no sustituye a la oxigenoterapia domiciliaria en el tratamiento de la insuficiencia respiratoria crónica de la EPOC sino que la complementa.
Protocolo de actuación
A1 plantearse la indicación de la ventilación mecánica domiciliaria, es conveniente disponer de los resultados de la historia clínica (tabla 9) junto a otras exploraciones complementarias, como el hemograma, el ECG, la radiografía de tórax, la gasometría arterial basal, la espirometría, la exploración funcional completa, las presiones inspiratoria y espiratoria máximas y el estudio del intercambio gaseoso durante el sueño. Cada caso debe estudiarse de forma individualizada, teniendo en cuenta el pronóstico vital y las características sociofamiliares, ya que el apoyo familiar tiene en estos pacientes un papel muy importante.
El sostén ventilatorio domiciliario puede adoptar dos formas: continuo o sólo nocturno. En el primer grupo se incluyen pacientes con dependencia completa de la ventilación mecánica, como es el caso de una lesión medular alta, los enfermos con enfermedades neuromusculares en situación de insuficiencia respiratoria muy evolucionada avanzada o los sujetos con ventilación mecánica domiciliaria como continuación del tratamiento en una unidad de vigilancia intensiva. Gran parte de estos pacientes van a recibir ventilación a través de una traqueostomía con un ventilador volumétrico dotado de alarmas de alta y baja presión (o de volumen por minuto) y con conexión a una batería externa, por lo que el propio ventilador debe disponer de una batería interna.
Otro grupo de pacientes necesita la ventilación mecánica parcialmente, sobre todo durante la noche. En la mayoría de los casos se realiza conectando el ventilador al paciente a través de una mascarilla nasal. El uso nocturno puede proporcionar una mejoría subjetiva y objetiva durante las horas de vigilia. Ciertos subgrupos de pacientes requieren soporte ventilatorio sólo durante una parte del día.
Cuando se decide aplicar a un paciente ventilación mecánica domiciliaria hay que tener en cuenta que va a representar un gran cambio en su estilo de vida y de sus familiares. Por otra parte, hay que conocer los parámetros ventilatorios más adecuados para cada paciente, que reviertan la sintomatología y las alteraciones gasométricas asociadas a la enfermedad. En la mayoría de los casos se procede al ingreso hospitalario para monitorizar y controlar la respuesta, o para conseguir la adaptación al soporte ventilatorio.
Respuesta clínica. Uno de los objetivos de la ventilación mecánica es aliviar la disnea, la hipersomnolencia diurna y las alteraciones del sueño. Todos estos datos clínicos pueden ser fácilmente controlados durante el ingreso.
Respuesta fisiológica e intercambio de gases. La valoración de la eficacia de la ventilación mecánica se hará en dos situaciones: cuando el paciente está despierto y durante el sueño.
Uno de los datos clínicos más consistentes de respuesta favorable es el descenso de la frecuencia respiratoria dentro de las primeras horas del inicio del soporte ventilatorio. Suele desaparecer el movimiento paradójico toracoabdominal, si existía, además de disminuir la frecuencia cardíaca.
La utilidad de la monitorización del sueño en la evaluación y el seguimiento de los pacientes sometidos a ventilación mecánica no ha sido bien establecida. Durante el curso de la ventilación se le puede realizar una pulsioximetría nocturna o una polisomnografía para valorar tanto la arquitectura del sueño como la ventilación nocturna. El registro nocturno se hará cuando la adaptación al ventilador es aceptable y se tolera toda la noche. La eficacia del soporte ventilatorio nocturno es adecuada si la SaO2 es superior al 90% durante más del 90% del período nocturno.
La mejoría de los gases diurnos se produce lentamente, dependiendo del uso nocturno del ventilador. La ventilación eficaz se acompaña de una mejoría de la gasometría arterial bajo este tratamiento, pero hay que tener en cuenta que algunos pacientes se adaptan lentamente y requieren varias semanas o meses antes de conseguir dormir toda la noche con el respirador. Consideraremos que la ventilación es eficaz cuando el paciente esté bien adaptado y confortable con la ventilación, y la gasometría arterial presente:
Un pH entre 7,35 y 7,50.
Una PaCO2 < 45 mmHg o una disminución de 10 mmHg sobre el nivel previo.
Una PaO2 > 60 mmHg o un incremento de 10 mmHg sobre el nivel previo.
Si el paciente se ventila correctamente pero la Pa02 es inferior a 60 mmHg, se debe añadir oxígeno suplementario a un flujo que consiga una SaO2 superior al 90%.
Marcapasos diafragmático
El marcapasos diafragmático no constituye realmente una modalidad de ventilación mecánica pero es una forma de ayuda externa a la ventilación. Este modo de ventilación fue inicialmente descrito hace unos 200 años. La estimulación eléctrica, como medio de conseguir respiración artificial, es motivo de estudio a partir del siglo xviii, poco después del descubrimiento de la electricidad. Durante la epidemia de poliomielitis en Norteamérica, se retomaron las experiencias anteriores, consiguiéndose una electroventilación en pacientes con parálisis diafragmática por lesión bulbar.
EI gran avance en este campo lo proporcionan Glenn et al en 1968, con el desarrollo experimental y clínico de un marcapasos diafragmático, consiguiendo por primera vez la estimulación permanente, en pacientes con insuficiencia ventilatoria. Posteriormente, en la década de los ochenta, Glenn consigue una electrostimulación frénica permanente en ambos diafragmas al mismo tiempo, sin observar alteraciones del nervio ni signos de fatiga. Desde entonces, la más correcta definición de los parámetros de estimulación y el desarrollo de nuevos modelos, sistemas y electrodos han permitido una mayor operatividad y una modalidad terapéutica.
La estimulación diafragmática sólo puede realizarse en el caso de que se encuentren preservados los siguientes componentes de la inervación frénica: las motoneuronas frénicas en C3-C5, los nervios frénicos, la placa motora y el diafragma.
Para indicar un marcapasos diafragmático el enfermo debe presentar una insuficiencia ventilatoria crónica claramente demostrada e irreversible con los nervios frénicos neurofisiológicamente normales, un diafragma funcionante y la ausencia de enfermedad respiratoria (resistencias de la vía aérea y la elasticidad pulmonar y torácica con valores cercanos a la normalidad). Los dos grupos principales de enfermos en que esta situación es planteable son: a) pacientes con insuficiencia ventilatoria crónica con necesidad de apoyo de ventilación artificial, portadores de lesión medular cervical alta sobre C3 o de tronco cerebral estable, con parálisis de la musculatura respiratoria y nivel cognitivo normal, y b) aquellos con síndrome de hipoventilación alveolar central idiopática.
El éxito de la estimulación frénica requiere una buena función del nervio frénico y del diafragma; por tanto, es indispensable comprobar la evaluación radioscópica y electroneurofisiológica de ambos, además de una función pulmonar aceptable y una función cerebral normal o casi normal. Asimismo, debe completarse el estudio en los casos de síndrome de hipoventilación central, con un estudio polisomnográfico y un estudio del control ventilatorio.
La mayoría de estos pacientes ha sido sometida, como tratamiento inicial, a una ventilación con presión positiva a través de traqueostomía. En una fase posterior, cuando se les introduce en un programa de ventilación con marcapasos diafragmático, es importante el mantenimiento del traqueostoma aunque pueda ser cerrado con tapón la mayor parte del día, en especial en aquellos casos con lesiones cervicales altas y de tronco que mantuvieron ventilación mecánica para aspirar y evitar la apnea del sueño.
Existen tres sistemas o tipos de marcapasos diafragmático, americano, finlandés y austríaco, que desarrollaron tipos para el tratamiento de la insuficiencia respiratoria crónica. Estos equipos tienen en común sus componentes mecánicos: electrodos y receptores implantados y componentes externos, como el transmisor de energía y sus antenas.
El marcapasos cuenta con la inducción de estímulos de radiofrecuencia generados por un transmisor externo y cuyas señales son transferidas por sendas antenas a los receptores o marcapasos implantados donde, a su vez, se generan las corrientes de frecuencia y amplitudes prefijadas que se transmitirán a través del electrodo al nervio frénico correspondiente.
Algunos enfermos con lesiones cervicales altas tienen una considerable atrofia diafragmática a la hora de la implantación y se debe iniciar con ellos un plan progresivo de adaptación. El condicionamiento diafragmático es un proceso de estimulación progresiva mediante pulsos de estímulo de baja frecuencia, por el cual las fibras de contracción rápida y fácil fatiga tipo II son convertidas a fibras de lenta contracción altamente resistentes a la fatiga tipo I, que permiten un soporte ventilatorio permanente sin fatiga con la electrostimulación frénica por medio de marcapasos diafragmático.
Cada caso requiere su control, evaluación y seguimiento de acuerdo con la ventilación conseguida y la posible aparición de fatiga diafragmática. La estimulación se inicia a los 14 días después de la cirugía, para evitar el edema, la inflamación o la reacción alrededor del nervio. Los valores de estímulo son ajustados al mínimo necesario para conseguir un volumen corriente que mantenga los gases sanguíneos en un rango normal.
Las complicaciones del marcapasos diafragmático ocurren en un 10-15% de los casos. Consisten en umbrales de estimulación muy altos o fallos en relación con la colocación del electrodo, la infección o el trauma del nervio. Las complicaciones tardías suelen estar en relación con fallos en el receptor y la rotura del electrodo. La vida media de sustitución de sus componentes suele estar alrededor de los 4-5 años.
El marcapasos diafragmático es capaz de suministrar un soporte ventilatorio prolongado, y los resultados parecen estar más en relación con la historia natural de la enfermedad base que con la eficacia del marcapasos diafragmático en sí. Hoy día tienen un uso muy limitado, ya que tanto la implantación como, sobre todo, la readaptación diafragmática posterior requieren un prolongado tiempo de hospitalización y un amplio equipo familiarizado con la técnica.
Bibliografía general
Baydur A, Layne E, Aral H, Krishnareddy N, Topacio R, Frederick G, et al. Long term non-invasive ventilation in the community for patients with musculoskeletal disorders: 46 year experience and review. Thorax 2000;55:4-11.
Bye PTP, Ellis ER, Issa FG, Donelly PM, Sullivan CE. Respiratory failure and sleep on neuromuscular disease. Thorax 1990;45:241-7.
Claman DM, Piper A, App B, Sanders MH, Stiller RA, Votteri BA. Nocturnal non-invasive positive pressure ventilatory assistance. Chest 1996;110:1581-8.
Consensus conference. Clinical indications for non-invasive positive pressure ventilation in chronic respiratory failure due to restrictive lung disease, COPD, and nocturnal hypoventilation. Chest 1999; 116:521-34.
De Lucas Ramos P, Rodríguez González-Moro JM, Paz González L, Santa-Cruz Siminiani A, Cubillo Marcos JM. Estado actual de la ventilación mecánica domiciliaria en España: resultados de una encuesta. Arch Bronconeumol 2000;36:545-50.
Garrido García H, Mazaira Álvarez M, Martín Escribano P, Romero Ganuza J, La Banda F, Gambarrutta C, et al. Treatment of chronic ventilatory failure using a diaphragmatic pacemaker. Spinal Cord 1998;36:310-4.
Golstein RS. Hipoventilation: neuromuscular and chest wall disorders. Clin Chest Med 1992;13:507-21.
González Lorenzo F, Díaz Lobato S. Soporte ventilatorio en pacientes con esclerosis lateral amiotrófica. Rev Neurol 2000;30:61-4.
Hill NS. Long Term mechanical ventilation. Lung biology in health and disease. New York: Marcel Decker, Inc., 2001.
Izquierdo JL. El pulmón en las enfermedades neuromusculares. Arch Bronconeumol 1997;33:369-71.
Kinnear WJM. Assisted ventilation at home. A practical guide. Oxford Med Publications, 1994.
Masa Jiménez JF. Ventilación mecánica domiciliaria. Perspectivas actuales. Arch Bronconeumol 1994;30:29-39.
Mazaira Álvarez M, García Moreno FJ, Gambarrutta C, Gutiérrez Romero R, Labanda F, Romero Ganuza J, et al. Marcapasos diafragmático. Revisión histórica, estado actual y nuestra experiencia. Med Espin. 1997;3:216-225.
Mehta S, Hill N. Non invasive ventilation. Am J Respir Crit Care Med 2001;163:540-77.
Moxham J, Shenerson JM. Diaphragmatic pacing. Am Rev Respir Dis 1993;148:533-6.
Petty TL. The modern evolution of mechanical ventilation. Clin Chest Med 1988;9:1-10.
Turkington PM. Rationale for the use of non-invasive ventilation in chronic ventilatory failure. Thorax 2000;55:417-23.