El tromboembolismo pulmonar es una patología relativamente frecuente y su diagnóstico sigue siendo hoy en día un grave problema en la práctica clínica diaria. Para realizarlo se combinan habitualmente la sospecha clínica con pruebas de imagen, como la gammagrafía de ventilación/perfusión, la tomografía computarizada y, en ocasiones, la angiografía. En el tromboembolismo agudo, la frecuencia de hipertensión pulmonar es elevada, mientras que un porcentaje mucho menor desarrolla hipertensión arterial pulmonar crónica. Presentamos el caso de una mujer de 81 años con antecedentes de hipertensión arterial y cardiopatía hipertensiva que tras un episodio de sensación de fatiga y disnea intensa y de la realización de las pruebas complementarias pertinentes fue diagnosticada de hipertensión arterial pulmonar crónica secundaria a tromboembolismo pulmonar. Estos enfermos habitualmente presentan un curso de deterioro progresivo y un pronóstico muy pobre a corto plazo.
Pulmonary embolism is a relatively frequent disease and its diagnosis continues to be a serious problem in the daily clinical practice. For its diagnosis, clinical suspicion is usually combined with other imaging tests, such as ventilation/perfusion lung scan, computed tomography (CT) and sometimes angiography. In acute thromboembolism, frequency of pulmonary hypertension is elevated while a much lower percentage develops chronic pulmonary arterial hypertension. We present the case of an 81-year-old woman with a background of arterial hypertension and hypertensive heart disease, who, after an episode of intense fatigue and breathlessness, and carrying out the pertinent complementary tests, was diagnosed of pulmonary hypertension secondary to chronic pulmonary thromboembolism. These patients usually follow a course of progressive deterioration and have a poor short-term prognosis.
El tromboembolismo pulmonar (TEP) es una patología relativamente frecuente con una elevada mortalidad en el caso de no ser tratada. La incidencia de enfermedad tromboembólica venosa, que incluye embolismo pulmonar y trombosis venosa profunda (TVP), es de 117/100.000 personas/año1. Se ha demostrado que su diagnóstico y tratamiento precoces mejoran la supervivencia y disminuyen la recurrencia2, repercutiendo de manera muy significativa en su pronóstico. La gammagrafía pulmonar desempeña un papel muy importante en dicho diagnóstico, siendo sin duda una de las pruebas de urgencia más solicitadas en los servicios de Medicina Nuclear y estando aceptada la idea de que debe ser la primera técnica diagnóstica por realizar3.
El TEP es una causa de hipertensión arterial pulmonar (HP). Aunque en la gran mayoría de los pacientes la hipertensión y la oclusión se resuelven, se ha descrito una incidencia acumulada de hipertensión tromboembólica crónica (HPTEC) del 1,0% a los 6 meses, del 3,1% al año y del 3,8% a los 2 años4.
Aunque el tratamiento médico con antagonistas del calcio, análogos de la prostaclina y, más recientemente, el bosentán o el sildafenilo ha mejorado el pronóstico a corto y a medio plazo, los enfermos con HP habitualmente presentan un importante deterioro funcional. Los avances recientes en la cirugía mediante tromboendarterectomía han convertido la HPTEC grave en una forma quirúrgicamente tratable, mejorando la supervivencia de estos enfermos5. Comparado con el trasplante pulmonar, única alternativa diferente de tratamiento viable en casos de HP crónica grave, este procedimiento es recomendable especialmente por no necesitar de terapia inmunosupresora a largo plazo y porque, según la experiencia de centros experimentados, tiene una mortalidad menor tanto inmediata como a largo plazo.
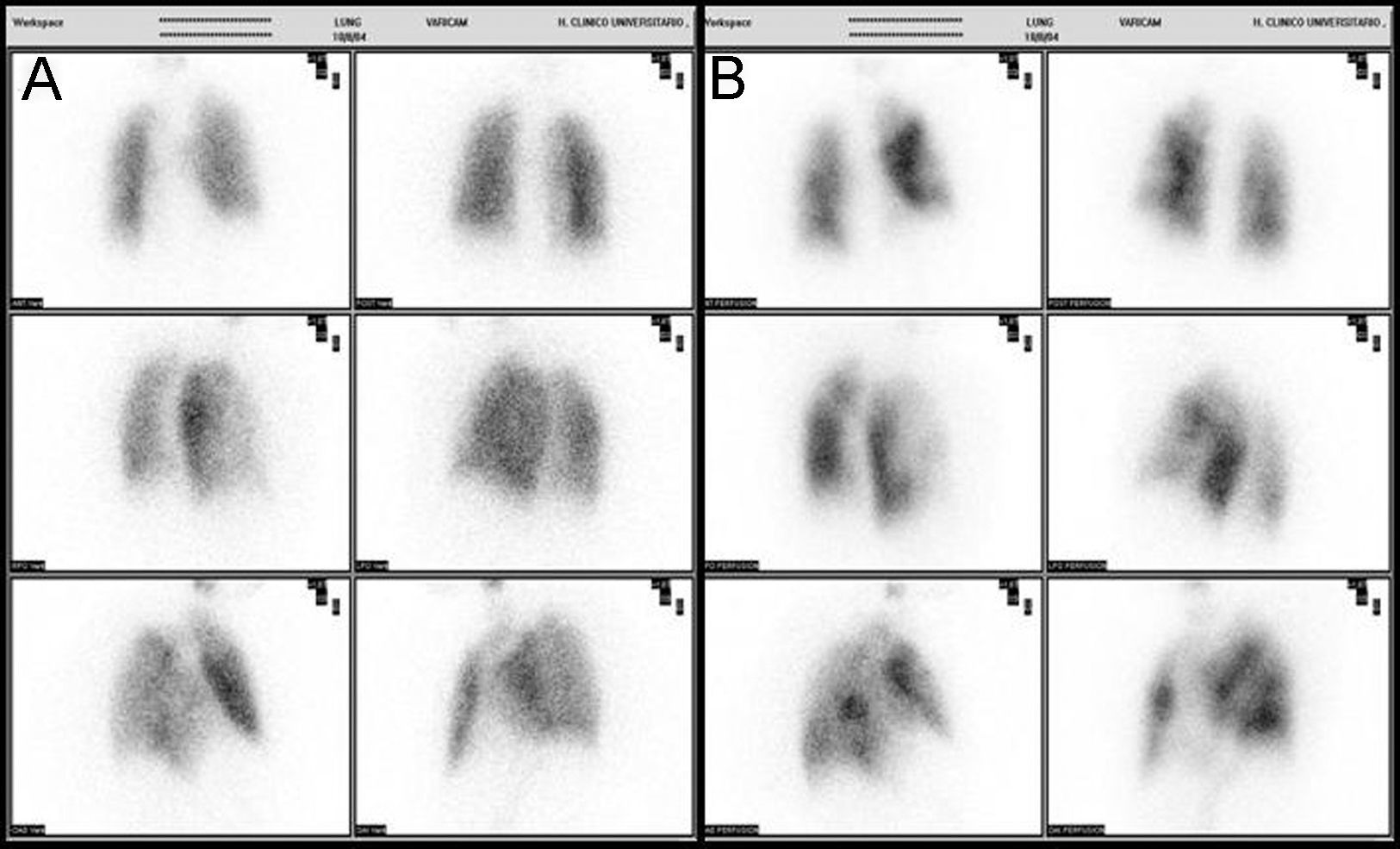
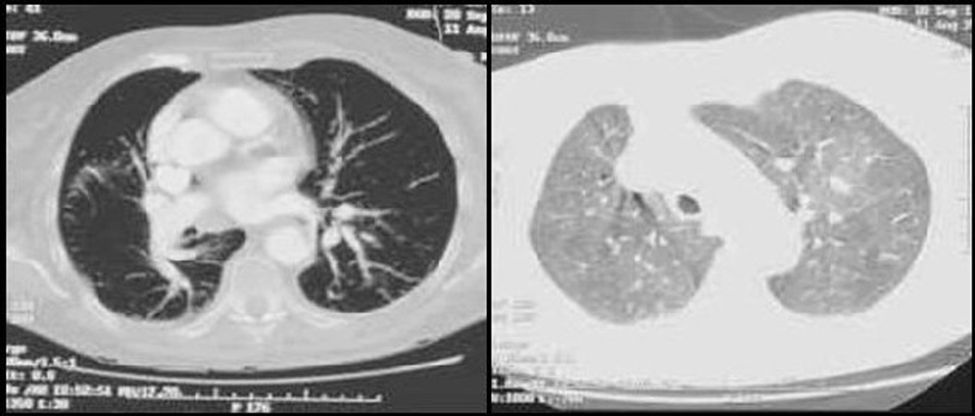
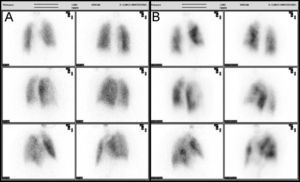
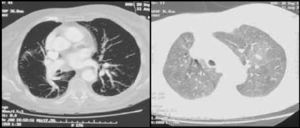
Caso clínicoPresentamos el caso de una mujer de 81 años que refería entre sus antecedentes personales hiperlipemia, hipertensión arterial y cardiopatía hipertensiva bien controladas, a tratamiento con estatinas, antagonistas de los receptores de la angiotensina y calcioantagonistas. Consultó por astenia y disnea de varios meses de evolución que había ido en aumento hasta hacerse de mínimos esfuerzos, presentando cuatro días antes de su ingreso un episodio de mareo intenso. Su estado general era bueno, con adecuada perfusión de la piel y las mucosas. En la exploración física, la tensión arterial era de 110/74mmHg, la frecuencia cardiaca de 75 latidos por minuto y la respiratoria de 15 respiraciones por minuto. Presentaba ligeros edemas maleolares, ventilación pulmonar conservada y un soplo sistólico en foco aórtico, grado ii/vi, sin irradiación y con segundo tono normal en la auscultación cardiaca. La radiografía de tórax mostró elongación aórtica con silueta cardiopericárdica dentro de la normalidad y sin datos concluyentes de enfermedad pleuropulmonar aguda. En el electrocardiograma se advertía un bloqueo auriculoventricular de primer grado con extrasístoles auriculares aisladas. La gammagrafía de ventilación/perfusión (fig. 1) mostró múltiples defectos de perfusión intrapulmonares en segmentos apical y superior e inferior de la língula del pulmón izquierdo con un estudio de ventilación normal, hallazgos compatibles con alta probabilidad de TEP. La saturación arterial de oxígeno era del 88,6% con una presión parcial de O2 de 51,0mmHg, una presión parcial de CO2 de 34,0mmHg y un potencial de hidrogeniones de 7,4. No se determinó el dímero D al ser la sospecha diagnóstica de un proceso crónico. Se le practicó un ecocardiograma que demostró, a pesar de contar con una deficiente ventana paraesternal, un ventrículo izquierdo con hipertrofia ligera y diámetros normales con función global conservada así como una insuficiencia mitral ligera, una insuficiencia tricuspídea moderada y una presión sistólica pulmonar de 115mmHg con ligera dilatación de cavidades derechas. La angio-tomografía computarizada (angio-TC) torácica (fig. 2) evidenció una heterogeneidad de la densidad pulmonar de distribución parcheada con áreas hipodensas oligoémicas sugestivas de «perfusión en mosaico», pero no mostró defectos de repleción en las arterias pulmonares o sus ramas y divisiones segmentarias que sugirieran TEP. La eco-Doppler de miembros inferiores no mostró datos de TVP. Finalmente, se le realizó a la paciente una arteriografía digital pulmonar que mostró un defecto de vascularización periférica en ambos pulmones sin datos angiográficos de hipertensión pulmonar arterial primaria. La paciente fue diagnosticada de HP secundaria a TEP crónico y tratada con anticoagulación.
Hemos descrito el caso de una paciente que como consecuencia de un TEP crónico ha desarrollado una HPTEC. La trascendencia de este caso es la de remarcar la importancia que las técnicas diagnósticas desempeñan en una patología que pasa frecuentemente desapercibida debido a que el episodio clínico inicial no se identifica usualmente a la hora de realizar la historia clínica y a que tras el evento agudo suele sucederse un largo período de tiempo libre de síntomas5.
La incidencia real de TEP es difícil de establecer dado que muchos episodios no se diagnostican en vida (hasta el 70%) y gran parte de ellos son asintomáticos (25–50%). Los datos españoles6, junto con la extrapolación de los datos publicados en Estados Unidos y Gran Bretaña, nos permiten estimar para España unas cifras de incidencia de TVP de unos 500.000 casos anuales, de los que unos 60.000 evolucionarían a TEP, generando unos 50.000 ingresos hospitalarios. Aproximadamente, 40 pacientes desarrollarían hipertensión pulmonar y se producirían unas 19.000 muertes anuales, la gran mayoría sin llegar a diagnosticarse en vida7.
El TEP es el enclavamiento en las arterias pulmonares de uno o más trombos procedentes del territorio venoso. El 90% de estos trombos se origina en el sistema venoso profundo de las extremidades inferiores. Existen tres factores que favorecen la trombogénesis venosa: estasis o enlentecimiento del flujo sanguíneo, daño de la pared endotelial y alteraciones en el mecanismo de coagulación.
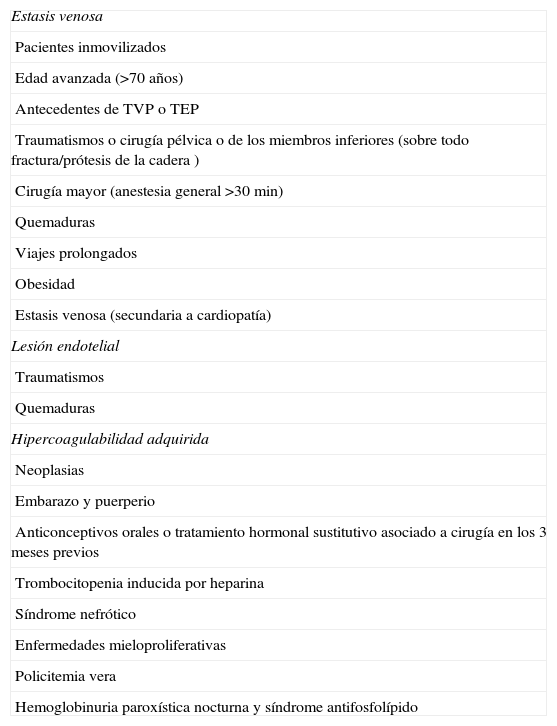
Las situaciones clínicas que predisponen al desarrollo de un TEP actuando sobre uno o varios de estos factores se resumen en la tabla 1.
Factores predisponentes al desarrollo de tromboembolismo pulmonar
| Estasis venosa |
| Pacientes inmovilizados |
| Edad avanzada (>70 años) |
| Antecedentes de TVP o TEP |
| Traumatismos o cirugía pélvica o de los miembros inferiores (sobre todo fractura/prótesis de la cadera ) |
| Cirugía mayor (anestesia general >30min) |
| Quemaduras |
| Viajes prolongados |
| Obesidad |
| Estasis venosa (secundaria a cardiopatía) |
| Lesión endotelial |
| Traumatismos |
| Quemaduras |
| Hipercoagulabilidad adquirida |
| Neoplasias |
| Embarazo y puerperio |
| Anticonceptivos orales o tratamiento hormonal sustitutivo asociado a cirugía en los 3 meses previos |
| Trombocitopenia inducida por heparina |
| Síndrome nefrótico |
| Enfermedades mieloproliferativas |
| Policitemia vera |
| Hemoglobinuria paroxística nocturna y síndrome antifosfolípido |
TEP: tromboembolismo pulmonar; TVP: trombosis venosa profunda.
Existen también factores genéticos que predisponen al desarrollo de enfermedad tromboembólica debido a una deficiencia hereditaria de factores que inhiben o regulan los procesos de coagulación o fibrinólisis (que solo explicarían una quinta parte de los casos) y que se han agrupado con el término de trombofilias hereditarias. Son causas de trombofilia primaria o congénita: resistencia a la proteína C activada por mutación del factor v de Leyden, mutación del gen de la protrombina, déficit de antitrombina iii, déficit de proteína C, déficit de proteína S y disfibrinogenemia. A ellas habría que añadir y la hiperhomocisteinemia (tabla 2).
La aparición de nuevos tratamientos médicos con prostaciclinas, antagonistas del calcio, sildenafilo y quirúrgicos, como los trasplantes pulmonares y la tromboendarterectomía, han mejorado el pronóstico y la calidad de vida de los pacientes8–14. La incidencia de HPTEC después de un episodio de TEP agudo es más frecuente de lo que habitualmente se piensa, describiéndose en algunos trabajos recientes que hasta un 3–4% de pacientes la desarrolla4,15.
En nuestro caso, la paciente estaba diagnosticada de cardiopatía hipertensiva y presentaba clínica de disnea progresiva no justificada por su cardiopatía de base. Como en otras formas de HP, la disnea y la intolerancia al ejercicio son características, pero suelen ser atribuidas a otros cuadros clínicos16. La expresión habitual de esta patología es la de síntomas y signos de cor pulmonale progresivo. Además, la historia clínica, en general, es de escasa ayuda en el diagnóstico de HPTEC, los pacientes con un claro episodio de TEP rara vez la desarrollan porque el tratamiento anticoagulante precoz evita el proceso crónico5. Los hallazgos de la exploración física son similares a los de otras formas de HP, describiéndose como hecho diferencial soplos continuos o sistólicos en los campos pulmonares originados por la obstrucción arterial en la HPTEC.
La realización de un diagnóstico precoz de TEP a través de la sospecha clínica inicial y su posterior confirmación mediante la realización de pruebas complementarias sobre la base de los protocolos específicos establecidos permitirían la instauración temprana de las medidas terapéuticas oportunas aumentando las posibilidades de beneficio terapéutico y disminuyendo la morbilidad y la mortalidad inicial asociada a este. Con el tratamiento anticoagulante, el desarrollo de eventos fatales puede ser reducido de una manera considerable. Aunque algunos pacientes fallecen a pesar de un diagnóstico correcto y un tratamiento adecuado, la mortalidad es 4–6 veces mayor en los casos en los que el diagnóstico no es sospechado. La trombosis recurrente tardía y los síndromes postrombóticos suponen también un problema significativo con incidencias acumuladas a los 5 años de un 25 y un 30%, respectivamente17.
El valor diagnóstico de la gasometría arterial (GSA) para confirmar o excluir el diagnóstico de TEP sigue siendo hoy en día controvertido. La alteración que aparece más frecuentemente en la GSA de estos pacientes es la hipoxemia, aunque en los casos de TEP severos o de existencia de patología previa puede estar en rango de insuficiencia respiratoria y existir hipocapnia. Este patrón gasométrico, no obstante, no es específico del TEP, pudiendo presentarse en cualquier patología que curse con hiperventilación. Así, a pesar de que se objetiva hipoxemia hasta en el 90% de los pacientes que presentan un evento embólico pulmonar agudo, existe bibliografía que ha demostrado que una GSA normal no tiene la sensibilidad ni la especificidad suficientes para excluir dicho diagnóstico18.
Otra técnica de reciente introducción en el ámbito clínico es el dímero D. Este es un producto de degradación de la fibrina que se considera como marcador de trombosis aguda. Su amplia disponibilidad hoy en día en el medio hospitalario, su fácil detección, su elevada sensibilidad y su alto valor predictivo negativo favorecieron su rápida inclusión como prueba no invasiva por realizar en el algoritmo diagnóstico del TEP. Existen suficientes estudios que confirman que un dímero D negativo permite excluir enfermedad tromboembólica con o sin TEP19–22, por lo que actualmente esta técnica juega un papel más que relevante en el diagnóstico de esta, habiendo incluso sido propuesta como primera prueba por realizar23. Ha de tenerse en cuenta, sin embargo, que su sensibilidad disminuye con la edad24, y que presenta, por otra parte, una baja especificidad pudiendo incrementarse sus niveles en situaciones como neumonía, intervención quirúrgica reciente, infarto del miocardio20, insuficiencia cardiaca, afecciones cerebrovasculares, neoplasias y enfermedades reumatológicas.
Ante la sospecha de TEP agudo, el primer estudio de imagen que se realiza es la radiología simple de tórax. En un alto porcentaje de casos esta prueba es normal y su principal papel sería el de excluir otros posibles diagnósticos25. El estudio radiológico puede mostrar, no obstante, ocupación de la ventana aortopulmonar y cardiomegalia, ambos signos de hipertensión pulmonar, así como asimetría en el tamaño de las arterias pulmonares, las zonas avasculares o las imágenes sugestivas de infarto pulmonar.
La realización de una eco-Doppler de los miembros inferiores puede ser útil para excluir la existencia de TVP. En nuestra paciente resultó negativa para trombosis. La exactitud de esta prueba es elevada en pacientes sintomáticos con sospecha de TVP, pero un resultado normal no excluiría el embolismo pulmonar en el caso de sospecha clínica elevada. Solo el 30% de los estudios eco-Doppler revela trombos periféricos en pacientes con HPTEC26.
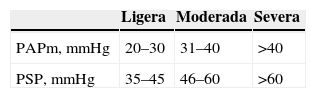
El ecocardiograma transtorácico permitió establecer el diagnóstico de HP a pesar de no ser óptima la ventana paraesternal. La ecocardiografía transtorácica informa de la magnitud de la hipertensión pulmonar y permite descartar otras patologías que pueden simular un TEP, como la disección aórtica y el taponamiento pericárdico, así como cuantificar de forma no invasiva la presión sistólica arterial pulmonar27. La HP se define como la presencia de una presión arterial pulmonar media superior a 25mmHg en reposo o superior a 30mmHg durante el ejercicio, siempre y cuando se hayan excluido otras causas28, o una presión sistólica en la arteria pulmonar superior a 35mmHg. La HP se clasifica según su severidad en 3 grados (tabla 3).
Frecuentemente, la ecocardiografía transtorácica es la primera exploración que sugiere la presencia de HPTEC, y dependiendo del estadio de la enfermedad, demuestra diferentes grados de dilatación, depresión de la función sistólica ventricular derecha e insuficiencia tricuspídea15,29. Existen estudios en los que se ha apuntado la conveniencia de hacer una ecocardiografía transesofágica30.
La prueba clave por realizar para determinar origen tromboembólico de la HP crónica es el estudio gammagráfico de ventilación/perfusión. Dicha técnica presenta una alta sensibilidad y especificidad en la evaluación diagnóstica del TEP crónico (el 90–100% y el 94–100%, respectivamente)16,31. En los pacientes con HPTEC, los estudios de ventilación/perfusión muestran uno o más defectos discordantes segmentarios o extensos a diferencia de la presencia de una perfusión normal o con defectos subsegmentarios en pacientes con HP primaria. Esta prueba diagnóstica es, junto con la radiología simple de tórax, la primera incluida en el diagnóstico tradicional del TEP agudo. No obstante, no puede definir la extensión proximal de la obstrucción tromboembólica, pudiendo subestimar la magnitud de los defectos de perfusión32.
En los últimos años, la TC helicoidal ha adquirido protagonismo en el diagnóstico del TEP agudo así como en el de la HPTEC, llegando algunos estudios a comparar su efectividad diagnóstica con la arteriografía pulmonar. Es una exploración no invasiva, bastante disponible y que presenta un índice coste/beneficio muy satisfactorio, permitiendo la visualización directa del sistema vascular pulmonar33. El patrón heterogéneo en la densidad pulmonar que presentaba la angio-TC torácica de nuestra paciente así como la perfusión en mosaico asociada a la dilatación de las arterias pulmonares forman parte de la variedad de alteraciones que pueden aparecer en este cuadro clínico16. La enfermedad tromboembólica crónica se puede manifestar en la TC con la oclusión completa de las arterias pulmonares, la presencia de defectos de llenado excéntricos compatibles con trombos, la recanalización y la presencia de estenosis o redes vasculares34.
Los principales inconvenientes de esta técnica residen en una menor rentabilidad diagnóstica en caso de afectación de las arterias segmentarias y en la necesidad de una amplia experiencia para la correcta interpretación de las imágenes. A pesar de que la TC no es referente de los cambios hemodinámicos, existen estudios que evidencian que es más específica que la gammagrafía de ventilación/perfusión35, y es una buena alternativa a la angiografía pulmonar, aunque no suficiente para seleccionar los candidatos tributarios de cirugía correctora36.
Finalmente, la paciente fue sometida a una arteriografía pulmonar, que resultó compatible con el diagnóstico de TEP crónico. La angiografía es la técnica considerada hasta ahora como «patrón oro», ya que esta prueba confirma definitivamente el diagnóstico de HPTEC. Es un procedimiento invasivo no exento de riesgos, de alto coste y no disponible en todos los centros, pero todavía es necesaria en aquellos casos en los que habiéndose demostrado una hipertensión pulmonar ecocardiográfica, permanezcan dudas de interpretación diagnóstica (gammagrafía pulmonar o la TC helicoidal no concluyentes), así como para la identificación de aquellos pacientes que pueden beneficiarse de una intervención quirúrgica delimitando la extensión de la enfermedad y la accesibilidad de los trombos16,37.
En definitiva, para concluir, los puntos más interesantes que nos muestra este caso serían:
- 1.
La valoración de estudios recientes indica que en el seguimiento de los pacientes tras un cuadro de tromboembolismo agudo se registra un mayor número de efectos adversos, además del desarrollo de HPTEC, un aumento de la mortalidad y el desarrollo de TVP. Estos efectos se observan hasta en un 50% de los pacientes durante los primeros 4 años tras el diagnóstico de TEP, lo que confirma la utilidad de la detección y el tratamiento precoces en estos pacientes38.
- 2.
Es preciso señalar que existen casos, como el que nos ocupa, en el que el cuadro agudo de TEP cursa de forma silente o no es diagnosticado en el momento de la fase aguda, lo que conllevaría el desarrollo de patologías crónicas y un peor manejo posterior de estos pacientes. Por todo ello, sería recomendable descartar la presencia de HPTEC en pacientes con disnea crónica no atribuible a otras causas.
- 3.
Finalmente, para ello disponemos en el momento actual de técnicas diagnósticas que han demostrado su utilidad en el diagnóstico de TEP, estando la mayoría disponibles, como es el caso de la determinación del dímero D, la radiografía torácica o el ecocardiograma, que permiten confirmar el diagnóstico de sospecha y seleccionar a aquellos pacientes que se beneficiarían de pruebas más específicas, como la TC helicoidal o la arteriografía. Entre ellas, destacar el papel de la gammagrafía de ventilación/perfusión que sigue siendo hoy en día una herramienta útil para el diagnóstico de TEP, marcando el punto de partida que orienta al origen tromboembólico de la enfermedad.