En nuestro quehacer diario apreciamos que las cosas están cambiando. Se establecen nuevas formas de trabajar y nuevos objetivos que debemos cumplir. Entre los cambios a los que estamos asistiendo tenemos la prescripción por principio activo (PA).
La primera Comunidad Autónoma que en 1996 puso en práctica un acuerdo de prescripción de principios activos fue la Comunidad Valenciana. Posteriormente fue el País Vasco en 1997 el que firmó un acuerdo de estas características. Ambas experiencias fueron pioneras en España cuando el mercado de especialidades farmacéuticas genéricas (EFG) no estaba desarrollado y sólo había indicios de una futura puesta en marcha de los precios de referencia. Ambos acuerdos ya no están actualmente en vigor.
Más de 5 años han pasado para que otra Comunidad, la andaluza, ponga en marcha la prescripción de principios activos con unos precios de referencia ya implantados en todo el país y un mercado cada vez más competitivo de EFG, marcas, precios, etc. Este acuerdo firmado en Andalucía poco tiene que ver con los firmados en Valencia y en el País Vasco años atrás, ya que las condiciones de las prestaciones farmacéuticas son distintas y el panorama farmacéutico ha variado considerablemente, que si bien se puso en marcha inicialmente en Andalucía, de forma progresiva se está implantando en el resto de las Comunidades Autónomas.
Esta práctica de prescripción, avalada por la Organización Mundial de la Salud (OMS) consiste en que el médico indica en la receta el nombre de la sustancia y no el de una determinada marca comercial. Con esta iniciativa, pionera en el Sistema Nacional de Salud y que ha sido adoptada posteriormente por Madrid y Extremadura, la Sanidad Pública Andaluza se ha ahorrado 29,5 millones de euros desde septiembre de 2001 hasta el mismo mes de 2003. Mientras que en septiembre de 2001 las recetas por principio activo representaban sólo el 0,35% del total, un año después, en septiembre de 2002 suponían ya el 17,76% del total, y en septiembre de este año se alcanzó el 39,47% del total de recetas.
Para promover este tipo de prescripción se han llevado a cabo campañas informativas mediante la colocación de dípticos y carteles, en colaboración con el Consejo Andaluz de Colegios Farmacéuticos y con las Organizaciones de Consumidores.
La contención del gasto farmacéutico es una de las grandes preocupaciones de las Comunidades Autónomas que, tras la definitiva descentralización de las competencias sanitarias, son las que asumen la factura de las recetas públicas, siendo una de las medidas para el control del mismo, la prescripción por principio activo (PPA). En el marco del Pacto de Estabilidad para el sector farmacéutico la Administración pretende adoptar esta medida, facultando al farmacéutico para que elija especialidad con menor precio.
La reforma sanitaria trae como una de las consecuencias la necesidad de controlar el gasto general y la factura farmacéutica en particular, poniendo en marcha una serie de medidas para la racionalización del mismo, siendo los principales mecanismos:
Establecimiento de presupuestos de prescripción al médico y su corresponsabilización en el gasto farmacéutico.
La posibilidad de sustitución de medicamentos por los farmacéuticos y su responsabilización en el control del gasto y calidad en el uso de medicamentos.
La percepción del coste por parte del paciente que se traduce en utilizar alternativas de la misma calidad sin coste adicional para él, o bien utilizar medicamentos originales mediante el pago total o parcial del diferencial del precio existente. Este mecanismo se denomina "precios de referencia" y es el elegido por el Ministerio de Sanidad.
Para entender la aplicación de precios de referencia se precisa conocer una serie de conceptos:
Especialidad farmacéutica bioequivalente: aquellas que son intercambiables entre sí por su idéntica composición cualitativa y cuantitativa, forma farmacéutica, presentación, dosis y vía de administración, así como su bioequivalencia, bien por tratarse del mismo medicamento aunque se presente con distinta denominación y titular, bien por haberse demostrado tal posibilidad en caso necesario según las directrices de la Unión Europea mediante un ensayo de bioequivalencia. Dentro del mercado de especialidades farmacéuticas podemos encontrar:
1. Medicamento original: es el que contiene el principio activo nuevo con el que se ha desarrolado la I + D completa para su comercialización.
2. Medicamentos licencia: igual que el original; se comercializan por otros laboratorios con autorización expresa del investigador original.
3. Medicamentos copia: se comercializan con posterioridad al Original sin autorización expresa del laboratorio investigador. Podrán intercambiarse con el original o no, según demuestren su bioequivalencia. Los que lo hayan demostrado llevarán las siglas EQ.
4. Especialidades farmacéuticas genéricas: sus características están definidas en la Circular 3/97 de 6 de febrero de la Dirección General de Farmacia y Productos Sanitarios, pudiendo intercambiarse con el original.
Cuando la denominación de la especialidad farmacéutica sea una marca comercial o nombre de fantasía, y sólo contenga una sustancia medicinal, deberá ir acompañada de la Denominación Oficial Española (DOE) o, en su defecto, de la Denominación Común Internacional (DCI).
Cuando se trate de especialidad farmacéutica genérica la denominación estará constituida por la DOE o, en su defecto, por la denominación común o científica acompañada del nombre o una marca del titular o fabricante.
Conjunto homogéneo de especialidades: son todas las especialidades farmacéuticas que tengan la misma composición cualitativa y cuantitativa, forma farmacéutica, dosis, vía de administración y presentación o el mismo número de unidades posológicas. Se consideran intercambiables aquellas formas farmacéuticas cuyo principio activo sea bioequivalente, de esta forma un EFG no tiene por qué tener exactamente la misma forma farmacéutica que la especialidad de referencia, sino que basta con que demuestre la correspondiente bioequivalencia. Es requisito indispensable que en cada conjunto homogéneo exista al menos una EFG, lo cual es importante puesto que al exigirse a los genéricos para su registro que el perfil de seguridad y eficacia del medicamento original se haya acreditado por su continuado uso clínico durante 10 años, se retrasa en un período igual la aplicación de los precios de referencia.
El artículo 94.6 de la Ley 25/1990, de 20 de diciembre, del Medicamento, en redacción dada al mismo por la Disposición final tercera de la Ley 16/2003, de 28 de mayo, de cohesión y calidad del Sistema Nacional de Salud, modifica la configuración del sistema de precios de referencia en la financiación de medicamentos con cargo a fondos de la Seguridad Social o a fondos estatales afectos a la sanidad.
En el BOE número 256 del sábado 25 octubre 2003 (38.169) dicha modificación afecta, principalmente, a las condiciones requeridas para el establecimiento de los conjuntos y a la exclusión, a efectos de integración en los mismos, de las formas farmacéuticas innovadoras hasta que se autorice la especialidad farmacéutica genérica correspondiente. Resulta necesario, por tanto, delimitar el concepto jurídico "formas farmacéuticas innovadoras ". Se señala que, a tales efectos, se ha optado por facultar a la máxima autoridad del organismo autónomo con competencias cientificotécnicas en el ámbito del medicamento y de los productos sanitarios para decidir sobre dicho aspecto, encomendándole que, a tales efectos, tenga en cuenta la evidencia clínica disponible orientada al incremento directo o indirecto de la eficacia terapéutica.
El precio de referencia en cada conjunto homogéneo se determinará de acuerdo con la media ponderada por las ventas de los precios de comercialización de las especialidades del conjunto. Para el cálculo de la media no se tomarán todas las especialidades que forma el conjunto, sino sólo aquellas de menor precio necesarias para que, de manera global, alcancen una cuota de mercado de al menos el 20%. Por ejemplo, si en el conjunto homogéneo hay 10 especialidades y los tres medicamentos más baratos suponen el 20% de las ventas totales en España, para la determinación del precio de referencia se tomarán exclusivamente estas tres especialidades. A efectos del cálculo de la cuantía del precio de referencia en cada conjunto: las tres presentaciones de especialidades farmacéuticas seleccionadas para fijar, conforme establece el párrafo quinto del apartado 6 del artículo 94 de la Ley 25/1990, de 20 de diciembre, del Medicamento, el correspondiente precio de referencia deben pertenecer siempre que ello sea posible, a tres grupos empresariales diferentes. A los efectos del artículo 94.6 de la Ley 25/1990, de 20 de diciembre, del Medicamento, y de lo dispuesto en la presente Orden, se considera que pertenecen a un mismo grupo las empresas que constituyan una unidad de decisión, en los términos del artículo 4 de la Ley 24/1988, de 28 de julio, del Mercado de Valores. A su vez, se situará el precio de referencia en una banda cuyos límites máximo y mínimo serán el 90% y el 50% del precio más elevado dentro de cada conjunto homogéneo. En ningún caso el precio de referencia será inferior al de la EFG con menor precio dentro de cada conjunto homogéneo.
Una vez establecidos los precios de referencia únicamente las especialidades bioequivalentes, cuyos precios no superen las cuantías que para cada presentación de principio activo se establezcan, serán objeto de financiación con cargo al Sistema Nacional de Salud. Aquellas que las superen sólo serán financiadas hasta los precios de referencia fijados.
El 27 de noviembre del 2002 el Consejo Andaluz de Colegios Oficiales de Farmacéuticos firmaba con el Servicio Andaluz de Salud y la Consejería de Salud el Convenio por el que se fijaban las condiciones para la ejecución de la prestación farmacéutica a través de las oficinas de farmacia de esta Comunidad Autónoma para los próximos 4 años, uno de cuyos elementos centrales es el fomento de la prescripción por principio activo y el proyecto de la receta electrónica denominado "Receta XXI".
En Andalucía y a través de la Orden SCO/2958/2003 de 23 de octubre se determinan los nuevos conjuntos de presentaciones de especialidades farmacéuticas y se aprueban los correspondientes precios de referencia, entrando en vigor desde el 1 de enero de 2004. Este acuerdo suscrito entre el Servicio Andaluz de Salud y el Consejo Andaluz de Colegios Oficiales de Farmacéuticos, tiene una cláusula adicional, en virtud de la cual a las recetas perscritas por PA sometido a precio de referencia, se les aplicará el que figura en el Anexo III de la Orden Ministerial citada. Se pone como objetivo para el año 2004 un porcentaje de recetas prescritas por PA igual o superior al 50%. Sin embargo, no serán sustituibles sin la autorización expresa del médico prescriptor ni se incluyen en el sistema de precios de referencia los siguientes medicamentos:
Insulinas y análogos.
Antagonistas de la vitamina K.
Factores VIII y IX de la coagulación.
Glucósidos cardíacos.
Medicamentos de especial control médico.
Medicamentos de estrecho margen terapéutico sometidos a monitorización de sus niveles plasmáticos
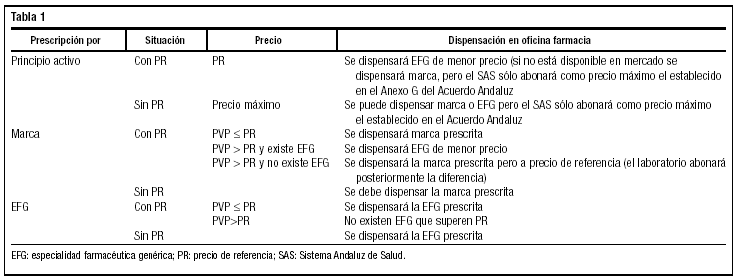
La situación en Andalucía quedaría tal y como se establece en la tabla 1.
Con estas medidas se ha mejorado el control del gasto farmacéutico. Sin embargo, crea una serie de incertidumbres que a todos nos repercute. A través de este foro se intentará valorar en qué medida estos cambios pueden beneficiar y/o perjudicar a todos los profesionales relacionados con la prescripción (médicos, farmacéuticos, laboratorios y Administración) y por supuesto, el centro de dicho acto: el usuario. ¿Podría haber otras medidas que sustituyeran la prescripción por PA para controlar el gasto?, ¿hay posibilidades de mejora?, ¿se implantará en el resto de las Comunidades de forma unánime y con los mismos criterios?, ¿perjudicará la investigación en un futuro? Esperamos que estas y otras dudas se nos aclaren.