Sr. Director: La anemia hemolítica microangiopática (AHMA) es una complicación poco habitual de los carcinomas diseminados productores de mucina y, excepcionalmente, de carcinomas localizados1,2. Se ha descrito con mayor frecuencia en adenocarcinomas gástricos (55%), de mama (13%) y pulmonares (7%), aunque también se ha relacionado con el carcinoma de páncreas, colon y próstata. En ocasiones (10%) no se llega a descubrir el tumor primario3. Entre las causas más comunes de AH-MA se encuentran el síndrome hemolítico urémico (SHU), la púrpura trombótica trombocitopénica (PTT), la coagulación intravascular diseminada (CID), la hipertensión maligna, la eclampsia, los hemangiomas, el rechazo de un trasplante renal y las enfermedades inmunológicas4.
Como consecuencia de la hemólisis intravascular que se origina puede aparecer hemoglobinemia, hemoglobinuria, hemosiderinuria y acortamiento de la vida eritrocitaria. La presencia de esquistocitos y microesferocitos en el estudio de sangre periférica, así como la negatividad de la prueba de Coombs, permite diferenciar las anemias hemolíticas mecánicas de otras anemias hemolíticas adquiridas y de las autoinmunes.
Las manifestaciones clínicas del tumor pueden pasar desapercibidas, bien por su inexpresividad o porque se consideren secundarias al síndrome anémico. Esto puede dificultar el reconocimiento del proceso primario, y explica el hecho de que en numerosas ocasiones se llegue al diagnóstico en el estudio necrópsico.
Por su rareza, nos parece de interés presentar el caso de una mujer joven con anemia hemolítica microangiopática secundaria a un carcinoma lobulillar de mama con invasión linfática y de médula ósea.
Mujer de 41 años de edad sin antecedentes personales ni familiares de interés y sin hábitos tóxicos. Tuvo la menarquia a los 13 años con ciclos menstruales de 30 x 4 días de duración. Tenía una hija sana. Aportaba un estudio mamográfico normal realizado dos años antes. Consulta por astenia y por la aparición de hematomas en extremidades, todo ello de tres semanas de evolución. La exploración física, salvo la palidez de piel y mucosas y los hematomas descritos, fue normal. De entre los hallazgos analíticos destacaban los siguientes: hemoglobina 10,5 g/dl; hematocrito 31,6%; hematíes 3.750.000/mm3; reticulocitos 146.300/mm3 y haptoglobina 0,24 g/l (valor normal [vn] = 0,7-3,7). Las series blanca y plaquetar y la velocidad de sedimentación globular fueron normales. El estudio de coagulación mostró una actividad de protrombina del 63%, un tiempo de trombina de 24,1 segundos (vn hasta 22) y un dímero D > 700 ng/ml (vn hasta 260). Los factores de la coagulación II, VII, VIII y X fueron normales y la prueba de Coombs directa, negativa. La extensión de sangre periférica reveló un síndrome leucoeritroblástico, con llamativa anisopoiquilocitosis en la serie roja y abundantes esquistocitos. Entre los parámetros bioquímicos destacaban: bilirrubina total 2,9 mg/dl, con fracción directa normal; lactato deshidrogenasa 890 UI/l (vn hasta 480), CA 15.3: 63,4 U/ml (vn hasta 32) y CA 125: 59,9 (vn hasta 35). El estudio de autoinmunidad fue negativo y la radiografía de tórax, normal.
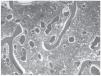
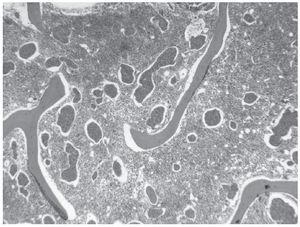
Una mamografía mostró varias imágenes nodulares de contorno bien definido en ambas mamas, la mayor de ellas en el cuadrante superointerno de la mama derecha, de poco más de 1 cm y con alguna microcalcificación aislada. Una ecografía mamaria puso de manifiesto múltiples lesiones focales quísticas y alguna sólido-quística, y dos adenopatías axilares derechas con la cortical engrosada de forma difusa, la mayor de casi 2 cm de diámetro. La punción-aspiración con aguja fina de una adenopatía axilar evidenció atipia sospechosa de malignidad, y la biopsia de médula ósea, una sustitución parcial del tejido hematopoyético por nidos de células tumorales de pequeño tamaño, con escaso pleomorfismo y con escasa cohesividad, alguno de los cuales ocupaba espacios vasculares (fig. 1). La inmunohistoquímica realizada en el cilindro de médula ósea mostró positividad nuclear con receptores de estrógenos y negatividad con receptores de progesterona, Her2neu y con cadherina. Todo ello muy sugestivo de una infiltración masiva por carcinoma lobulillar de mama. La paciente presentó un rápido deterioro respiratorio y hemodinámico secundario al desarrollo de hemotórax y hemoperitoneo consecuencia de una coagulación intravascular diseminada. Tras la realización de laparoscopia -que reveló una lesión quística hemorrágica en ovario con estudio anatomopatológico de benignidad- y la colocación de tubo de drenaje torácico, se instauró tratamiento con plasma, concentrados de hematíes y factor VII, dexametasona, ácido zolendrónico, paclitaxel y carboplatino, a pesar de lo cual evolucionó hacia un fracaso multiorgánico que provocó el fallecimiento de la paciente.
Figura 1. Sustitución parcial del tejido hematopoyético por nidos de células tumorales que, en algún caso, ocupan espacios vasculares
La AHMA asociada al cáncer es una entidad con graves implicaciones pronósticas3,4 y que suele conducir al fallecimiento generalmente pocas semanas después de su diagnóstico. Su mecanismo de producción es poco conocido, si bien se sabe que en aquellos pacientes con cáncer y CID, el factor tisular y el factor activador del factor VII parecen expresarse en la superficie de ciertas células tumorales y en micropartículas procoagulantes de la circulación5. Además, el factor de necrosis tumoral, la interleucina 6 y las citoquinas proinflamatorias pueden alterar la regulación de los mecanismos anticoagulantes y antifribrinolíticos.
El manejo de la AHMA requiere la identificación precoz y el tratamiento de la causa subyacente. De ahí la importancia de caracterizar tempranamente la enfermedad sistémica maligna, y de iniciar el tratamiento específico, única medida teóricamente eficaz.
La AHMA suele presentarse con las manifestaciones inespecíficas de un síndrome anémico. Menos veces, aparece ictericia. Desde el punto de vista del laboratorio debe sospecharse ante una hemólisis -con o sin anemia- (reticulocitos elevados, hiperbilirrubinemia indirecta, elevación de la lactato deshidrogenasa y haptoglobina disminuida o ausente) y con prueba de Coombs negativa. La extensión de sangre periférica muestra un elemento característico: los hematíes fragmentados o esquistocitos, que pueden originarse fundamentalmente por tres mecanismos: a) tras ejercicio físico importante, debido al traumatismo que supone el paso de los hematíes por pequeños vasos situados junto a prominencias óseas, b) por paso de los hematíes a través de zonas con gradiente de presión debido a válvulas cardíacas anormales o a válvulas protésicas, y c) por fragmentación de los hematíes al atravesar depósitos de fibrina de la microcirculación4.
Finalizamos insistiendo en dos consideraciones que nos parecen relevantes: por una parte, en la conveniencia de realizar una biopsia ósea con estudio inmunohistoquímico en todos los casos de AHMA con sospecha de enfermedad maligna subyacente. Por otra, en la necesidad de tener en consideración las metástasis de carcinoma en el diagnóstico diferencial de la AHMA, una vez descartadas las entidades más frecuentemente asociadas1,4.