RECUERDO ANATÓMICO1
La glándula pineal es un cuerpo impar y central que se desarrolla a expensas de una invaginación de la bóveda del ventrículo medio. Se denomina también epífisis o excrecencia superior, en contraposición a la hipófisis o excre-cencia inferior.
Situación
La glándula pineal está situada por debajo del rodete del cuerpo calloso, entre los dos tubérculos cuadrigéminos anteriores, que forman una especie de canal denominado lecho de la glándula pineal. Se mantiene en su lugar por medio de algunas adherencias con la piamadre y por cierto número de prolongaciones que partiendo de su base van a terminar en varios órganos próximos. Debajo de la epífisis se ve el abombamiento del acueducto de Silvio en el tercer ventrículo.
Dimensiones
La glándula pineal tiene el tamaño de un guisante ordinario. Mide por término medio 7 u 8 mm de longitud por 4 a 6 mm de anchura; su peso es de aproximadamente 20 a 25 cgr.
Conformación exterior y relaciones
La glándula pineal clásicamente ha sido comparada a una piña, de ahí su nombre. Se diferencian en ella una parte media o cuerpo, un extremo anterior o base y un extremo posterior o vértice.
1) Cuerpo: el cuerpo, algo aplanado de arriba abajo, es liso o ligeramente granuloso. Está en relación, por arriba, con las venas de Galeno y el rodete del cuerpo calloso; por abajo, con el surco longitudinal que separa los dos tubérculos cuadrigéminos anteriores; por los lados, con los plexos coroideos del ventrículo medio, a los cuales está unido por numerosos tractos conjuntivos o vasculares.
2) Base: la base, dirigida hacia delante, se desdobla en dos laminillas transversales, una superior y otra inferior. Ambas laminillas están separadas entre sí por un surco más o menos profundo que se denomina fondo de saco pineal, que no es más que un simple divertículo del ventrículo medio.
3) Vértice: el vértice de la glándula pineal, dirigido hacia atrás y abajo, flota libremente, por encima de los tubérculos cuadrigéminos, en los espacios subaracnoideos.
Relaciones de la glándula pineal con la tela coroidea
Algunos autores sitúan la glándula pineal entre las dos hojas de la tela coroidea superior; otros autores consideran esta descripción como inexacta y consideran que corresponde exclusivamente a la hoja inferior de la tela y no tiene ninguna relación inmediata con la hoja superior.
Si, en un corte sagital, seguimos de delante hacia atrás la hoja inferior de la tela coroidea, vemos que se inserta en la cara superior de la glándula, tapiza luego sus partes laterales, su vértice y su cara inferior, y se refleja hacia atrás para extenderse por encima de los tubérculos cuadrigéminos. La inserción de la tela coroidea en la cara superior de la glándula pineal se verifica solamente en su tercio inferior o en su tercio posterior, resultando de ello que por encima de la glándula pineal, entre su base y la tela coroidea, existe un nuevo divertículo del ventrículo medio, que tiene forma de fondo de saco: es el fondo de saco suprapineal, el cual está tapizado por el epitelio ependimario.
Conexiones: pedúnculos de la glándula pineal
La glándula pineal está unida al cerebro por un conjunto de fascículos nerviosos que nacen de su base. Estos fascículos, denominados pedúnculos de la glándula pineal, son seis, tres en cada lado, y se distinguen en anteriores, medios e inferiores.
1) Pedúnculos anteriores: parten de la laminilla superior de la base y se dirigen hacia fuera hasta la parte interna de una pequeña región triangular llamada triángulo de la habénula. Se desvían luego hacia delante y siguen el tálamo óptico, donde se les puede seguir por el relieve que forman. En los tálamos ópticos, los pedúnculos anteriores de la glándula pineal ocupan el ángulo que forman sus dos caras superior o interna, y limitan en este punto la cavidad ventricular. Llegados a la extremidad anterior del tálamo óptico, se mezclan con los capilares anteriores del trígono y bajan con ellos a la sustancia gris de la base del cerebro.
2) Pedúnculos medios: nacen, al igual que los anteriores, de la laminilla superior de la base. Están poco desarrollados y son a menudo poco visibles. Se dirigen directamente hacia fuera, siguen el borde superior de la comisura blanca posterior y, después de un trayecto muy corto, desaparecen en el espesor del tálamo óptico.
3) Pedúnculos inferiores: generalmente delgadísimos, se desprenden de la laminilla inferior. Descienden primero por delante de la comisura blanca posterior, se desvían luego hacia afuera y penetran, como los precedentes, en el tálamo óptico, donde terminan.
RECUERDO HISTOLÓGICO2
El desarrollo embrionario de la glándula pineal comienza en la fase precoz de la vida embrionaria. Por entonces, el techo del diencéfalo, detrás de la zona de origen del plexo coroideo del tercer ventrículo, forma prominencia dorsal, constituyendo un divertículo. A medida que el desarrollo prosigue, las paredes del divertículo se hacen más gruesas, de manera que la luz de la excrecencia se oblitera gradualmente.
La excrecencia del techo del diencéfalo que da origen a la glándula pineal contiene dos tipos de células. En primer lugar, el propio techo contiene células neuroectodérmicas; en segundo lugar, la piamadre, que cubre la excrecencia, tiene células mesenquimatosas. Ambos tipos celulares participan en la formación de la glándula pineal. Las células neuroectodérmicas dan origen a las células parenquimatosas que se denominan pinealocitos, y también a las células que suelen considerarse de glía. Las células mesenquimatosas dan origen al tejido conectivo de la cápsula pineal y a los tabiques incompletos que dividen el cuerpo en lobulillos.
Al observar un corte de la glándula pineal pueden verse lobulillos de células parenquimatosas incompletamente separados por tabiques de tejido conectivo, que penetran en el cuerpo desde la cápsula y llevan consigo vasos sanguíneos a la substancia de la glándula. Los dos tipos de células principales que contiene la glándula pineal son los pinealocitos y células de la glía.
Pinealocitos
Son las células más abundantes observadas en la pineal cuando se ve un corte al microscopio de luz; son células relativamente voluminosas, muchas veces agrupadas en cúmulos.
Sus núcleos son voluminosos y tienen una cantidad moderada de cromatina condensada, de manera que sus nucleolos voluminosos son fáciles de observar. Su citoplasma contiene algunos cúmulos de material basófilo, que se ha comprobado se disuelve por acción de la ARNasa.
El citoplasma de los pinealocitos se extiende desde sus cuerpos celulares en forma de prolongaciones, las cuales son muy extensas. Además, el citoplasma de la glía también se extiende saliendo de los cuerpos celulares en forma de prolongaciones. De esta forma, la substancia del cuerpo pineal en muchos lugares está formada por una maraña de cuerpos celulares y de prolongaciones entreveradas de pinealocitos y células de la glía, no pudiendo a veces distinguirse a qué cuerpo celular pertenecen.
Con el microscopio electrónico el citoplasma de los pinealocitos muestra los orgánulos celulares usuales: mitocondrias, centríolos, un complejo de Golgi, algunos cuerpos densos que pueden ser lisosomas, algunas vesículas de retículo endoplásmico liso, y ciertos ribosomas dispuestos como polirribosomas. En el citoplasma, como característica rara, se ven gran número de microtúbulos que tienen de 220 a 300 Å de diámetro. En los cuerpos celulares los microtúbulos están dispuestos al azar, pero en las prolongaciones de los pinealocitos se ven sobre todo paralelamente a la prolongación. Las prolongaciones terminan en los bordes de otros pinealocitos, en células de la glía y en vasos sanguíneos.
Células de la glía
Con el microscopio de luz se reconocen bien por sus núcleos, que están más aplanados y tienen más cromatina condensada que los núcleos de los pinealocitos. Algunos tienen forma más o menos triangular. Muchas veces se observan juntas dos o más de estas células. Su citoplasma es más basófilo que el de los pinealocitos.
Con el microscopio electrónico las células de la glía revelan los orgánulos usuales, incluyendo algunos microtúbulos. Lo característico de su citoplasma es su amplio contenido de filamentos delgados, que tienen de 50 a 60 Å de diámetro y suelen estar dispuestos en haces; filamentos como estos no se observan en los pinealocitos. Los filamentos de las prolongaciones de la célula de la glía siguen paralelamente a dichas prolongaciones, y se insertan como tonofibrillas de las células epiteliales, en placas de fijación, a través de las membranas celulares. Otro carácter en que difieren los orgánulos citoplasmáticos de las células de la glía con respecto a los de los pinealocitos es que las mitocondrias de las células de la glía tienen una matriz mucho más densa que la de los pinealocitos. Las prolongaciones de las células de la glía terminan sobre todo como dilataciones bulbosas en pinealocitos, otras células de la glía o sobre las células que revisten espacios perivasculares. Sus terminaciones muchas veces contienen gran cantidad de glucógeno.
La glándula pineal está bien provista de nervios que penetran en ella siguiendo las trabéculas. Las fibras penetran en la substancia de la glándula, y se han visto terminaciones nerviosas asociadas a los pinealocitos, las células de la glía y los capilares.
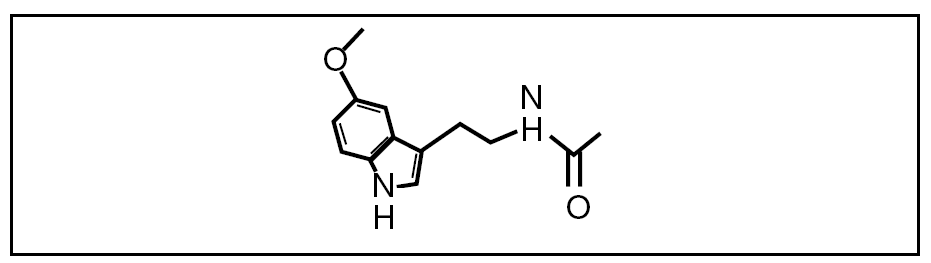
Figura 1. Estructura de la melatonina.
RECUERDO NEUROFISIOLÓGICO
La glándula pineal, situada, como acabamos de mencionar en el apartado anterior, en el epitálamo entre ambos tubérculos cuadrigéminos superiores, recibe información sobre la luz ambiental a través de la vía: retina → núcleos supraquiasmáticos →→ proyecciones descendentes a la columna intermedio lateral cervical →→ ganglios simpáticos cervicales superiores → inervación simpática postganglionar pineal. La función primaria principal de la glándula pineal es la síntesis y secreción de melatonina3.
La melatonina es una neuro-hormona que fue descubierta por el dermatólogo Lerner en 1958 al comprobar que los extractos biológicos preparados a partir de millares de glándulas pineales bovinas producían el aclaramiento de la piel del anfibio Xenopus.
La melatonina se sintetiza a partir del triptófano en las células de la glándula pineal o pinealocitos, por medio de la hidroxilación se transforma en 5-hidroxitriptófano, por la posterior descarboxilación en serotonina, y por la N-acetilación y la O-metilación de la serotonina en melatonina3.
La liberación de melatonina se ve afectada por los mecanismos neuroquímicos que se producen en el sistema nervioso central (SNC) por el ácido gamma-aminobutírico (GABA). Parece ser que al amanecer existe un aumento creciente de la liberación de GABA sobre las neuronas pre-autonómicas del núcleo paraventricular del hipotálamo, lo que da lugar a una disminución de la estimulación de norepinefrina de la glándula pineal, y en última instancia una detención de la liberación de melatonina4.
La acción de la melatonina en el SNC se produce en unos receptores específicos, pero también existen receptores específicos para la melatonina en arterias cerebrales y tejidos periféricos como órganos del sistema inmune, intestino, riñón, glándulas endocrinas y tejido adiposo5.
Los efectos de la melatonina son mediados por la interacción con los receptores MT1 y los receptores MT2. En el receptor MT1 se diferencian tres subtipos, todos pertenecientes a la familia de receptores asociados a la proteína G. Estos receptores son mediadores de la acción inhibitoria de la melatonina sobre la adenilato ciclasa. Como segundos mensajeros de la melatonina sobre los receptores MT2 se especula sobre distintos fosfoinositósidos y derivados del ácido araquidónico (también se especula sobre la posibilidad de un supuesto receptor MT3)6,7. Otros efectos parecen ser debidos a la naturaleza antioxidante que tiene la melatonina8.
FUNCIONES
Hace años se consideraba a la glándula pineal de los mamíferos como un órgano vestigial, resto de una estructura que en una etapa previa del desarrollo de las especies o del individuo servía para un fin particular, pero en la vida posnatal no, teoría avalada porque en la vida intrauterina y prenatal el tamaño de la glándula es mayor, y posteriormente va disminuyendo de tamaño, siendo menor en la vejez.
Hoy día continúa sin estar claro cuáles son las funciones fisiológicas de la glándula pineal. Son muchos los trabajos y estudios realizados para saber las funciones fisiológicas de la glándula y de la melatonina, y parece que son las siguientes9-18:
1) Sincronización circadiana.
2) Promoción del sueño.
3) Regulación de la temperatura corporal.
4) Acción sobre el sistema inmune.
5) Pubertad.
6) Osteogénesis19.
7) Acción metabólica sobre carbohidratos y lípidos20.
8) Efecto protector digestivo21.
9) Efecto sobre los desórdenes psiquiátricos y determinadas enfermedades degenerativas22,23.
DEPRESIÓN
Epidemiología
La depresión es una patología muy frecuente y discapacitante. Según datos recogidos en la encuesta nacional de salud del año 2003, el 3,62% del total de la población padece una depresión24. La prevalencia de los episodios depresivos es del 1,9% en la población masculina y del 3,2% en la femenina25.
Los trastornos depresivos se asocian a una significativa morbilidad, a una disminución del nivel de actividad y a un aumento de días de incapacidad y absentismo laboral, así como a un aumento de la atención sanitaria26.
Definiciones y clasificación27
Los trastornos del estado de ánimo son un conjunto de enfermedades cuyo síntoma fundamental es la alteración del estado de ánimo, y que se acompañan del cortejo sintomático correspondiente (ya sea en el espectro depresivo o maniaco).
El término depresivo se utiliza en tres sentidos:
1) Como síntoma: puede acompañar a otros trastornos psicopatológicos, como los trastornos por angustia.
2) Como síndrome: agrupa una serie de procesos con unos criterios diagnósticos definidos, caracterizados por tristeza, inhibición, culpa, minusvalía y pérdida del impulso vital.
3) Como enfermedad: se observa un trastorno de origen biológico en el que puede delimitarse una etiología clínica, curso, pronóstico y tratamiento específico.
Se han elaborado muchas clasificaciones en función de los diversos parámetros. Actualmente las más utilizadas son la Clasificación de la Asociación Psiquiátrica Americana DSM IV-TR26, y la Clasificación de los Trastornos Mentales y del Comportamiento de la 10ª edición de la clasificación internacional de enfermedades de la Organización Mundial de la Salud (OMS) (CIE-10)28.
Etiopatogenia29,30
Actualmente se desconocen las causas exactas de los trastornos depresivos y se han enunciado distintas teorías etiopatogénicas. Se han involucrado factores genéticos, biológicos y psicosociales; analizaremos los dos primeros pues son los que más nos interesan en este trabajo.
Factores genéticos
La frecuencia con la que los familiares de los individuos depresivos presentan una depresión es tres veces superior a la del resto de la población, y además, también aumenta el riesgo de que padezcan otros trastornos afectivos, como el trastorno bipolar.
Los estudios realizados en gemelos diagnosticados de depresión mayor demuestran que la concordancia encontrada es del 50% en monocigóticos frente al 20% que aparece en los dicigóticos.
Aunque los datos anteriores indican un factor genético, no ha podido ser identificado el patrón de transmisión genética de los trastornos de los estados de ánimo.
Factores biológicos
Se pueden distinguir dentro de este apartado los siguientes:
1) Factores bioquímicos.
2) Factores endocrinológicos.
3) Neuroanatomía y neuroimagen.
4) Fisiopatología y electrofisiología del sueño.
5) Ritmos circadianos.
Factores bioquímicos
En la etiología de los trastornos depresivos se han manejado distintas hipótesis que implican varios neurotransmisores. Actualmente el déficit serotoninérgico y la alteración en los niveles de noradrenalina son los más aceptados.
Serotonina. El ácido 5-hidroxiindolacético (5-HIAA), metabolito de la serotonina, está disminuido en el líquido cefalorraquídeo (LCR) de los pacientes deprimidos y suicidas. En autopsias de suicidas hay una disminución en el número de lugares de captación de serotonina en cerebro y plaquetas. Los inhibidores selectivos de recaptación de serotonina (ISRS) provocarían una hiperactivación de las neuronas, y por lo tanto una disminución en el número de receptores 5-HT2. También está disminuida la actividad de los receptores postsinápticos β-adrenérgicos y de los receptores 5-HT2 en tratamientos antidepresivos en modelos animales. Esto explicaría la latencia de tres semanas del efecto de los antidepresivos.
Noradrenalina. El tratamiento antidepresivo se ha relacionado con una disminución de receptores β-adrenérgicos que se correlaciona con la respuesta clínica a antidepresivos; además estos receptores también pueden actuar modificando la cantidad de serotonina liberada.
Dopamina. En el LCR de pacientes depresivos se encuentra disminuido el ácido homovalínico, que es un metabolito de la dopamina. La dopamina está aumentada en la manía y disminuida en la depresión. Así, sustancias como las anfetaminas, que producen un aumento de dopamina, reducen la sintomatología depresiva, y una disminución de la dopamina, como se produce en los tratamientos con reserpina o en la enfermedad de Parkinson, se relaciona con síntomas depresivos.
Factores endocrinológicos
Las alteraciones endocrinológicas parecen ser más una consecuencia de la alteración de las aminas cerebrales, que una causa de estas. Los ejes más implicados son el tiroideo y el suprarrenal, pero también se han observado otros cambios neuroendocrinos, como son una menor secreción de prolactina después de una administración de triptófano, disminución de la secreción nocturna de melatonina, menor concentración de hormonas folículo estimulantes (FSH) y luteinizantes (LH), disminución de la hormona liberadora de corticotropina (CRH), o de la hormona liberadora de gonadotropinas (GHRH).
Eje hipotálamo-hipofiso-suprarrenal. La depresión se asocia a una hipersecreción de cortisol. En la prueba de supresión de dexametasona, la inhibición en la secreción de cortisol se encuentra disminuida en los pacientes depresivos.
Eje hipotálamo-hipofiso-tiroideo. Un hipo o hipertiroidismo suele asociarse a alteraciones en el estado de ánimo. Es necesario valorar en todos los pacientes con síntomas afectivos el funcionamiento tiroideo. En un tercio de pacientes con depresión mayor y un eje tiroideo normal aparece una respuesta disminuida a la hormona tiroestimulante (TSH), a la administración de hormona liberadora de tirotropina (TRH).
Neuroanatomía y neuroimagen
En estudios con tomografía axial computarizada (TAC) se ha observado en pacientes depresivos un aumento en el tamaño de los ventrículos cerebrales, siendo más frecuente el aumento en los pacientes en los que los síntomas depresivos van acompañados de síntomas psicóticos.
En los estudios con resonancia magnética se observa una disminución del tamaño del núcleo caudado y lóbulos frontales.
Las tomografías por emisión de positrones (PET) y de fotones simples (SPECT) muestran disminución en el metabolismo de la glucosa y del flujo sanguíneo de las citadas áreas. Estas alteraciones son especialmente frecuentes en los pacientes con síntomas psicóticos asociados, y en los que la enfermedad comienza después de los 65 años.
Se piensa que el sistema límbico y los ganglios basales son la base neuroanatómica de la depresión.
Fisiopatología y electrofisiología del sueño
En el estudio electroencefalográfico de los pacientes deprimidos se ha observado un retraso en el inicio del sueño, un sueño de fase δ alterado, y que la primera fase de REM posee una longitud alargada y una patencia (periodo que transcurre entre el inicio del sueño y el comienzo de dicha fase) disminuida. Estas alteraciones se traducen en la clínica como quejas de insomnio de conciliación, despertar precoz, despertares frecuentes a lo largo de la noche o hipersomnia diurna.
Ritmos circadianos
En modelos animales los antidepresivos pueden modificar los relojes biológicos, y la deprivación de sueño produce una mejoría clínica transitoria de la depresión.
ANTIDEPRESIVOS31
Podemos encontrar una clasificación de estos fármacos en la tabla 1.
DEPRESIÓN Y GLÁNDULA PINEAL
Aunque las funciones de la glándula pineal ya han sido mencionadas en el apartado correspondiente, su relación con determinadas patologías y enfermedades es y ha sido motivo de estudio desde hace años; así, ya en los años 50 Ostenfeld32 trató pacientes con depresión mayor deprivando el sueño. Existen múltiples ensayos sobre el efecto de la fototerapia en el tratamiento de los trastornos afectivos estacionales33; Rovescallli et al34 comentan que la relación del ritmo estacional con la ocurrencia de episodios depresivos sugiere la posible implicación de la glándula pineal o de otros osciladores biológicos en la patofisiología de la enfermedad depresiva, y realizan estudios para clarificar si el cambio horario noche-día puede inducir cambios en los blancos bioquímicos de los antidepresivos. Como ya comentábamos anteriormente en las funciones de la melatonina, esta ha sido relacionada con algunas enfermedades neurodegenerativas y trastornos tales como la obesidad, la depresión y otras alteraciones psiquiátricas22,23.
Debido a la relación de la melatonina sobre los estados de ánimo y su posible contribución a los estados depresivos, son variados los estudios realizados sobre el efecto de los antidepresivos sobre la glándula pineal. Pasaremos a revisar algunos de ellos.
En 1976 Parfitt et al35 demostraron que la inyección del metabolito del antidepresivo imipramina, desmetil-imipramina (DMI), provocaba un aumento de actividad N-acetil transferasa (NAT) en la glándula pineal en las ratas intactas, siendo menor en las ratas a las que se les había realizado una extirpación del ganglio cervical superior.
En 1977 Bade et al36 demuestran que la inyección de pargilina (inhibidor de la monoaminooxidasa [IMAO]) aumenta la actividad NAT, y niveló los cambios circadianos en el contenido de serotonina, mientras que los niveles de noradrenalina no se modificaron.
En 1979 Moyer et al37 estudian los efectos del tratamiento agudo y repetido con el DMI en la producción de AMP-c, y los resultados sugieren que, mientras una sola administración de DMI puede realzar respuestas adrenérgicas mediadas por la norepinefrina, la administración crónica de DMI conduce a disminuciones compensatorias de la densidad del receptor y de la sensibilidad adrenérgica. Estos mismos autores, en otro estudio publicado en 198138, además de tratar con el DMI lo hacen con nialamida, llegando a la misma conclusión que en el experimento anterior.
En 1980 Wirz-Justice et al39, tratando ratas con varios antidepresivos, consiguen una elevación de la melatonina en la glándula pineal y en el plasma. Heydorn et al40 comentan que son muchos los efectos farmacológicos de los antidepresivos tricíclicos, y teniendo claro que tienen efectos múltiples sobre las sinapsis aminérgicas, se duda sobre sus mecanismos de acción; plantean cuál es el beneficio neto de todos estos efectos en el resto del proceso de la transmisión, por lo que analizan los efectos de la administración sola y repetida del DMI. La glándula pineal de la rata proporciona una oportunidad de estudiar tal sensibilidad adrenérgica de la glándula pineal porque contiene una alta densidad de receptores β-adrenérgicos y un sistema catecolamínico que responde a la adenil ciclasa capaz de generar el AMP-c. Después de realizar el estudio en animal experimental, obtienen como resultado que las ratas tratadas con DMI tienen un incremento en la concentración de AMP-c en la glándula pineal mayor que los controles.
En 1982 King et al41,42 demuestran que la pargilina aumenta la concentración de melatonina a nivel pineal; ese mismo año Heydorn et al43 demuestran que la administración de DMI y de nialamida produce una disminución de la concentración de melatonina en la glándula pineal anteriormente elevada por el tratamiento con L-isoproterenol o la oscuridad.
En 1983 Mendlewicz44, partiendo del hecho de que en pacientes depresivos existe una alteración de los niveles circadianos de melatonina, considera que podría ser importante medir la concentración de melatonina plasmática en los pacientes depresivos; se ha encontrado que las concentraciones de melatonina son muy variables en pacientes depresivos comparadas con controles de pacientes tratados con antidepresivos, pero no cree que la monitorización de concentraciones plasmáticas de melatonina en pacientes depresivos sea un camino apropiado para diferenciar entre el incremento de la neurotransmisión noradrenérgica beta adrenorreceptor regulada a nivel pineal como efecto final del tratamiento con desipramina.
En 198445 Hsu comenta que la clomipramina, la imipramina y la pargilina inhiben la actividad pineal de aril-acilamidasa (AAA). Friedman et al46, después de tratar de forma aguda y crónica con dos antidepresivos (imipramina, iprindole), sacrificaban al animal experimental en distintas fases del ciclo circadiano y durante distintos periodos de tratamiento midieron las concentraciones de NAT, diohidroalprenolol (DHA) y N-acetil serotonina (NAS) y de melatonina, así como las concentraciones de fármacos y de sus metabolitos en suero, viendo que después de tres días de tratamiento con imipramina no hubo cambios en la concentración de DHA, pero hubo un aumento en la concentración de serotonina pineal y en la NAS y la melatonina. Después de tres semanas de tratamiento con imipramina se observó una disminución de la concentración pineal de DHA, y suprimió la activación oscuro-inducida de la NAT y las concentraciones de NAS y de melatonina, siendo el comportamiento del tratamiento con iprindole algo diferente. Szmigielski et al47 trataron durante 21 días a ratas con imipramina y mianserina y vieron que producía una disminución de la sensibilidad de los receptores β-adrenérgicos situados en el hipocampo, glándula pineal porque tuvieron que utilizar dosis más altas de isoprenalina para bloquear la actividad de dicho receptor.
En 1985 Oxenkrug et al48 sugieren que el estímulo de la síntesis de la melatonina causado por los IMAO puede contribuir a su efecto antidepresivo. Mouren et al49 prueban varios antidepresivos y todos elevan las concentraciones de melatonina plasmática y en la glándula pineal.
En 1986 Ask et al50 trataron ratas con imipramina, zimeldine no tuvieron efecto sobre el contenido pineal de melatonina en las horas de máxima concentración. Friedman et al51 midieron el efecto de la edad y de la imipramina sobre la serotonina cortical y los receptores β-adrenérgicos y la NAS pineal y la melatonina en las ratas, observando que la imipramina indujo una disminución de los indoles en los animales adultos y una reducción en NAS en los animales envejecidos. Murphy et al52 refieren cómo los fármacos antidepresivos y algunos psicotropos afectan la síntesis y la excreción de melatonina por varios mecanismos, variando si el paciente es depresivo. Vaughan et al53 observaron cómo la norepinefrina producía un aumento de melatonina en la pineal del animal experimental y la desipramina tenía un efecto sobre la concentración dependiendo del ciclo o ritmo luz-oscuridad. Moyer et al54 intentaron describir los mecanismos moleculares implicados en la reducción en la sensibilidad noradrenérgica inducida por los antidepresivos, y los efectos de los antidepresivos en el sistema AMP-c dependiente de la actividad proteína cinasa de la glándula pineal, observando que el tratamiento con desipramina la altera y puede alterar el efecto a ese nivel de otros antidepresivos como zimelidine (es un antidepresivo nuevo, estructuralmente sin relación con los antidepresivos tricíclicos), iprindole (es un antidepresivo tricíclico que tiene acciones y aplicaciones similares a la amitriptilina) o fluoxetina. Sack et al55 comentan que la melatonina producida en la glándula pineal es afectada por fármacos con actividad adrenérgica, y los metabolitos de degradación de la melatonina son eliminados por la orina. En este estudio tratan a cuatro pacientes diagnosticados de depresión mayor (DSM-III) con DMI y observan cómo después de varias semanas de tratamiento existe un aumento de los metabolitos de melatonina en orina, sin influir en la concentración de forma estadísticamente significativa el tiempo de tratamiento.
En 1988 Oxenkrug et al56 realizan un estudio con glándulas pineales cultivadas llegando a la conclusión de que los IMAO estimulan la síntesis de melatonina protegiendo la norepinefrina contra la degradación.
En 1989 Wakabayashi et al57 sugieren que los fármacos psicotrópicos (diazepam, clorpromazina, haloperidol, imipramina, amitriptilina, etc.) utilizados extensamente en usos clínicos podrían causar cambios significativos en el contenido pineal de indolamina. Illnerova et al58 vieron el efecto de la fluoxetina sobre la actividad NAT en ratas, donde se alteraba el ritmo circadiano. McIntyre et al59 observaron que el efecto del antidepresivo bupropión en dosis aguda o crónica no tenía efecto relevante sobre la síntesis pineal de melatonina ni sobre las concentraciones de indolamina, concluyendo que el efecto del bupropión sobre los receptores β-adrenérgicos es discutido.
En 1990 Oxenkrug et al60 encontraron que moclobemida, inhibidor selectivo y reversible de la MAO-A, in vitro produce un estímulo muy débil de la actividad NAT pineal de la rata, pero in vivo induce un aumento significativo de la NAS de la rata y del contenido pineal de melatonina, concluyendo que las razones de las discrepancias entre datos humanos y animales se discute. Arushanian et al61 observaron un aumento de actividad del antidepresivo amitriptilina en ratas sometidas a comportamiento forzado después de extirpar el ganglio cervical superior. Yardley et al62 examinaron el efecto sobre la capacidad de inhibir el receptor de imipramina en el cerebro de la rata de una serie de derivados, así como el receptor sináptico de norepinefrina y de serotonina, observando que algunos de ellos, entre los que se encontraba la venlafaxina, posiblemente facilitaban el inicio de acción más rápido del antidepresivo.
En 1991 Arushanian et al63 observaron en ratas pinealectomizadas e intactas la acción de la imipramina sobre el ritmo circadiano.
En 1992 Palazidou et al64 trataron 10 varones sanos con oxaprotiline (inhibidor selectivo del receptor de noradrenalina), determinaron durante varios días las concentraciones de melatonina en plasma, y observaron un aumento después de tres semanas de tratamiento, concluyendo que dicho aumento es debido a una mayor actividad noradrenérgica dentro de la glándula pineal. McNulty et al65 probaron en esta investigación cómo la denervación y el bloqueo crónico del receptor de serotonina previamente bloqueado por la fluoxetina no afecta a los niveles del ácido acético hidroxiindolacético, siendo, pues, una propiedad del pinealocito la desaminación de la serotonina pineal. Kennedy et al66, partiendo del supuesto de que la excreción de melatonina y su metabolito proporciona un índice de actividad noradrenérgica en la glándula pineal, siendo importante en los pacientes depresivos, y durante el tratamiento con desipramina, observaron un aumento de los niveles de melatonina después de una semana de tratamiento, Sin embargo, después de 6 semanas de tratamiento existía una normalización en los niveles, mientras que en los pacientes tratados con adinazolam, benzodiacepina con propiedades antidepresivas, no provocaba dichas alteraciones.
En 1993 Arushanian et al67 vuelven a realizar estudios en ratas sobre el cambio de ritmo circadiano y el efecto de la imipramina sobre animales pinealectomizados.
En 1994 Requitina et al68, tratando con clorgilina a distintos tipos de ratas, estimularon la biosíntesis pineal de melatonina y eliminaron las diferencias en la producción de melatonina observadas entre los distintos grupos. Oxenkrug et al69 refieren que los efectos crónicos sobre la glándula pineal en la biosíntesis de melatonina de los IMAO selectivos irreversibles (clorgilina) o reversibles (moclobemida) podían tener implicaciones clínicas. Reuss et al70 demostraron que la clorgilina produce un aumento de melatonina en ratas masculinas adrenalectomizadas y en ratas simpatectomizadas recién nacidas. Oxenkrug et al71 intentaron corroborar la hipótesis cronofarmacológica del efecto antidepresivo, para lo que utilizaron moclobemida inyectada en distintas fases del ciclo circadiano, y los resultados obtenidos sugieren que la sincronización de la administración del fármaco IMAO-A debe ser considerada en la práctica clínica. Monteleone et al72 realizan un estudio en pacientes sanos para demostrar el efecto de la fluoxetina sobre la secreción de melatonina comparando con pacientes tratados con placebo, no encontrando variaciones estadísticamente significativas.
En 1996 Nathan et al73 intentaron demostrar el efecto sobre la secreción nocturna de determinados fármacos, entre los que se encontraba el antidepresivo paroxetina, llegando a la conclusión de que ningún fármaco tenía un efecto estadísticamente significativo sobre la síntesis nocturna de melatonina, aunque refieren que ello puede ser debido a las limitaciones impuestas por los requisitos de las dosis.
En 1998 Pahkla et al74, basándose en trabajos recientes que demuestran el efecto limpiador de los antioxidantes de la melatonina, comparan el efecto antioxidante de la melatonina con el pinoline (6-metoxi-tetra-hidro-beta-carbolina) formado en el cuerpo de los mamíferos en condiciones fisiológicas a partir de la 5-hidroxitriptamina (5-HT) o como metabolito tricíclico de la melatonina, corroborando el efecto antioxidante de ambos. Debido a que el pinoline en algunos estudios ha demostrado ejercer un efecto antidepresivo y tener baja toxicidad, induce a realizar estudios más a fondo con pinoline para utilizarlo como antidepresivo potencial por su efecto antioxidante, concluyendo que estos resultados fomentan la importancia de la glándula pineal en la protección antioxidante. Nathan et al75 investigan el efecto de algunos agonistas de la serotonina, entre los que se encontraba la paroxetina, en las concentraciones de melatonina en la glándula pineal durante el día y la noche; todos aumentaron la concentración de melatonina durante la noche. Aunque durante el día la paroxetina aumentó la concentración, sin embargo no era estadísticamente significativo. Concluyen que los datos sugieren que las concentraciones sinápticas de serotonina se podrían utilizar para manipular la concentración de melatonina durante el día o la noche, sugiriendo la influencia del subtipo de receptor 5-HT-A en mediar concentraciones nocturnas de melatonina quizás a través de un acoplador funcional β-1-adrenoceptor en la glándula pineal. Oxenkrug et al76 observan en distintos tipos de ratas el efecto sobre los receptores MAO-A del estrés con la frío inmovilización y de la clorgilina, observando que la clorgilina indujo una elevación más alta de melatonina pineal y de NAS en ratas SHR que en ratas WKY. Franklin et al77 refieren que, habiendo sido constatado por otros estudios que el antidepresivo venlafaxina inhibe el receptor de serotonina 5-HT y de noradrenalina pero tiene poca actividad sobre otros receptores del neurotransmisor, hay pocos estudios del efecto de la venlafaxina sobre la neurotransmisión de la monoamina in vivo; en el estudio examinan el efecto del tratamiento con venlafaxina en el contenido de melatonina en la glándula pineal de la rata porque la síntesis de melatonina es regulada por el efecto de la noradrenalina sobre los β-adrenorreceptores del pinealocito, viendo que los tratamientos agudos a dosis altas aumentan de forma creciente la melatonina y la noradrenalina pineal, pero el efecto es atenuado con los tratamientos subcrónicos. Concluyen que los datos son superponibles a los obtenidos in vitro, que sugieren que la venlafaxina aumenta la neurotransmisión de la noradrenalina en dosis altas y que el tratamiento repetido puede desensibilizar los β-adrenorreceptores del pinealocito.
En 1999 Oxenkrug78 realiza un nuevo trabajo para ver el efecto de antidepresivo y antihipertensivo en la inhibición de los receptores MAO-A y el papel desempeñado por la NAS, la administración aguda de IMAO-A selectivos reversibles o irreversibles a dosis altas, o la realizada por la administración crónica de dosis bajas, y realizado por fármacos IMAO-β no selectivos que suprimen también la actividad MAO-A que estimula la N-acetilación de la serotonina pineal en NAS, precursor inmediato de la melatonina. El aumento consiguiente de melatonina es más acentuado en las ratas de 21 días, y el efecto es tensión y sexo dependiente (mayor en ratas hipertensas y mayor en varón que en hembras).
En el año 2001 Miller et al79 comentan que, ante la controversia respecto al papel de los sistemas noradrenérgicos en la determinación de la respuesta clínica a los antidepresivos, y partiendo de que la producción de melatonina por la glándula pineal puede servir como índice fisiológico de la función noradrenérgica, el objetivo de este estudio era examinar los efectos del tratamiento antidepresivo en la excreción urinaria de 24 horas del metabolito principal de la melatonina (6-sulfatoximelatonina) en los respondedores o no respondedores al tratamiento. El estudio se realizó en un grupo de 24 pacientes no internados que cumplían criterios de depresión mayor (DSM-III-R); recibieron tratamiento con fluvoxamina o imipramina durante 6 semanas mientras participaban en un ensayo clínico doble-ciego placebo controlado. La excreción de 6-sulfatoximelatonina fue determinada al comienzo y al final del tratamiento. Los cambios en la excreción de 6-sulfatoximelatonina distinguieron a respondedores de no respondedores, siendo mayor en los respondedores, y el grado de respuesta clínica fue correlacionado con el cambio en la excreción de 6-sulfatoximelatonina. Estos resultados sugieren que la función noradrenérgica realzada pueda desempeñar un papel importante en la determinación de la respuesta clínica al tratamiento antidepresivo.
En 2002 Chardenot et al80 demuestran que determinados tratamientos, benzodiacepinas, neurolépticos como haloperidol, antidepresivos como fluoxetina, imipramina, iproniazida, tranilcipromida, terapia electroconvulsiva tienen acción sobre el receptor ARNm-PRAX-1 situado en una amplia gama de estructuras cerebrales, entre las que se encuentra la glándula pineal.
En 2004 Uz et al81 intentan explicar el efecto ansiogénico paradójico inicial que ocurre en algunos pacientes tratados con fluoxetina. Partiendo del supuesto de que la respuesta del comportamiento de los fármacos psicoactivos pueda ser modificado por la glándula pineal, trataron distintas poblaciones de roedores con fluoxetina. Observaron que la fluoxetina era ineficaz en los ratones pinealectomizados, lo que apunta a la posibilidad de que el sistema pineal contribuya a la acción ansiogénica previamente observada de la fluoxetina en seres humanos.
CONCLUSIONES
1) La glándula pineal y su producto principal, la melatonina, en contra de antiguas creencias, poseen múltiples funciones como son: a) regulación de la sincronización circadiana; b) interviene en la relación del sueño-vigilia; c) termorregulación corporal; d) acción sobre el sistema inmune, pubertad u osteogénesis; e) acción metabólica sobre carbohidratos y lípidos, y f) efecto protector digestivo.
2) La etiopatogenia de la depresión es compleja y son muchos los factores involucrados; la glándula pineal y la melatonina intervienen en los desórdenes psiquiátricos y en determinadas enfermedades degenerativas.
3) Son muchos los efectos y mecanismos de actuación de los antidepresivos sobre el SNC; existen trabajos de investigación que demuestran su acción sobre la glándula pineal.
Correspondencia: J. Polo García.
Centro de Salud de Torrejoncillo.
Correo electrónico: jpolog@semergen.es
Recibido el 11-06-07; aceptado para su publicación el 18-12-07.