en el paciente con COVID-19, el cuadro clínico permite estimar cierta probabilidad pretest de afectación pulmonar, predicción que se incrementa al asociar la ecografía pulmonar. Esta aporta mayor sensibilidad que la radiografía de tórax en la detección de infiltrados y permite predecir el resultado de TC pulmonar patológico. Están descritos los hallazgos característicos de la neumonía por SARS-CoV-2 y se ha relacionado la localización de las lesiones con el pronóstico. Se han publicado pocas experiencias sobre la capacidad pronóstica de la ecografía pulmonar que prescindan de los parámetros de laboratorio de obtención hospitalaria.
Material y métodosmediante un estudio observacional prospectivo, multicéntrico, de muestreo consecutivo, realizado entre abril y julio de 2020, se seleccionaron 263 pacientes adultos que acudieron a urgencias de hospitales españoles por síntomas compatibles con infección respiratoria. Se exploraron 6 campos por pulmón y se describió la presencia o ausencia de líneas B focales, líneas B globales, consolidación parenquimatosa, consolidación subpleural y derrame pleural. A los pacientes se les realizó, en el mismo día, una radiografía de tórax posteroanterior.
Resultadosen la población de estudio predominaron los varones. La principal comorbilidad fueron las neoplasias, seguidas de la enfermedad renal crónica y la cardiopatía isquémica. Fueron más frecuentes los pacientes con resultado positivo para la RT-PCR para SARS-CoV-2 y que precisaron ingreso, y el 8% fallecieron. La radiografía de tórax patológica fue positiva en el 75% de los enfermos, frente a un 94,59% de las ecografías. Los hallazgos más frecuentes fueron las líneas B focales en las zonas R6, R3 y L3. Destaca la especificidad de la consolidación bilateral o el infiltrado parcheado unilateral y, en ecografía, la especificidad de las líneas B globales, de las consolidaciones, tanto pulmonares como subpleurales y el derrame pleural izquierdo.
Conclusionesse ha elaborado un modelo de regresión que incorpora los hallazgos de la ecografía pulmonar y predice la probabilidad de ingreso en los pacientes que acuden a los servicios de urgencias, sin utilizar otras pruebas de laboratorio hospitalario. Se puede elaborar una herramienta que permita al médico de familia identificar a los pacientes con elevada probabilidad de ser hospitalizados, de los que van tener un seguimiento ambulatorio para priorizar un enfoque terapéutico precoz o la derivación a urgencias.
In COVID-19 patients, the clinical picture allows estimating a certain pre-test probability of lung involvement; prediction that increases when associating lung ultrasound. This provides greater sensitivity than chest radiography in the detection of infiltrates, and makes it possible to predict the result of pathological pulmonary CT. The characteristic findings of SARS-CoV-2 pneumonia have been described, and the location of the lesions has been related to the prognosis. Few experiences have been published on the prognostic capacity of lung ultrasound, which do not include hospital-obtained laboratory parameters.
Material and methodsThrough a prospective, multicenter, observational study with consecutive sampling, carried out between April and July 2020, 263 adult patients who attended the emergency department of Spanish hospitals due to symptoms compatible with respiratory infection were recruited. Six fields per lung were explored, and the presence or absence of focal B lines, global B lines, parenchymal consolidation, subpleural consolidation, and pleural effusion were described. The patients underwent a postero-anterior chest X-ray on the same day.
ResultsMales predominated in the study population. The main comorbidity was neoplasms, followed by chronic kidney disease and ischemic heart disease. Patients with a positive result for SARS-CoV-2 RT-PCR and who required admission were more frequent, and 8% died. The pathological chest x-ray was positive in 75% of the patients, compared to 94.59% of the ultrasound scans. The most frequent findings were focal B lines in zones R6, R3, and L3. The specificity of bilateral consolidation or unilateral patchy infiltrate stands out, and in ultrasound the specificity of global B lines, consolidations, both pulmonary and subpleural, and left pleural effusion.
ConclusionsA regression model has been developed that incorporates the findings of the lung ultrasound and predicts the probability of admission in patients presenting to the emergency department, without using other hospital laboratory tests. A tool can be developed that allows the family physician to identify patients with a high probability of being hospitalized from those who will have an outpatient follow-up, to prioritize an early therapeutic approach or referral to the emergency room.
Las enfermedades respiratorias contribuyen en gran medida a la carga de enfermedad mundial. Cinco enfermedades respiratorias (asma, enfermedad pulmonar obstructiva crónica (EPOC), infecciones respiratorias agudas, tuberculosis y cáncer de pulmón) se encuentran entre las principales causas de mortalidad1. El cáncer letal más común en el mundo es el de pulmón, que mata a 1,6 millones de personas cada año2. En 2015, 1.400.000 personas desarrollaron tuberculosis, muriendo 1.400.000 por esta causa2. La neumonía provoca el 14% de las muertes en menores de 5 años, causando la muerte de 740.180 niños en 20193 y originando más de 800.000 ingresos hospitalarios anuales en Estados Unidos4.
En España, la EPOC y el cáncer de pulmón constituyeron la cuarta y quinta causa de mortalidad en 2016, produciendo el 6,9 y el 5,0% de los fallecimientos, respectivamente2. En el año 2019 se produjeron 635.538 ingresos hospitalarios por enfermedades respiratorias, incluyendo tumores5.
Desde diciembre de 2019, la pandemia por el virus SARS-CoV-2 ha impactado de manera notable en la salud de la población mundial. El 13 de diciembre de 2023 se habían confirmado 772.138.818 casos de COVID-19, causando un total de 6.985.964 fallecimientos en todo el mundo6.
En España, en esa misma fecha, se habían registrado 13.980.340 casos y 121.852 fallecimientos6. En 2020 las enfermedades del aparato respiratorio fueron la principal causa de hospitalización (12,4% del total).
Respecto al impacto de la pandemia por COVID-19 en la atención primaria de nuestro país, disponemos de datos indirectos. Se ha estimado que durante la primera ola, de un millón de afectados por un cuadro clínico compatible con COVID-19 y sin test microbiológico, 900.000 constituyeron cuadros leves y fueron atendidos en atención primaria7. La labor de vigilancia epidemiológica mediante el rastreo de casos se realizó desde los centros de salud, y esta se solapó con la tarea asistencial (en el centro de salud y en el domicilio de los pacientes) y con el seguimiento de pacientes realizado fundamentalmente de manera no presencial, lo que sobrecargó la atención primaria8,9.
NeumoníaLa neumonía adquirida en la comunidad (NAC) es una enfermedad aguda causada por una infección del parénquima pulmonar adquirida fuera del ámbito hospitalario. Esta definición excluye la neumonía intrahospitalaria10.
Desde el punto de vista epidemiológico, constituye una de las principales causas mundiales de morbimortalidad en pacientes inmunocompetentes e inmunocomprometidos11. Constituye la primera causa de muerte por infección y continúa siendo un problema de salud muy relevante, con una incidencia anual de 2–5 adultos por cada 1.000 habitantes12,13.
Diagnóstico por imagenEl diagnóstico de NAC generalmente requiere la identificación de un infiltrado radiológico en un paciente con un síndrome clínicamente compatible (p. ej., fiebre, disnea, tos y producción de esputo)14:
A la mayoría de los pacientes se les realiza radiografía de tórax posteroanterior y lateral. Los hallazgos radiológicos NAC incluyen: consolidaciones lobares, infiltrados intersticiales y/o cavitaciones, que no son exclusivos de la neumonía y pueden corresponder a otras enfermedades, que deberemos considerar en función de la evolución del paciente (insuficiencia cardíaca congestiva con edema pulmonar, tromboembolismo pulmonar, hemorragia pulmonar, atelectasias, neumonitis química o aspirativa, reacciones a fármacos, tumores pulmonares, colagenopatías, vasculitis, exacerbación de bronquiectasias o neumopatías intersticiales).
Si la sospecha clínica es elevada, a pesar de una radiografía normal, como puede ocurrir en pacientes inmunodeprimidos o en pacientes con exposición conocida a patógenos respiratorios, se realiza una tomografía computarizada (TC) de tórax. También está indicada cuando el paciente no experimenta mejoría clínica a pesar del tratamiento y para evaluar posibles complicaciones, como derrames pleurales o abscesos pulmonares15.
La ecografía pulmonar en el estudio de la neumonía se está convirtiendo en una técnica cada vez más utilizada en varios entornos16. Ha demostrado una elevada sensibilidad en el diagnóstico de las consolidaciones neumónicas, superior a la radiografía de tórax, permitiendo una menor exposición a radiaciones ionizantes17–19. Además, en el seguimiento de pacientes con neumonía, permite observar la evolución desde la consolidación, que persiste con menor tamaño a los 7 días y muestra una resolución completa a los 14 días20.
Dado que en la mayoría de los casos la neumonía afecta el tejido pulmonar periférico, las vías respiratorias periféricas y los alvéolos están inundados por un exudado rico en neutrófilos que desplaza al aire del tejido afectado, dando lugar a artefactos que permiten la evaluación ecográfica, si la lesión se extiende hasta la pleura16.
Se han definido criterios ecográficos para la NAC. Entre los criterios parenquimatosos, destacan la presencia de broncogramas aéreo y líquido positivos, a menudo dependientes de la respiración, lesiones bilaterales en el 10–15% de los casos y alveolograma fluido superficial. El papel de las líneas B en el diagnóstico de la neumonía es controvertido, si bien está aceptado que se pueden encontrar en neumonía intersticial. Existe una buena correlación entre la presencia de estos criterios y hallazgos patológicos en la TC pulmonar durante el seguimiento16.
Neumonía por SARS-CoV-2Sabemos que la manifestación más grave de la COVID-1921 es la neumonía22. Una vez realizado el diagnóstico microbiológico mediante la detección de antígenos víricos o mediante la RT-PCR (prueba de referencia), nos debemos plantear, en función de los signos y síntomas que presente el paciente, sus factores de riesgo y comorbilidades, su abordaje23.
En el contexto epidemiológico reciente por la pandemia de COVID-19, el uso de la ecografía pulmonar se ha generalizado, permitiendo, mediante un menor uso de las radiaciones ionizantes19,24, clasificar a los pacientes covid positivos en fenotipos de afectación pulmonar según la ecografía25, detectar infiltrados con mayor sensibilidad que la radiografía de tórax26,27 y predecir la positividad de una prueba RT-PCR para SARS-CoV-225. La ecografía ha aportado información sobre la topografía de las lesiones, la gravedad de la afectación pulmonar, la necesidad de oxigenoterapia28 o ventilación mecánica, e incluso la mortalidad29. La aplicación de una escala de gravedad ecográfica pulmonar en pacientes con sospecha de COVID-19 ha permitido la estratificación del riesgo de los pacientes derivados a los servicios de urgencias hospitalarios30,31, se correlacionó con una mayor probabilidad de derivación hospitalaria correcta y con una mayor gravedad en la radiografía de tórax32. Sin embargo, se han publicado pocas experiencias33 sobre la capacidad pronóstica de la ecografía pulmonar que no asocien los métodos de diagnóstico exclusivamente hospitalarios.
Objetivo: describir las lesiones y su localización en los pacientes con neumonía COVID-19 mediante la realización de ecografía pulmonar, y explorar su capacidad para predecir la evolución clínica de los pacientes.
Material y métodosSelección de pacientesMediante un estudio observacional prospectivo, multicéntrico, de muestreo consecutivo, realizado entre abril y julio de 2020, se seleccionaron 263 pacientes que acudieron a las urgencias de los siguientes centros hospitalarios: Hospital Comarcal Sierrallana (Torrelavega-Cantabria), Hospital San Eloy (Barakaldo-Bizkaia), Hospital Universitario San Agustín (Avilés), Hospital Santa María (Lleida), Hospital Clínico Universitario de Valladolid, Hospital de Santa Bárbara (Puertollano-Ciudad Real), Hospital General Nuestra Señora del Prado (Talavera de la Reina-Toledo) y Hospital Universitario de A Coruña (A Coruña).
Criterios de inclusiónPacientes de edad igual o superior a 18 años, que acudieron a un servicio de urgencias hospitalarias por tos, fiebre y/o dificultad respiratoria, y que presentaban saturación de oxígeno por pulsioximetría o gasometría arterial menor o igual al 94% sin suplemento de oxígeno.
Criterios de exclusión- ○
Pacientes menores de 18 años.
- ○
Pacientes en situación terminal con pronóstico estimado menor de 6 meses de vida.
- ○
Pacientes que hayan sido derivados a la unidad de cuidados intensivos.
Los investigadores del estudio eran médicos de los servicios de urgencias de dichos centros, miembros del grupo de trabajo de ecografía de la sociedad científica SEMES (Sociedad Española de Medicina de Urgencias y Emergencias), con formación en ecografía y experiencia de al menos 5 años de uso de la ecografía en su práctica clínica habitual.
Se obtuvo la aprobación del comité de ética de los respectivos hospitales participantes. Se elaboró un documento de consentimiento informado y un formulario para la recogida de datos.
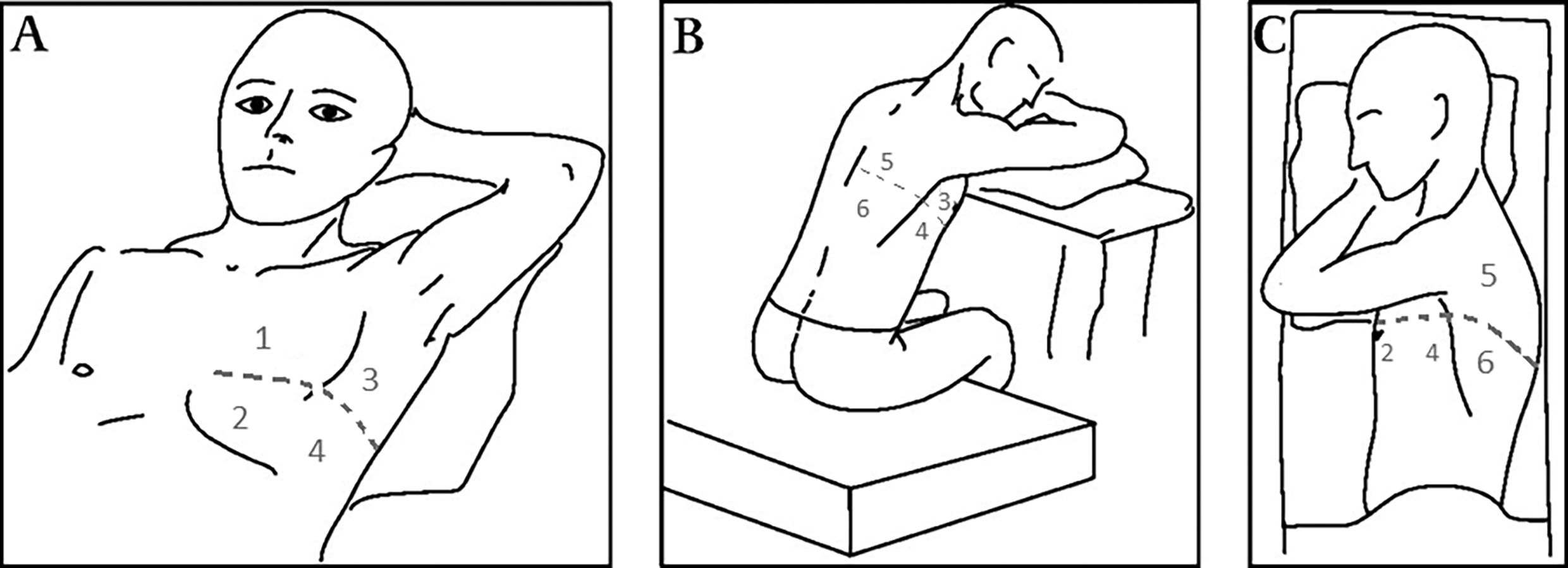
Las ecografías pulmonares fueron realizadas con los pacientes en posición de decúbito supino a 45 grados, con sonda convexa de baja frecuencia (1–6 MHz), configuración pulmonar. Se definieron 6 campos de exploración por pulmón, delimitados por el esternón, la línea axilar anterior, la línea axilar posterior y la columna vertebral, de modo que en cada paciente se exploraron 2 campos anterosuperiores, 2 anteroinferiores, 2 laterales superiores, 2 laterales inferiores, 2 posterosuperiores y 2 posteroinferiores denominados según R1-R2-R3-R4-R5-R6 en el lado derecho, y L1-L2-L3-L4-L5-L6 en el izquierdo, de manera similar a lo realizado por otros autores24,34 y según la recomendación para el diagnóstico y el seguimiento35. En la figura 136 se identifican las áreas de exploración mediante ecografía pulmonar, anteriores, laterales y posteriores de cada hemitórax.
Ilustración de las 6 zonas por hemitórax exploradas en el estudio. Adaptado de Havelock et al.36.
Para cada una de las 6 zonas pulmonares, se describió la presencia o ausencia de líneas B focales (definidas como más de 3 líneas en la imagen explorada), líneas B globales (más de 4 líneas confluyentes)37, consolidación parenquimatosa, consolidación subpleural y la presencia o ausencia de derrame pleural.
A los pacientes se les realizó, en el mismo día, una radiografía de tórax posteroanterior. En función de los hallazgos, se registraron la presencia o ausencia de infiltrado intersticial unilateral, bilateral, consolidación unilateral, bilateral, e infiltrado parcheado unilateral o bilateral.
Se registraron, además, las siguientes variables de cada paciente durante las 3 primeras horas de su estancia en el servicio de urgencias: edad y sexo, días de evolución hasta la visita a urgencias, temperatura, tensión arterial, pulsioximetria, frecuencia respiratoria, resultado de la RT-PCR para SARS-CoV-2, creatinina sérica y tasa de filtrado glomerular, PCR y hemoglobina. Se registró, además, la presencia o no de comorbilidades como obesidad, diabetes, insuficiencia renal, cardiopatía isquémica, EPOC o neoplasia activa. Por último, se registraron, en su caso, el ingreso en la planta y su duración, y el fallecimiento.
Análisis estadísticoSe analizaron las características demográficas de los pacientes. Para la edad, se calcularon la mediana y el rango intercuartílico. Para el sexo, las frecuencias y su intervalo de confianza. Se calcularon las frecuencias de las comorbilidades y su intervalo de confianza y, de igual modo, el resultado de la RT-PCR para SARS-CoV-2, y los eventos «ingreso en planta» y «fallecimiento».
A continuación, se analizaron los parámetros clínicos de los pacientes, en función de su resultado para la RT-PCR, habiéndose comprobado la homogeneidad de ambos grupos. Para las variables cuantitativas (edad, días de evolución y días de ingreso), se calculó la U de Mann–Whitney; la W de Wilcoxon, la prueba Z de 2 muestras y el nivel de significación basado en la distribución asintótica. Para las variables cualitativas se realizó la prueba de chi-cuadrado.
Se realizó el análisis cuantitativo de los parámetros clínicos de los pacientes, divididos según su resultado para la RT-PCR, destacándose la medida que mejor expresaba la tendencia central y la dispersión en cada variable.
Se analizaron la sensibilidad, especificidad, valor predictivo positivo, valor predictivo negativo de la radiografía de tórax y la ecografía, en conjunto y de manera independiente, según los hallazgos por zonas pulmonares.
Para la ecografía pulmonar se identificaron, con base en el análisis de frecuencias, las zonas pulmonares que presentan hallazgos de manera predominante.
Se exploró la capacidad de ambas pruebas diagnósticas para identificar poblaciones con lesiones pulmonares, mediante la prueba de chi-cuadrado de Pearson.
Por último, se realizó una regresión logística para explorar la capacidad de la ecografía pulmonar, asociada a variables clínicas, para predecir el ingreso hospitalario o el fallecimiento.
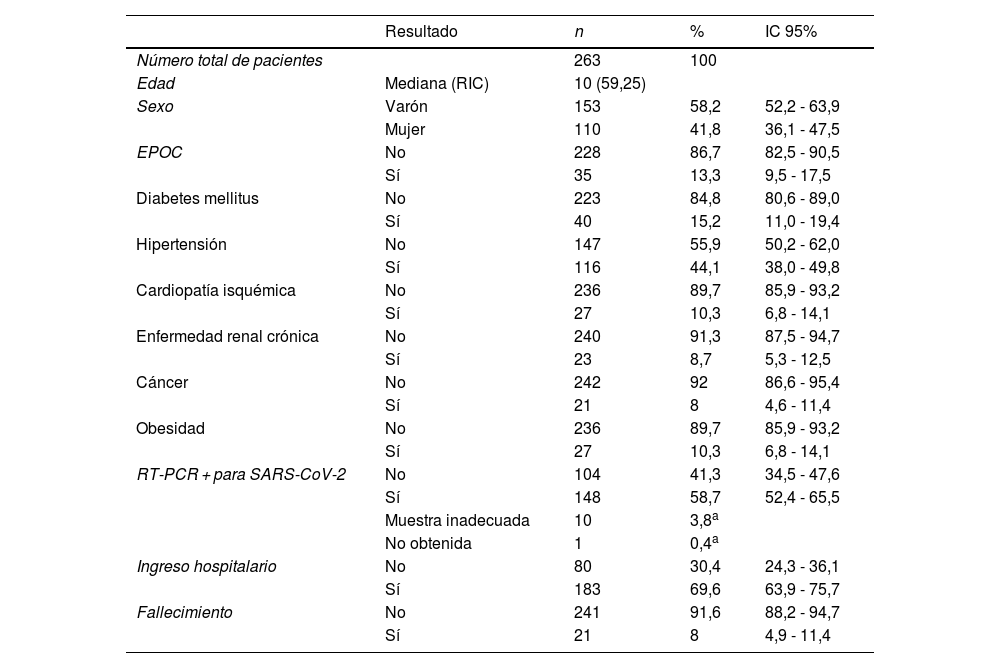
ResultadosEn la tabla 1 se muestran las características demográficas y las comorbilidades de la población de estudio. Se observa un ligero predominio de hombres sobre las mujeres. La principal comorbilidad de los pacientes han sido las neoplasias, seguidas de la enfermedad renal crónica y la cardiopatía isquémica. Han predominado los pacientes con resultado positivo para la RT-PCR para SARS-CoV-2 y que han precisado ingreso hospitalario. El 8% han fallecido.
Características demográficas y comorbilidades
| Resultado | n | % | IC 95% | |
|---|---|---|---|---|
| Número total de pacientes | 263 | 100 | ||
| Edad | Mediana (RIC) | 10 (59,25) | ||
| Sexo | Varón | 153 | 58,2 | 52,2 - 63,9 |
| Mujer | 110 | 41,8 | 36,1 - 47,5 | |
| EPOC | No | 228 | 86,7 | 82,5 - 90,5 |
| Sí | 35 | 13,3 | 9,5 - 17,5 | |
| Diabetes mellitus | No | 223 | 84,8 | 80,6 - 89,0 |
| Sí | 40 | 15,2 | 11,0 - 19,4 | |
| Hipertensión | No | 147 | 55,9 | 50,2 - 62,0 |
| Sí | 116 | 44,1 | 38,0 - 49,8 | |
| Cardiopatía isquémica | No | 236 | 89,7 | 85,9 - 93,2 |
| Sí | 27 | 10,3 | 6,8 - 14,1 | |
| Enfermedad renal crónica | No | 240 | 91,3 | 87,5 - 94,7 |
| Sí | 23 | 8,7 | 5,3 - 12,5 | |
| Cáncer | No | 242 | 92 | 86,6 - 95,4 |
| Sí | 21 | 8 | 4,6 - 11,4 | |
| Obesidad | No | 236 | 89,7 | 85,9 - 93,2 |
| Sí | 27 | 10,3 | 6,8 - 14,1 | |
| RT-PCR + para SARS-CoV-2 | No | 104 | 41,3 | 34,5 - 47,6 |
| Sí | 148 | 58,7 | 52,4 - 65,5 | |
| Muestra inadecuada | 10 | 3,8a | ||
| No obtenida | 1 | 0,4a | ||
| Ingreso hospitalario | No | 80 | 30,4 | 24,3 - 36,1 |
| Sí | 183 | 69,6 | 63,9 - 75,7 | |
| Fallecimiento | No | 241 | 91,6 | 88,2 - 94,7 |
| Sí | 21 | 8 | 4,9 - 11,4 | |
EPOC: enfermedad pulmonar obstructiva crónica.
aEstos valores se consideran perdidos.
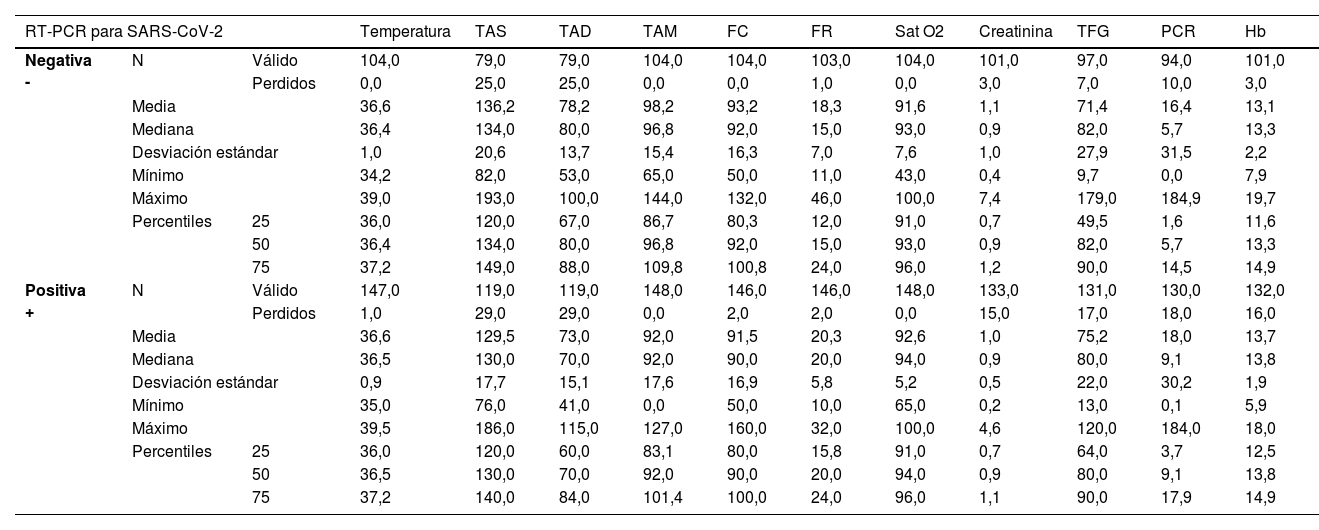
Se analizaron los parámetros clínicos de los pacientes del estudio en función de su resultado para la RT-PCR, concluyendo que no existe homogeneidad en cuanto a los días de evolución entre los pacientes positivos y negativos. Con respecto a la edad, sexo, los desenlaces ingreso, la duración de este y el fallecimiento, las muestras pertenecen a poblaciones similares. En la tabla 2 se muestran los parámetros clínicos de los pacientes de estudio. Se observa que, en ambos grupos de estudio, los valores de tendencia central se encuentran dentro de rango, excepto la saturación de O2. La desviación estándar ilustra la presencia de valores patológicos de presión arterial, frecuencia respiratoria, la saturación de O2 y hemoglobina.
Parámetros clínicos de los pacientes incluidos en el estudio
| RT-PCR para SARS-CoV-2 | Temperatura | TAS | TAD | TAM | FC | FR | Sat O2 | Creatinina | TFG | PCR | Hb | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Negativa - | N | Válido | 104,0 | 79,0 | 79,0 | 104,0 | 104,0 | 103,0 | 104,0 | 101,0 | 97,0 | 94,0 | 101,0 |
| Perdidos | 0,0 | 25,0 | 25,0 | 0,0 | 0,0 | 1,0 | 0,0 | 3,0 | 7,0 | 10,0 | 3,0 | ||
| Media | 36,6 | 136,2 | 78,2 | 98,2 | 93,2 | 18,3 | 91,6 | 1,1 | 71,4 | 16,4 | 13,1 | ||
| Mediana | 36,4 | 134,0 | 80,0 | 96,8 | 92,0 | 15,0 | 93,0 | 0,9 | 82,0 | 5,7 | 13,3 | ||
| Desviación estándar | 1,0 | 20,6 | 13,7 | 15,4 | 16,3 | 7,0 | 7,6 | 1,0 | 27,9 | 31,5 | 2,2 | ||
| Mínimo | 34,2 | 82,0 | 53,0 | 65,0 | 50,0 | 11,0 | 43,0 | 0,4 | 9,7 | 0,0 | 7,9 | ||
| Máximo | 39,0 | 193,0 | 100,0 | 144,0 | 132,0 | 46,0 | 100,0 | 7,4 | 179,0 | 184,9 | 19,7 | ||
| Percentiles | 25 | 36,0 | 120,0 | 67,0 | 86,7 | 80,3 | 12,0 | 91,0 | 0,7 | 49,5 | 1,6 | 11,6 | |
| 50 | 36,4 | 134,0 | 80,0 | 96,8 | 92,0 | 15,0 | 93,0 | 0,9 | 82,0 | 5,7 | 13,3 | ||
| 75 | 37,2 | 149,0 | 88,0 | 109,8 | 100,8 | 24,0 | 96,0 | 1,2 | 90,0 | 14,5 | 14,9 | ||
| Positiva + | N | Válido | 147,0 | 119,0 | 119,0 | 148,0 | 146,0 | 146,0 | 148,0 | 133,0 | 131,0 | 130,0 | 132,0 |
| Perdidos | 1,0 | 29,0 | 29,0 | 0,0 | 2,0 | 2,0 | 0,0 | 15,0 | 17,0 | 18,0 | 16,0 | ||
| Media | 36,6 | 129,5 | 73,0 | 92,0 | 91,5 | 20,3 | 92,6 | 1,0 | 75,2 | 18,0 | 13,7 | ||
| Mediana | 36,5 | 130,0 | 70,0 | 92,0 | 90,0 | 20,0 | 94,0 | 0,9 | 80,0 | 9,1 | 13,8 | ||
| Desviación estándar | 0,9 | 17,7 | 15,1 | 17,6 | 16,9 | 5,8 | 5,2 | 0,5 | 22,0 | 30,2 | 1,9 | ||
| Mínimo | 35,0 | 76,0 | 41,0 | 0,0 | 50,0 | 10,0 | 65,0 | 0,2 | 13,0 | 0,1 | 5,9 | ||
| Máximo | 39,5 | 186,0 | 115,0 | 127,0 | 160,0 | 32,0 | 100,0 | 4,6 | 120,0 | 184,0 | 18,0 | ||
| Percentiles | 25 | 36,0 | 120,0 | 60,0 | 83,1 | 80,0 | 15,8 | 91,0 | 0,7 | 64,0 | 3,7 | 12,5 | |
| 50 | 36,5 | 130,0 | 70,0 | 92,0 | 90,0 | 20,0 | 94,0 | 0,9 | 80,0 | 9,1 | 13,8 | ||
| 75 | 37,2 | 140,0 | 84,0 | 101,4 | 100,0 | 24,0 | 96,0 | 1,1 | 90,0 | 17,9 | 14,9 | ||
FC: frecuencia cardíaca; FR: frecuencia respiratoria; TAS: tensión arterial sistólica; Hb: hemoglobina; PCR: proteína C-reactiva; TAD: tensión arterial diastólica; TAM: tensión arterial media;TFG:tasa de filtrado glomerular; RT-PCR: reaccion en cadena de la polimerasa mediante transcriptasa inversa.
La sensibilidad (S), especificidad (E), valor predictivo positivo (VPP) y valor predictivo negativo (VPN) de ambas pruebas de imagen para la detección de infiltrados, con respecto al patrón de oro, la RT-PCR para SARS-CoV-2 fue, con sus respectivos intervalos de confianza, de 75 (68,82), 46 (37,56), 66 (59,74) y 56 (46,67) para la radiografía de tórax; y de 95 (91,98), 6 (1,10), 59 (53,65) y 43 (17,69) para la ecografía pulmonar.
Con respecto a la validez de cada hallazgo aislado, destaca la especificidad de la consolidación bilateral o el infiltrado parcheado unilateral (de manera que la ausencia de estos permite excluir con elevada probabilidad la afectación pulmonar). En cuanto a la ecografía pulmonar patológica (al menos un hallazgo patológico en una de las 6 zonas pulmonares), fue positiva en el 94,59% de los enfermos con RT-PCR para SARS-CoV-2 positiva, sin que ninguno de los hallazgos patológicos presentara por separado una sensibilidad similar, pero destacando la especificidad de las líneas B globales, las consolidaciones pulmonares y subpleurales, y el derrame pleural izquierdo.
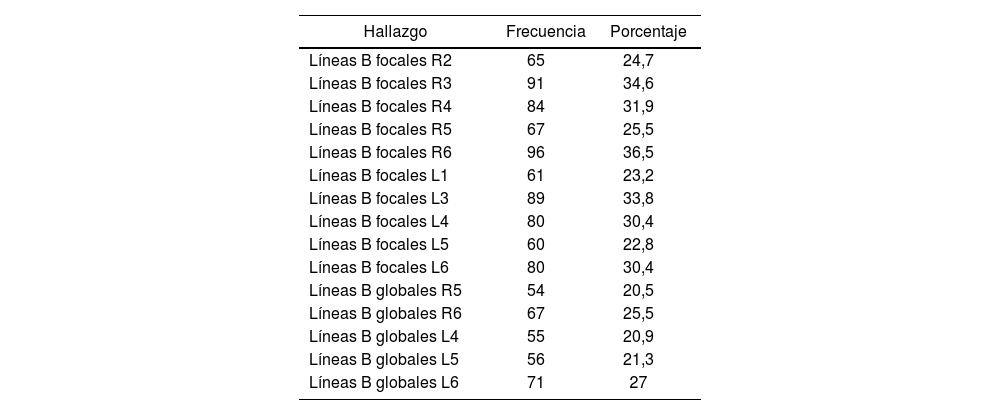
Hemos identificado las zonas pulmonares que de manera predominante han presentado hallazgos en la ecografía pulmonar. Destacan las líneas B focales en la zona R6, seguido por líneas B focales en la zona R3 y en la zona L3 (tabla 3).
Hallazgos en la ecografía pulmonar
| Hallazgo | Frecuencia | Porcentaje |
|---|---|---|
| Líneas B focales R2 | 65 | 24,7 |
| Líneas B focales R3 | 91 | 34,6 |
| Líneas B focales R4 | 84 | 31,9 |
| Líneas B focales R5 | 67 | 25,5 |
| Líneas B focales R6 | 96 | 36,5 |
| Líneas B focales L1 | 61 | 23,2 |
| Líneas B focales L3 | 89 | 33,8 |
| Líneas B focales L4 | 80 | 30,4 |
| Líneas B focales L5 | 60 | 22,8 |
| Líneas B focales L6 | 80 | 30,4 |
| Líneas B globales R5 | 54 | 20,5 |
| Líneas B globales R6 | 67 | 25,5 |
| Líneas B globales L4 | 55 | 20,9 |
| Líneas B globales L5 | 56 | 21,3 |
| Líneas B globales L6 | 71 | 27 |
L1: zona pulmonar izquierda 1; L3: zona pulmonar izquierda 3; R2: zona pulmonar derecha 2; R3: zona pulmonar derecha 3.
Se realizó, además, un contraste de hipótesis mediante el test de chi-cuadrado de Pearson entre ambas pruebas diagnósticas. Se encontraron diferencias estadísticamente significativas para la radiografía de tórax patológica, como variable agrupada, y también para el infiltrado intersticial bilateral, y los infiltrados parcheados unilateral y bilateral. En la ecografía pulmonar patológica como variable agrupada, no se encontraron diferencias estadísticamente significativas, pero sí para hallazgos como las líneas B focales en R3, R4, líneas B globales en R1-R4, R6, en L1-L4 y L6, la presencia de consolidación pulmonar derecha en R2 y R4, izquierda en L6, consolidación subpleural en R3, L3, y el derrame pleural derecho.
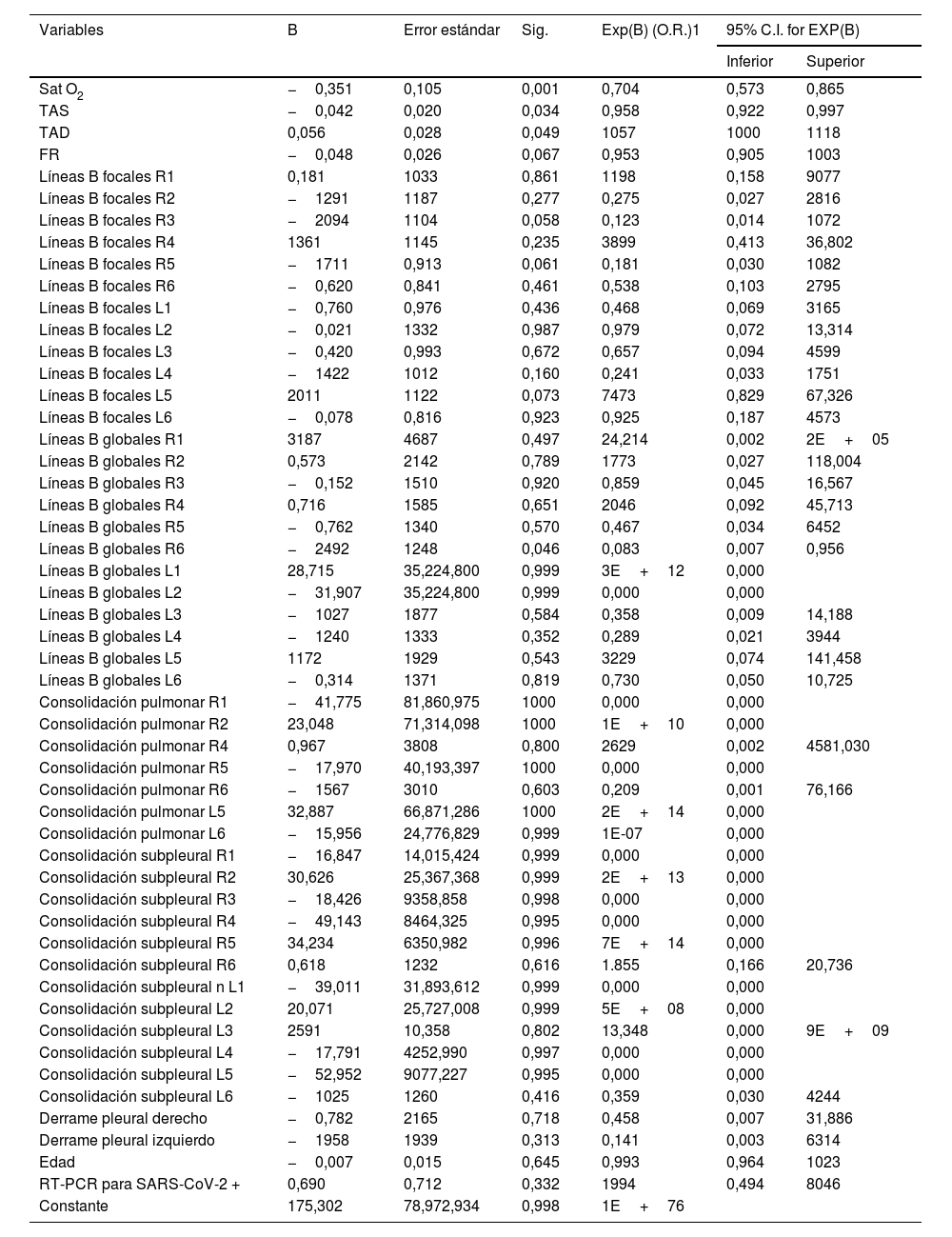
Implicaciones pronósticasSe integró la información de la ecografía pulmonar en un modelo para predecir la hospitalización de los pacientes, asociada a parámetros clínicos que no fueran de obtención hospitalaria. Se elaboró una regresión logística que explica el comportamiento de la variable dicotómica «ingreso hospitalario» en los pacientes que acudían a los servicios de urgencias. La ecuación se puede consultar en la figura 2, y en la tabla 4 se detallan los componentes del modelo.
P(ingreso) = 11 + exp. (−175,302 + 0,351*SatO2 + 0,042*TAS-0,056*TAD+0,048*FC + 0,007*Edad −0,690*RT-PCR SARS-CoV-2 + Σlesiones 12 zonas).
donde «Σ lesiones 12 zonas» constituye el sumatorio de:
0,181 *Líneas B focales R1 + 129060016486824*Líneas B focales R2 + 209416421074771*Líneas B focales R3 + 136076081942497*Líneas B focales R4 + 171052003927168*Líneas B focales R5 + 0,620,295,860,997,982*Líneas B focales R6 + 0,760,139,729,278,911*Líneas B focales L1 + 0,0214865823846529*Líneas B focales L2 + 0,419,984,091,104,229*Líneas B focales L3 + 142247886067366*Líneas B focales L4–201127545358623*Líneas B focales L5 + 0,078*Líneas B focales L6 +.
−3187*Líneas B globales R1–0,573*Líneas B globales R2 + 0,152*Líneas B globales R3–0,716*Líneas B globales R4 + 0,762*Líneas B globales R5 + 2492*Líneas B globales R6 + −28,715*Líneas B globales L1 + 31,907*Líneas B globales L2 + 1027*Líneas B globales L3 + 1240*Líneas B globales L4–1172*Líneas B globales L5 + 0,314*Líneas B globales L6 +.
41,775*Consolidación pulmonar R1–23,048*Consolidación pulmonar R2–0.967*Consolidación pulmonar R4 + 17,970*Consolidación pulmonar R5 + 1567*Consolidación pulmonar R6 + −32,887*Consolidación pulmonar L5 + 15,956*Consolidación pulmonar L6 + 16,847*Consolidación subpleural R1–30,626*Consolidación subpleural R2 + 18,426*Consolidación subpleural R3 + 49,143*Consolidación subpleural R4–34,234*Consolidación subpleural R5–0,618*Consolidación subpleural R6 + 39,011*Consolidación subpleural L1–20,071*Consolidación subpleural L2–2591*Consolidación subpleural L3 + 17,791*Consolidación subpleural L4 + 52,952*Consolidación subpleural L5 + 1025*Consolidación subpleural L6 + 0,782*Derrame Pleural Derecho +1958*Derrame Pleural Izquierdo.
Modelo de regresión logística para la probabilidad de ingreso hospitalario en pacientes SARS-CoV-2+
| Variables | B | Error estándar | Sig. | Exp(B) (O.R.)1 | 95% C.I. for EXP(B) | |
|---|---|---|---|---|---|---|
| Inferior | Superior | |||||
| Sat O2 | −0,351 | 0,105 | 0,001 | 0,704 | 0,573 | 0,865 |
| TAS | −0,042 | 0,020 | 0,034 | 0,958 | 0,922 | 0,997 |
| TAD | 0,056 | 0,028 | 0,049 | 1057 | 1000 | 1118 |
| FR | −0,048 | 0,026 | 0,067 | 0,953 | 0,905 | 1003 |
| Líneas B focales R1 | 0,181 | 1033 | 0,861 | 1198 | 0,158 | 9077 |
| Líneas B focales R2 | −1291 | 1187 | 0,277 | 0,275 | 0,027 | 2816 |
| Líneas B focales R3 | −2094 | 1104 | 0,058 | 0,123 | 0,014 | 1072 |
| Líneas B focales R4 | 1361 | 1145 | 0,235 | 3899 | 0,413 | 36,802 |
| Líneas B focales R5 | −1711 | 0,913 | 0,061 | 0,181 | 0,030 | 1082 |
| Líneas B focales R6 | −0,620 | 0,841 | 0,461 | 0,538 | 0,103 | 2795 |
| Líneas B focales L1 | −0,760 | 0,976 | 0,436 | 0,468 | 0,069 | 3165 |
| Líneas B focales L2 | −0,021 | 1332 | 0,987 | 0,979 | 0,072 | 13,314 |
| Líneas B focales L3 | −0,420 | 0,993 | 0,672 | 0,657 | 0,094 | 4599 |
| Líneas B focales L4 | −1422 | 1012 | 0,160 | 0,241 | 0,033 | 1751 |
| Líneas B focales L5 | 2011 | 1122 | 0,073 | 7473 | 0,829 | 67,326 |
| Líneas B focales L6 | −0,078 | 0,816 | 0,923 | 0,925 | 0,187 | 4573 |
| Líneas B globales R1 | 3187 | 4687 | 0,497 | 24,214 | 0,002 | 2E+05 |
| Líneas B globales R2 | 0,573 | 2142 | 0,789 | 1773 | 0,027 | 118,004 |
| Líneas B globales R3 | −0,152 | 1510 | 0,920 | 0,859 | 0,045 | 16,567 |
| Líneas B globales R4 | 0,716 | 1585 | 0,651 | 2046 | 0,092 | 45,713 |
| Líneas B globales R5 | −0,762 | 1340 | 0,570 | 0,467 | 0,034 | 6452 |
| Líneas B globales R6 | −2492 | 1248 | 0,046 | 0,083 | 0,007 | 0,956 |
| Líneas B globales L1 | 28,715 | 35,224,800 | 0,999 | 3E+12 | 0,000 | |
| Líneas B globales L2 | −31,907 | 35,224,800 | 0,999 | 0,000 | 0,000 | |
| Líneas B globales L3 | −1027 | 1877 | 0,584 | 0,358 | 0,009 | 14,188 |
| Líneas B globales L4 | −1240 | 1333 | 0,352 | 0,289 | 0,021 | 3944 |
| Líneas B globales L5 | 1172 | 1929 | 0,543 | 3229 | 0,074 | 141,458 |
| Líneas B globales L6 | −0,314 | 1371 | 0,819 | 0,730 | 0,050 | 10,725 |
| Consolidación pulmonar R1 | −41,775 | 81,860,975 | 1000 | 0,000 | 0,000 | |
| Consolidación pulmonar R2 | 23,048 | 71,314,098 | 1000 | 1E+10 | 0,000 | |
| Consolidación pulmonar R4 | 0,967 | 3808 | 0,800 | 2629 | 0,002 | 4581,030 |
| Consolidación pulmonar R5 | −17,970 | 40,193,397 | 1000 | 0,000 | 0,000 | |
| Consolidación pulmonar R6 | −1567 | 3010 | 0,603 | 0,209 | 0,001 | 76,166 |
| Consolidación pulmonar L5 | 32,887 | 66,871,286 | 1000 | 2E+14 | 0,000 | |
| Consolidación pulmonar L6 | −15,956 | 24,776,829 | 0,999 | 1E-07 | 0,000 | |
| Consolidación subpleural R1 | −16,847 | 14,015,424 | 0,999 | 0,000 | 0,000 | |
| Consolidación subpleural R2 | 30,626 | 25,367,368 | 0,999 | 2E+13 | 0,000 | |
| Consolidación subpleural R3 | −18,426 | 9358,858 | 0,998 | 0,000 | 0,000 | |
| Consolidación subpleural R4 | −49,143 | 8464,325 | 0,995 | 0,000 | 0,000 | |
| Consolidación subpleural R5 | 34,234 | 6350,982 | 0,996 | 7E+14 | 0,000 | |
| Consolidación subpleural R6 | 0,618 | 1232 | 0,616 | 1.855 | 0,166 | 20,736 |
| Consolidación subpleural n L1 | −39,011 | 31,893,612 | 0,999 | 0,000 | 0,000 | |
| Consolidación subpleural L2 | 20,071 | 25,727,008 | 0,999 | 5E+08 | 0,000 | |
| Consolidación subpleural L3 | 2591 | 10,358 | 0,802 | 13,348 | 0,000 | 9E+09 |
| Consolidación subpleural L4 | −17,791 | 4252,990 | 0,997 | 0,000 | 0,000 | |
| Consolidación subpleural L5 | −52,952 | 9077,227 | 0,995 | 0,000 | 0,000 | |
| Consolidación subpleural L6 | −1025 | 1260 | 0,416 | 0,359 | 0,030 | 4244 |
| Derrame pleural derecho | −0,782 | 2165 | 0,718 | 0,458 | 0,007 | 31,886 |
| Derrame pleural izquierdo | −1958 | 1939 | 0,313 | 0,141 | 0,003 | 6314 |
| Edad | −0,007 | 0,015 | 0,645 | 0,993 | 0,964 | 1023 |
| RT-PCR para SARS-CoV-2 + | 0,690 | 0,712 | 0,332 | 1994 | 0,494 | 8046 |
| Constante | 175,302 | 78,972,934 | 0,998 | 1E+76 | ||
En la columna B están representados los coeficientes. 1: Odds ratio.
Sat O2: saturación de oxígeno; FR: frecuencia respiratoria; TAS: tensión arterial sistólica; TAD: tensión arterial diastólica
En el análisis del modelo se calculó el valor de 97,939 como E–2 (logaritmo de la verosimilitud) o desviación, para conocer el ajuste del modelo a los datos, siendo mejor cuando más pequeño fuera el valor38. Por otro lado, para explorar la proporción de variancia de la variable ingreso hospitalario explicada por las variables predictoras, se calculó la R cuadrado de Cox y Snell, cuyos valores oscilan entre 0 y 1, siendo el valor de 0,524; este cálculo ha sido mejorado por la R cuadrado de Nagelkerke, que corrige la escala para cubrir el rango de 0 a 1, y constituye el coeficiente de mayor relevancia39, siendo de 0,736 en nuestro caso. Esto implica que las variables independientes o predictoras explican el 73,6% de la variancia de la variable dependiente en nuestro estudio. Por último, se calculó mediante una tabla de contingencia la prueba de Hosmer y Lemeshow para evaluar la bondad del ajuste del modelo de regresión, mostrándose bastante similitud entre los valores esperados y observados.
Como se puede ver en la tabla 4, podría ser cuestionable la inclusión de algunas variables del modelo relacionadas con las lesiones ecográficas, dado su error estándar, los valores de Odds Ratio o el intervalo de confianza de este. Sin embargo, al excluirlas del modelo, su capacidad predictiva sobre la variable dependiente disminuye de 73,6 a 33,8%.
Este modelo de regresión logística permite, por tanto, predecir con un 73,6% de probabilidad, si un paciente covid positivo va a ser hospitalizado, basándose en los valores de saturación de O2, presión arterial, frecuencia cardíaca y la presencia de lesiones en 12 zonas pulmonares valoradas mediante ecografía.
DiscusiónEn este estudio, partimos de una población con cierto predominio masculino y comorbilidades que acudió a urgencias hospitalarias por sintomatología respiratoria. A su llegada, presentaban parámetros clínicos cerca del rango de la normalidad. Sin embargo, estos pacientes tenían en su mayoría lesiones pulmonares, identificables tanto mediante radiografía de tórax como ecografía pulmonar. La mayoría fueron hospitalizados y el 8% fallecieron.
Mediante una regresión logística hemos podido predecir con un 73,6% la probabilidad de ingreso, teniendo en cuenta los hallazgos de la ecografía pulmonar, asociados a la edad, a las constantes vitales y al resultado de genética molecular. Al extraer del modelo la información de la ecografía, disminuyó drásticamente la capacidad predictiva, lo que nos permitió descartar esta prueba de imagen como variable de confusión. Sin embargo, este modelo no fue suficiente para predecir la probabilidad de fallecimiento, lo que nos sugiere que hay más factores pronósticos que no se han considerado en el estudio.
Este modelo predictivo puede tener utilidad en la atención primaria, donde se dispone de la información obtenida en la exploración física, de RT-PCR (de diagnóstico hospitalario) y de las imágenes obtenidas mediante ecografía pulmonar. Se puede elaborar una herramienta que de manera sencilla y sistemática permita al médico de familia identificar a los pacientes con elevada probabilidad de ingreso hospitalario, de los que no van a ser hospitalizados, para priorizar un enfoque terapéutico precoz o la derivación a urgencias hospitalarias.
LimitacionesSe trata de un estudio multicéntrico que ha obtenido datos de distintos hospitales de la geografía española. Entre ellos, existe variabilidad en cuanto a la prevalencia del coronavirus.
Derivado de lo primero, existe variabilidad interoperador, ya que las ecografías fueron realizadas por personas distintas en cada hospital.
Dada la limitada sensibilidad y especificidad de las pruebas de laboratorio, existe la posibilidad de falsos positivos o falsos negativos en las pruebas de RT-PCR para SARS-CoV-2, lo que puede haber derivado en resultados erróneos derivados de la asignación de pacientes a ambos grupos de estudio (positivos y negativos).
El modelo de regresión logística planteado puede estimar erróneamente la probabilidad de ingreso hospitalario en el 26,4% de los casos, lo que puede conducir a decisiones equivocadas en el manejo del paciente. Creemos que la historia clínica y la exploración física siguen siendo primordiales en la obtención de información y en la toma de decisiones. Además, la experiencia del médico y la interconsulta a otro facultativo pueden ayudar a minimizar este error.
Responsabilidades éticasEl estudio ha sido revisado y aprobado por los comités de ética de los respectivos hospitales participantes.
Los datos de los pacientes han sido utilizados con estricta confidencialidad, siguiendo las regulaciones locales e internacionales de protección de datos. La información personal de los pacientes ha sido anonimizada para garantizar su privacidad.
Consentimiento informadoTodos los pacientes incluidos en el estudio dieron su consentimiento informado por escrito antes de participar. Se les proporcionó información detallada sobre los objetivos, procedimientos y posibles riesgos del estudio.
FinanciaciónEste estudio no ha recibido financiación específica de agencias de los sectores público, comercial o sin fines de lucro.
Contribuciones de los autoresTodos los autores han contribuido significativamente al diseño del estudio, la recolección y análisis de los datos, así como a la redacción del manuscrito. Todos los autores han leído y aprobado la versión final del manuscrito y acuerdan su envío para publicación.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses financiero o personal que pueda haber influido en el trabajo reportado en este manuscrito.
Originalidad y publicación duplicadaConfirmamos que el contenido del presente manuscrito es original y no ha sido publicado previamente ni está en consideración para publicación en otro lugar.