La hipertensión arterial maligna puede presentarse en forma de insuficiencia renal aguda grave, raramente acompañada de microangiopatía trombótica renal. Siendo difícil diferenciarla de otros procesos similares como el síndrome hemolítico urémico atípico, cuyo tratamiento difiere sustancialmente. La discrepancia se genera con respecto a la activación del complemento, siendo transitoria o permanente bajo un contexto genético. Presentamos el caso de una paciente que debuto con hipertensión arterial maligna asociado a una microangiopatía trombótica e insuficiencia renal aguda grave.
Malignant arterial hypertension can present in the form of severe acute kidney injury, rarely accompanied by renal thrombotic microangiopathy. It is difficult to differentiate it from other similar processes such as atypical hemolytic uremic syndrome; whose treatment differs substantially. The discrepancy is generated with respect to complement activation, being transitory or permanent under a genetic context. We present the case of a patient who debuted with malignant arterial hypertension associated with thrombotic microangiopathy and severe acute kidney injury.
La hipertensión arterial maligna (HTAm) (cifras elevadas de presión arterial y la realización de un fondo de ojo con datos de retinopatía hipertensiva grado III o IV) puede presentarse en forma de fracaso renal aguda (FRA) grave, raramente acompañada de microangiopatía trombótica (MAT) renal, ocasionado por daño endotelial. Las MAT son un grupo de enfermedades caracterizadas por anemia hemolítica microangiopática, trombocitopenia y afectación de órgano diana. La patología de la MAT glomerular se caracteriza por trombos en los capilares glomerulares, tumefacción endotelial, mesangiólisis y acumulación subendotelial de material celular y esponjoso con una formación de doble contorno. Siendo difícil diferenciarla de otros procesos similares como el síndrome hemolítico urémico atípico (SHUa), cuyo tratamiento difiere sustancialmente. La investigación del complemento en la patogenia del SHUa y otras MAT ha permitido el desarrollo de terapias para bloquear la vía alternativa del complemento. Eculizumab es el primer anticuerpo monoclonal que bloquea el componente C5 del complemento, aprobado para el tratamiento de la hemoglobinuria paroxística nocturna y el SHUa. La discrepancia se genera con respecto a la activación del complemento, siendo transitoria o permanente bajo un contexto genético. Presentamos el caso de una paciente que debutó con HTAm asociado a una MAT y FRA.
Descripción del casoMujer 61 años de raza negra con hipertensión arterial (HTA) mal controlada con la combinación de antagonistas de los receptores de angiotensina II (ARA II) e hidroclorotiazida, diabetes mellitus tipo 2, dislipidemia, obesidad grado 2 y enfermedad renal crónica (ERC) categoría G3b-4/A3 según las guías KDIGO (Kidney Disease: Improving Global Outcomes) del 20121, sin seguimiento estricto por nefrología. En febrero del 2020 presentaba creatinina (Cr) sérica de 2,5 mg/dl con filtrado glomerular estimado (FGe) por CKD-EPI de 23,5 ml/min/1,73 m2 y proteinuria de 1 g/24 h. Acude a urgencias por clínica de 15 días de evolución por astenia, anorexia, náuseas, vómitos; y 72 h previas con cefalea global intensa. En la exploración presentó confusión, bradipsiquia, tensión arterial 250/180 mmHg, sin edemas en los miembros inferiores ni signos de focalidad neurológica. El fondo del ojo con retinopatía hipertensiva grado III-IV. En la analítica destaca: Cr de 5,8 mg/dl sin datos de anemia hemolítica microangiopática (AHM) ni esquistocitos en frotis de sangre periférica (tabla 1). Sedimento urinario con microhematuria y proteinuria 3+ en tira reactiva. Ecografía: riñones de pequeño tamaño (RI 9,4 cm y RD 9 cm), con mala diferenciación córtico medular sin apreciar dilatación del sistema colector.
Hallazgos de laboratorio al ingreso hospitalario.
| Valores de referencia/unidades | ||
|---|---|---|
| Leucocitos | 9.800 | 103/l |
| Hemoglobina | 11,3 | 12-16 g/dl |
| Plaquetario | 168 | 103/ul |
| Conteo reticulocitario | 2,77 | 2-4% |
| Haptoglobina | 58 | 30-200 mg/dl |
| Lactato deshidrogenasa | 503 | 135-214 IU/l |
| Actividad de ADAMTS-13 | 55 | 40-124% |
| Test Coombs | Negativo | NA |
| Bilirrubina total | 0,53 | 0,1-1 mg/dl |
| Proteínas totales | 5,9 | 6,4-8,7 g/dl |
| Albumin serica | 2,6 | 3-5,5 g/dl |
| GOT | 18 | 5-32 IU/l |
| GPT | 19 | 5-33 IU/l |
| Urea | 139 | 17-60 mg/dl |
| Creatinina | 5,83 | 0,6-1,2 mg/dl |
| Na | 141 | 135-145 mmol/l |
| K | 4,8 | 3,5-5,5 mmol/l |
| Cl | 102 | 95-110 mmol/l |
| PCR | 2,51 | 0,1-0,5 mg/dl |
| Ag-HBs | Negativo | NA |
| Anti-VHC | Negativo | NA |
| VIH | Negativo | NA |
| Niveles CFI | 42,83 | 15-50 U/ml |
| Niveles CFH | 9,39 | 12-56 mg/dl |
| Ac. anti-FH | Negativo | < 18 AU/l |
| Ensayo hemolitico de regulación vía alternativa del complemento | Negativo | NA |
| Niveles de C3-Nef | Negativo | Ratio > 1.022 |
| Niveles de C3 | 124 | 90-180 mg/dl |
| Niveles de C4 | 37,5 | 10-40 mg/dl |
| Niveles MCP/PMN | 89 | 70-109% control |
| ANA, anti-DNAd, ANCA y crioglobulinas | Negativo | NA |
| Anti-MBG | Negativo | < 1 AI |
| FR | Negativo | < 15 IU/ml |
| Ac anti-PLA2R (ELISA) | Negativo | NA |
| IgG | 1.070 | 800-1600 mg/dl |
| IgA | 179 | 70-400 mg/dl |
| IgM | 107 | 90-180 mg/dl |
| Cociente albúmina/creatinina (ACR) | 666,38 | < 0,03 g/gCr |
| Micro-hematuria | 10-15 | /CAP |
| Proteinuria | 0,86 | g/24 h |
| Electroforesis sérica | Distribución policlonal Igs | Negativo g/l |
| Inmunofijación sérica/orina | Negativo | NA |
| Cortisol sérico | 8,6 | 4,8-19,5 μg/dl |
| Renina concentración | 20,19 | mUI/l |
| Niveles séricos de aldosterona | 424 | pg/ml |
| Cociente aldosterona/renina | 2,10 | 0-2,5 |
| Metanefrinas urinaria | 0,11 | 0-1 mg/24 h |
| Ácido 5-hidroxiindolacético | 2,4 | 2-6 mg/24 h |
| Ácido vanil-mandelico urinaria | 2,82 | 0-13,6 mg/24 h |
| Resumen de mutaciones (panel estudio genético 14 genes-SHUa) | ||
| CFHR1,2,3,4,5: No se detectan | C3: No se detectan | CFI: No se detectan |
| MCP: No se detectan | CFB: No se detecan | THBP No se detectan |
| DGKE: No se detectan | CFP: No se detectan | ADAMTS13: No se detectan |
Ac: anticuerpos; AI: index de actividad; Ag-HBs: antígeno de superficie de la hepatitis B; anti-VHC: anticuerpo contra la hepatitis C; anti-PLA2R-Ab: anticuerpo anti-receptor de fosfolipasa A2; anti-DNAds: anticuerpo anti-DNA doble cadena; anti-MBG: anti-membrana basal glomerular; ANA: anticuerpos antinucleares; ANCA: auto anticuerpo citoplasmático antineutrófilo; CAP: campo de alta potencia; CFH: factor H; CFHR: factores relacionados con factor H; CFI: factor I; CFP: factor P; C3-Nef: factor nefrítico C3; DGKE: Diacyl glycerolquinasa; ELISA: ensayo por inmunoabsorción ligado a enzimas; FR: factor reumatoideo; Ig: inmunoglobulinas; MCP: por sus siglas en inglés «Membrane Cofactor Protein»; NA: no aplicable; PMN: células polimorfonucleares; THBP: trombomodulina; VIH: virus de la inmunodeficiencia humana.
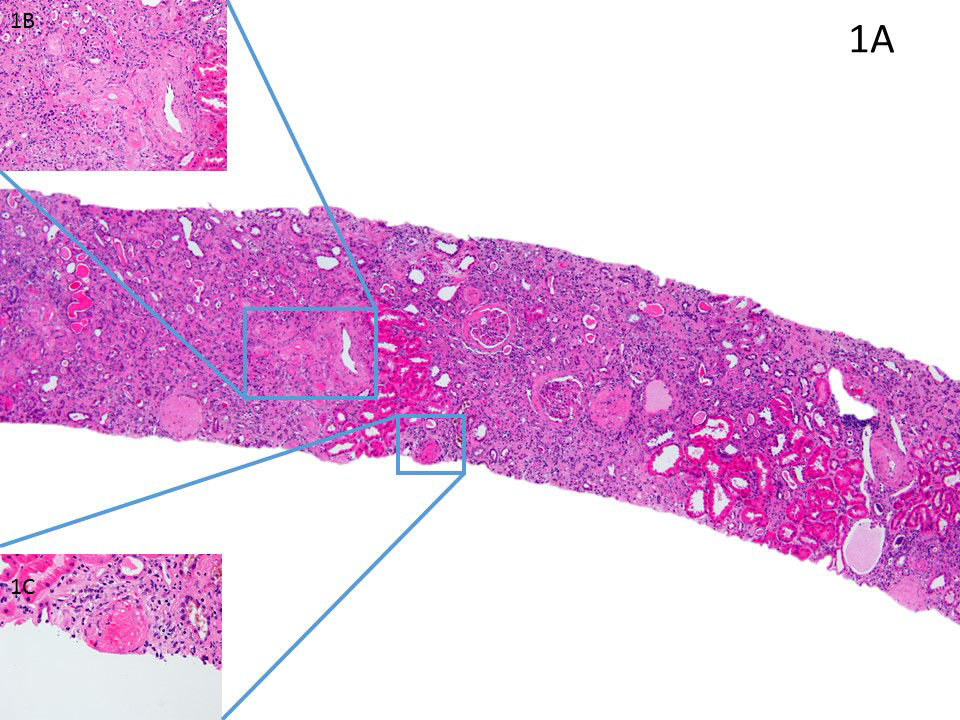
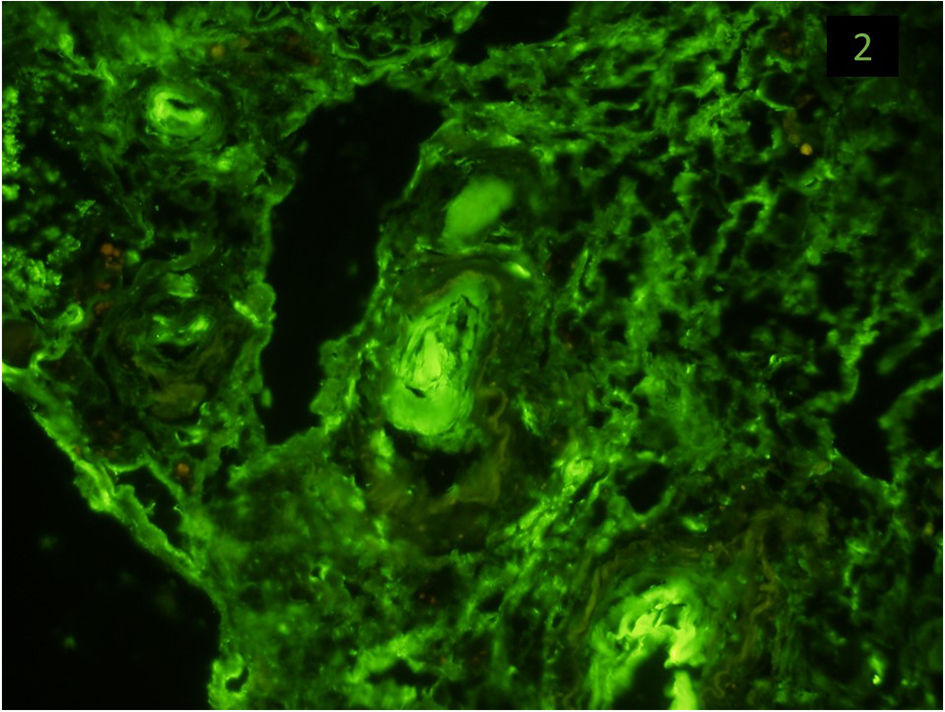
Se inició tratamiento con perfusión de solinitrina, urapidilo y furosemida con mejoría parcial de las cifras tensionales, posteriormente en la planta de hospitalización se pautaron diuréticos del asa, antagonistas del calcio, bloqueador alfa y ARAII, con progresiva mejoría tensional. Al cuarto día, la Cr empeoró hasta 7,2 mg/dl, a pesar de mantener diuresis adecuada, se inició hemodiálisis. El estudio de ADAMTS-13, inmunidad, factor reumatoideo y complemento (C3 y C4) fueron normales. Serología de VHB, VHC y VIH negativos. La electroforesis e inmunofijación en sangre y orina no detectó paraproteínas monoclonales. Las catecolaminas y metanefrinas en orina no presentaron alteraciones. Los valores de renina, aldosterona y cortisol no estaban alterados (tabla 1). La biopsia renal mostró un total de 8 glomérulos, de los cuales 5 estaban esclerosados globalmente. Los 3 restantes mostraron un ensanchamiento mesangial leve compatible con glomeruloesclerosis diabética. Histológicamente, las principales lesiones se observaron en arteriolas y pequeñas arterias; estas mostraban hipertrofia concéntrica con imágenes en «piel de cebolla» e hialinización con obliteración luminal casi total (fig. 1 A-C), así como trombos recientes que se tiñeron positivamente para fibrinógeno (fig. 2). El intersticio mostró intensos cambios fibróticos. La inmunofluorescencia directa no mostró depósitos glomerulares (fig. 2).
Tinción de fibrinógeno positiva en los trombos mencionados en la figura 1.
El estudio de la vía alternativa del complemento mostró niveles disminuidos del factor H con anticuerpos anti-factor H y ensayo hemolítico de regulación negativos (tabla 1). Ante la sospecha de una HTAm con MAT mediada por complemento (SHUa), se administraron 4 dosis de eculizumab 900 mg/semanal. Ante la ausencia de recuperación de la función renal y al obtener los resultados negativos del estudio genético del complemento, se suspendió el bloqueo del completo y fue incluida en el programa crónico de hemodiálisis.
DiscusiónEn recientes estudios se evidencia la baja frecuencia de presentación de MAT renal (5-12%) en los pacientes con HTAm secundaria a otras etiologías2–4, siendo una rara manifestación del cuadro hipertensivo. Mientras que la HTAm es altamente prevalente (30-35%) en los pacientes con SHUa primario, ocasionado por una isquemia yuxtaglomerular y la activación del sistema renina-angiotensina. Sin embargo, los pacientes con HTAm y MAT secundaria pueden presentar mutaciones en los genes del complemento que regulan la vía alternativa y por tanto encuadrarse dentro del diagnóstico de SHUa primario como una forma de MAT mediada por complemento, pero se desconoce si estos eventos son transitorios o permanentes. Porello es trascendental el estudio genético del complemento, ante una sospecha de una alteración genética adicional no identificada en la actualidad o bien por factores ambientales (infecciones, fármacos, embarazo, etc.) que activen este proceso. La identificación de mutaciones de proteínas reguladoras solubles (factor H, B e I) y de membrana, permiten establecer un pronóstico sobre el éxito de un posible trasplante renal en los individuos afectos.
Zhan et al.5, proporcionan nuevos paradigmas sobre las interacciones entre HTAm, MAT y SHUa. Hace referencia a la identificación oportuna de aquellos pacientes con HTAm y SHUa, que requieren una terapia dirigida. Sin embargo, este estudio y otros6, no proporcionan datos claros sobre el beneficio transitorio del bloqueo de la vía alternativa del complemento (eculizumab), independientemente de la causa subyacente de la MAT, debido a que no se puede determinar si la activación del complemento puede disminuir rápidamente tras la corrección tensional, en los casos de HTAm secundaria a otras etiologías. Pero plantea una cuestión interesante en la terminología de la clasificación de los pacientes con MAT e HTAm, en quienes la desregulación genética del complemento es subsecuentemente documentada, incluyendo el término de nefroangioesclerosis maligna mediada por complemento.
En consonancia con este tema pero en población pediátrica con lupus, Tseng et al.7 investigaron el papel de las mutaciones genéticas responsables de la activación del sistema del complemento en los pacientes con nefropatía lupica (NL) y MAT renal. Ellos observaron en 3 pacientes con mutaciones en los genes que regulan la vía del complemento que a pesar de haber recibido terapia de intercambio plasmático (TIP) para corregir los niveles séricos bajos del factor H, I y ADAMTS-13, 2 de ellos fallecieron por hemorragia intracraneal y sepsis, y el otro desarrolló una ERC terminal. Ellos concluyen que la corrección temporal e insuficiente de la TIP para proporcionar los factores funcionales implicados en esta alteración, podrían generar una recurrencia o estado asintomático de la activación del complemento después de esta terapia. Por ello, con estos hallazgos destacan el uso del bloqueo del complemento como agente terapéutico en los pacientes con NL y MAT renal con desregulación del complemento.
Nosotros concluimos que ante un caso de MAT renal e HTAm sin datos de AHM y alteración de uno de los componentes de la vía alternativa del complemento sin afectación del estudio genético, debería plantearse como una forma específica de SHUa de mal pronóstico ocasionada por una alteración transitoria del sistema del complemento, siendo el bloqueo de la vía alternativa en este supuesto una opción terapéutica con potenciales beneficios.
Responsabilidades éticasEl estudio cumplió con los principios enunciados en la declaración de Helsinki. Los autores declaran que en este artículo no aparecen datos del paciente y que para esta investigación no se realizaron experimentos en seres humanos ni en animales.
FinanciaciónLos autores declaran no contar con ningún tipo de financiación para el estudio.
Conflicto de interesesLos autores declaran no tener conflictos de intereses.