Buenas prácticas en metodología científica en salud
Más datosUna primera clasificación de los objetivos de un estudio clínico sería si queremos «intervenir» para cambiar el futuro de los pacientes o si, más modestos, solo pretendemos anticiparlo, «predecirlo». Esta división tal vez sea un poco simple, pero está robustamente cimentada. Para intervenir necesitamos una relación de causa-efecto entre nuestra acción y su resultado. Pero predecir, sólo se requiere asociación entre 2 variables. Usemos un ejemplo extremo: que alguien lleve tabaco encima anticipa un mal futuro, quizás con cáncer o enfisema. Que esa persona deje de llevar tabaco, pero siga fumando a expensas de otros, no mejorará su futuro.
En ambos escenarios se necesita «medir». Si queremos intervenir, para cuantificar la magnitud del efecto: ¿cuánto más viven los que dejan de fumar? Y si queremos predecir, para conocer su capacidad para discriminar: ¿cuánta información sobre la variable «respuesta» anticipa la variable predictora?
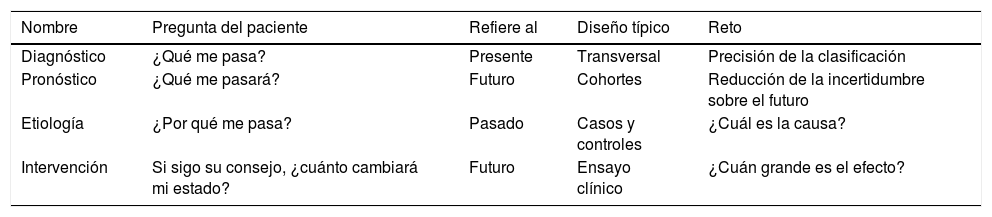
La pregunta clínica de relevanciaA partir de aquí, podemos ampliar esta clasificación. Desde el punto de vista del paciente, un estudio diagnóstico responde la pregunta «¿qué tengo?»; un estudio pronóstico, «¿qué me va a pasar?»; un estudio etiológico, «¿por qué me pasa esto?»; y uno de intervención, «si sigo su consejo, ¿cuánto cambiará mi estado?». Estas 4 preguntas refieren a distintos momentos del tiempo. Diagnóstico es la única sobre el presente; las otras 3 requieren un lapso de tiempo, o bien desde el pasado —etiología—, o bien hacia el futuro —pronóstico e intervención—. La tabla 1 esquematiza el reto estadístico de estos 4 objetivos clínicos y su diseño más habitual. Poco a poco los iremos explicando en estas píldoras. Hagamos ahora un primer resumen.
Objetivo clínico, pregunta del paciente, momento del tiempo al que refiere, diseño habitual y reto metodológico
| Nombre | Pregunta del paciente | Refiere al | Diseño típico | Reto |
|---|---|---|---|---|
| Diagnóstico | ¿Qué me pasa? | Presente | Transversal | Precisión de la clasificación |
| Pronóstico | ¿Qué me pasará? | Futuro | Cohortes | Reducción de la incertidumbre sobre el futuro |
| Etiología | ¿Por qué me pasa? | Pasado | Casos y controles | ¿Cuál es la causa? |
| Intervención | Si sigo su consejo, ¿cuánto cambiará mi estado? | Futuro | Ensayo clínico | ¿Cuán grande es el efecto? |
Como la pregunta del diagnóstico refiere al presente, es «instantánea» y sus estudios se conocen como transversales («cross-sectional»). Al resto, que requieren que pase un tiempo entre la observación de las variables, les llamamos longitudinales. El diseño más habitual para estudiar el pronóstico es el de cohortes. Para la etiología, el de casos y controles. Y para la intervención, el ensayo clínico aleatorizado. El ensayo clínico y el estudio de cohortes siguen la línea temporal de los acontecimientos («el efecto es posterior a la causa»), mientras que el de casos y controles supone una mirada hacia el pasado.
Pero recordemos un principio básico: asociación no implica causalidad. Un estudio que haya podido observar una relación no debe ser utilizado para defender la existencia de un efecto a partir de una supuesta causa.
Importancia de las guías de publicaciónCada objetivo requiere su diseño y su análisis, lo que ha generado diferentes guías de publicación. La red EQUATOR1 las recopila junto a numerosa documentación que explica cómo entender las guías y cómo aplicarlas. En el diagnóstico y el pronóstico, la guía para validar un indicador es STARD2; y para construirlo, TRIPOD3. Para ambos objetivos también ayuda STROBE4, la guía general para diseños observacionales, incluyendo los de etiología. Para reportar los resultados de los estudios con asignación aleatoria de la intervención, CONSORT5; y para publicar su protocolo, SPIRIT6. CONSORT, publicada en 1996 y revisada en 2001 y 2010, es la guía más antigua. Es sin ninguna duda la más madura. Finalmente, para juntar toda la evidencia disponible y obtener una estimación más precisa, tenemos PRISMA7. Su principal uso, lo tenemos para las revisiones sistemáticas de los efectos de una intervención. Todas ellas tienen un sitio web que es fácilmente localizable escribiendo su nombre al lado de «statement». Su documento acompañante «explicación y elaboración», será su mejor herramienta para leer críticamente las conclusiones de sus autores y, si procede, reproducir sus resultados.
FinanciaciónPID2019-104830RB-I00 DOI (AEI): 10.13039 / 501,100,011,033: STATISTICAL METHODOLOGIES FOR CLINICAL AND OMICS DATA AND THEIR APPLICATIONS IN HEALTH SCIENCES (SAMANTHA) del Ministerio de Ciencia e Innovación.
Responsabilidades éticasNo implica pacientes y no requiere permiso ético.