El cáncer de origen desconocido (COD) es un tipo de neoplasia metastásica cuyo tumor primario no se identifica tras una exhaustiva evaluación diagnóstica. Representa un desafío importante en la oncología moderna debido a la complejidad en su diagnóstico y tratamiento. Aunque el COD constituye entre el 2 y el 5% de todos los casos de cáncer, los avances recientes en técnicas diagnósticas, como la inmunohistoquímica y la secuenciación genómica, han mejorado la capacidad de clasificar y tratar el COD mediante terapias dirigidas. No obstante, persisten limitaciones, incluidas la heterogeneidad biológica del COD y la necesidad de tratamientos empíricos todavía en muchos casos. La presente revisión discute los avances en el diagnóstico y tratamiento del COD, enfatizando la importancia de un enfoque multidisciplinar que integre la oncología de precisión y los cuidados paliativos para mejorar la calidad de vida de estos pacientes.
Cancer of unknown primary (CUP) is a clinical type of metastatic malignancy where the primary tumor remains unidentified despite thorough diagnostic evaluation. It presents a significant challenge in modern oncology due to its complex management and diagnostic difficulties. Although CUP accounts for approximately 2 to 5% of cancer cases worldwide, recent advancements in diagnostic techniques, such as immunohistochemistry and genomic sequencing, have improved the ability to classify and treat CUP using targeted therapies. However, limitations persist, including the biological heterogeneity of CUP and the frequent need for empirical treatments. This review discusses advancements in CUP diagnosis and treatment, emphasizing the importance of a multidisciplinary approach that integrates precision oncology and palliative care to enhance patient quality of life.
El cáncer de origen desconocido (COD), también denominado cáncer de primario desconocido (cancer unknown primary), y más recientemente cáncer de primario oculto (occult primary cancer), es una categoría clínica que agrupa a aquellos cánceres metastásicos cuyo origen primario no puede ser identificado a pesar de realizar una evaluación diagnóstica exhaustiva. Este diagnóstico es uno de los mayores desafíos en la oncología moderna, dado que las metástasis que se identifican en el paciente pueden tener múltiples orígenes posibles, pero sin una localización primaria específica que las vincule a un órgano o tipo de tumor conocido.
El diagnóstico de COD se realiza cuando, después de una serie de pruebas diagnósticas estándar que incluyen historia clínica, exploración física, pruebas de imagen, análisis de sangre y biopsia, no se consigue identificar el tumor primario. Aunque este grupo de pacientes es relativamente pequeño, alrededor del 2 al 5% de todos los diagnósticos, lo que más llama la atención es tanto su rareza como su complejidad clínica1–5.
EpidemiologíaIncidenciaEl COD representa entre el 2 y el 5% del total de los diagnósticos de cáncer en el mundo. En España, la prevalencia ronda el 3% de los casos oncológicos, lo cual posiciona a esta enfermedad como un importante desafío debido a la complejidad que implica diagnosticar una neoplasia en ausencia de una localización primaria identificable2–7.
Estudios recientes han revelado que su incidencia ha mostrado una ligera tendencia a la disminución en países con sistemas de salud avanzados. Este descenso ha sido posible gracias a la mejora en las tecnologías de diagnóstico, como la tomografía computarizada (TC), la resonancia magnética (RM), la positron emission tomography (PET, «tomografía por emisión de positrones») y, más recientemente, la next generation sequencing (NGS, «secuenciación de nueva generación»), que han permitido identificar más tumores primarios, que antes se habrían clasificado como de origen desconocido6,7.
Modelos biológicos del cáncer de origen desconocidoPara comprender el desarrollo del COD, se han propuesto diversos modelos biológicos que buscan explicar su origen y progresión8:
- •
Modelo de progresión paralela: este enfoque plantea que el tumor primario crece y se disemina de forma temprana, antes de ser clínicamente detectable en su lugar de origen, generando metástasis que ya están presentes en el momento del diagnóstico.
- •
Modelo de enfermedad metastásica primaria desconocida: este modelo plantea que el tumor primario nunca ha existido, posiblemente porque las metástasis se originan directamente a partir de células madre pluripotenciales y su transformación cancerígena.
Desde una perspectiva molecular, los COD comparten con frecuencia alteraciones genéticas como la angiogénesis persistente, la resistencia a la apoptosis y las disrupciones en las vías de señalización celular o de la transición epitelio-mesénquima8. Estos factores podrían explicar también que los COD tengan un peor pronóstico y una historia natural impredecible, incluso aunque se lograra encontrar el tumor primario.
Asimismo, se estima que entre el 30 y el 40% de los pacientes con COD presentan mutaciones genéticas que pueden ser tratadas mediante terapias dirigidas, destacando la relevancia de la biología molecular tanto en el diagnóstico como en el tratamiento de esta enfermedad9–13.
Proceso diagnóstico en el cáncer de origen desconocido (tabla 1)Evaluación inicial, radiología y pruebas de laboratorioEl diagnóstico del COD comienza con una evaluación del historial médico y una exploración física enfocada en cabeza y cuello, así como en exámenes rectales, pélvicos, ginecológicos y mamarios, buscando signos del tumor primario y características de las metástasis2–4.
Algoritmo para la confirmación de la existencia de cáncer de origen desconocido
| Primer nivel |
| Datos clínicos y anamnesis |
| Historia médica detallada: hábitos tóxicos, antecedentes patológicos médicos y quirúrgicos, neoplasias previas, historia laboral e historia familiar |
| Exploración física completa por aparatos, incluyendo todas las áreas ganglionares periféricas, exploración mamaria, revisión de la piel y exploración pélvico-genital y rectal |
| Pruebas básicas para todos los pacientes |
| Hemograma completo |
| Bioquímica completa: función hepática y renal, electrólitos incluyendo calcio y LDH |
| TC de tórax, abdomen y pelvis |
| Mamografía (para todas las mujeres a valorar caso a caso)a |
| Biopsia (no PAAF). Cáncer metastásico histológicamente confirmado |
| Segundo nivel |
| Estudios adicionales para un grupo de pacientes seleccionados (existencia de signos o síntomas diana) según los hallazgos previos |
| RM de mama (si mamografía no concluyente)b |
| Ecografía testicular/ecografía de tiroides |
| Concentración sérica de PSA (para todos los hombres) |
| Concentración sérica de CA-125 (para todas las mujeres con afectación peritoneal) |
| Endoscopia (colonoscopia y/o gastroscopia) cuando existen síntomas digestivos o una TC indicativa |
| PET-TC en presentaciones en forma de metástasis única, o adenopatías supraclaviculares o laterocervicales |
| Concentración sérica de α-FP y β-hCG en tumores indiferenciados en pacientes menores de 50 años, o afectación metastática predominantemente ganglionar de la línea media |
| Laringoscopia en casos de afectación predominantemente ganglionar cervical |
| Broncoscopia en casos de síntomas pulmonares y/o hallazgos radiológicos como adenopatías hiliares o mediastínicas |
| Ecografía ginecológica ante metástasis pélvicas o peritoneales CK7+ |
| Datos anatomopatológicos |
| Revisión histopatológica con un estudio IHQ específico |
CA-125: carbohydrate antigen 125 («antígeno carbohidrato 125»); CK7+: citoqueratina 7 positiva; IHQ: inmunohistoquímica; LDH: lactato deshidrogenasa; PAAF: punción-aspiración con aguja fina; PET: positron emission tomography («tomografía por emisión de positrones»); PSA: prostate specific antigen («antígeno prostático específico»); RM: resonancia magnética; TC: tomografía computarizada; α-FP: alfafetoproteína; β-hCG: beta human chorionic gonadotropin («betagonadotropina coriónica humana»).
Las pruebas de laboratorio incluyen hemograma, función hepática y renal, LDH y electrólitos. Los marcadores tumorales tienen un valor limitado, salvo excepciones como el PSA en metástasis óseas sospechosas de cáncer de próstata, calcitonina para carcinoma medular de tiroides, catecolaminas y cromogranina A en neuroendocrinos, y alfafetoproteína (α-FP) y beta human chorionic gonadotropin (β-hCG, «betagonadotropina coriónica humana») en afectación ganglionar de línea media (tumor germinal) o hepática (hepatocarcinoma)2–4.
El diagnóstico por imagen es clave en la localización de metástasis y posibles tumores primarios. La TC toracoabdominal permite evaluar la extensión de la enfermedad y visualizar metástasis en hígado, pulmones y ganglios. Su capacidad para evaluar la extensión de la enfermedad y localizar metástasis potenciales es crucial para planificar el tratamiento. La RM es útil para detectar metástasis en el sistema nervioso central, especialmente de fosa posterior, evaluar tumores mamarios ocultos en la mamografía y caracterizar lesiones hepáticas, biliopancreáticas o neoplasias de cérvix o endometrio.
La PET-TC ha revolucionado el diagnóstico del COD en los últimos años. Utiliza un marcador radiactivo (fluorodesoxiglucosa) que se acumula en las células tumorales debido a su alta actividad metabólica. Esta acumulación permite la visualización de tumores en estadios tempranos, incluso antes de que sean visibles en otros estudios de imagen2–4.
En el contexto del COD, la PET-TC puede ser útil para localizar el tumor primario en aproximadamente un tercio de los casos. Sin embargo, aunque puede detectar metástasis ocultas y ofrecer pistas sobre el origen del tumor, su capacidad para identificar un tumor primario no es significativamente superior a la TC y su uso se restringe a tumores del área otorrinolaringológica, localizaciones metastásicas únicas, o cuando la realización de una PET-TC, a juicio de su clínico, pueda cambiar la estrategia terapéutica en un paciente14,15.
Anatomía patológicaEl estudio anatomopatológico es un componente esencial en el diagnóstico del COD, ya que permite clasificar los tumores según su estirpe (epitelial, mesenquimal, hematológico, germinal o neuroendocrino). El examen morfológico, junto con técnicas adicionales como la inmunohistoquímica (IHQ) y los análisis moleculares, proporciona indicios valiosos sobre la posible localización del tumor primario y contribuye de manera significativa a orientar el diagnóstico y a identificar tumores potencialmente tratables con terapias específicas (como, por ejemplo, neoplasias hematológicas o tumores germinales).
Con el fin de aprovechar al máximo el material disponible, que suele ser escaso en los casos de COD, se recomienda que el estudio IHQ se lleve a cabo de forma sistemática y para ello se han propuesto diversos algoritmos16,17 (fig. 1).
Algoritmo para el diagnóstico del cáncer de origen desconocido mediante inmunohistoquímica. CAM5.2: anticuerpo contra citoqueratinas de bajo peso molecular; CDX2: marcador de cáncer colorrectal; CD10: metaloproteasa expresada en linfomas de células B; CK AE1/AE3: citoqueratina AE1/AE3; CK7: citoqueratina 7; CK20: citoqueratina 20; EMA: epithelial membrane antigen («antígeno de membrana epitelial»); GATA3: factor de transcripción asociado a tumores de mama y uroteliales; HepPar-1: hepatocyte paraffin 1 («hepatocito de parafina 1»); LCA: leukocyte common antigen («antígeno leucocitario común»); NCAM: neural cell adhesion molecule («molécula de adhesión celular neuronal»); PSA: prostate specific antigen («antígeno prostático específico»); p63: factor de transcripción relacionado con p53; RE: receptor de estrógenos; RP: receptor de progesterona; S100: proteína de la familia S100 con función en señalización celular; TTF1: thyroid transcription factor 1 («factor de transcripción tiroideo 1»).
Modificado de Losa et al.4.
Entre los marcadores inmunohistoquímicos, destacan por su utilidad las citoqueratinas CK7 y CK20, que desempeñan un papel clave en la clasificación de los carcinomas. Las diversas combinaciones de positividad de estos marcadores orientan hacia diferentes orígenes tumorales, los cuales pueden confirmarse posteriormente mediante marcadores más específicos de la organicidad, como TTF1 para el adenocarcinoma de pulmón o PAX8 para el tracto ginecológico, el riñón y la tiroides (tabla 2).
Principales marcadores en el análisis inmunohistoquímico extendido
| Tipo de cáncer de sospecha | Marcador inmunohistoquímico |
|---|---|
| Origen urotelial | GATA3, p63, CK7, CK20, uroplaquina, trombomodulina |
| Ovario mucinoso | WT1 |
| Ovario seroso | PAX8, CK7 WT1, BerEp4, CA-125, RE, MUC5AC, mesotelina |
| Adenocarcinoma pulmonar | CK7, TTF1, napsina A, surfactante A y B |
| Pulmón (no adenocarcinoma) | CK7, TTF1, p63, CK5/6, napsina A |
| Carcinoma microcítico de pulmón | CD56, sinaptofisina, cromogranina, TTF1, Ki-67 |
| Mama | CK7, GATA3, RE, RP, Her2neu, mamaglobina, GcdFP-15, p53 |
| Endometrio | Vimentina, RE, PAX8 |
| Mesotelioma | Calretinina, WT1, mesotelina, CK5/6, D2-40, trombomodulina, antimesotelina |
| Tumores germinales | α-FP, β-hCG, CD30, OCT3/4, SALL4 |
| Tiroides | TTF1, tiroglobulina, PAX8, PAX9 |
| Próstata | PSA, PSMA, PSAP, NKX3, racemasa |
| Riñón (no urotelial) | PAX8, CD10, RCC, vimentina, EMA |
| Colorrectal | CEA, CDX2, SATB2 |
| Carcinoma hepatocelular | Glutamina sintetasa, HSP70, glipican 3, pCEA, antihepatocitario |
| Páncreas/vía biliar | CDX2, CK7, CA 19.9 |
| Neuroendocrinos | CD56, sinaptofisina, cromogranina, INSM1, PGP9.5 |
| Adrenal | Alfa-inhibina, Melan-A |
BerEp4: antígeno epitelial, útil en la diferenciación entre carcinoma y mesotelioma; CA-125: carbohydrate antigen 125 («antígeno carbohidrato 125»); CA 19.9: marcador de adenocarcinoma pancreático; CDX2: marcador de cáncer colorrectal; CD10: expresado en cánceres renales y linfomas; CD30: expresado en linfomas y tumores germinales; CEA: carcinoembryonic antigen («antígeno carcinoembrionario»); CK7: citoqueratina 7; CK20: citoqueratina 20; D2-40: marcador de cánceres linfáticos y mesoteliomas; EMA: epithelial membrane antigen («antígeno de membrana epitelial»); GATA3: factor de transcripción asociado a tumores de mama y uroteliales; GcdFP-15: gross cystic disease fluid protein15 («proteína 15 del fluido de la enfermedad quística macroscópica de la mama»); Her2neu: receptor de factor de crecimiento epidérmico humano 2; HSP70: heat shock protein70 («proteína de shock térmico de 70KDa»); INSM1: insulinoma-associated 1 («proteína 1 asociada al insulinoma»); Ki-67: índice de proliferación celular; MUC5AC: mucina asociada a adenocarcinomas pancreáticos y gástricos; NKX3: factor de transcripción específico de próstata; OCT3/4: expresado en tumores germinales; PAX8: factor de transcripción en cáncer de ovario, endometrio y riñón; PAX9: factor de transcripción en desarrollo tiroideo y dentario; pCEA: polyclonal carcinoembryonic antigen («antígeno carcinoembrionario policlonal»); PGP9.5: protein gene product 9.5 («proteína génica 9.5»); PSA: prostate specific antigen («antígeno prostático específico»); PSAP: prostatic-specific acid phosphatase («fosfatasa ácida prostática específica»); PSMA: prostate-specific membrane antigen («antígeno prostático específico de membrana»); p53: proteína supresora tumoral; p63: proteína del grupo p53; RCC: renal cell carcinoma marker («marcador para el carcinoma de células renales»); RE: receptor de estrógenos; RP: receptor de progesterona; SALL4: factor de transcripción en tumores germinales; SATB2: expresado en cáncer colorrectal; TTF1: thyroid transcription factor 1 («factor de transcripción tiroideo 1»); WT1: Wilms tumor 1 («tumor de Wilms 1»); α-FP: alfafetoproteína; β-hCG: beta human chorionic gonadotropin («betagonadotropina coriónica humana»).
Cabe señalar que, aunque el estudio IHQ es una herramienta poderosa para el diagnóstico del cáncer, presenta ciertas limitaciones, especialmente en muestras escasas de tumores diseminados y poco diferenciados, donde el perfil IHQ puede diferir significativamente del tejido del tumor primario original.
Diagnóstico genómico y molecularHa revolucionado la forma de abordar el COD, permitiendo avances significativos en la identificación del tumor primario y en la selección de tratamientos personalizados. Las plataformas de diagnóstico molecular y las técnicas de secuenciación masiva (NGS) han hecho posible un análisis detallado del perfil genético y epigenético de los tumores, lo que contribuye a un diagnóstico más preciso y a la elección de terapias dirigidas. Herramientas que permiten conocer la expresión génica como CancerTYPE ID y EPICUP, junto con técnicas de secuenciación masiva tipo NGS, son técnicas novedosas de la oncología molecular que ofrecen información clave sobre el comportamiento de los tumores y sus posibles orígenes4,8,18,19.
Plataformas de expresión génicaLas plataformas de expresión génica, como CancerTYPE ID, permiten predecir el tipo de tumor primario analizando la expresión de genes específicos. Este método es capaz de identificar hasta 39 tipos diferentes de cáncer con una precisión que oscila entre el 75 y el 92%, reduciendo la necesidad de procedimientos invasivos y mejorando la toma de decisiones clínicas8,20. Por su parte, EPICUP, basada en el análisis de patrones de metilación del ADN, destaca por su capacidad de predecir el origen tumoral incluso en casos donde las técnicas tradicionales no arrojan resultados concluyentes. Con una precisión superior al 95% en determinados contextos, esta herramienta epigenómica analiza las modificaciones químicas del ADN tumoral y las compara con bases de datos de perfiles conocidos, proporcionando una segunda línea de diagnóstico crucial en situaciones complejas21 (Tabla suplementaria 1).
Técnicas de secuenciación masivaEn cuanto a las técnicas de NGS, su impacto en el diagnóstico del COD es notable. Esta tecnología analiza el genoma de los tumores, identificando mutaciones específicas y alteraciones genéticas responsables de su agresividad. Entre las aplicaciones más destacadas de la NGS se encuentra la identificación de mutaciones en genes clave como BRCA1/BRCA2, tratables con inhibidores de PARP, y fusiones génicas como NTRK, que permiten terapias dirigidas con inhibidores específicos como entrectinib o larotrectinib. Además, esta tecnología facilita la detección de alteraciones en genes relacionados con la angiogénesis y la reparación del ADN, elementos cruciales para comprender la biología del cáncer y desarrollar estrategias terapéuticas más eficaces.
El potencial de la NGS y de otras plataformas moleculares en el COD incluye, entre otras aplicaciones, la detección de alteraciones genómicas clave que permitan un planteamiento terapéutico dirigido (tabla 3).
- •
Guía para terapias dirigidas: la generación de perfiles moleculares permite elegir opciones más precisas, como inmunoterapias o inhibidores específicos.
- •
Detección de mutaciones o alteraciones genómicas clave: mutaciones en genes como EGFR, BRAFV600E, KRASG12C, FGFR2, IDH1/2 o amplificaciones de HER2 ofrecen opciones de tratamiento oncoespecífico dirigido. Otras mutaciones como STK11 o KEAP1 confieren resistencia primaria a inmunoterapia.
- •
Fusiones génicas tratables: reordenamientos como NTRK, ALK, RET o ROS1 pueden ser abordados con terapias dirigidas, revolucionando el manejo del COD.
- •
Detección de genes asociados a cáncer hereditario: detectar alteraciones moleculares en genes conocidos de predisposición al cáncer como BRCA1/2 o PALB2.
Tratamiento dirigido según el perfil genómico
| Alteración genómica accionable | Tratamiento dirigido |
|---|---|
| ALK | Crizotinib, ceritinib, alectinib, brigatinib, lorlatinib |
| RET | Selpercatinib, pralsetinib |
| ROS1 | Crizotinib, ceritinib, lorlatinib, repotrectinib |
| NTRK | Entrectinib, larotrectinib |
| PI3K | Temsirolimus, everolimus, alpelisib |
| BRCA1/2 | Olaparib, niraparib, rucaparib, talazoparib |
| EGFR | Gefitinib, erlotinib, afatinib, dacomitinib, osimertinib |
| FGFR2/3 | Pazopanib, ponatinib, erdafitinib |
| MET | Crizotinib, tepotinib, capmatinib |
| BRAF V600 | Vemurafenib, encorafenib, dabrafenib, regorafenib |
| KRAS G12C | Sotorasib, adagrasib |
| ERBB2 | Trastuzumab, lapatinib, pertuzumab, afatinib, neratinib, trastuzumab-deruxtecán, trastuzumab emtansina, tucatinib |
| SMO | Vismodegib |
| AKT1 | Ipatasertib, capivasertib |
| IDH1 | Ivosidenib, vorasidenib |
| IDH2 | Vorasidenib |
| TMB-High | Inhibidores de puntos de control inmunitario |
| MSI-High | Inhibidores de puntos de control inmunitario |
MSI-High: microsatellite instability-high («inestabilidad de microsatélites alta»); TMB-High: tumor mutational burden-high («tumores con alta carga mutacional»).
Sin embargo, estas herramientas no están exentas de controversias. El coste elevado de las plataformas moleculares y la tecnología asociada sigue siendo una barrera importante, limitando su disponibilidad en muchas instituciones sanitarias. La interpretación de los resultados moleculares es otro desafío, ya que la complejidad de los datos a menudo requiere personal altamente especializado y, en algunos casos, los resultados no son concluyentes. Esto puede obligar a realizar pruebas adicionales o adoptar enfoques combinados para alcanzar un diagnóstico certero. Además, aunque los estudios retrospectivos han demostrado el valor de estas tecnologías, aún se necesitan ensayos prospectivos que evalúen su impacto en la mejora de la supervivencia y la calidad de vida de los pacientes.
A pesar de estas limitaciones, el diagnóstico molecular y genómico representa un avance crucial en la oncología moderna, ofreciendo herramientas poderosas para comprender y tratar el COD. La continua investigación y la integración de estas plataformas en la práctica clínica son esenciales para maximizar su potencial y hacer accesibles estas innovaciones a una mayor cantidad de pacientes.
TratamientoEl tratamiento del COD se basa principalmente en la quimioterapia (QT) empírica y en las terapias dirigidas basadas en los perfiles moleculares. Sin embargo, el tratamiento debe ser personalizado, adaptándose a las características específicas del tumor y del paciente.
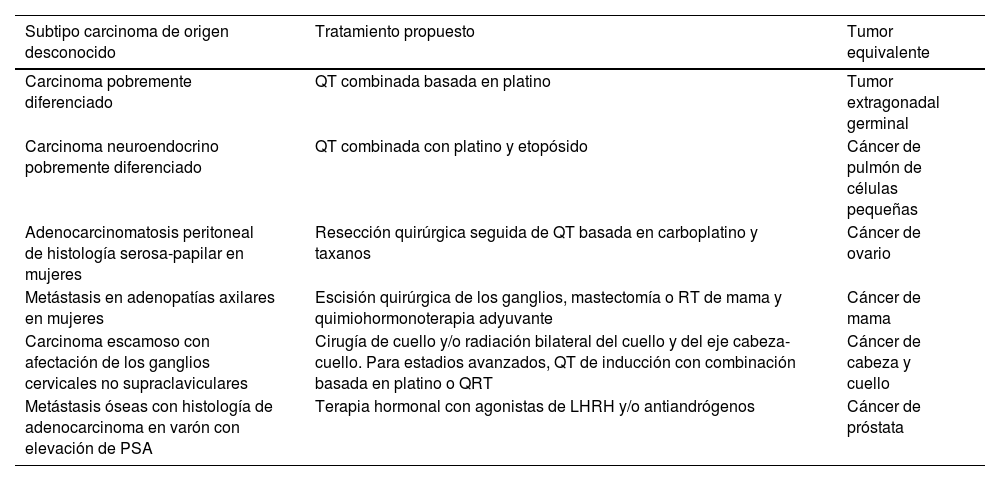
El tratamiento del COD distingue a los pacientes en 2 grandes grupos: aquellos con características clínicas que permiten un tratamiento específico similar al de tumores conocidos, llamados COD favorables, y aquellos sin características específicas, que requieren un abordaje empírico mediante QT, denominados COD desfavorables (tabla 4).
Abordaje óptimo de los pacientes en el grupo de cáncer de origen desconocido favorable
| Subtipo carcinoma de origen desconocido | Tratamiento propuesto | Tumor equivalente |
|---|---|---|
| Carcinoma pobremente diferenciado | QT combinada basada en platino | Tumor extragonadal germinal |
| Carcinoma neuroendocrino pobremente diferenciado | QT combinada con platino y etopósido | Cáncer de pulmón de células pequeñas |
| Adenocarcinomatosis peritoneal de histología serosa-papilar en mujeres | Resección quirúrgica seguida de QT basada en carboplatino y taxanos | Cáncer de ovario |
| Metástasis en adenopatías axilares en mujeres | Escisión quirúrgica de los ganglios, mastectomía o RT de mama y quimiohormonoterapia adyuvante | Cáncer de mama |
| Carcinoma escamoso con afectación de los ganglios cervicales no supraclaviculares | Cirugía de cuello y/o radiación bilateral del cuello y del eje cabeza-cuello. Para estadios avanzados, QT de inducción con combinación basada en platino o QRT | Cáncer de cabeza y cuello |
| Metástasis óseas con histología de adenocarcinoma en varón con elevación de PSA | Terapia hormonal con agonistas de LHRH y/o antiandrógenos | Cáncer de próstata |
LHRH: luteinizing hormone-releasing hormone («hormona liberadora de gonadotropina»): PSA: prostate specific antigen («antígeno prostático específico»); QRT: quimiorradioterapia; QT: quimioterapia; RT: radioterapia.
Esta distinción es fundamental, ya que los pacientes del primer grupo suelen tener un pronóstico considerablemente mejor que los del segundo.
Cánceres de origen desconocido favorables y estrategias terapéuticas específicasAlgunos cuadros clínicos asociados al COD han demostrado responder bien a tratamientos que siguen pautas específicas para tumores conocidos:
Mujer con adenopatías axilares sin otras lesiones detectablesEste cuadro se asocia con frecuencia al cáncer de mama oculto. Su evolución y tratamiento son similares al de un cáncer de mama en estadio ii o iii, según la extensión ganglionar. La supervivencia a 5 y 10 años para este grupo es del 75 y el 60%, respectivamente.
Mujer con carcinomatosis peritonealEste cuadro clínico, similar al cáncer de ovario avanzado, puede también relacionarse con tumores de origen mamario o gastrointestinal. Generalmente, la histología muestra adenocarcinomas serosos papilares o pobremente diferenciados. El tratamiento sigue los protocolos de cáncer de ovario en estadio iii-iv, en particular si se asocia a un CA-125 elevado.
Varón con adenopatías en línea mediaEste síndrome clínico apunta a un tumor germinal extragonadal. Los marcadores inmunohistoquímicos, como PLAP, α-FP, β-hCG y CD117, son esenciales para diferenciar entre seminomas y no seminomas.
Adenopatías cervicales con histología escamosaRepresentan cerca del 5% de los tumores de cabeza y cuello. Su abordaje incluye cirugía para la extirpación de los ganglios linfáticos afectados, radioterapia postoperatoria o quimiorradioterapia combinada.
Varón con metástasis óseas y elevación de PSAEn pacientes con metástasis óseas y adenocarcinoma, la elevación de PSA orienta el diagnóstico de cáncer de próstata metastásico. Estos pacientes deben recibir el tratamiento correspondiente a un cáncer de próstata estadio iv.
Pacientes con metástasis únicaEste grupo tiene mejor pronóstico, ya que muchas veces estas lesiones corresponden a tumores primarios inusuales con una apariencia metastásica. Tras descartar otras lesiones con estudios como la PET/TC, el abordaje se basa en cirugía y/o radioterapia con intención curativa. Algunos pacientes logran supervivencias prolongadas.
Cánceres de origen desconocido desfavorables y tratamiento empírico o dirigidoEl tratamiento del COD está evolucionando rápidamente hacia un enfoque más personalizado y basado en las características moleculares del tumor. Sin embargo, la combinación de tratamientos empíricos tradicionales sigue siendo la estrategia clave para abordar esta compleja enfermedad4,8,22.
Tratamiento empírico con quimioterapiaLa QT empírica sigue siendo el enfoque predominante en los casos de COD cuando no se logra identificar el tumor primario. Los tratamientos estándar combinan agentes derivados del platino, como cisplatino o carboplatino, con otros fármacos como taxanos, gemcitabina o irinotecán. Aunque estos regímenes ofrecen beneficios a ciertos pacientes, las tasas de respuesta no son altas y los resultados suelen ser limitados en cuanto a la supervivencia a largo plazo23–29 (tabla 5).
Regímenes de quimioterapia en pacientes con cáncer de origen desconocido desfavorable
| Referencia | Esquema de quimioterapia | RO | SG |
|---|---|---|---|
| Culine et al.23, 2003 | Cisplatino+gemcitabina frente a cisplatino+irinotecán | 55 frente a 38 | 8 frente a 6 |
| Greco et al.24, 2000 | Cisplatino+docetaxel frente a carboplatino+docetaxel | 26 frente a 22 | 8 frente a 8 |
| Huebner et al.25, 2009 | Carboplatino+paclitaxel frente a gemcitabina+vinorelbina | 23,8 frente a 20 | 11 frente a 7 |
| Dowel et al.26, 2001 | Carboplatino+etopósido frente a paclitaxel+5-fluorouracilo+leucovorina | 19 frente a 19 | 8,3 frente a 6,4 |
| Briasoulis et al.27, 2008 | Irinotecán+oxaliplatino | 13 | 2,7 |
| Schuette et al.28, 2009Hainsworth et al.29, 2010 | Capecitabina+oxaliplatino | 11,7-19 | 3,9-9,7 |
RO: respuesta objetiva; SG: supervivencia global.
Los resultados del uso de QT empírica en COD son modestos, con una mediana de supervivencia que varía entre 6 y 9 meses. Estos resultados dependen de múltiples factores, como el estado funcional del paciente, la histología, la ubicación y la extensión de las metástasis. En general, los pacientes con metástasis hepáticas o múltiples localizaciones tienen peores tasas de respuesta a la QT, inferiores al 20%, y una supervivencia mediana que rara vez supera los 9 meses (Tabla suplementaria 2).
Tratamientos dirigidos basados en perfiles molecularesLa incorporación de la medicina personalizada en el tratamiento del COD permite a los oncólogos diseñar terapias específicas que aprovechan las características genéticas únicas de cada tumor, mejorando la precisión y eficacia del enfoque terapéutico.
El desarrollo de terapias dirigidas ha marcado un cambio sustancial en el tratamiento del COD. La capacidad de identificar alteraciones genéticas específicas mediante tecnologías moleculares permite diseñar tratamientos claramente más precisos. Este enfoque ha mostrado mejoras en la supervivencia, especialmente en pacientes que presentan mutaciones tratables, como los reordenamientos en NTRK o tumores con alta carga mutacional30–34 (tabla 3).
Los inhibidores del dominio tirosina cinasa de TRK, que impiden su autofosforilación y la activación de las vías de señalización intracitoplasmática, como entrectinib y larotrectinib, representan avances destacados en terapias dirigidas. Estos reordenamientos o fusiones genéticas, presentes en una gran variedad de tumores, pueden detectarse mediante técnicas como la NGS. Los estudios clínicos han demostrado que estos inhibidores ofrecen altas tasas de respuesta y mejoras significativas en la supervivencia libre de progresión, siendo bien tolerados por los pacientes35–37.
Las mutaciones en genes de reparación del ADN, como BRCA1 y BRCA2, también son objetivos efectivos para terapias dirigidas. Los inhibidores de PARP, utilizados en estos casos, interfieren en la reparación del ADN de las células tumorales, conduciendo a su destrucción. Estos tratamientos pueden combinarse con inmunoterapia o QT para potenciar su efectividad.
Por último, la inmunoterapia ha emergido como una opción prometedora para ciertos subgrupos de pacientes con COD, especialmente aquellos con alta carga mutacional o inestabilidad de microsatélites. El pembrolizumab o el atezolizumab, inhibidores de PD-1 y PD-L1, respectivamente, han demostrado ser eficaces en estos casos, mostrando una mayor tasa de respuesta y una mejora significativa en la supervivencia en comparación con los tratamientos convencionales. Ensayos clínicos han confirmado su eficacia independientemente de su origen primario, lo que subraya la importancia de realizar análisis moleculares exhaustivos9,38.
Terapias de combinación y tratamientos experimentalesEstas formas de tratamiento están redefiniendo el abordaje del COD. El futuro del tratamiento del COD apunta hacia terapias combinadas, que integran terapias dirigidas con tratamientos convencionales como la QT o la radioterapia. Este enfoque multifacético busca incrementar la eficacia terapéutica al atacar el tumor desde diferentes ángulos, reduciendo la posibilidad de resistencia al tratamiento y mejorando los resultados para los pacientes.
Los ensayos clínicos están evaluando combinaciones de tratamientos para el COD, con resultados prometedores. Por ejemplo, la integración de inhibidores de NTRK con inmunoterapia o QT ha mostrado potencial para mejorar la supervivencia libre de progresión en estudios iniciales. Un estudio destacado, el ensayo CUPISCO, con más de 600 pacientes incluidos, demostró que los pacientes que recibieron tratamientos guiados por perfiles moleculares, incluidas terapias dirigidas, tuvieron mejores resultados en comparación con aquellos tratados únicamente con QT empírica. Estos hallazgos subrayan la importancia de seguir desarrollando y evaluando enfoques personalizados9.
La investigación en COD está progresando rápidamente, con nuevas terapias en desarrollo. Estas incluyen vacunas contra el cáncer y moduladores de la respuesta inmune, que podrían transformar el panorama terapéutico en los próximos años. El futuro también contempla terapias más personalizadas basadas en la genética y el perfil inmunológico del tumor. Estos enfoques buscan maximizar la eficacia y reducir los efectos secundarios mediante tratamientos diseñados específicamente para las características únicas de cada tumor.
Tratamientos localizados y radioterapiaEn casos de COD donde las metástasis son limitadas o presentan lesiones solitarias, los tratamientos localizados, como la cirugía y la radioterapia, pueden ser opciones válidas. Aunque estas estrategias son menos comunes debido a la naturaleza diseminada del COD, pueden ofrecer beneficios significativos en pacientes seleccionados3,4.
Cirugía en el cáncer de origen desconocidoEn casos de COD donde las metástasis son limitadas o presentan lesiones solitarias, los tratamientos localizados, como la cirugía y la radioterapia, pueden ser opciones válidas. Aunque estas estrategias son menos comunes debido a la naturaleza diseminada del COD, pueden ofrecer beneficios significativos en pacientes seleccionados3,4.
La cirugía puede ser una opción efectiva cuando las metástasis son localizadas y accesibles. El éxito quirúrgico es mayor cuando se trata de lesiones únicas u oligometastásicas. Sin embargo, debido a la naturaleza frecuentemente avanzada y diseminada de la enfermedad, la cirugía no es aplicable en la mayoría de los casos.
La radioterapia, por su parte, tiene un rol importante en el tratamiento de metástasis localizadas o solitarias, como las que afectan al cerebro, los huesos o los pulmones. En particular, la radioterapia estereotáctica permite administrar dosis altas de radiación de manera precisa, minimizando el daño a los tejidos circundantes.
Además de su uso curativo, la radioterapia puede mejorar la calidad de vida al aliviar síntomas como el dolor óseo o las obstrucciones en órganos afectados.
Evaluación de la respuesta al tratamiento y seguimientoEl manejo del COD requiere evaluación constante mediante pruebas de imagen como la TC, la RM y la PET-TC, junto con marcadores tumorales. La variabilidad en la respuesta obliga a ajustar estrategias terapéuticas de manera continua, optimizando el tratamiento según la evolución del paciente.
Calidad de vida en pacientes con cáncer de origen desconocidoEl impacto del COD en la calidad de vida abarca aspectos físicos, emocionales y sociales, exigiendo un enfoque integral que combine el manejo de síntomas, el apoyo nutricional, el cuidado psicológico y el respaldo familiar. El tratamiento multidisciplinar con la integración precoz de cuidados paliativos, así como el fortalecimiento de las redes de apoyo, permite mejorar el control de síntomas, proporcionar soporte familiar y mejorar la atención de manera integral.
Terapias paliativas y el abordaje integral. Impacto en la calidad de vida en pacientes con cáncer de origen desconocidoEl diagnóstico de COD impacta profundamente la calidad de vida del paciente debido a su pronóstico incierto y la carga de los tratamientos. La inespecificidad del COD exige un enfoque terapéutico amplio, que conlleva efectos secundarios y desafíos emocionales y físicos.
El COD presenta síntomas diversos según las metástasis presentes. El dolor, especialmente en huesos, pulmones o abdomen, es debilitante y requiere manejo con analgésicos, incluidos opioides. La disnea, frecuente en metástasis pulmonares, agrava el malestar y demanda soporte de oxígeno y tratamientos para reducir la inflamación. La fatiga crónica y la pérdida de peso, exacerbadas por la QT y la progresión de la enfermedad, afectan la funcionalidad del paciente, haciendo esencial un soporte nutricional adecuado.
El cuidado paliativo es clave para aliviar síntomas físicos y emocionales, enfocándose en mejorar la calidad de vida. Un equipo multidisciplinar es crucial para el manejo integral del paciente.
Importancia del apoyo psicológico, familiar y socialEl COD suele ser agresivo y de mal pronóstico, lo que genera una rápida progresión de la enfermedad y una carga emocional significativa. El soporte psicológico ayuda al paciente y a su familia a afrontar el estrés, la ansiedad, la depresión y el insomnio. La detección precoz de problemas emocionales y la intervención psicooncológica son esenciales para mejorar la adaptación39.
El papel de la familia es fundamental en el tratamiento de síntomas y el apoyo emocional. Estudios como el de Ishida et al.40 evidencian que el bienestar del paciente está estrechamente relacionado con el estado emocional de sus familiares, mostrando una mayor depresión en los cuidadores cuando la calidad de vida del paciente es peor. Es vital cuidar la salud mental de los cuidadores para evitar el desgaste emocional.
Las redes sociales y grupos de apoyo proporcionan un espacio para compartir experiencias, reduciendo la carga emocional del paciente y su entorno. Estos recursos fortalecen el bienestar psicológico, promoviendo estrategias de afrontamiento adaptativas y una mejor calidad de vida para todos los involucrados.
El papel de la enfermería clínicaLa enfermería de práctica avanzada especializada en oncología tiene un rol clave en la atención de pacientes con COD40.
El cuidado de los pacientes diagnosticados con COD requiere una anamnesis detallada para identificar, por un lado, problemas de salud, y por otro, los deseos y preferencias del paciente en cada etapa del proceso de la enfermedad para poder establecer planes de cuidados dinámicos y personalizados.
Estos pacientes, generalmente frágiles y con múltiples síntomas, se enfrentan a un largo proceso diagnóstico y presentan una mayor incertidumbre sobre su enfermedad41. Además, el impacto emocional causado por pertenecer a un grupo de pacientes diagnosticados de un tipo de cáncer de baja incidencia es mayor, dado que el grado de desconocimiento e incomprensión de la enfermedad aumenta las tasas de ansiedad, el estrés psicológico y los sentimientos de aislamiento y soledad42,43.
Este impacto no ocurre sólo en la esfera emocional, sino que afecta a todas las dimensiones que vive el paciente y la familia: nivel económico, social, psicológica y física. Por ello, tras el diagnóstico, estos pacientes y sus familias presentan unas necesidades y unos cuidados específicos y el papel de la enfermera de práctica avanzada especializada en cáncer es crucial para asegurar la continuidad asistencial gestionando de forma individualizada los casos, coordinando pruebas, visitas y tratamientos, pero también elaborando planes de cuidados individualizados con una mirada holística, que vayan dirigidos a fomentar la autonomía del paciente y en los que se dé especial relevancia a las necesidades educativas y el apoyo psicosocial tanto al paciente como a la familia.
Dada la incorporación de los tratamientos personalizados, es fundamental que los profesionales de enfermería reciban formación específica y participen en la discusión de los casos, la toma de decisiones y los proyectos de investigación tanto multidisciplinarios como de su propia competencia, para mejorar la atención y calidad de vida de estos pacientes.
ConclusionesEl COD sigue siendo uno de los mayores retos en oncología. Aunque ha habido avances importantes en el diagnóstico y tratamiento de esta enfermedad, el pronóstico sigue siendo generalmente desfavorable. Pese a ello, los recientes avances en la biología molecular, las plataformas de diagnóstico genético y las terapias dirigidas están abriendo nuevas perspectivas para estos pacientes.
La identificación de alteraciones genéticas clave, como las fusiones NTRK y las mutaciones en genes de reparación del ADN, están transformando el tratamiento del COD, proporcionando opciones más específicas y personalizadas que mejoran la respuesta al tratamiento y la calidad de vida de los pacientes. La medicina personalizada y las terapias dirigidas serán, sin duda, el futuro del tratamiento del COD, permitiendo que los médicos adapten las terapias a las características únicas de cada paciente y cada tumor.
Si bien el tratamiento empírico con QT sigue siendo el pilar en el manejo del COD, las terapias de inmunoterapia y los tratamientos basados en perfiles moleculares ofrecen nuevas opciones para pacientes seleccionados. Los ensayos clínicos y la investigación serán cruciales para seguir mejorando los resultados de los pacientes con COD, y para garantizar que estos avances se traduzcan en un tratamiento más efectivo y en una mayor supervivencia.
La integración de todas estas tecnologías y enfoques representa un paso hacia el futuro de la oncología de precisión, donde el tratamiento de cada paciente será más específico, menos invasivo y, en última instancia, más eficaz y multidisciplinar.
Es vital la colaboración de un equipo multidisciplinar para garantizar una atención personalizada e integral, ya que permite abordar el caso desde las diferentes perspectivas y seleccionar las estrategias idóneas en el tratamiento y cuidado del paciente y su familia, adaptándonos a sus necesidades específicas tanto físicas como emocionales y sociales, para optimizar los resultados en el tratamiento del COD.
Consentimientos informados y consideraciones éticasNo se mencionan pacientes y, por consiguiente, no se precisan consentimientos informados.
FinanciaciónNo ha existido ninguna financiación.
Conflicto de interesesNi el autor principal y de correspondencia, ni tampoco ningún otro coautor del artículo tenemos ningún conflicto de interés.
Marta Martin Richard1, Javier Míguez González2, Mariluz Villegas Urbano3, Juan Carlos Pardo Ruiz4, Gemma Soler González4, Alejandro Hernández Martínez5, Eduard Teixidor Vila5, Andrés Tapias Mesa6, Angels Cañas Tello7, María Pané Foix8.
1Servicio de Oncología Médica. H. Sant Joan Despí Moisès Broggi/ICO-Hospitalet, 2Servicio de Radiodiagnóstico, H. Sant Joan Despí Moisès Broggi, 3Servicio de Medicina Interna. H. Sant Joan Despí Moisès Broggi, 4Servicio de Oncología Médica, ICO-Badalona, 5Servicio de Oncología Médica, ICO-Girona, 6Servicio de Medicina Nuclear. H. U. Bellvitge, 7Servicio de Anatomía Patológica. H. Sant Joan Despí Moisès Broggi, 8Servicio de Anatomía Patológica. H. U. Bellvitge.
Todos los autores colaboradores forman parte del Comité multicéntrico de COD del Institut Català d’Oncologia (ICO), el Hospital Universitari de Bellvitge (HUB) y el Complex Hospitalari Moisès Broggi (CHMBroggi).