Editado por: Dr. Xavier Nogues Solan - Institut Hospital del Mar d'Investigacions Mèdiques (IMIM) Spain
Última actualización: Junio 2025
Más datosTeriparatida (TPTD) y abaloparatida (ABL) son fármacos osteoanabólicos pertenecientes al grupo de los análogos de la parathormona y de la proteína relacionada con la parathormona, respectivamente. Ambos fármacos han demostrado ser eficaces y seguros en el tratamiento de la osteoporosis posmenopáusica (OPM), al reducir el riesgo de fractura vertebral y no vertebral, y mejorar la microarquitectura ósea, especialmente en pacientes con osteoporosis grave. Por este motivo, las guías recomiendan su utilización como primera línea de tratamiento para pacientes con muy alto riesgo de fractura. Aunque TPTD y ABL actúan sobre el mismo receptor, PTHR1, desencadenan una respuesta de señalización diferente, lo que explica que los efectos sobre el remodelado óseo también sean diferentes, con similar acción osteoanabólica, pero con menor estimulación de la resorción por parte de ABL, que le confiere un mayor beneficio sobre el hueso cortical.
Teriparatide (TPTD) and abaloparatide (ABL) are osteoanabolic drugs belonging to the group of parathyroid hormone analogues and parathyroid hormone-related protein analogues, respectively. Both drugs have been shown to be effective and safe in the treatment of postmenopausal osteoporosis (PMO), reducing the risk of vertebral and nonvertebral fractures and improving bone microarchitecture, especially in patients with severe osteoporosis. For this reason, guidelines recommend their use as first-line treatment for patients at very high risk of fracture. Although TPTD and ABL act on the same receptor, PTHR1, they trigger a different signaling response, which explains why their effects on bone remodeling are also different, with similar osteoanabolic action, but with less stimulation of resorption by ABL, which confers a greater benefit on cortical bone.
La osteoporosis es una enfermedad esquelética sistémica, caracterizada por una baja masa ósea y/o un deterioro de la microarquitectura del esqueleto, que condiciona una mayor fragilidad ósea con un incremento del riesgo de fractura1. Dada la alta morbimortalidad asociada a la presencia de fracturas, especialmente vertebral y de cadera, y al impacto negativo sobre la calidad de vida de los pacientes que las padecen, la osteoporosis se considera un grave problema de salud pública, con una importante repercusión socioeconómica2,3.
No obstante, a pesar de disponer de tratamientos eficaces en la reducción del riesgo de fractura, persiste en la actualidad una importante brecha de tratamiento4.
Las guías clínicas más recientes, tanto nacionales5-7 como internacionales8-11, coinciden en recomendar tratamiento osteoanabólico a aquellos pacientes clasificados como de muy alto riesgo de fractura, basándose en la superioridad de los fármacos osteoanabólicos frente a los antirresortivos en cuanto a eficacia y rapidez de acción, tanto en términos de ganancia de densidad mineral ósea (DMO) como de reducción del riesgo de fractura. Igualmente, existe consenso universal en admitir que el beneficio logrado con un fármaco osteoanabólico debe mantenerse con la administración secuencial de un fármaco antirresortivo12-14.
Actualmente, en España se dispone de tres fármacos osteoanabólicos, de administración subcutánea, comercializados: teriparatida (TPTD), un análogo de la parathormona o PTH; romosozumab (ROMO), un inhibidor de la esclerostina, y el recientemente comercializado abaloparatida (ABL), un análogo del péptido relacionado con la PTH, o PTHrP.
El objetivo de la presente revisión es repasar el mecanismo de acción y los datos de eficacia y seguridad de los agentes análogos de la PTH/PTHrP (ABL y TPTD), describiendo las principales semejanzas y diferencias, para poder definir el perfil de paciente más adecuado para cada uno de estos tratamientos.
MetodologíaPara llevar a cabo esta revisión narrativa se realizó una búsqueda exhaustiva de la literatura científica disponible en revistas indexadas en PubMed. Los términos de búsqueda utilizados incluyeron «teriparatide» [MeSH Terms], «abaloparatide» [MeSH Terms], «PTH analogues» [MeSH Terms], «PTHrP analogues» [MeSH Terms], «osteoanabolics» [MeSH Terms], «bone forming agents» [MeSH Terms], «osteoporosis» [MeSH Terms], «fracture» [MeSH Terms]. Se aplicaron filtros para incluir únicamente artículos en inglés y en español, y se excluyeron artículos de opinión y cartas al editor. Los estudios seleccionados fueron revisados críticamente por los autores para evaluar su calidad metodológica. La información relevante fue extraída y sintetizada para ofrecer una visión comprensiva y actualizada sobre el mecanismo de acción, eficacia y seguridad de los análogos de PTH/PTHrP en el tratamiento de la osteoporosis posmenopáusica.
Mecanismo de acción de los análogos de PTH/PTHrPLa hormona paratiroidea (PTH) es un polipéptido de 84 aminoácidos, sintetizada y secretada por las glándulas paratiroides, que desempeña un papel central en la regulación del metabolismo del calcio y del fósforo. Aunque durante muchos años se consideró que la acción de la PTH sobre el hueso era exclusivamente catabólica, la evidencia experimental y clínica indica que los niveles elevados de PTH incrementan el remodelado óseo y conducen a efectos óseos tanto anabólicos como catabólicos, dependiendo de la forma de liberación (continua o intermitente). Se ha observado en estudios preclínicos que la PTH administrada de forma exógena una vez al día tiene una acción predominantemente anabólica. Además, se pudo comprobar que la actividad biológica de la PTH intacta (hPTH1-84) residía en la secuencia N-terminal, y, en particular, en los 34 primeros aminoácidos. Este hallazgo permitió la síntesis y producción del primer análogo de la PTH, la TPTD, que corresponde al fragmento 1-34 de la PTH humana15,16.
La principal célula diana de la PTH en el hueso, y también de la TPTD, es el osteoblasto, aunque también actúan sobre el osteocito. Ambas, PTH y TPTD, se unen al receptor de la PTH tipo1 (PTH1R), un receptor de membrana acoplado a la proteínaG, y desencadenan dos vías de señalización paralelas: la activación de la adenilato ciclasa y la activación de la proteína quinasaC (PKC). La adenilato ciclasa cataliza la generación de un segundo mensajero, el adenosín monofosfato cíclico (AMPc), que, en última instancia, activa la proteína quinasaA (PKA), que es la responsable de estimular la función, diferenciación y proliferación del osteoblasto17.
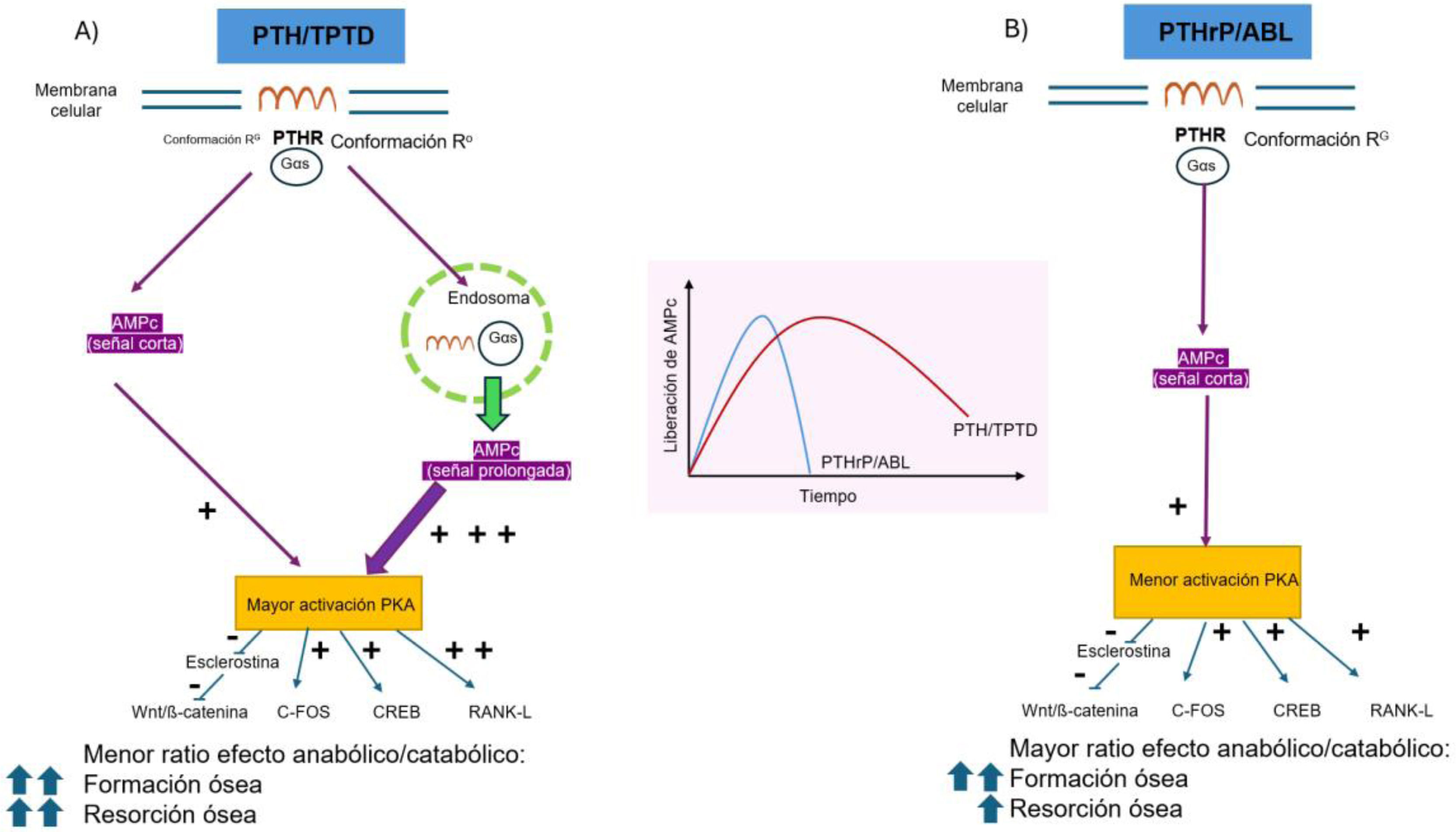
Los efectos anabólicos de la PTH y de la TPTD, cuando se administran de forma intermitente, están mediados por tres mecanismos: 1)la expresión transcripcional regulada al alza de factores de crecimiento pro-osteoblastogénicos; 2)la modulación de la vía de señalización osteoanabólica Wnt/beta-catenina, y 3)el aumento de la expresión y actividad de Runx2. Para ejercer sus efectos catabólicos, la PTH actúa aumentando la expresión de citoquinas pro-osteoclastogénicas, como el ligando del receptor activador factor nuclear kappa-B (RANKL)18,19 (fig. 1).
Activación diferencial del receptor PTH1R por análogos de PTH y PTHrP en el osteoblasto. A)Mecanismo de acción de la PTH y teriparatida (TPTD), resultando en una alta tasa de formación y resorción. B)Mecanismo de acción de la PTHrP y abaloparatida (ABL), resultando en una alta tasa de formación, pero con menor resorción.
ABL: abaloparatida; AMPc: adenosín monofosfato cíclico; CREB: cAMP response element-binding protein (proteína de unión al elemento de respuesta a AMPc); Gαs: subunidad alfa de la proteínaG; PKA: proteína kinasaA; PTH: hormona paratiroidea; PTHrP: péptido relacionado con la hormona paratiroidea; PTHR1: receptor1 de la hormona paratiroidea; RANK-L: receptor activator of nuclear factor κB ligand (ligando del activador del receptor del factor nuclear kappa beta); TPTD: abaloparatida.
La proteína relacionada con la hormona paratiroidea (PTHrP) es una proteína con cierta similitud a la PTH en el extremo amino terminal, por el que se une al mismo receptor PTH1R. La ABL es un análogo sintético de la PTHrP, compuesto por 34 aminoácidos, 20 de los cuales son idénticos a la PTHrP17. La ABL se une e interactúa con el mismo receptor que TPTD, el receptor PTH1R, desencadenando también una respuesta dependiente del AMPc17,18.
La PTH y la TPTD, con una afinidad mayor por la conformación R0 del PTH1R, inducen la generación de AMPc por un mecanismo dependiente de la activación de Gαs en la membrana celular y por la internalización del receptor unido a Gαs en los endosomas. Como resultado de ambos mecanismos, se generan concentraciones altas y prolongadas de AMPc, potenciando así una mayor acción de la proteína quinasaA (PKA) y de la expresión de los efectores posteriores de la PKA: c-Fos, CREB y el RANK-L. Por el contrario, la esclerostina es inhibida por un mecanismo dependiente de PKA que provoca la estimulación de la vía de señalización Wnt/β-catenina. Estas vías de señalización inducen tanto el aumento de la formación ósea como el de la resorción ósea17,18 (fig. 1).
En cambio, la PTHrP y la ABL, con una afinidad preferencial por la conformación RG del PTH1R, inducen la generación de AMPc por un mecanismo dependiente de la activación de Gαs solo en la membrana celular. Como resultado, se generan concentraciones de AMPc más cortas y más bajas, lo que desencadena acciones menores de PKA y de la consiguiente expresión de los efectores posteriores de PKA: c-Fos, CREB y RANK-L. La esclerostina es inhibida asimismo por acciones dependientes de PKA que estimulan la vía de señalización Wnt/β-catenina, de un modo similar a PTH/TPTD. El resultado es un balance mayor de la formación ósea respecto a la resorción ósea17,18 (fig. 1).
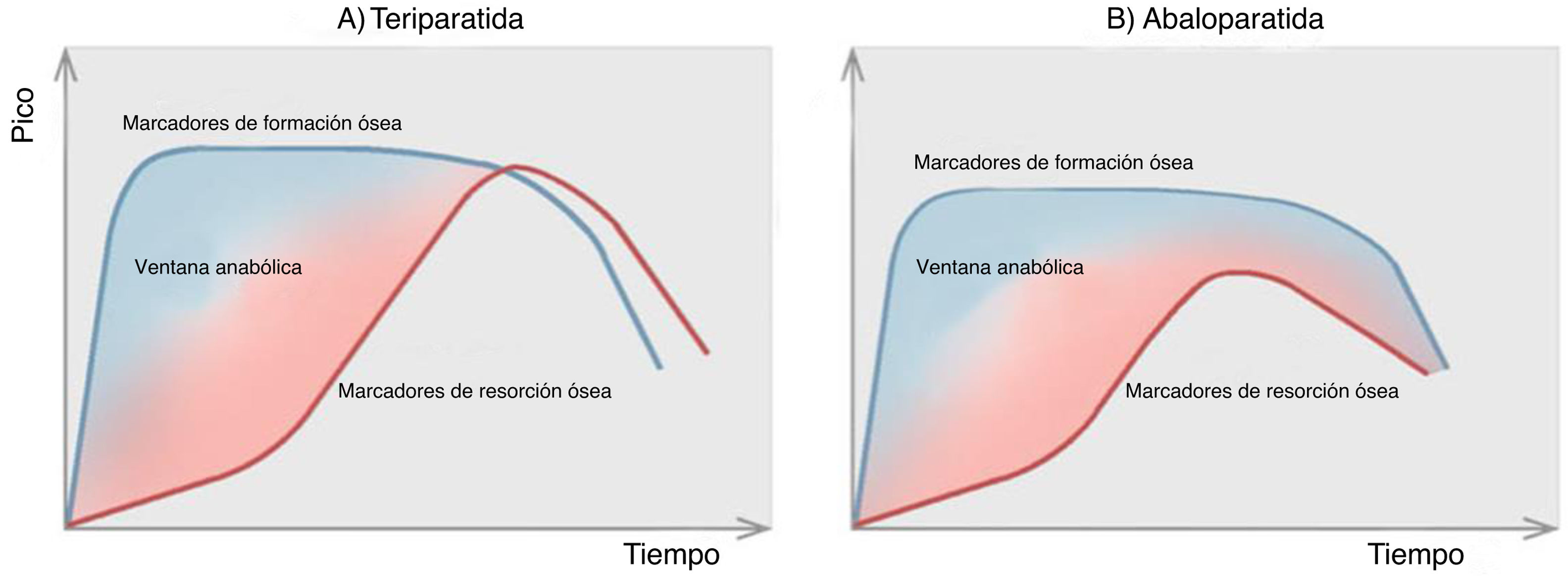
Tras la administración de TPTD y ABL se observa un aumento rápido de los marcadores de formación, aunque de magnitud algo menor en el caso de ABL, seguido de un aumento posterior (a los 2-3meses) de los marcadores de resorción, que en el caso de ABL es menor y más corto en el tiempo. Por lo tanto, la «ventana anabólica», período en el que la osteoformación predomina sobre la resorción, probablemente sea más amplia con ABL que con TPTD, lo que se traduciría en una acción anabólica neta más pronunciada20 (fig. 2).
Ventana anabólica de teriparatida (A) y de abaloparatida (B); en ellas se observa el período de tiempo en el que los fármacos ejercen el máximo efecto osteoanabólico.
Fuente: figura adaptada y con permiso de Tabacco y Bilezikian20.
TPTD ha demostrado aumentar consistentemente la DMO en el hueso predominantemente trabecular, como el de la columna lumbar (CL) y, en menor grado, en el hueso de predominio cortical, como el cuello femoral (CF) y la cadera total (CT), pudiéndose observar incluso una discreta pérdida de DMO en los primeros meses de tratamiento. En el ensayo pivotal fase3 de TPTD, el Fracture Prevention Trial (FPT), en el que se trató a mujeres con osteoporosis posmenopáusica (OPM) durante una mediana de 19meses, el incremento medio de la DMO en CL en el grupo que recibió 20μg/día fue del 9,7%, frente al 1,1% de las pacientes tratadas con placebo21. Esta ganancia de DMO en hueso trabecular con TPTD es muy consistente, como quedó demostrado en un análisis post hoc, en el que se observó que el 96% de las pacientes del estudio ganaron DMO en CL de forma significativa, siendo esta ganancia >5% en el 72% de los casos22. Sin embargo, los cambios en la DMO tanto en cadera como en radio distal no son tan significativos. Incluso se ha descrito una disminución de la DMO, más marcada en radio, que podría obedecer a un aumento del remodelado endocortical y de los sistemas corticales haversianos, aunque compensado por la aposición ósea perióstica simultánea. De hecho, técnicas de análisis biomecánico han demostrado que los cambios estructurales resultan en un hueso más resistente23.
AbaloparatidaEl efecto de ABL sobre la DMO en mujeres con OPM se analizó en el ensayo fase2 de búsqueda de dosis24 y en el ensayo clínico pivotal fase3, aleatorizado, doble ciego, de 18meses de duración (estudio ACTIVE), que comparaba ABL 80μg, TPTD 20μg y placebo, en 2.463 mujeres con OPM. En este estudio los cambios en la DMO al final de los 18meses (objetivo secundario del estudio) fueron significativamente mayores con ABL que con placebo (+11,20% vs +0,63% en CL; +3,60% vs −0,43% en CF; +4,18% vs −0,10% en CT)25.
Al comparar ABL y TPTD se observó que tras 18meses de tratamiento no hubo diferencias significativas en las ganancias de DMO en CL (+11,20% vs +10,49%). Sin embargo, el tratamiento con ABL obtuvo incrementos de DMO significativamente mayores que TPTD en CF (+3,60% vs +2,66%) y CT (+4,18% vs +3,26%), lo que sugeriría un mayor beneficio de ABL en el hueso cortical25.
Por otra parte, los cambios observados en los marcadores de remodelado óseo en el estudio ACTIVE fueron consistentes con las diferencias observadas en la DMO, de forma que ABL inducía una menor resorción ósea, y por lo tanto conseguía una mayor acción anabólica neta en comparación con TPTD25.
Efectos de los análogos de PTH/PTHrP sobre la microarquitectura óseaTeriparatidaDiversos estudios en modelos animales y humanos confirmaron que TPTD 20μg/día no solo incrementa la masa ósea, sino que también aumenta el número de trabéculas y la conectividad trabecular, mejorando la microarquitectura ósea y, consecuentemente, la resistencia del esqueleto26. En el hueso cortical, TPTD 20μg aumenta el grosor, como consecuencia de la aposición de hueso nuevo perióstico y endocortical, aunque también produce una porosidad cortical27.
En un subestudio del FPT, que valoraba los cambios en la microarquitectura ósea en biopsias de cresta iliaca con microtomografía computarizada (μ-TC), la administración diaria de TPTD durante 19meses se asoció con un aumento del volumen y de la conectividad trabecular, así como con un aumento del grosor cortical. A pesar de que se observó un incremento en la porosidad intracortical, la resistencia ósea no se vio comprometida27,28.
Un análisis realizado con tomografía computarizada cuantitativa (QCT) en una muestra de pacientes procedentes del estudio FPT mostró cambios positivos en la geometría cortical ósea del radio distal, indicativos de una mejora de la resistencia ósea29.
Recientemente, y mediante la utilización del software DXA-3D, se ha observado un aumento en la DMO volumétrica (DMOv) trabecular y una disminución de la DMOv cortical, en CL y CF30; hallazgos consistentes con estudios previos realizados con QCT29.
AbaloparatidaABL, en estudios preclínicos, también ha demostrado mejorar la microarquitectura ósea, consiguiendo una mayor resistencia del hueso31-33. Sin embargo, a diferencia de TPTD, se ha observado que ABL aumenta los índices histomorfométricos de formación ósea trabecular, endocortical y perióstica sin aumentar el número de osteoclastos o las superficies erosionadas33.
La microarquitectura ósea, evaluada indirectamente mediante el Trabecular Bone Score (TBS) de CL, se estudió en el ensayo clínico controlado de fase2, en el que se comparaban ABL 80μg, TPTD 20μg y placebo. Al final del estudio, el incremento del TBS fue significativamente mayor en los grupos de ABL y TPTD frente a placebo, y en el grupo de ABL respecto al de TPTD34. Un posterior análisis efectuado en pacientes del estudio ACTIVE, tras 18meses de tratamiento con ABL subcutánea 80μg, confirmó estos resultados35. En el estudio ACTIVExtend, extensión del ACTIVE, los resultados del TBS en el grupo de pacientes que continuaron con alendronato (ALN) tras ABL (ABL/ALN) se mantuvieron, resultando superiores a los del grupo placebo seguido de ALN (PBO/ALN)35.
Un estudio realizado con DXA-3D, en una muestra aleatoria de pacientes del estudio ACTIVE, mostró que ABL y TPTD, al cabo de 18meses, incrementaron la DMOv trabecular de forma similar. Sin embargo, el incremento en la DMO superficial (DMOs) y la DMOv cortical fue mayor con ABL que con TPTD, pudiendo reflejar estas diferencias el mayor aumento de la porosidad intracortical con TPTD comparado con ABL36.
Eficacia antifractura de los análogos de PTH/PTHrPTeriparatidaLa eficacia antifractura de TPTD se evaluó por primera vez en el FPT. Se incluyeron 1.637 mujeres con OPM y fracturas vertebrales prevalentes que fueron aleatorizadas a tratamiento diario con TPTD 20μg, TPTD 40μg o placebo (PBO). Al cabo de 19meses, TPTD 20μg, comparado con PBO, redujo significativamente el riesgo de nuevas fracturas vertebrales morfométricas en un 65% y el riesgo de fracturas no vertebrales en un 53%21. Aunque la incidencia de fractura de cadera fue menor en los grupos tratados con TPTD, el estudio no tenía la potencia estadística suficiente para valorar las diferencias entre grupos21. Análisis posteriores de subgrupos del FPT han demostrado que la eficacia antifractura de TPTD era independiente de la edad de las pacientes del estudio, de los valores de remodelado óseo pretratamiento, de los niveles basales de 25-hidroxivitaminaD, de los valores basales de DMO y del número de fracturas vertebrales prevalentes previas a la inclusión en el estudio37.
Un ensayo clínico controlado realizado con el objetivo primario de valorar la eficacia antifractura de TPTD frente a un bifosfonato (BF) fue el estudio VERO. En este ensayo clínico doble ciego, con doble enmascaramiento, 1.366 pacientes con OPM severa (al menos dos fracturas vertebrales moderadas o una fractura vertebral severa, junto con una T-score ≤−1,5 en CL, CF o CT) fueron asignadas aleatoriamente a recibir TPTD 20μg/día o risedronato (RIS) 35mg/semana. Al cabo de 24meses las mujeres que recibieron TPTD frente a las que recibieron RIS presentaron una reducción significativa del riesgo de fractura vertebral morfológica y de fractura clínica del 56% y del 52%, respectivamente38. Un análisis de subgrupos del estudio VERO demostró que la eficacia antifractura de TPTD se mantenía independientemente de la edad de las pacientes, del número y de la severidad de las fracturas vertebrales en el momento de inclusión, y de haber recibido tratamiento previo con BF39.
La eficacia en la reducción de fracturas en pacientes con OPM tratadas con TPTD 20μg observada en ensayos clínicos controlados ha sido confirmada en estudios observacionales de vida real40,41.
Un motivo de controversia ha sido la supuesta falta de eficacia de TPTD en la reducción del riesgo de fractura de cadera en diversos ensayos clínicos. Sin embargo, un metaanálisis, que incluía 23 ensayos clínicos controlados comparando TPTD con placebo u otros fármacos anti-osteoporóticos, demostró que TPTD reducía significativamente el riesgo de fractura de cadera en un 56%, tras una mediana de tratamiento de 18meses42. Sin embargo, estos datos deben tomarse con cautela, dada la gran heterogeneidad de los estudios incluidos.
AbaloparatidaLa eficacia antifractura de ABL fue evaluada en el estudio ACTIVE. Se incluyeron 2.463 mujeres con OPM (definida por criterios densitométricos y/o de fractura), que fueron asignadas aleatoriamente a recibir tratamiento diario durante 18meses con ABL 80μg, TPTD 20μg (brazo abierto) o PBO. El objetivo primario del estudio fue valorar la incidencia de nuevas fracturas vertebrales morfométricas. Adicionalmente, se evaluó la incidencia de fractura no vertebral, fractura clínica y fractura osteoporótica mayor (húmero, muñeca, cadera y vertebral clínica). Al cabo de 18meses, ABL demostró, frente a PBO, reducir de forma significativa el riesgo de nueva fractura vertebral (86%), fractura no vertebral (43%), fractura clínica (43%) y fractura osteoporótica mayor (70%)25. Aunque el tratamiento con TPTD también redujo de forma significativa frente a PBO el riesgo de nueva fractura vertebral (80%), no se observaron diferencias significativas entre TPTD y PBO en el resto de las fracturas25. Es de destacar que la reducción del riesgo de fractura osteoporótica mayor (variable exploratoria) fue un 55% superior con ABL que con TPTD. No obstante, cabe decir que el estudio no tenía la potencia estadística suficiente para detectar diferencias en la incidencia de fractura entre las pacientes tratadas con ABL o TPTD25. El estudio ACTIVE se continuó con una extensión en modo abierto, ACTIVExtend, de 24meses adicionales, donde las pacientes previamente tratadas con ABL fueron cambiadas a alendronato (ALN)43.
Subsiguientes análisis post hoc de los estudios ACTIVE y ACTIVExtend han confirmado que la eficacia antifractura de ABL es independiente de factores de riesgo basales, tales como la edad, la presencia de fractura previa, el valor de la DMO y el riesgo basal de fractura según FRAX44-48.
Aunque no hay estudios que comparen directamente la eficacia antifractura de ABL frente a un BF, un análisis post hoc ha permitido comparar el grupo tratado con ABL en el ACTIVE con el grupo tratado únicamente con ALN (PBO/ALN) en el ACTIVExtend, concluyendo que el riesgo de nueva fractura vertebral es un 71% menor con ABL que con ALN49.
Finalmente, en un estudio de vida real realizado en mujeres con OPM se observó una menor y significativa incidencia de fractura de cadera en las pacientes tratadas con ABL respecto al grupo de TPTD (reducción del riesgo del 22%)50. Los investigadores del estudio sugieren, como posible explicación de este resultado, las diferencias histomorfométricas y biomecánicas en subregiones anatómicas de la cadera observadas algunos estudios previamente comentados50.
Las comparaciones de ABL y TPTD procedentes de estudios clínicos directamente comparativos se muestran en la tabla 1.
Estudios clínicos comparativos entre abaloparatida y teriparatida
| Tipo de estudio | Población | n | Fármaco, dosis y vía | Tiempo de seguimiento | Densidad mineral ósea (DMO) | Fracturas | Seguridad | Ref |
|---|---|---|---|---|---|---|---|---|
| Fase II, ECA (búsqueda de dosis) | Mujeres con OPM (DMO <−2,5 T en CL, CF o CT; o DMO <−2,0 T, más historia de fractura por fragilidad en 5años previos; o DMO <−2,0 T, más factores de riesgo de OP), y de 55 a 85 años | 222 | ABL, 20μg scABL, 40μg scABL, 80μg scTPTD, 20μg scPbo | 24 semanas | DMO, CL: incremento significativo con ABL (40 y 80) y TPTD 20, vs Pbo.DMO, CF: incremento significativo con ABL 80, vs Pbo.DMO, CT: incremento significativo con ABL (40 y 80), vs Pbo y TPTD | NE | EA se comunicaron en 71% a 78% de las pacientes; la mayoría de intensidad leve y moderada.Cefalea y mareos fueron más frecuentes en ABL (40 y 80).La hipercalcemia (calcio sérico >10,5mg/dl), a 4 horas post-dosis fue significativamente más frecuente con TPTD (40%) que con ABL (7%-14%). A las 24 horas se perdió la significación estadística | Leder BZ et al., 201524 |
| Fase III, ECAACTIVE | Mujeres de 49 a 86 años, con OPM (DMO <−2,5 T y >−5,0 T en CL o CF, y evidencia radiológica de >2 FV leves o >1 FV moderada, o antecedentes de FNV por fragilidad, en 5años previos).Mujeres de >65años, con fractura por fragilidad y una DMO <−2,0 T y >−5,0 T, o sin fractura y una DMO <−3,0 T y >−5,0 T | 2.463 | ABL, 80μg sc (n=824)Pbo (n=821)TPTD, 20μg sc (n=818, grupo abierto) | 18 meses | Incremento significativo (p<0,001) en DMO de CL, CF y CT, con ABL respecto a Pbo, a 6, 12, y 18 meses.Incremento significativo (p<0,001) en DMO de CL, CF y CT, con TPTD respecto a Pbo, a 6, 12, y 18 meses.Incremento significativo (p<0,001) en DMO de CF y CT a 6, 12, y 18 meses, y en DMO de CL a 6 y 12 meses con ABL respecto a TPTD | Reducción significativa (p<0,001) del RR de nuevas FV respecto a Pbo con ABL (86%) y TPTD (80%).Reducción significativa del RR de FNV (43%; p<0,05), fractura clínica (43%; p<0,05) y fractura OP mayor (70%; p<0,001) con ABL respecto a Pbo.Reducción significativa del RR de fractura OP mayor con ABL respecto a TPTD (55%; p<0,05) | La incidencia de EA, incluidos los graves, fue similar en los tres brazos del ensayo.Más abandonos debidos a EA en el grupo de ABL (9,9%), siendo los que más frecuentemente causaron abandono con ABL: náusea (1,6%), mareo (1,2%), cefalea (1,0%), y palpitaciones (0,9%).La incidencia de hipercalcemia (calcio sérico >10,7mg/dl) fue significativamente mayor (p=0,006) con TPTD (6,4%) que con ABL (3,4%) a lo largo del estudio | Miller PD et al., 201625 |
| Estudio retrospectivo, observacional (bases de datos de compañías aseguradoras de salud) | Mujeres de >50años con al menos una prescripción de ABL o TPTD, excluidas enfermedad de Paget y neoplasias malignas | 23.232 | ABL, 80μg sc (n=11.616)TPTD, 20μg sc (n=11.616)Poblaciones finales tras pareamiento por puntaje de propensión | Fecha índice: mayo 2017 a julio 2019.Seguimiento de 18 meses tras la fecha índice | NE | El RR para FNV nueva fue equiparable en los grupos de ABL (2,9%) y TPTD (3,2%).Se observó una reducción del RR del 22% (p<0,05) en la incidencia de fractura de cadera con ABL respecto a TPTD | La incidencia estimada de eventos adversos cardiovasculares mayores (MACE), con/sin IC, fue similar en ambos grupos: ABL (3,0%) y TPTD (3,1%) | Cosman et al.50 |
ABL: abaloparatida; CF: cuello femoral; CL: columna lumbar; CT: cadera total; DMO: densidad mineral ósea; EA: eventos adversos; ECA: ensayo clínico aleatorizado; FNV: fractura no vertebral; FV: fractura vertebral; IC: insuficiencia cardiaca; MACE: Major Adverse Cardiovascular Event; μg: microgramos; NE: no evaluado; OP: osteoporosis; OPM: osteoporosis posmenopáusica; Pbo: placebo; RR: riego relativo; sc: subcutánea; TPTD: teriparatida.
Los análogos de PTH/PTHrP son fármacos que, por lo general, presentan buena tolerabilidad. En los ensayos clínicos controlados de TPTD21,38 y ABL25, igual que en los estudios de vida real40,41,50, los eventos adversos (EA) más comúnmente reportados con ambos tratamientos fueron náuseas, mareos, cefalea, hipotensión ortostática, calambres, dorsalgia, artralgias y dolor en las extremidades. Algunos pacientes tratados con TPTD o ABL pueden presentar hipercalcemia, hipercalciuria, hiperuricemia o hipomagnesemia. La hipercalcemia suele ser leve, asintomática y transitoria. En el estudio ACTIVE, la incidencia de hipercalcemia (un objetivo pre-especificado de seguridad) fue menor en el grupo de ABL que en el de TPTD, hallazgo consistente con la menor resorción ósea causada por ABL comparada con TPTD25. En este mismo estudio, el abandono por EA de origen vascular (palpitaciones, mareo, náusea y cefalea) fue mayor con ABL que con TPTD, aunque estos EA fueron de intensidad leve y moderada25. Los autores del estudio no descartan un posible sesgo en la comunicación de EA, debido al brazo abierto de TPTD en el ensayo25.
Seguridad cardiovascularLa seguridad cardiovascular (CV) de TPTD y ABL ha sido evaluada, además de en los estudios pivotales, en un estudio observacional de vida real. En este estudio, tras 18meses de tratamiento, TPTD y ABL mostraron riesgos bajos y similares de EA CV mayores (MACE), incluyendo infarto de miocardio, ictus y muerte hospitalaria de causa CV (3,1% con TPTD frente a 3% con ABL)50.
Seguridad ósea (riesgo de osteosarcoma no demostrado)El ensayo clínico pivotal FPT de TPTD, diseñado para 3años de duración, tuvo que interrumpirse prematuramente después de una mediana de 19meses de tratamiento21, cuando un estudio concomitante toxicológico en ratas Fischer344 mostró una probable mayor incidencia de osteosarcoma51. La Food and Drug Administration (FDA) decidió aprobar el uso de TPTD (Forteo®), si bien durante una administración máxima de 24meses, e incluyendo en la información de producto un recuadro de advertencia sobre el riesgo potencial de osteosarcoma52.
En 2020, la FDA, tomando en consideración la ausencia de casos de osteosarcoma con TPTD desde su comercialización, decidió retirar la advertencia del posible riesgo de osteosarcoma en humanos, aunque manteniendo la recomendación de evitar este tratamiento en población con riesgo elevado de este tipo de tumor (pacientes con enfermedad ósea de Paget o con antecedentes de radioterapia sobre el esqueleto)52.
Durante el desarrollo clínico de ABL también se llevaron a cabo estudios de toxicidad ósea similares a los de TPTD53. La FDA, al igual que exigió en su momento con Forteo®, autorizó el registro de ABL (Tymlos®), con la restricción de uso de 24meses (teniendo en cuenta también el tiempo de tratamiento de un análogo de PTH como TPTD), y con un recuadro de advertencia en la información de producto sobre el riesgo de osteosarcoma. En 2021, en la línea de lo sucedido con TPTD, la FDA también eliminó la advertencia sobre el riesgo potencial de osteosarcoma en humanos con ABL54.
Los análogos de la PTH/PTHrP en la terapia secuencialLas guías clínicas recomiendan el uso de análogos de la PTH/PTHrP, dentro del grupo de fármacos osteoformadores, como tratamiento de primera línea en pacientes con osteoporosis (OP) con riesgo muy alto de fractura5-11. Sin embargo, la limitación de la duración del tratamiento con los análogos de la PTH y de la PTHrP a un máximo de 24 y 18meses, respectivamente, y el riesgo de pérdida de las ganancias en DMO y calidad ósea, tras la discontinuación de estos tratamientos, obliga a plantear un tratamiento secuencial con fármacos antirresortivos. La evidencia parece apoyar la secuencia fármaco anabólico seguido de un antirresortivo tanto por la ganancia de DMO, como por la eficacia antifractura12-14.
Antirresortivos seguidos de análogos de la PTH/PTHrPSe ha observado una atenuación y retraso en la respuesta anabólica de TPTD, cuando se administra después de BF, especialmente los más potentes. No obstante, el efecto atenuador precoz sobre la DMO del tratamiento previo con BF no parece repercutir negativamente ni en la resistencia ósea, ni en la eficacia antifractura de TPTD, tal y como se ha podido comprobar en un análisis de subgrupos del estudio VERO39.
En el estudio DATA-Switch se observó que el cambio de tratamiento de denosumab (DMAB), un potente antirresortivo, a TPTD se asoció con un incremento del remodelado óseo y con pérdidas de DMO significativas y transitorias en cadera y CL, y aún mayores en radio distal55. Por este motivo, algunos expertos recomiendan en pacientes con fracaso terapéutico a DMAB combinar el tratamiento de TPTD (sin suspender el DMAB). En el estudio DATA-Switch no se analizó el efecto del tratamiento sobre la incidencia de fractura, por lo que no se conoce si estos cambios en la DMO se traducen en un aumento del riesgo de fractura55.
Análogos de la PTH/PTHrP seguidos de antirresortivosEsta es la secuencia terapéutica más recomendada para el tratamiento de los pacientes con OP grave o con riesgo muy alto de fractura, y así se refleja en las guías para el manejo de la OP, conforme a la evidencia disponible.
En el ACTIVExtend, único ensayo clínico que ha evaluado el riesgo de fractura tras la transición de un análogo de PTH/PTHrP a un antirresortivo, después del período total de 42meses (18 +24), el grupo ABL/ALN, respecto al grupo PBO/ALN, mantuvo la eficacia en la reducción del riesgo de fractura vertebral (84%), fractura no vertebral (39%), fractura clínica (34%) y fractura osteoporótica mayor (50%)43.
Perfil de paciente tributario a teriparatida o abaloparatidaLas guías clínicas nacionales5-7 e internacionales8-11 más recientes para el manejo de la OPM posicionan los fármacos osteoanabólicos (análogos de la PTH y ROMO) como primera línea de tratamiento para las pacientes con OP y con riesgo muy alto de fractura, durante el tiempo establecido en las respectivas fichas técnicas, y seguidos de un tratamiento antirresortivo potente, preferiblemente ácido zoledrónico o DMAB.
La definición de «riesgo muy alto de fractura» varía entre las guías de las diferentes sociedades médicas. En España, las guías de la SEIOMM 20227 y SECOT 20225 utilizan un enfoque basado en la presencia de fracturas previas y/o valor de la DMO, medido con puntuaciónT. La edición de las recomendaciones para el tratamiento de la osteoporosis de la SER de 2019 incluye la categoría «riesgo alto de fractura» basada en valores de FRAX o en la presencia de dos o más factores de riesgo elevado de fractura6.
A la hora de elegir entre TPTD o ABL debemos tener en cuenta que son fármacos con un perfil de seguridad similar y sin diferencias significativas en la reducción del riesgo de fractura vertebral. Las diferencias radican en su efecto sobre el hueso cortical, consiguiendo ABL una mayor ganancia de DMO en fémur proximal25,46.
Por todo ello ABL podría indicarse igual que TPTD en pacientes con muy alto riesgo de fractura, con o sin fractura vertebral previa, aunque podría ser más beneficioso que TPTD en pacientes con DMO muy baja en cadera o antecedentes de fractura no vertebral o fractura de cadera.
Es importante mencionar que en el momento de la redacción de este artículo de revisión ABL solo tiene indicación en Europa para mujeres posmenopáusicas, mientras que TPTD también tiene indicación en varones con alto riesgo de fractura.
ConclusionesLos análogos de la PTH/PTHrP, fármacos incluidos dentro del grupo de los osteoanabólicos u osteoformadores, han demostrado ser eficaces y seguros en el tratamiento de la OPM, especialmente en el grupo de pacientes con osteoporosis grave y riesgo muy alto de fractura.
TPTD y ABL comparten algunas semejanzas, pero también presentan diferencias. Ambos fármacos se unen al mismo receptor, PTH1R, y desencadenan respuestas de señalización muy parecidas, con una acción anabólica similar, pero con un efecto resortivo que es mayor con TPTD, visible sobre todo en hueso cortical17-19. Por esta razón la ventana anabólica probablemente sea mayor con ABL20, consiguiendo mayores ganancias de DMO sobre todo en cadera25,46. Sin embargo, son necesarios estudios clínicos comparativos entre ambos tratamientos para confirmar estas diferencias.
FinanciaciónNo ha habido financiación para la realización del estudio ni para la redacción del manuscrito.
Consideraciones éticas: obtención de consentimiento informadoNo procede.
Conflicto de interesesEC ha recibido financiación para asistencia a congresos, y por ponencias o por consultorías de Lilly, Amgen, UCB, Theramex, Rubió, STADA, Gedeon-Richter y GP-Pharm.
GMDG ha recibido financiación para asistencia a congresos, y por ponencias, consultorías y elaboración de documentos de consenso, de UCB, Amgen, Alexion, Kyowa-Kirin, Italfarmaco, Takeda, Ascendis, Theramex y Grünenthal.
JRCR ha recibido financiación para asistencia a congresos, y por ponencias o consultorías, de Amgen, Gedeon-Richter, Lilly, STADA, Theramex y UCB.