La pandemia de COVID-19 ha impactado gravemente en la población mundial, con una gran tasa de morbilidad y mortalidad. Si bien la evidencia hasta la fecha ha intentado definir la clínica de la enfermedad aguda, informes recientes también han comenzado a describir síntomas persistentes que se extienden más allá del período inicial de la enfermedad. Se ha encontrado que los resultados adversos, además de respiratorios, se presentan a diferentes niveles: cardiovascular, neurológico o inmunológico, manifestaciones cutáneas, gastrointestinales o renales. También se ha descrito el efecto perjudicial sobre la salud mental, no solo en pacientes con COVID-19. Es probable que la carga de enfermedad secundaria a esta pandemia sea enorme y no se limite únicamente a la enfermedad aguda, por lo que se necesitan estudios epidemiológicos que investiguen más a fondo el impacto a largo plazo de esta patología. Esta revisión resume la evidencia actual sobre los efectos a corto plazo y describe las posibles secuelas a largo plazo de la COVID-19.
COVID-19 pandemic has impacted the world population, with a high rate of morbidity and mortality. While the evidence to date has attempted to describe clinical feature of acute illness, recent reports have also begun to describe persistent symptoms that extend beyond the initial period of illness. Adverse outcomes, in addition to respiratory, have been found to occur at different levels: cardiovascular, neurological, or immunological; skin, gastrointestinal or renal manifestations. The detrimental effect on mental health has also been described, not only in COVID-19 patients. The burden of disease secondary to this pandemic is likely to be enormous and not limited to acute disease alone, thus epidemiological studies are needed to further investigate the long-term impact of this disease. This review summarizes the current evidence on short-term effects and describes the possible long-term sequelae of COVID-19.
La batalla contra la COVID-19 no parece terminar con su detección y el tratamiento de la enfermedad aguda. Los síntomas persistentes descritos hasta ahora por supervivientes de la COVID-19, aunque heterogéneos, muestran una alta incidencia. Sin embargo, aún no existen estudios a largo plazo sobre este tema. No se ha determinado si estas manifestaciones persistentes experimentadas por los pacientes representan un nuevo síndrome exclusivo de COVID-19 o si existe una superposición con la fase de recuperación de enfermedades similares. Gran parte de lo informado hasta ahora está en línea con los hallazgos de otros síndromes postvirales1 y los encontrados en pacientes críticos (no COVID) que han sido dados de alta de la Unidad de Cuidados Intensivos (UCI) y que aún experimentan una amplia gama de síntomas meses después de la hospitalización, lo cual ha sido denominado síndrome post-UCI2.
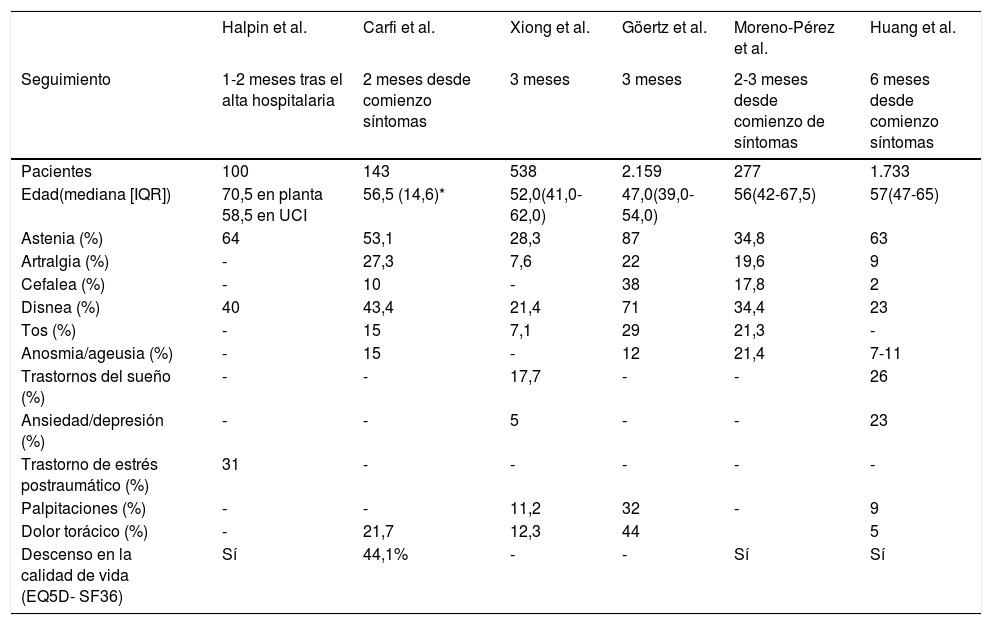
Los síntomas físicos más frecuentes descritos son la fatiga, la disnea, el dolor u opresión en el pecho, las alteraciones de gusto u olfato y la tos. Otras secuelas descritas menos recurrentes son cefalea, artralgias, anorexia, mareos, mialgias, insomnio, alopecia, sudoración y diarrea. La bibliografía sostiene que algunos síntomas se resuelven más rápidamente que otros. Por ejemplo, la fiebre, los escalofríos y las manifestaciones olfativas/gustativas suelen resolverse entre las dos y las cuatro semanas, mientras que la fatiga, la disnea, la opresión en el pecho, los déficits cognitivos y los efectos psicológicos pueden llegar a durar meses3–7 (tabla 1).
Síntomas más frecuentes en la fase postaguda de COVID-19
| Halpin et al. | Carfi et al. | Xiong et al. | Göertz et al. | Moreno-Pérez et al. | Huang et al. | |
|---|---|---|---|---|---|---|
| Seguimiento | 1-2 meses tras el alta hospitalaria | 2 meses desde comienzo síntomas | 3 meses | 3 meses | 2-3 meses desde comienzo de síntomas | 6 meses desde comienzo síntomas |
| Pacientes | 100 | 143 | 538 | 2.159 | 277 | 1.733 |
| Edad(mediana [IQR]) | 70,5 en planta 58,5 en UCI | 56,5 (14,6)* | 52,0(41,0-62,0) | 47,0(39,0-54,0) | 56(42-67,5) | 57(47-65) |
| Astenia (%) | 64 | 53,1 | 28,3 | 87 | 34,8 | 63 |
| Artralgia (%) | - | 27,3 | 7,6 | 22 | 19,6 | 9 |
| Cefalea (%) | - | 10 | - | 38 | 17,8 | 2 |
| Disnea (%) | 40 | 43,4 | 21,4 | 71 | 34,4 | 23 |
| Tos (%) | - | 15 | 7,1 | 29 | 21,3 | - |
| Anosmia/ageusia (%) | - | 15 | - | 12 | 21,4 | 7-11 |
| Trastornos del sueño (%) | - | - | 17,7 | - | - | 26 |
| Ansiedad/depresión (%) | - | - | 5 | - | - | 23 |
| Trastorno de estrés postraumático (%) | 31 | - | - | - | - | - |
| Palpitaciones (%) | - | - | 11,2 | 32 | - | 9 |
| Dolor torácico (%) | - | 21,7 | 12,3 | 44 | 5 | |
| Descenso en la calidad de vida (EQ5D- SF36) | Sí | 44,1% | - | - | Sí | Sí |
El propósito de esta revisión es describir el conocimiento existente sobre la fase postaguda-crónica de COVID-19 para cada uno de los órganos y aparatos sobre los que disponemos información y comprender la evidencia existente sobre las manifestaciones en fase crónica para brindar atención a estos pacientes a largo plazo.
Material y métodosPara la realización de esta revisión se han usado herramientas de búsqueda internacional tales como: PubMed, Scholar, Embase, Web of Science y UpToDate. Se ha efectuado una búsqueda sistemática de la bibliografía, utilizando los siguientes términos como criterios de búsqueda en diferentes combinaciones: COVID-19, SARS-CoV-2, coronavirus, respiratorio, función respiratoria, tomografía computarizada (TC); imagen, fibrosis, disminución de la capacidad de difusión (DLCO), digestivo, diarrea, ageusia, anosmia, bradipsiquia, neuropatía, ansiedad, suicidio, Alzheimer, gasto cardiaco, función cardiaca, troponinas, deportistas, miocarditis, resonancia magnética (RM); enfermedad tromboembólica, troboembolismo, hipertensión pulmonar, autoinmunidad, anti-fosfolípidos, entre otros términos. Hemos consultado más de 200 artículos para la realización de esta revisión.
ResultadosAsteniaLa astenia es reconocida como una de las secuelas más frecuentes en personas infectadas con SARS-CoV-2. A pesar de su elevada prevalencia, existe poca bibliografía que haya pormenorizado en este fenómeno. La astenia que dura seis meses o más, sin una explicación que la justifique, se denomina síndrome de fatiga crónica (SFC) y, a pesar de haber sido relacionada con infecciones por coronavirus previos, en el caso de COVID-19, la ausencia de asociación entre su aparición y la gravedad de la infección inicial tiene importantes implicaciones en el número potencial de pacientes que pueden verse afectados8.
Sin embargo, debe tenerse en cuenta que la astenia es una sensación, pudiendo variar de una persona a otra y carecemos de una prueba que confirme este diagnóstico. El sexo femenino y las personas con un diagnóstico previo de depresión o ansiedad tenían un mayor riesgo de sufrir fatiga. No obstante, su fisiopatología en pacientes que han superado la COVID-19, así como sus posibles asociaciones y valores predictores, deben investigarse en estudios longitudinales a largo plazo.
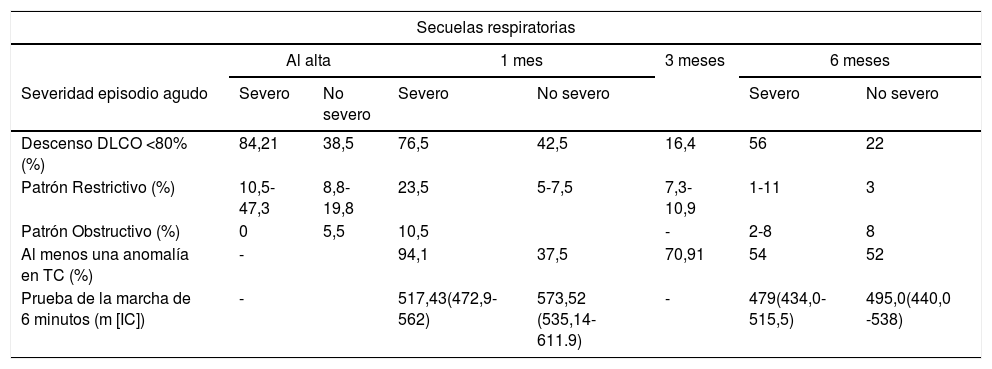
Secuelas respiratoriasEn torno a los supervivientes de COVID-19, se ha informado de un amplio espectro de manifestaciones pulmonares que se hacen patentes en las pruebas funcionales y espirométricas (tabla 2). Atendiendo al período subagudo, en un estudio de 110 pacientes hospitalizados se realizaron pruebas de función pulmonar (PFP) al alta o un día antes9. Se observaron anomalías en la DLCO en el 47,2% de los pacientes con < 80% de la capacidad prevista, con una mayor frecuencia en aquellos que habían experimentado una enfermedad más grave.
Prevalencia de las secuelas respiratorias y neurológicas en pacientes que han sufrido la COVID-19
| Secuelas respiratorias | |||||||
|---|---|---|---|---|---|---|---|
| Al alta | 1 mes | 3 meses | 6 meses | ||||
| Severidad episodio agudo | Severo | No severo | Severo | No severo | Severo | No severo | |
| Descenso DLCO <80% (%) | 84,21 | 38,5 | 76,5 | 42,5 | 16,4 | 56 | 22 |
| Patrón Restrictivo (%) | 10,5-47,3 | 8,8-19,8 | 23,5 | 5-7,5 | 7,3-10,9 | 1-11 | 3 |
| Patrón Obstructivo (%) | 0 | 5,5 | 10,5 | - | 2-8 | 8 | |
| Al menos una anomalía en TC (%) | - | 94,1 | 37,5 | 70,91 | 54 | 52 | |
| Prueba de la marcha de 6 minutos (m [IC]) | - | 517,43(472,9-562) | 573,52 (535,14-611.9) | - | 479(434,0-515,5) | 495,0(440,0 -538) | |
| Secuelas neurológicas | ||
|---|---|---|
| 6 meses | ||
| No hospitalizados | UCI | |
| ACV hemorrágico (%) | 0,31 | 2,66 |
| ACV isquémico (%) | 0,14 | 1,05 |
| Guillain-Barré (%) | 0,05 | 0,33 |
| Neuropatía, plexopatía, radiculopatía (%) | 2,69 | 4,24 |
| Miopatía (%) | 0,16 | 3,35 |
| Encefalitis (%) | 0,05 | 0,35 |
| Delirio (%) | 0,35 | 1,74 |
| 2 meses | 6 meses | |
| Anosmia/ageusia (%) | 12-32,6 | 24 |
ACV: accidente cerebrovascular; DLCO: disminución de la capacidad de difusión; IC: intervalo de confianza; TC: tomografía computarizada; UCI: Unidad de Cuidados Intensivos.
En un metanálisis, Torres et al.10 establecen la DLCO como la alteración de la función respiratoria más repetida a corto-medio plazo, ocurriendo en el 39% de los pacientes ingresados. Secundariamente, se describe el desarrollo de patrón restrictivo y patrón obstructivo en 15 y 7% de los pacientes, respectivamente. Huang et al.11, tras el seguimiento de 57 pacientes a los 30 días del alta, muestran que aproximadamente tres cuartas partes desarrollaron deterioro de la función pulmonar, volviendo a ser lo más frecuente el descenso de la DLCO y la disminución de la relación volumen espiratorio forzado en el primer segundo/capacidad vital forzada (FEV1/FVC). En contraposición a lo anterior, un estudio más reciente del que se excluyó a aquellos pacientes que necesitaron ventilación mecánica (VM), a las seis semanas del ingreso no se reflejaron alteraciones en las PFP, salvo una mínima disminución de la DLCO. Esto sugiere que secuelas descritas en estudios previos no son sino consecuencia de los efectos que provoca la VM a corto-medio plazo12.
A los tres meses tras el alta, Zhao et al.13 encuentran que estas anomalías residuales de la función pulmonar persisten en el 25,4% de los pacientes, en su mayoría en forma de reducciones de la DLCO, seguidas de descensos de FEV1, FVC y capacidad pulmonar total (TLC), sugerentes de cambios fibróticos. Por su parte, Moreno et al.7, tras el seguimiento de una cohorte mediterránea durante 10 a 14 semanas, muestra que las alteraciones espirométricas estaban presentes en 9,3% de los pacientes; aunque, esta vez, a favor del patrón obstructivo, que fue leve en el 63,6%. Huang et al.14 observan que, a los meses, aún permanece el descenso de la difusión, en una proporción que oscila entre el 22% para los pacientes que no necesitaron oxígeno suplementario durante el ingreso y el 56% para aquellos que requirieron VM.
Las secuelas mantenidas en la función respiratoria son compatibles con un patrón restrictivo secundario a anomalías intersticiales. Diversos informes describen la existencia de anomalías radiológicas residuales tras la recuperación clínica y el alta, incluso meses después. Por ejemplo, Huang et al.11 reflejan que a los 30 días tras el alta más de la mitad de los pacientes aún presentaban alteraciones en el TC, principalmente opacidades en vidrio deslustrado (OVD) de distribución periférica, que en comparación con los TC previos habían disminuido. A los tres meses, Zhao et al.13 encuentran que las manifestaciones radiológicas típicas de la fase aguda como la consolidación y el patrón en empedrado estaban prácticamente resueltas, pero se siguen manteniendo anomalías radiológicas (70,91%) a pesar de la mejoría clínica respiratoria, incluso con fibrosis en forma de engrosamiento intersticial (27,7%). A los seis meses14, aproximadamente la mitad de los pacientes que requirieron ingreso hospitalario mantenían en el TC al menos un hallazgo patológico, siendo las OVD y la fibrosis, las más importantes; relacionándose el volumen de la lesión con la gravedad del estado agudo. El patrón en empedrado es mínimo en el seguimiento como resultado de esa recuperación. Tampoco se observan adenopatías, patrón de árbol en brote, masas, afectación mediastínica, derrame pleural, cavitación ni calcificaciones.
Por su parte, Rogliani et al.15 describen que las anomalías radiológicas se recuperan por completo durante el seguimiento en aquellos casos leve-moderados, sin evidencia de anormalidades fibróticas. La función pulmonar y la capacidad de ejercicio también se encontraban en el rango normal. Esto proporciona evidencia preliminar para sugerir que en los pacientes hospitalizados con formas predominantemente leves-moderadas de COVID-19 el riesgo de secuelas funcionales y fibróticas es mínimo.
Un dato valioso en la posible predicción de secuelas respiratorias es la información aportada por el TC, habiéndose hallado una relación entre el grado de compromiso pulmonar durante la evaluación radiológica inicial y la persistencia de anomalías pulmonares a medio-largo plazo. Tabatabaei et al.16 observaron que existía una relación entre la evaluación radiológica inicial y la persistencia de anomalías pulmonares a medio-largo plazo (10,3±5,4 vs. 7,3±4,6; p = 0,036).
Diversos trabajos han estudiado la capacidad funcional tras la COVID-19, especialmente mediante la prueba de la marcha de seis minutos (6 MWT)17. Daher et al.12 informan que el 79% de los pacientes a los 30 días del alta tenían distancias de marcha por debajo de sus valores predichos, de los cuales el 46% tenía cifras incluso inferiores a los límites mínimos normales ajustados por edad. Los valores a los tres meses de otro estudio18 revelan que el 22% de los pacientes tuvo una 6 MWD < 80% de lo previsto. El 16% de los individuos desaturaron, presentando una asociación con el descenso de la DLCO.
La limitación de las capacidades físicas y funcionales de los pacientes puede suponer un agravante para su calidad de vida. Halpin et al.5 describen a las semanas del alta una caída significativa del cuestionario European Quality of Life - 5 Dimensions (EQ5D)19 en el 68,8% de los participantes que requirieron UCI y en el 45,6% de los del grupo de planta. Van der Sar et al.20 informan que todos los ítems del cuestionario SF-3621, excepto el dolor corporal, fueron significativamente inferiores a la norma, encontrándose una correlación importante con el descenso de la DLCO. Sin embargo, esta asociación es débil, lo que indica que la calidad de vida está determinada por más aspectos como el aislamiento social. A los seis meses14 persisten estos síntomas, con mayor gravedad y prevalencia para aquellos pacientes en estado crítico durante la fase aguda, presentando más problemas de movilidad, dolor/malestar y ansiedad/depresión.
Secuelas cardiológicasEn lo relativo a las manifestaciones cardiacas, inicialmente se pensó que la frecuencia de compromiso cardiaco resultante de la enfermedad del SARS-CoV-2 se asociaba directamente con la gravedad del curso clínico de la patología y la presencia de comorbilidades. Apoyando esta teoría, un estudio realizado por Huang et al.22 en sujetos recuperados que presentaron clínica cardiológica durante la fase aguda reveló hallazgos anormales en la resonancia magnética cardiaca (RMC) en el 58% de los pacientes a los 50 días del inicio de los síntomas, destacando la disminución de la fracción de eyección del ventrículo derecho, edema miocárdico sugestivo de miocarditis y fibrosis. Sin embargo, los estudios de RMC más recientes de individuos recuperados de COVID-19 han demostrado una alta frecuencia de compromiso cardiaco a pesar de un curso asintomático o benigno de la enfermedad23,24.
Puntmann et al.23 compararon las imágenes de RMC de 100 pacientes (49±14 años) con COVID-19 tras tres meses del diagnóstico con controles sanos. Los participantes que se habían recuperado tenían una fracción de eyección del ventrículo izquierdo más baja y en una proporción considerable se detectaron valores altos de troponina T ultrasensible. El 78% de los pacientes con COVID-19 recuperados presentaban algún tipo de compromiso cardiaco observable en la RMC, como miocarditis, cicatrización o realce pericárdico. Curiosamente, los sujetos con COVID-19 oligosintomáticos tuvieron una inflamación miocárdica similar al subgrupo hospitalizado, lo cual podría relacionarse con la edad de los pacientes del estudio y la presencia más frecuente de factores de riesgo, así como de lesiones previas silentes o no diagnosticadas.
Rajpal et al.24 demuestran, tras el seguimiento (11 a 53 días) de 26 deportistas universitarios, signos de miocarditis activa en el 15% de ellos y en un 30% adicional, fibrosis miocárdica aislada. Sin embargo, en otro grupo de 26 atletas de élite que cursaron de forma mayoritariamente asintomática o leve la infección por COVID-1925 no han existido criterios para el diagnóstico de miocarditis activa por RM tras uno o dos meses desde el diagnóstico, pudiéndose explicar los hallazgos por la adaptación fisiológica al ejercicio (edema miocárdico aislado).
Secuelas neurológicasLos síntomas neurológicos más frecuentes en COVID-19 son cefalea, mareo, anosmia y ageusia. Otros hallazgos neurológicos incluyen accidentes cerebrovasculares (ACV), deterioro de la conciencia, convulsiones y encefalopatía26 (tabla 2).
Las disfunciones olfativa y/o gustativa son las manifestaciones neurológicas más frecuentes tras la cefalea, con una prevalencia del 52,73% para la disfunción olfativa y del 43,93% para la gustativa informada en un metanálisis reciente27. La mayoría de los pacientes tiene una recuperación completa o casi completa un mes después de la enfermedad aguda, aunque en algunos estudios, estos síntomas persisten más tiempo. Nguyen et al.28, en un seguimiento a 125 pacientes, constatan que el 68,1% recuperó el olfato y el 73% el gusto durante las primeras seis semanas posteriores al inicio de los síntomas. Un total de 30 pacientes (24%) informaron de la persistencia de anosmia/ageusia hasta siete meses después.
También se han publicado casos, durante la fase aguda, de ACV. La incidencia de ACV en pacientes hospitalizados es del 1,1%, relacionándose el riesgo de padecerlos con la mayor gravedad de la fase aguda y la presencia previa de factores de riesgo cardiovascular29. La evidencia sugiere que el ACV asociado a la enfermedad COVID-19 presenta mayor gravedad que el no asociado, con tasas de mortalidad y de discapacidad mayores30.
Un efecto indirecto de la pandemia COVID-19 ha sido el descenso de los ingresos por ACV, observándose una reducción del 40% en las admisiones en comparación con el mismo período del año anterior31. El miedo a contraer la infección por COVID-19 puede haber disuadido a algunos pacientes con síntomas de ACV más leves de buscar atención.
El síndrome de Guillain-Barré (GBS) también ha sido descrito en pacientes COVID-19. En una revisión de 73 casos de GBS post-COVID-19, Abu-Rumeileh et al.32 informan en estos pacientes síntomas sensoriales solos o en combinación con paraparesia o tetraparesia, ataxia y arreflexia generalizada. La encefalopatía33 se ha descrito en personas con COVID-19 como un factor de mal pronóstico, requiriendo ingresos más largos, mayor deterioro funcional al alta hospitalaria y una tasa de mortalidad a los 30 días más alta.
Se han informado en determinados pacientes secuelas neurológicas derivadas de la estancia en UCI; como la polineuropatía34 y miopatía35 asociadas a la enfermedad. Sin embargo, en un estudio reciente, Daia et al.36 describen casos de estas patologías en individuos que no llegaron a requerir estos cuidados durante la estancia hospitalaria.
Por otra parte, se ha descrito en estos pacientes un riesgo aumentado de delirio debido, además de la invasión directa del sistema nervioso central (SNC) y la inducción de mediadores inflamatorios del mismo, al efecto de las estrategias sedantes, la VM, la inmovilización y otros factores ambientales como el aislamiento social y la cuarentena37.
Secuelas psiquiátricasLa pandemia provocada por el virus SARS-CoV-2 ha supuesto un factor de estrés psicológico significativo. El miedo a la enfermedad, la muerte, la incertidumbre del futuro y el aislamiento social resultante de la pérdida de actividades educativas y laborales amenazan con empeorar la salud mental pública38.
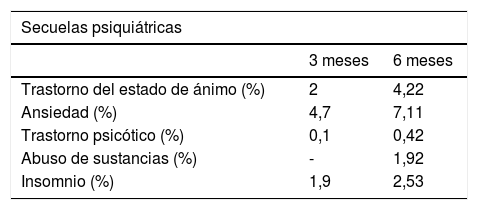
Taquet et al.39 constatan que, a los 90 días del diagnóstico, el riesgo de cumplir criterios para alguna enfermedad psiquiátrica era el doble que en pacientes diagnosticados de otras patologías no COVID-19, siendo la mayor incidencia para los trastornos de ansiedad. Los trastornos del estado de ánimo y de insomnio también fueron elevados. Se ofrecen, además, indicios de que el riesgo de demencia podría multiplicarse por dos o tres tras la infección por SARS-CoV-2. En una publicación del mismo autor40, se realiza un seguimiento a 236.379 supervivientes de COVID-19 durante seis meses, observándose que el riesgo para el diagnóstico de ansiedad o de trastornos del estado de ánimo se mantuvo elevado, aunque menor que a los tres meses. Los trastornos por abuso de sustancias y el insomnio también fueron más comunes en los supervivientes de COVID-19 que en aquellos que padecieron gripe u otras infecciones del aparato respiratorio. La incidencia estimada de diagnóstico neurológico o psiquiátrico en los siguientes seis meses fue 33,62%, con 12,84% recibiendo un primer diagnóstico de estas patologías (tabla 3). En otro seguimiento de 100 pacientes con COVID-195, el 18% afirmó haber sufrido alteración de la memoria y el 16% de concentración entre los 30 a 70 días después de haber recibido el alta; siendo el número mayor entre los pacientes ingresados ??en la UCI.
Prevalencia de las secuelas psiquiátricas y hematológicas en pacientes que han sufrido la COVID-19
| Secuelas psiquiátricas | ||
|---|---|---|
| 3 meses | 6 meses | |
| Trastorno del estado de ánimo (%) | 2 | 4,22 |
| Ansiedad (%) | 4,7 | 7,11 |
| Trastorno psicótico (%) | 0,1 | 0,42 |
| Abuso de sustancias (%) | - | 1,92 |
| Insomnio (%) | 1,9 | 2,53 |
| Secuelas hematológicas | ||
|---|---|---|
| 1 mes | 6 meses | |
| Trombosis arteriales y venosas (%) | 2,5 | 0 |
| Trombosis venosa (%) | 0,6 | - |
| Hemorragia | 3.7 | - |
Con respecto a los efectos indirectos de la COVID-19 en la salud mental general, parece haber evidencia de un aumento de los síntomas de depresión y ansiedad. En un estudio41 se siguió a 333 participantes durante la primera ola y tras cuatro semanas, descubriendo inicialmente tasas de estrés moderado-severo en el 81%, ansiedad en el 28,8% y depresión en el 16,5%. No obstante, no se encontró una reducción significativa en ninguna de las tres tras las cuatro semanas, lo cual puede sugerir una continuación de patología psiquiátrica pasado el control de la pandemia, necesitando estudios que arrojen luz a mayor plazo. En un metanálisis reciente42 de 43 grandes estudios, se estima que la prevalencia de trastornos de ansiedad en la población general durante el inicio de la pandemia fue del 25%, triplicando la prevalencia previa a la pandemia. Por su parte, en otro metanálisis, Bueno et al.43 constatan un aumento en la prevalencia de trastornos depresivos siete veces superior a los presentes antes de la pandemia. Consecuentemente, los resultados de otro estudio indicaron aumentos sustanciales relacionados con COVID-19 en el abuso de alcohol (23%) y drogas (16%)44. A esto, debemos sumar los efectos perjudiciales alimentados por una difusión «infodémica»45 a través de diferentes plataformas, suscitando miedo y pánico mediante rumores sin control y sensacionalismo.
Los trabajadores de la salud deben considerarse un grupo altamente expuesto, no solo al propio virus, sino que presentan un mayor riesgo de desarrollar síntomas psiquiátricos, habiéndose descrito un aumento del estrés, trastorno de estrés postraumático, trastornos del sueño, ansiedad y depresión en este grupo46.
Secuelas trombóticasLa fase aguda de la enfermedad se asocia con una respuesta inflamatoria exacerbada que acompaña un riesgo importante de trombosis de entre los que se han descrito la isquemia aguda de extremidades, síndrome coronario agudo, tromboembolismo venoso (TEV) o ACV, entre otros47. Dadas las altas tasas de trombosis en pacientes hospitalizados con COVID-19, cabría esperar que este riesgo se extendiera tras el alta en el ámbito ambulatorio.
Sin embargo, el riesgo a largo plazo de tromboembolia post-COVID-19 está mal definido; un estudio de 163 pacientes, de los cuales 42 (26%) requirieron ingreso en la UCI, tuvo una incidencia acumulada de TEV a los 30 días del alta del 0,6%. Por otra parte, la tasa acumulada a los 30 días de hemorragia fue del 3,7%. Estas tasas son comparables a las de TEV y hemorragias posteriores al alta observadas en pacientes con formas similares de enfermedad aguda no COVID-1948 (tabla 3). De esta forma, todo parece apuntar a que la hospitalización por COVID-19 no aumenta el riesgo de TEV tras el alta en comparación con el ingreso por otra enfermedad médica aguda al alta.
Por tanto, en lo relativo a la profilaxis del TEV tras el alta, a pesar del estado protrombótico y proinflamatorio observado durante la hospitalización, la evidencia actual iría en contra de realizar desviaciones de la práctica estándar para los pacientes con COVID-19.
AutoinmunidadAunque no está bien establecida la patogenia de las enfermedades autoinmunes, dados los mecanismos patogénicos y los aspectos clínico-radiológicos compartidos entre las enfermedades proinflamatorias y la COVID-19, se ha sugerido que el SARS-CoV-2 podría actuar como un factor desencadenante para el desarrollo de una desregulación autoinmune49.
Desde el comienzo de la pandemia, ha habido un aumento notable en el número de casos de enfermedad de Kawasaki (EK)50, lo que sugiere una asociación entre el SARS-CoV-2 y esta patología. Además, se han descrito casos de EK atípica o incompleta. Esta afección se ha denominado síndrome inflamatorio multisistémico en niños (MIS-C)51. Los informes registran una alta incidencia de afectación intestinal, miocarditis, compromiso cardiaco, shock y activación macrofágica en el MIS-C, en comparación a la EK clásica. Esto provoca que los niños afectos asocien un peor pronóstico (miocarditis y afectación coronaria) y necesidad de cuidados intensivos52.
La COVID-19 se ha asociado con el desarrollo de púrpura trombocitopénica inmune (PTI). En una revisión sistemática53, se encontró que ciertos pacientes comenzaron a mostrar alteraciones incluso después de la recuperación clínica, hasta tres semanas después de la hospitalización. Es importante que la infección por SARS-CoV-2 forme parte del diagnóstico diferencial de la PTI, si bien es necesario tener en cuenta la posible concomitancia en estos pacientes de otras causas de trombocitopenia, como pueden ser diferentes fármacos (heparina o betalactámicos), coagulación intavascular diseminada o sepsis.
La aparición de anticuerpos antifosfolípido (aPL) secundaria a infecciones es un fenómeno que se ha descrito en algunos pacientes tras la infección por SARS-CoV-254. Por tanto, la búsqueda de aPL debe ser tenida en cuenta en el manejo de individuos con COVID-19 con manifestaciones vasculares.
Otras manifestacionesSe ha hipotetizado el potencial diabetogénico del SARS-CoV-2, no solo por las dianas empleadas por el virus sino por el estrés inflamatorio secundario a la enfermedad. La hiperglucemia de nueva aparición y la descompensación metabólica aguda de la diabetes mellitus (DM) preexistente están emergiendo ahora como complicaciones de la COVID-19, especialmente entre los pacientes hospitalizados55. Esta hiperglucemia de novo no está asociada con ningún otro factor de riesgo.
La afectación renal también es frecuente en pacientes con COVID-19. La incidencia de lesión renal aguda (LRA) llega incluso al 36% en sujetos hospitalizados56, considerándose un factor de riesgo de gravedad y mortalidad de COVID-19. En el estudio de la fase de convalecencia, Ng et al.57 informan que el 36,9% de los pacientes con LRA durante el ingreso seguía teniendo disfunción renal en el momento del alta hospitalaria, lo que sugiere una disfunción renal prolongada a pesar de la resolución de la fase aguda. El único estudio que ha investigado el filtrado glomerular a largo plazo14 describe que el 35% de los pacientes con LRA durante la hospitalización tenían una tasa de filtrado glomerular (TFG) disminuida (< 90 mL/min/1,73 m2) a los seis meses, frente al 13% en los pacientes sin LRA.
DiscusiónLa bibliografía revisada muestra secuelas en diferentes sistemas y órganos, sustentándose la hipótesis que los efectos adversos para la salud fueron mediados por la activación exagerada del sistema inmune en respuesta al virus.
La gran mayoría de registros de supervivientes COVID-19 tienen un período de seguimiento de seis meses después de la recuperación; por lo tanto, aún no hay datos sobre estos pacientes a largo plazo. De esta manera, la interpretación de los resultados se ve obstaculizada por evaluaciones no sistemáticas y a corto plazo, una alta heterogeneidad en relación con la edad, gravedad de la infección, seguimiento y características de la evaluación clínica. Todavía existe, por tanto, una brecha de información importante en la literatura científica debido al escaso nivel de evidencia de la bibliografía disponible y la falta de publicaciones sobre la historia natural de la enfermedad y la eficacia de diferentes estrategias de rehabilitación.
Por ello, la información preliminar obtenida hasta la fecha, en combinación con los datos propios de epidemias por coronavirus previos, solo nos permiten establecer hipótesis sobre las secuelas y la sintomatología a largo plazo en pacientes que han superado la infección por SARS-CoV-2, así como el alcance real de esta patología. Siendo necesario un consenso a la hora de clasificar las manifestaciones en el período postsagudo de la COVID-19.
En un intento por abordar el síndrome post-COVID-19 y facilitar la comparación en futuras series, guías recientes58 proponen la diferenciación de estos síntomas en: subagudos o continuos, que incluyen anomalías presentes de cuatro a 12 semanas después de la COVID-19 aguda; y el síndrome crónico o post-COVID-19, que incluye síntomas que persisten o están presentes más allá de las 12 semanas del inicio de la COVID-19 aguda y que no son atribuibles a diagnósticos alternativos. Es, por tanto, un objetivo clave la caracterización de la enfermedad en cada una de sus fases, para circunscribir su historia natural y la fisiopatología con el fin de entenderla mejor.
Es evidente que la atención a los pacientes con COVID-19 no concluye en el momento del alta hospitalaria y que se necesita una visión interdisciplinaria para el desarrollo de futuros planes de actuación que busquen la atención integral de estos individuos en el ámbito ambulatorio. De esta manera, ya se están poniendo en marcha unidades, formadas por diferentes especialistas (internistas, cardiólogos, rehabilitadores, neumólogos y psicólogos), que evalúan de forma integrada al paciente.
Es necesario resaltar la importancia de evaluar a todos los pacientes diagnosticados de COVID-19 que presenten sintomatología pasada la fase aguda y no solo a aquellos que requirieron hospitalización. En este sentido, ya se han propuesto herramientas para investigar parámetros predictores de síndrome post-COVID-19 con el fin de identificar pacientes vulnerables, priorizar la atención hacia estos, evaluar mejor el impacto en el sistema de salud y distribuir los recursos de manera adecuada59. No obstante, al día de hoy solo existe evidencia de baja calidad con respecto a la eficacia de cualquier intervención de rehabilitación en estos sujetos60. Dada la magnitud de esta pandemia, las necesidades de atención médica para los pacientes con secuelas de COVID-19 continuarán aumentando en el futuro inmediato. Hacer frente a este desafío requerirá la optimización de la infraestructura sanitaria, el desarrollo de modelos de atención médica orientados a esta patología y la integración multidisciplinar para mejorar la salud de los supervivientes de COVID-19 a largo plazo.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.