Identificar los factores de riesgo y estimar los efectos brutos de la infección por Clostridium difficile (ICD) adquirida en el hospital.
Pacientes y métodoEstudio de casos y controles apareados por edad, sexo y fecha de ingreso. Se evaluaron factores de riesgo del paciente y de la asistencia. Se compararon las estancias hospitalarias y la mortalidad.
ResultadosSe incluyeron 38 casos y 76 controles (edad media de 73 años). Los casos presentaban un peor índice de Charlson (p = 0,02), una estancia preinfección superior (mediana 10 frente a 5,5 días) y habían recibido tratamiento antibiótico previo con mayor frecuencia (89,5 frente a 40,7%) que sus controles. La albuminemia < 3,5g/dL (odds ratio [OR] 7,1; intervalo de confianza del 95% [IC 95%] 1,4-37,0), y haber recibido cefalosporinas (OR 10,1; IC 95% 1,8-55,1), quinolonas (OR 9,4; IC 95% 1,1-41,1), o inhibidores de la bomba de protones (OR 6,6; IC 95% 1,1-41,1) se asociaron independientemente a mayor riesgo de ICD. Tanto la estancia hospitalaria total (31,5 frente a 5,5 días) como la mortalidad hospitalaria (31,6 frente a 6,6%) fueron superiores en los casos que en los controles. Los aislados de C. difficile correspondieron al toxinotipo V (PFGE NAP 8) y al 0.
ConclusionesEl uso de inhibidores de la bomba de protones, cefalosporinas y quinolonas, y la hiponutrición aumentan el riesgo de ICD; esta se asocia a importantes efectos brutos de mortalidad y exceso de estancia.
To identify risk factors, and to estimate the crude effects attributable to hospital acquired Clostridium difficile infection (CDI).
Patients and methodsCase-control study matched by age, gender, and admission date. Patient and healthcare risk factors were evaluated. Hospital stays and mortality were compared.
ResultsThirty-eight cases and 76 controls were included (mean age 73 years). Cases presented worse Charlson index (P .02), higher pre-infection stay (median 10 vs. 5.5 days) and had received antibiotic treatment more frequently (89.5 vs. 40.7%) than their control counterparts. Albuminemia < 3.5 gr/dL (OR 7.1; 1.4-37), having received cephalosporins (OR 10.1; 1.8-55.1), quinolones (OR 9.4; 1.1-41.1), or proton pump inhibitors (OR 6.6; 1.1-41.1) were associated with an independent higher risk of CDI. Total hospital stay (31 vs. 5.5 days), as well as crude mortality, was higher for cases than for control patients (31.6 vs. 6.6%).
ConclusionsReceiving cephalosporins, quinolones and proton pump inhibitors, as well as hyponutrition, increase the risk of CDI. CDI is associated with relevant crude effects on mortality and excess of stay.
Clostridium difficile (C. difficile) se ha convertido en los últimos años en la causa más frecuente de diarrea nosocomial en países desarrollados, incluida España, donde la incidencia también está en aumento1,2. Este agente es responsable de un espectro de enfermedades denominado infección por Clostridium difficile (ICD), que va desde un cuadro de diarrea no complicada y colitis pseudomembranosa hasta el megacolon tóxico y, en ocasiones, sepsis e incluso la muerte. Una vez ingerida la espora de C. difficile, llega al estómago, donde pasa a forma vegetativa y cuyo crecimiento sería inhibido por el pH gástrico ácido normal. Los principales reservorios de C. difficile en el hospital lo constituyen los pacientes colonizados o infectados, y los ambientes y superficies contaminadas del hospital3 donde, en su forma esporulada, puede permanecer durante largos períodos de tiempo resistiendo la acción de gran parte de los desinfectantes. El mecanismo de transmisión incluye tanto las manos del personal sanitario como los fómites contaminados.
Desde el año 2003 se ha observado un aumento no sólo en la incidencia sino también en la gravedad de los casos de ICD en Norteamérica y Europa, en parte debido a la aparición de una nueva cepa hipervirulenta (toxinotipo III, PCR ribotipo 027)4,5. Esta nueva cepa ha sido la causante de numerosos brotes en estos territorios6,7. En España sólo se han detectado dos casos8 y aún no se han descrito brotes hospitalarios.
En España, durante los años 1997 a 2005, la tasa de incidencia media anual de la ICD fue de 41,2 diagnósticos por cada 100.000 altas1 y durante el período 1999-2007 se ha venido incrementando a una tasa del 1,09 anual. Además, se ha observado que la incidencia en los pacientes mayores de 64 años es 2,5-2,7 veces superior a la del resto1,2.
El coste económico de la ICD se ha estimado en 3.669 dólares USA por paciente9. En otros países, donde la frecuencia de la ICD y los brotes hospitalarios por C. difficile son más frecuentes, existen numerosos estudios que han descrito los factores de riesgo asociados a la ICD10,11. Sin embargo, en España son escasos los estudios que se han realizado para identificar dichos factores12,13. En el año 2006 observamos un aumento de los casos de ICD en pacientes ingresados en un hospital en Madrid que se prolongó durante 6 meses y cuyas características ya han sido publicadas14. El objetivo de este estudio es identificar los factores de riesgo de desarrollar ICD hospitalaria, estimar los efectos brutos de dicha infección sobre el alargamiento de la estancia y la mortalidad, e intentar caracterizar la epidemiología molecular del microorganismo causal.
MétodoA partir de febrero de 2006 se observó una agrupación de casos de ICD en un hospital de tercer nivel de Madrid. Se evidenció un brote de transmisión hospitalaria, se pusieron en marcha las medidas de control recomendadas14 y se inició una investigación prospectiva para identificar factores de riesgo asociados a la ICD. Los últimos casos asociados aparecieron en julio de 2006. Durante este período no se pudo identificar ningún cambio en la población de pacientes hospitalizados, ni en los métodos de diagnóstico para la detección de toxina de C. difficile.
Los casos de ICD se definieron como aquellos pacientes hospitalizados con clínica de diarrea (cambio en el hábito intestinal produciendo 3 o más deposiciones no formadas al menos durante 2 días), colitis pseudomembranosa o megacolon tóxico, y una prueba positiva para las toxinas de C. difficile en heces. La detección de los casos nuevos se realizó únicamente a partir de las pruebas para toxina que ordenaban los clínicos y cuyo resultado fuera positivo. Se definió como origen nosocomial (u hospitalario) cuando el cuadro clínico de ICD se había iniciado al menos pasadas 48h desde el ingreso en el centro sanitario, o bien se hubiera iniciado anteriormente pero dentro de las 4 semanas posteriores a haber sido dado de alta del centro sanitario. Para el presente estudio fueron excluidos aquellos pacientes con ICD recurrente (pacientes con pruebas microbiológicas positivas para toxinas de C. difficile dentro de las 8 semanas posteriores a un episodio de ICD), o aquellos pacientes para los cuales no se dispuso en su historia clínica de la información adecuada. La confirmación de la toxina se realizó en el laboratorio de microbiología del propio hospital mediante la prueba TOX A/B QUIK CHEK (inmunoensayo rápido) para toxina A y B. Dado que el hospital no realizaba el cultivo de C. difficile, algunas de las muestras de pacientes correspondientes al final del período epidémico pudieron ser enviadas a otro laboratorio donde se aisló el microorganismo y se caracterizó la presencia de toxina binaria. Posteriormente, esas cepas fueron enviadas a los laboratorios del Centers for Disease Control (CDC) de Atlanta donde se realizaron análisis por PFGE, toxinotipia y reacción en cadena de la polimerasa (PCR) para la detección de toxina binaria y deleciones en el fragmento tcdC15,16.
Para el análisis de los factores de riesgo de infección por C. difficile se diseñó un estudio de casos y controles en el que a cada uno de los pacientes caso con ICD se le asignaron dos pacientes controles elegidos aleatoriamente de entre aquellos que no desarrollaron ICD durante su ingreso hospitalario y que cumplían con los siguientes criterios de emparejamiento: edad (± 5 años), sexo y fecha de ingreso (± 3 días).
Para la recogida de datos se revisaron las historias clínicas de los pacientes y las bases de datos informatizadas del hospital de dispensación de fármacos, datos de laboratorio y del programa de gestión de pacientes.
De cada paciente se recogió información demográfica y administrativa: sexo, edad, procedencia al ingreso, servicio de hospitalización y las fechas de ingreso, de alta y de inicio de la ICD. Se registró la presencia de comorbilidades: diabetes mellitus (diagnóstico en historia clínica o glucemias iguales o superiores a 145mg/dl en pacientes no sometidos a fluidoterapia que pueda producir aumentos en la glucemia; en los sometidos a este tratamiento se considerarán valores iguales o superiores a 200mg/dl), diverticulosis, enfermedad pulmonar obstructiva crónica (EPOC), neoplasia (enfermos diagnosticados de neoplasia maligna en el curso de los últimos 5 años), enfermedad inflamatoria intestinal, cardiopatía isquémica, demencia, trasplante de órgano sólido, insuficiencia renal crónica (diagnóstico en la historia clínica o valores de creatinina superiores a 1,7mg/dl en la analítica de ingreso), presencia de colostomía, infección por el virus de la inmunodeficiencia humana (VIH), inmunodepresión, accidente cerebrovascular agudo (ACVA), insuficiencia cardiaca congestiva, úlcera péptica y se calculó el índice de Charlson. También se incluyó información sobre los valores de albúmina y de leucocitos al ingreso, y los antecedentes de cirugía gastrointestinal previa, colonoscopia en los últimos 7 días, endoscopia en los últimos 7 días, portador de sonda nasogástrica, y uso de nutrición parenteral o enteral. Finalmente, se recogió información sobre el uso de fármacos recibidos antes del inicio de ICD para los casos o durante toda la estancia para los controles, tales como los inhibidores de la bomba de protones (IBP), anti-H2, laxantes, antidiarreicos, inmunodepresores y antibióticos.
Las variables cualitativas fueron descritas mediante proporciones, y las variables cuantitativas mediante su media, cuando seguían una distribución normal, o en otro caso mediante su mediana y rango intercuartílico. Para la comparación de los casos y los controles se realizó un primer análisis univariante mediante las pruebas de Chi al cuadrado, t de Student y U de Mann-Whitney. Para la identificación de los factores de riesgo que se asociaban de forma independiente a la ICD, a partir de aquellos que se asociaron con un valor de p < 0,1 en el análisis univariante, se realizó un análisis multivariante mediante regresión logística condicional y una estrategia de selección de variables paso a paso hacia atrás. La magnitud de la asociación se evaluó mediante la odds ratio (OR) para datos apareados con el intervalo de confianza del 95% (IC 95%). Para el análisis estadístico se utilizó el programa estadístico STATA SE, versión 9.
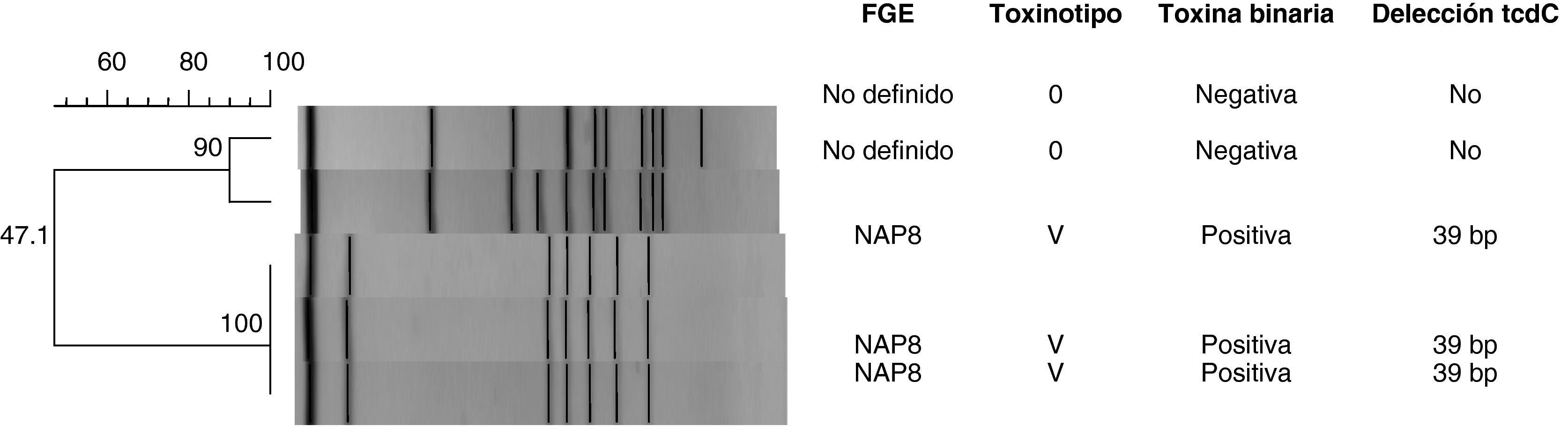
ResultadosDesde principios de febrero a finales de julio se identificaron 51 pacientes hospitalizados con diagnóstico de ICD. De ellos, 41 (80,4%) correspondieron a casos de origen nosocomial. Tres de estos pacientes fueron excluidos del estudio de factores de riesgo al carecer sus historias clínicas de información suficiente. Todos los casos nosocomiales presentaron diarrea, siendo uno de ellos además diagnosticado de colitis pseudomembranosa. Solamente en muestras de heces de 5 pacientes se realizó cultivo para C. difficile. Dos de los aislados fueron toxinotipo 0 y tres fueron toxinotipo V, tipo PFGE NAP 8 (fig. 1). En total, se incluyeron en el estudio 38 pacientes como casos de ICD de origen hospitalario, para los que se seleccionaron aleatoriamente 76 pacientes controles, de entre aquellos pacientes que no hubieran desarrollado ICD, y fueron emparejados por edad (± 5 años), sexo y fecha de ingreso (± 3 días). La mediana de edad de los pacientes casos y de los controles fue de 73 y 72,5 años, respectivamente (rango intercuartílico 55-89) y el 55,3% fueron varones. El 10,5% de los casos provenían de residencia frente al 21% de los controles (p=0,12).
Las características demográficas y clínicas, así como los parámetros de laboratorio al ingreso de los pacientes casos y controles, se detallan en la tabla 1. Los pacientes caso tendían a tener un peor índice de comorbilidad de Charlson que los controles (p = 0,02), y además llevaban hospitalizados una mediana de 10 días frente a los 5,5 de los controles. Casi tres cuartas partes de los casos estaban hospitalizados en plantas no quirúrgicas frente al 58% de los controles. No se observaron diferencias en cuanto a las enfermedades subyacentes de los pacientes casos y sus controles, excepto para la mayor frecuencia de insuficiencia renal crónica (OR 4,4; IC 95% 1,1-17,1) y de inmunodepresión (OR 12; IC 95% 1,4-99,7). Los pacientes casos habían estado expuestos con mayor frecuencia a sonda nasogástrica y a nutrición parenteral que los controles, pero sin alcanzar significación estadística. No se observaron diferencias en cuanto a la cifra de leucocitos en sangre al ingreso; sin embargo los casos mostraron una albuminemia inferior a la de los controles (3,0 frente a 3,9g/dL; p < 0,001). La estancia hospitalaria total fue muy superior para los casos que para los controles (estancia mediana de 31,5 días para los casos frente a 5,5 días para los controles), y asimismo la mortalidad hospitalaria fue muy superior para los casos que para los controles (31,6 frente a 6,6%).
Características de los pacientes con infección por C. difficile y de los pacientes controles. Análisis univariante
| Características | Casos (n = 38) | Controles (n = 76) | OR | IC 95% | p |
| Índice de Charlson | 2,1 | 1,1-4,2 | 0,02 | ||
| 0 | 4 (10,5) | 16 (21,0) | |||
| 1 | 7 (18,4) | 14 (18,4) | |||
| 2 | 18 (47,4) | 34 (44,7) | |||
| 3 | 9 (23,7) | 12 (15,8) | |||
| Días en riesgo, mediana (extremos) | 10,0 (5-18) | 5,5 (2-14) | 0,046a | ||
| Planta no quirúrgica | 28 (73,7) | 44 (57,9) | 2 | 0,8-5,3 | 0,1 |
| Enfermedades subyacentes | |||||
| Diabetes mellitus | 6 (15,8) | 9 (11,8) | 1,3 | 0,5-4,3 | 0,5 |
| Insuficiencia renal crónica | 8 (21,1) | 5 (6,6) | 4,4 | 1,1-17,1 | 0,03 |
| Diverticulosis | 4 (10,5) | 4 (5,3) | 2,2 | 0,5-10,4 | 0,2 |
| Neoplasia | 10 (26,3) | 11 (14,5) | 2,2 | 0,8-5,9 | 0,1 |
| Cardiopatía isquémica | 5 (13,2) | 4 (5,3) | 2,9 | 0,7-12,4 | 0,1 |
| Inmunosupresión | 6 (15,8) | 1 (1,3) | 12 | 1,4-99,7 | 0,02 |
| Accidente cerebrovascular | 6 (15,8) | 9 (11,8) | 1,5 | 0,4-5,5 | 0,5 |
| Insuficiencia cardiaca congestiva | 9 (23,6) | 9 (11,8) | 2,6 | 0,8-8,0 | 0,09 |
| Procedimientos previos | |||||
| Colonoscopia en los últimos 7 días | 1 (2,6) | 4 (5,3) | 0,4 | 0,1-4,6 | 0,5 |
| Endoscopia en los últimos 7 días | 2 (5,3) | 4 (5,3) | 1 | 0,1-6,4 | 1 |
| Uso de sonda nasogástrica | 5 (13,2) | 3 (3,9) | 3,3 | 0,8-13,9 | 0,09 |
| Nutrición parenteral | 4 (10,5) | 1 (1,3) | 8 | 0,9-71,6 | 0,06 |
| Valores de laboratorio al ingreso | |||||
| Albúmina, g/dL (media ± DE) | 2,97 ± 0,57 | 3,9 ± 0,69 | 10,7 | 3,3-10,7 | < 0,001 |
| Leucocitos x 103/mm3, mediana, (rango intercuartílico) | 9,95 (5,30) | 7,90 (3,90) | 1,0 | 0,9-1,0 | 0,1 |
| Estancia hospitalaria total, mediana (extremos) en días | 31,5 (24-55) | 5,5 (2-14) | < 0,001a | ||
| Exitus | 12 (31,6) | 5 (6,6) | 6,6 | 2,1-20,4 | < 0,001 |
Entre paréntesis figura el porcentaje, a menos que se especifique lo contrario.
DE: desviación estándar; IC 95%: intervalo de confianza del 95%; OR: odds ratio.
El 89,5% de los pacientes casos habían recibido algún antibiótico durante unos 6 días (mediana) frente a sólo el 40,7% de los controles. Además, los casos habían recibido mayor número de antibióticos. De todas las clases de antibióticos recibidos, los que se asociaron a un mayor riesgo de infección por C. difficile fueron cefalosporinas, quinolonas y carbapenemas (tabla 2). En cuanto a la utilización de otros fármacos, los pacientes casos habían recibido con mayor frecuencia IBP e inmunodepresores.
Exposición a antibióticos y otros fármacos. Análisis univariante
| Fármacos | Casos (n =3 8) | Controles (n = 76) | OR | IC 95% | p |
| Antibióticos | |||||
| Número de antibióticos recibidos | < 0,001 | ||||
| 0 | 4 (10,5) | 45 (59,3) | |||
| 1 | 18 (47,4) | 20 (26,3) | 10,5 | 2,7-40,1 | |
| 2-4 | 10 (26,3) | 10 (13,1) | 7,8 | 2,0-30,8 | |
| ≥ 5 | 6 (15,8) | 1 (1,3) | 59,8 | 5,2-685,4 | |
| Días de exposición, mediana (extremos) | 6 (2-14) | 0 (0-4) | < 0,001a | ||
| Clase de antibiótico | |||||
| Cefalosporinas | 16 (42,1) | 6 (7,9) | 9,2 | 2,7-32 | < 0,001 |
| Quinolonas | 15 (39,5) | 6 (7,9) | 8,9 | 2,5-31 | 0,001 |
| Carbapenemas | 8 (21,1) | 3 (3,9) | 7,3 | 1,5-34,7 | 0,01 |
| Sulfamidas | 4 (10,5) | 0 | |||
| Piperacilina-tazobactam | 4 (10,5) | 3 (4,0) | 2,7 | 0,6-12,0 | 0,2 |
| Macrólidos | 4 (10,5) | 3 (4,0) | 2,7 | 0,6-12 | 0,2 |
| Penicilinas | 9 (23,7) | 17 (22,4) | 1,1 | 0,4-2,6 | 0,9 |
| Metronidazol | 4 (10,5) | 5 (6,6) | 1,6 | 0,4-6,0 | 0,5 |
| Otros fármacos | |||||
| Inhibidores de la bomba de protones | 31 (81,6) | 43 (56,6) | 3,6 | 1,3-10,1 | 0,01 |
| Laxantes | 11 (28,9) | 11 (14,5) | 2,5 | 0,9-6,7 | 0,06 |
| Anti-H2 | 6 (15,8) | 0 | |||
| Inmunosupresores | 7 (18,4) | 3 (3,9) | 11,1 | 1,3-92,4 | 0,03 |
| Antidiarreicos | 3 (7,9) | 0 | |||
Entre paréntesis figura el porcentaje, a menos que se especifique lo contrario.
IC 95%: intervalo de confianza del 95%; OR: odds ratio.
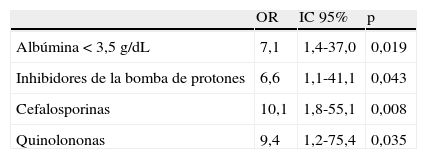
El análisis por regresión logística condicional identificó como principales factores de riesgo independientes de desarrollar ICD en el hospital la albuminemia inferior a 3,5g/dL, y haber recibido tratamientos con antibióticos (cefalosporinas o quinolonas) o con IBP (tabla 3).
Factores de riesgo de infección por Clostridium difficile . Análisis multivariantea
| OR | IC 95% | p | |
| Albúmina < 3,5 g/dL | 7,1 | 1,4-37,0 | 0,019 |
| Inhibidores de la bomba de protones | 6,6 | 1,1-41,1 | 0,043 |
| Cefalosporinas | 10,1 | 1,8-55,1 | 0,008 |
| Quinolononas | 9,4 | 1,2-75,4 | 0,035 |
IC 95%: intervalo de confianza del 95%; OR: odds ratio.
La cantidad de pacientes afectados durante el período de observación, más de 40, nos permitió estudiar con cierto detalle los factores de riesgo para el desarrollo de esta enfermedad. El período de observación transcurrió desde mediados de invierno hasta el final de la primavera, coincidiendo con la época en que las tasas de incidencia de ICD en España son más elevadas y mayor es la tendencia a la infección y diseminación de esta bacteria en el hospital1. La edad de los pacientes infectados (73 años) era bastante superior a la de los pacientes ingresados en nuestro hospital y en los hospitales españoles (66 años)2. Numerosos estudios han encontrado este mayor riesgo de infección en los pacientes ancianos12,17,18.
Los pacientes con ICD mostraban un mayor índice de comorbilidad medido por la puntuación de Charlson. De hecho, por cada aumento en una unidad de la escala, el riesgo se duplicaba. También los pacientes con ICD padecían con mayor frecuencia enfermedades subyacentes como la insuficiencia renal crónica, inmunodepresión, y asimismo, mostraban unas cifras de albuminemia inferiores a las de los controles. Se ha visto en otros estudios que son los pacientes más ancianos y más debilitados los más vulnerables a esta infección18,19.
Un hallazgo importante de nuestro estudio ha sido la asociación independiente encontrada entre la exposición a los fármacos IBP y la ICD. Se ha observado que una vez ingerida la espora de Clostridium, al alcanzar el estómago pasa a forma vegetativa, y que a un pH gástrico ácido normal (alrededor de 2,0) estas formas vegetativas mueren sin llegar a producir daño en la mucosa intestinal en la mayoría de las ocasiones. En situaciones de hipoclorhidria, como la que producen los IBP, el pH gástrico aumenta (alrededor de 5,0), disminuyendo esta capacidad20. Asímismo, la alteración de la microflora intestinal del colon producida por la inhibición del pH gástrico es otro mecanismo por el que se puede explicar la asociación entre ICD y los IBP21,22. En nuestro estudio hemos encontrado que la exposición a IBP es mucho más frecuente en los casos (82%) que en los controles (57%), y que, ajustando por otros factores, se mantiene como factor de riesgo independiente (OR 6,6; IC 95% 1,1-41,1). Esta asociación ya se ha observado en estudios observacionales previos23. Por otro lado, el consumo de IBP se ha incrementado sustancialmente en la última década24. En Inglaterra, a pesar de la redacción de unas guías basadas en la evidencia para la prescripción de estos fármacos, su impacto a nivel clínico aparentemente ha sido escaso25. Choudhry et al realizaron un estudio prospectivo sobre la prescripción de IBP en 138 pacientes hospitalizados diagnosticados de infección por C. difficile y valoraron la correcta indicación de su prescripción. El 64% de los pacientes estaban siendo tratados con IBP y en un 63% de ellos la indicación del tratamiento con estos no era apropiada26. En nuestro estudio, un 81,6% de los pacientes con ICD estaban siendo tratados con estos fármacos supresores de la secreción gástrica, cifra que a priori parece muy elevada. Por tanto, una valoración más cuidadosa de la adecuación de la prescripción de los IBP, apoyada en las guías de uso clínico, garantizaría una mejor indicación clínica y podría disminuir el riesgo de desarrollar ICD y de otros efectos secundarios de los IBP.
Es importante observar cómo la frecuencia de uso de antibióticos fue muy superior en los pacientes con ICD que en sus controles emparejados. Más del doble de los casos (90%) había recibido anteriormente algún antibiótico comparado con los controles (41%). Es más, tanto la cantidad de antibióticos recibidos como el número de días recibiéndolos se asociaron con gran fuerza a un mayor riesgo de infección por C. difficile, y esta mayor exposición a los antibióticos se ha identificado como uno de los factores de riesgo más importante para el desarrollo de ICD12,27. Además, la exposición a los antibióticos más frecuentemente recibidos por los casos (cefalosporinas, quinolonas y carbapenemas) también se asoció con fuerza a un mayor riesgo de infección. En nuestro estudio, el uso de fluorquinolonas se ha identificado como factor de riesgo independiente para el desarrollo de ICD (OR 21,4; IC 95% 1,8-257,4). Dado que el patrón de prescripción de fluorquinolonas en este hospital difiere sustancialmente de aquellas otras instituciones de EE.UU. y Canadá donde se han declarado brotes recientes de ICD11,23 (menos del 5% de los pacientes de nuestro estudio habían recibido las nuevas fluorquinolonas gatifloxacino o moxifloxacino), no se pudo evaluar el efecto de cada uno de estos principios activos. Además, el uso de cefalosporinas ha demostrado ser, análogo al efecto de las fluorquinolonas, un factor de riesgo independiente para desarrollar ICD, algo que concuerda con resultados de otros autores23. Es probable que la utilización de antibióticos de amplio espectro como las cefalosporinas y las quinolonas durante períodos suficientes de tiempo alteren el ecosistema intestinal facilitando la infección por las formas vegetativas de C. difficile que hubieran sido capaces de alcanzar la mucosa intestinal.
Debido a la dificultad para realizar cultivos de los aislados hasta los últimos casos del período de observación, no nos fue posible caracterizar en detalle la cepa responsable de todos ellos. En las muestras aisladas encontramos dos cepas diferentes que en ninguno de los casos se identificaron como la cepa epidémica hipervirulenta toxinotipo III, PCR ribotipo 027, que se ha extendido por numerosos países. Aunque el origen de los casos observados no parece atribuible a dicha cepa, no podemos estar totalmente seguros para descartar dicho origen.
Tanto la mortalidad bruta como la estancia hospitalaria total fueron sustancialmente superiores para los pacientes con ICD que para sus controles; sin embargo hay que tener en cuenta que los casos tenían a su ingreso un mayor índice de comorbilidad y que esas comparaciones no son ajustadas.
La vulnerabilidad de los pacientes medida por la escala de Charlson se asoció a un mayor riesgo de ICD en el análisis univariante, pero no en el multivariante. Sin embargo, una albuminemia baja, que está ligada a la hiponutrición y a un compromiso en los niveles de defensas del huésped, sí se mostró como factor de riesgo independiente. Aunque en España hay descritos algunos brotes epidémicos nosocomiales de diarrea por C. difficile, no son numerosos los que analizan los posibles factores de riesgo asociados12,28,29. Nuestro estudio incluyó un número mayor de casos y así mismo pudimos analizar un mayor número de factores de riesgo. Una limitación de nuestro estudio es no haber podido cultivar una mayor cantidad de muestras de heces para su caracterización molecular y poder caracterizar con mayor precisión las cepas responsables de los casos. Otra de las limitaciones es el tamaño de la muestra de casos, que no nos permite una potencia estadística suficiente para obtener estimadores de riesgo muy precisos.
En resumen, este estudio apoya la asociación entre ICD y factores de riesgo del paciente como la edad y el grado de desnutrición, medido indirectamente por la albuminemia. Y aún más importante, que la optimización en el uso de determinados tratamientos, como los IBP o antibióticos de amplio espectro, fluorquinolonas y cefalosporinas, podría disminuir el riesgo de infección por C. difficile en los pacientes hospitalizados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Brandi Limbago, de la Division of Healthcare Quality Promotion, Centers for Disease Control and Prevention, por su asistencia en la identificación molecular de las cepas, y a Margarita Alonso por su ayuda en el diseño del cuaderno de recogida de datos y gestión de la base de datos.