El tratamiento farmacológico de la epilepsia no es curativo, pretende evitar las crisis o que sean lo menos frecuentes, intensas y prolongadas posible, y un 30% de las epilepsias de la infancia son resistentes a los fármacos antiepilépticos (FAE). El pronóstico en general no cambia por instaurar o no el tratamiento, o por hacerlo antes o después. El tratamiento se inicia según la certeza de que el paciente tenga epilepsia y de la frecuencia, intensidad y repercusión de las crisis. Cualquier FAE puede provocar efectos paradójicos de empeoramiento del síndrome epiléptico, por agravar las crisis preexistentes o por desencadenar un nuevo tipo de crisis1. Los efectos de los FAE sobre la función ejecutiva también son impredecibles. Por tanto, en el manejo y seguimiento del tratamiento con FAE hay que vigilar su posible repercusión negativa sobre las crisis y, especialmente en edades pediátricas, sobre el neurodesarrollo (más cuanto más pequeño sea el niño) y aspectos de función ejecutiva como atención, comportamiento o rendimiento escolar.
Tuvimos la oportunidad de analizar nuestra experiencia reciente con lamotrigina (LTG), FAE de amplio espectro aprobado para el tratamiento de epilepsia a partir de los 2 años, con, en general, buena eficacia y tolerancia2–4. Entre los efectos adversos, se considera la erupción cutánea maculopapular que aparece generalmente en las primeras 8 semanas de tratamiento, más frecuente si asociado a valproato (VPA); aunque la mayoría son leves y de resolución espontánea, se han notificado casos graves donde predomina el síndrome de Stevens-Johnson; que se evita con titulación inicial muy lenta2–4.
Algunos FAE pueden causar o empeorar síntomas de disfunción ejecutiva cerebral como déficit de atención, hiperactividad e impulsividad (muy prevalentes en población pediátrica, notificados hasta en un 59% de los pacientes), siendo los FAE más frecuentemente prescritos levetiracetam (LVT) y VPA5. Se ha señalado que debe considerarse como tratamiento de primera línea para las epilepsias de ausencia etosuximida o LTG, con el fin de evitar efectos negativos del VPA sobre la atención6. Con VPA se ha reportado un rendimiento en tareas cognitivas significativamente menor comparado con otros FAE como etosuximida o carbamacepina7. Se describen problemas de comportamiento adverso (hiperactividad, irritabilidad, labilidad y agresividad) lo suficientemente graves como para interrumpir el tratamiento con VPA hasta en un 25%8. Los efectos conductuales más comunes del tratamiento con LVT son labilidad emocional, irritabilidad y agresividad, siendo la irritabilidad el motivo más frecuente de interrupción del mismo9.
Algunos estudios han demostrado que LTG asocia menos efectos secundarios cognitivos que otros FAE prescritos habitualmente. Varios autores coinciden en que LTG también ha demostrado reducir los síntomas afectivos10.
Para responder a alguna de las cuestiones planteadas, se analizó nuestra experiencia con los pacientes epilépticos de la consulta de la unidad de neuropediatría de nuestro hospital, controlados desde noviembre de 2017 hasta febrero de 2021, tratados en algún momento de su evolución con LTG.
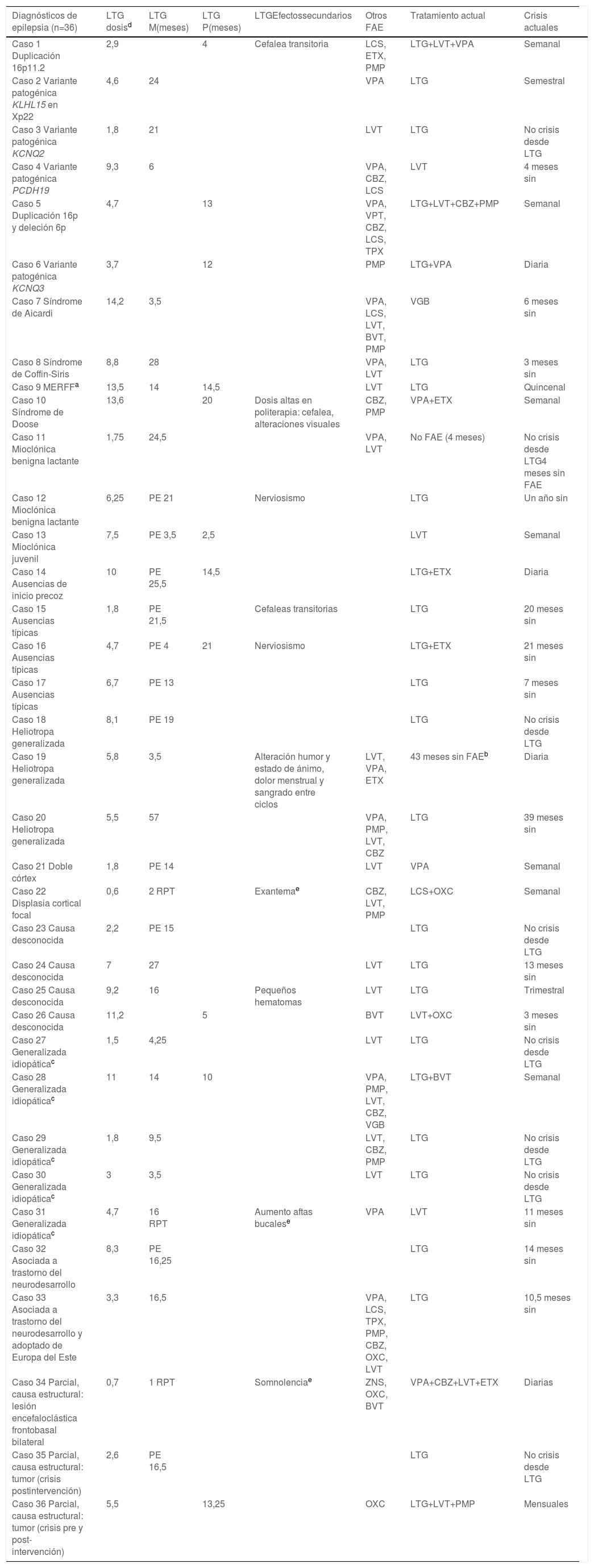
Se recogieron un total de 36 pacientes, 21 varones y 15 mujeres. La media de edad en el momento del diagnóstico de epilepsia fue 6 años y 7 meses, mediana 6 años y 5 meses (edad mínima 4 meses y máxima 15 años). La tabla 1 muestra la mayor parte de los datos analizados: diagnóstico de los 36 casos, meses de tratamiento de LTG en cada caso, monoterapia o politerapia, si fue de primera elección, dosis empleadas y efectos secundarios, otros FAE empleados (y sus efectos secundarios), tratamiento actual y número de crisis en última visita.
Diagnóstico de los 36 casos de epilepsia y tratamiento
| Diagnósticos de epilepsia (n=36) | LTG dosisd | LTG M(meses) | LTG P(meses) | LTGEfectossecundarios | Otros FAE | Tratamiento actual | Crisis actuales |
|---|---|---|---|---|---|---|---|
| Caso 1 Duplicación 16p11.2 | 2,9 | 4 | Cefalea transitoria | LCS, ETX, PMP | LTG+LVT+VPA | Semanal | |
| Caso 2 Variante patogénica KLHL15 en Xp22 | 4,6 | 24 | VPA | LTG | Semestral | ||
| Caso 3 Variante patogénica KCNQ2 | 1,8 | 21 | LVT | LTG | No crisis desde LTG | ||
| Caso 4 Variante patogénica PCDH19 | 9,3 | 6 | VPA, CBZ, LCS | LVT | 4 meses sin | ||
| Caso 5 Duplicación 16p y deleción 6p | 4,7 | 13 | VPA, VPT, CBZ, LCS, TPX | LTG+LVT+CBZ+PMP | Semanal | ||
| Caso 6 Variante patogénica KCNQ3 | 3,7 | 12 | PMP | LTG+VPA | Diaria | ||
| Caso 7 Síndrome de Aicardi | 14,2 | 3,5 | VPA, LCS, LVT, BVT, PMP | VGB | 6 meses sin | ||
| Caso 8 Síndrome de Coffin-Siris | 8,8 | 28 | VPA, LVT | LTG | 3 meses sin | ||
| Caso 9 MERFFa | 13,5 | 14 | 14,5 | LVT | LTG | Quincenal | |
| Caso 10 Síndrome de Doose | 13,6 | 20 | Dosis altas en politerapia: cefalea, alteraciones visuales | CBZ, PMP | VPA+ETX | Semanal | |
| Caso 11 Mioclónica benigna lactante | 1,75 | 24,5 | VPA, LVT | No FAE (4 meses) | No crisis desde LTG4 meses sin FAE | ||
| Caso 12 Mioclónica benigna lactante | 6,25 | PE 21 | Nerviosismo | LTG | Un año sin | ||
| Caso 13 Mioclónica juvenil | 7,5 | PE 3,5 | 2,5 | LVT | Semanal | ||
| Caso 14 Ausencias de inicio precoz | 10 | PE 25,5 | 14,5 | LTG+ETX | Diaria | ||
| Caso 15 Ausencias típicas | 1,8 | PE 21,5 | Cefaleas transitorias | LTG | 20 meses sin | ||
| Caso 16 Ausencias típicas | 4,7 | PE 4 | 21 | Nerviosismo | LTG+ETX | 21 meses sin | |
| Caso 17 Ausencias típicas | 6,7 | PE 13 | LTG | 7 meses sin | |||
| Caso 18 Heliotropa generalizada | 8,1 | PE 19 | LTG | No crisis desde LTG | |||
| Caso 19 Heliotropa generalizada | 5,8 | 3,5 | Alteración humor y estado de ánimo, dolor menstrual y sangrado entre ciclos | LVT, VPA, ETX | 43 meses sin FAEb | Diaria | |
| Caso 20 Heliotropa generalizada | 5,5 | 57 | VPA, PMP, LVT, CBZ | LTG | 39 meses sin | ||
| Caso 21 Doble córtex | 1,8 | PE 14 | LVT | VPA | Semanal | ||
| Caso 22 Displasia cortical focal | 0,6 | 2 RPT | Exantemae | CBZ, LVT, PMP | LCS+OXC | Semanal | |
| Caso 23 Causa desconocida | 2,2 | PE 15 | LTG | No crisis desde LTG | |||
| Caso 24 Causa desconocida | 7 | 27 | LVT | LTG | 13 meses sin | ||
| Caso 25 Causa desconocida | 9,2 | 16 | Pequeños hematomas | LVT | LTG | Trimestral | |
| Caso 26 Causa desconocida | 11,2 | 5 | BVT | LVT+OXC | 3 meses sin | ||
| Caso 27 Generalizada idiopáticac | 1,5 | 4,25 | LVT | LTG | No crisis desde LTG | ||
| Caso 28 Generalizada idiopáticac | 11 | 14 | 10 | VPA, PMP, LVT, CBZ, VGB | LTG+BVT | Semanal | |
| Caso 29 Generalizada idiopáticac | 1,8 | 9,5 | LVT, CBZ, PMP | LTG | No crisis desde LTG | ||
| Caso 30 Generalizada idiopáticac | 3 | 3,5 | LVT | LTG | No crisis desde LTG | ||
| Caso 31 Generalizada idiopáticac | 4,7 | 16 RPT | Aumento aftas bucalese | VPA | LVT | 11 meses sin | |
| Caso 32 Asociada a trastorno del neurodesarrollo | 8,3 | PE 16,25 | LTG | 14 meses sin | |||
| Caso 33 Asociada a trastorno del neurodesarrollo y adoptado de Europa del Este | 3,3 | 16,5 | VPA, LCS, TPX, PMP, CBZ, OXC, LVT | LTG | 10,5 meses sin | ||
| Caso 34 Parcial, causa estructural: lesión encefaloclástica frontobasal bilateral | 0,7 | 1 RPT | Somnolenciae | ZNS, OXC, BVT | VPA+CBZ+LVT+ETX | Diarias | |
| Caso 35 Parcial, causa estructural: tumor (crisis postintervención) | 2,6 | PE 16,5 | LTG | No crisis desde LTG | |||
| Caso 36 Parcial, causa estructural: tumor (crisis pre y post-intervención) | 5,5 | 13,25 | OXC | LTG+LVT+PMP | Mensuales |
BVT: brivaracetam; CBZ: carbamazepina; ETX: etosuximida; FAE: fármacos antiepilépticos; LCS: lacosamida; LTG: lamotrigina; LVT: levetiracetam; M: monoterapia; OXC: oxcarbazepina; P: politerapia; PE: primera elección; PMP: perampanel; RPT: retirado por tolerancia; TPX: topiramato; VGB: vigabatrina; VPA: ácido valproico o valproato; ZNS: zonisamida.
MERRF: Epilepsia mioclónica con fibras rojas rasgadas, por mutación de origen materno (familiares en diferentes grados de heteroplasmia y diferente expresividad clínica) A8344G localizada en el gen mitocondrial que codifica para el ARNtLys en sangre 70% y en orina 97%.
Se retiró el tratamiento por falta de efectividad y problemas con la tolerancia. Actualmente se mantiene sin tratamiento (3 años y 7 meses), continúa realizando crisis diarias, en cuanto sale a la calle: movimientos oculares con parpadeo fuerte y continuo, con ausencias muy breves. Mejor con gafas de sol, que es lo más efectivo.
Epilepsias generalizadas diferentes a la epilepsia ausencia, benigna del lactante, heliotropa y mioclónica juvenil. Antecedentes de crisis febriles 6 casos: casos 11, 24, 27, 28, 29, 34. Caso 3 convulsiones neonatales.
La dosis reflejada (mg/kg/día) es la dosis actual en los casos que todavía mantienen el tratamiento con LTG. En los que no mantienen dicho tratamiento, la dosis reflejada (mg/kg/día) es la máxima administrada durante su periodo de tratamiento.
Retirada de LTG por efectos adversos en 3 casos (22, 31, 34): Caso 22 presenta un primer episodio de fiebre asociado a exantema en tronco, dorso, cuello e ingles al cuarto día de tratamiento, con dosis de 0,6mg/kg/día. No presenta crisis durante estos días con lamictal. Se suspende y tras la resolución del cuadro se intenta reiniciar de nuevo, presentando otro exantema con la misma dosis, esta vez no asociado a fiebre, por lo que se suspende definitivamente. Caso 31 aftas bucales previo al tratamiento con FAE, el aumento con LTG es reseñado por la madre y no se visualiza posteriormente durante un ingreso donde la paciente mantiene tratamiento con LTG (6,25mg/kg/día).
De los 36 pacientes que recibieron LTG, 30 (83,3%) fue en monoterapia en algún momento. En 11 (30,6%) la LTG fue de primera elección. En 8 casos (22,1%) LTG fue elegida como segunda monoterapia y en otros 11 casos (30,6%) como monoterapia tras politerapia previa.
La adherencia a LTG en nuestra serie fue alta. En el momento de finalizar el estudio, continuaban tomando LTG 25 pacientes (69,4%), 18 en monoterapia (50%): 7 (19,5%) monoterapia inicial, 7 (19,5%) segunda monoterapia y 4 (11%) monoterapia tras politerapia. El caso 11 permitió la retirada de la monoterapia con LTG tras haber permanecido 2 años libre de crisis, en el momento de análisis mantenía 4 meses sin FAE y libres de crisis. Añadiendo este caso a los 25 previamente mencionados, son 26 pacientes (72,2%) los que han mantenido el tratamiento con LTG durante una media de 19,7 meses (intervalo 3,5-57 meses) y 19 (52,7%) los que lo hacen en monoterapia.
De estos 19 casos que mantuvieron LTG en monoterapia, en 8 niños (42,1%) cesaron las crisis con LTG en monoterapia; tasa de libertad de crisis sobre el total de pacientes: 22,2%, media de 14,7 meses de tiempo sin crisis (intervalo 3,5-28,5). Presentaron reducción de las crisis en frecuencia y/o intensidad con LTG en monoterapia 11 pacientes (57,9%): casos 2, 8, 9, 12, 15, 17, 20, 24, 25, 32, 33.
Así pues, pudimos observar que un total de 19 pacientes fueron resistentes a FAE. En 17 pacientes (47,2%) la epilepsia era resistente previamente al inicio de LTG, consiguiendo en 2 casos (11,8%) la remisión de las crisis (casos 11 y 29). Al finalizar el estudio, de estos 17 casos 2 tienen suspendido el FAE (caso 11 libre de crisis y caso 19 crisis diarias sin repercusión), 6 mantienen FAE sin LTG y 9 mantienen el tratamiento con LTG (5 en politerapia y 4 en monoterapia). En 2 casos en los que la epilepsia fue resistente tras LTG (previamente tratados con VPA y LVT en monoterapia), se consiguió el control de las crisis con LVT y VPA, respectivamente.
La tasa de efectos adversos presentada con el tratamiento de LTG en nuestra serie fue del 27,8% (10 pacientes: 7 monoterapia, 2 politerapia y uno ambas), retirándose en el 8,3% (3 pacientes en monoterapia).
Asimismo, la tasa de efectos adversos con los 2 FAE más utilizados fue: 75% con VPA (12 de 16 pacientes: alteración rendimiento escolar, descanso nocturno, comportamiento, aumento y pérdida de apetito, aumento de peso, ansiedad, nerviosismo, irritabilidad, aumento de actividad, vómitos, somnolencia, trombocitopenia, coprolalia, alopecia, babeo, temblor y labilidad emocional) y 58,3% con LVT (14 de 24: alteración rendimiento escolar, descanso nocturno, comportamiento, alimentación, memoria, concentración, lenguaje y equilibrio, nerviosismo, irritabilidad, temblor, bruxismo, pesadillas, somnolencia y babeo), con retirada del 18,8% (3/16) de VPA y 12,5% (3/24) de LVT. Lógicamente estos datos no son extrapolables a los efectos adversos de la población en tratamiento con estos fármacos, pues se trata de una serie de casos en los que se han suprimido por no eficacia o tolerancia o se ha añadido al menos otro FAE (LTG).
En el caso de LTG solo precisaron la retirada del fármaco el 8% de los pacientes, un porcentaje considerablemente menor que el presentado por VPA o LVT.
Los resultados recogen la gran diversidad de epilepsias que se ven en la práctica clínica pediátrica. En nuestra experiencia: causas genéticas, algunas invariablemente asociadas a trastornos del neurodesarrollo, enfermedades metabólicas (mitocondrial), también de origen genético, y causas adquiridas secundarias a problemas disruptivos prenatales o a tumores. En 4 de 36 casos la etiología es desconocida, como es común en la epilepsia. Al tratarse de una serie muy heterogénea, es difícil comparar datos de efectividad de diferentes FAE, más considerando la alta frecuencia de resistencia a fármacos.
El estudio presentó como limitación principal que se trata de un estudio retrospectivo, con una serie pequeña y muy heterogénea: pacientes con diversas etiologías epilépticas y diferentes pautas y respuestas al tratamiento con LTG. Otra limitación fue que la valoración de la respuesta a los FAE en cuanto a intensidad de las crisis es subjetiva, basada en la percepción de los cuidadores. Entendemos como positivo que el trabajo recoge la evolución de nuestra acción clínica, en permanente replanteamiento crítico, buscando el beneficio de los niños epilépticos, y no está sesgado ni encorsetado como sucede con los estudios prospectivos, que difícilmente pueden ser homogéneos con amplia población, en pacientes pediátricos epilépticos. Defendemos la importancia de las revistas médicas como herramienta de comunicación y discusión de las acciones clínicas en la vida real.
La calidad asistencial exige un esfuerzo continuado por adecuar las intervenciones a la mejor respuesta y tolerancia en un proceso de mejora que no tiene punto final. En el caso de los FAE en niños, tiene especial relevancia la vigilancia de su repercusión sobre las funciones cognitivas, atención y comportamiento. Nuestros datos de eficacia, tolerancia y adherencia nos animan a seguir usando LTG de primera elección en cualquier tipo de epilepsia pediátrica, si no existe urgencia en el control de las crisis. Debe prevalecer sobre la inmediatez, el control a largo plazo de las crisis y la repercusión sobre función ejecutiva, comportamiento y neurodesarrollo.
FinanciaciónEl trabajo presentado y la preparación del manuscrito no ha recibido financiación de ningún tipo.
Conflicto de interesesLos autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.