Los linfocitos B (LB) son células del sistema inmune adaptativo responsables de la respuesta humoral. Durante los últimos años se ha demostrado en humanos y murinos la existencia de LB con capacidad reguladora (Breg). La función reguladora de estos LB se ha adjudicado a la capacidad de producir IL-10 y de reducir la secreción de IFN-γ, TNF-α e IL-17 por parte de linfocitos T CD4+; además, las células Breg promueven la diferenciación de linfocitos T a un fenotipo regulador e inducen la remisión de manifestaciones autoinmunes en diferentes modelos murinos. En humanos, alteraciones en el número y función de células Breg se han reportado en lupus eritematoso sistémico, artritis reumatoide, entre otras enfermedades autoinmunes. Por consiguiente, se sugiere que las células Breg tienen un papel importante en la inmunopatología de las enfermedades autoinmunes y podrían convertirse en blanco potencial para tratamientos futuros.
B lymphocytes belong to the adaptive immune system and they are responsible for humoral responses. In recent years, it has been demonstrated the existence of B cells with regulatory capacity (Breg) in humans and mouse models. The regulatory function of these B cells is explained by the production of IL-10 and the reduction of IFN-γ, TNF-α and IL-17 secretion by CD4 + T cells; in addition, Breg cells promote the differentiation of T lymphocytes into a regulatory phenotype and induce the remission of autoimmune manifestations in different murine models. In humans, alterations in number and function of Breg cells have been reported in systemic lupus erythematosus, rheumatoid arthritis, and other autoimmune diseases. Therefore, it has been suggested that Breg cells have an important role in the immunopathology of autoimmune diseases and may be a potential target for future treatments.
Desde hace varias décadas se conoce el papel que desempeñan los linfocitos B (LB) en la respuesta inmune adaptativa y humoral, esencialmente como células presentadoras de antígeno profesionales y como productoras de anticuerpos y citocinas. La importancia de estas células en la respuesta inmune humoral se ha evidenciado en pacientes con defectos en la generación de LB maduros y funcionales, como es el caso de la enfermedad de Bruton o agammaglobulinemia ligada al cromosoma X (XLA, del inglés «X-linked agammaglobulinemia»), en la cual los LB se detienen en el estadio pre-B, por lo cual los pacientes cursan con agammaglobulinemia y sufren infecciones recurrentes causadas principalmente por patógenos extracelulares1. Sin embargo, llama la atención que aproximadamente el 20% de estos individuos desarrollan, además, manifestaciones autoinmunes tales como artritis reumatoide (AR)2.
En otras inmunodeficiencias primarias en las cuales hay compromiso de la maduración, diferenciación y activación del LB, también se ha evidenciado esta asociación. Es, por ejemplo, el caso del síndrome de hiperinmunoglobulinemia M (hiper-IgM), el cual se explica por diferentes defectos moleculares en la vía CD40-CD40L, complejo de coestimulación importante en la activación del LB. Este síndrome se caracteriza por poca o nula producción de inmunoglobulinas (Ig) de los isotipos A, E y G, así como por niveles normales o elevados de IgM3; el 25% de estos pacientes desarrolla manifestaciones autoinmunes como anormalidades hematológicas, artritis e inflamación intestinal4.
Pacientes con mutaciones en TACI (del inglés «tumor necrosis factor receptor superfamily member 13B»), un receptor del factor de sobrevida del LB, BAFF (del inglés «B cell–activating factor of the TNF family»), presentan una inmunodeficiencia común variable caracterizada por niveles bajos de producción de 2 o más isotipos de Ig, infecciones recurrentes del tracto respiratorio superior e inferior y 3,8 veces más probabilidad de sufrir trombocitopenia autoinmune que la población general5. En la deficiencia selectiva de IgA, del 7-36% de los pacientes, además de presentar un síndrome de infección recurrente6, desarrollan enfermedades autoinmunes como AR, lupus eritematoso sistémico (LES) y púrpura trombocitopénica7. Por lo tanto, estos hallazgos han sugerido que los LB además de su función como células efectoras del sistema inmune adaptativo, pueden tener un papel en el control y regulación negativa de las respuestas de dicho sistema.
En modelos animales también existe evidencia preliminar que sugiere un papel regulador de los LB. En la década de los setenta del siglo xx se observó que las reacciones de hipersensibilidad retardada de cobayos silvestres al HEA (del inglés «hen egg albumin») en adyuvante incompleto de Freund, tenían una mayor duración cuando los animales recibían ciclofosfamida, que reduce el número de LB, observándose reacción aun a los 12 días postratamiento en comparación con la ausencia de síntomas a los 8 días sin el tratamiento8. Esto sugirió un papel potencial de los LB en la regulación de este tipo de respuestas; sin embargo, debido a que este fármaco no es específico de LB sino de células en división9 y como se presenta a continuación, se requirieron posteriores estudios que demostraran que la regulación observada era explicada específicamente por los LB.
Células B con función reguladora en el modelo murino y moléculas implicadasEvidencias preliminares recopiladas a partir de diferentes modelos murinos de enfermedades autoinmunes sugirieron la existencia de LB con un fenotipo regulador. En 1996, el estudio de un modelo de encefalomielitis experimental autoinmune (EAE, del inglés «experimental autoimmune encephalomyelitis») en ratones C57BL/10.PL inmunizados con MBP (del inglés «myelin basic protein»), mostró que los ratones silvestres tuvieron remisión espontánea 23 días después de presentar los primeros síntomas, mientras que en ratones μMT (con deficiencia en células B maduras) no se observó remisión10. Estos resultados sugirieron que se requería por lo menos de una población de LB para el control de las manifestaciones autoinmunes observadas en estos ratones.
Estudios posteriores en el modelo de EAE mostraron cómo la capacidad reguladora de los LB se asociaba a la producción de IL-10. Se observó que ratones C57BL/6 inmunizados con MOG (del inglés «myelin oligodendrocyte glycoprotein») entraron en remisión espontánea de la EAE a los 30 días, en tanto que en ratones con deficiencia de IL-10 selectiva en LB no se observó dicha remisión. La transferencia adoptiva de LB de ratones silvestres con EAE a ratones deficientes de IL-10 inmunizados con MOG condujo a la remisión de la enfermedad en un periodo similar a lo observado con ratones silvestres. Adicionalmente, en este mismo estudio se encontró que la estimulación in vitro de LB provenientes de ratones C57BL/6 en remisión de la EAE con un anticuerpo agonista de CD40, condujo a la producción de IL-10 por parte de estas células, mientras que en los LB de ratones Cd40−/− no se halló dicha producción11. Estos resultados demostraron como la regulación de las manifestaciones autoinmunes de la EAE se debe en parte a la producción de IL-10 por parte de los LB y esta a su vez depende del estímulo de CD40.
Se ha observado que ratones con LB deficientes de la proteína MyD88 o de los receptores TLR2/4 (del inglés«toll like receptor») desarrollan una forma crónica de EAE mientras que ratones silvestres logran remisión de la enfermedad. La estimulación de los LB vía TLR4 o TLR9 induce la producción de IL-10, y en cocultivo, la supresión de linfocitos T (LT) CD4+CD25− estimulados con anti-CD312,13; esto sugiere que la función reguladora de los LB también puede inducirse a través de estos receptores de la inmunidad innata.
Adicionalmente se ha observado cómo ratones C57BL/6 Cd19−/− inmunizados con MOG cursan con mayores niveles de IFN-γ y de autoanticuerpos y sufren de una forma más agresiva de EAE. La transferencia adoptiva de LB de un ratón Cd19−/− con EAE a ratones silvestres inmunizados con MOG condujo a una EAE con mayores índices de inflamación, desmielinización y niveles aumentados de IFN-γ y menores de IL-10, comparados con los ratones que no recibieron dicha transferencia14. Ratones C57BL/10.PL con deficiencia de las moléculas de la familia B7 restringida a LB e inmunizados con MBP desarrollaron una EAE crónica sin remisión y con menores niveles de transcripción de IL-10 y Foxp3 en médula espinal15. Estos resultados sugieren que moléculas que participan en la activación del LB, como el CD19 y moléculas coestimuladoras implicadas en el contacto célula-célula como CD80/CD86, parecen ser importantes en la función reguladora de estos linfocitos.
El papel regulador de los LB también se evidenció inicialmente en un modelo murino de colitis autoinmune, en el cual la transferencia pasiva de Ig de ratones silvestres (C57BL/6) no enfermos o de ratones C57BL/6 Tcr-α−/− (los cuales desarrollan espontáneamente colitis) a ratones μMT Tcr-α−/− (los cuales desarrollan una inflamación aún más marcada) disminuyó significativamente la severidad de la colitis en estos animales16. En este modelo de colitis, también se ha observado que los ratones Cd1d−/−Tcr-α−/−desarrollan una forma más severa de la enfermedad. La transferencia adoptiva de LB de ratones Tcr-α−/− a ratones μMTTcr-α−/− disminuyó la inflamación del colon, lo que no ocurrió con la transferencia de LB de ratones Tcr-α−/−Cd1d−/−MHC-II−/−, con los que se incrementó dicha inflamación. En este mismo estudio, el bloqueo de la IL-10 con un anticuerpo específico suprimió el efecto benéfico observado con la transferencia de LB de ratones Tcr-α−/−17. Estos resultados sugirieron que los LB tienen un papel protector y antiinflamatorio en este modelo, en parte asociado con la producción de IL-10 y a la presencia de CD1d y MHC-II así como de Ig.
Evidencias de esta función reguladora de los LB también se encontraron en el modelo de ratones NOD (del inglés «non-obese diabetic»), los cuales desarrollan espontáneamente diabetes autoinmune. Se observó que la transferencia adoptiva de LB activados in vitro con lipopolisacárido (LPS) tuvo efectos protectores en el desarrollo de las manifestaciones autoinmunes de estos ratones, tales como la inhibición del desarrollo de diabetes (>80%), inducción de la producción de TGF-β y la presencia de 15-30 veces más apoptosis de LT en comparación con la transferencia de LB no estimulados18. Se encontró que la transferencia adoptiva de LB de ratón NOD activados con anti-IgM a ratones en etapa de iniciación de diabetes (5 semanas) indujo un retardo en el desarrollo de la enfermedad y una baja incidencia (30-40%) comparada con los controles (75%). Sin embargo, cuando esta transferencia se hizo a ratones con diabetes ya establecida (9 semanas) la incidencia de la enfermedad fue mayor (85-90%). El cocultivo de LB de estos ratones estimulados con anti-IgM y LT CD4+ estimulados con anti-CD3 llevó a la producción de altos niveles de IL-4, IL-10 y bajos niveles de IFN-γ por parte de LT CD4+19. Estos hallazgos sugieren que en algunos casos la estimulación a través del BCR podría inducir en células B un fenotipo regulador.
Algo similar se observó en el modelo murino de artritis CIA (del inglés «collagen induced arthritis») donde LB provenientes de ratones DBA/1 (ratón susceptible al desarrollo de CIA) en fase de remisión de la enfermedad, estimulados in vitro con un anticuerpo agonista para CD40 y transferidos adoptivamente a un ratón DBA/1, previnieron el desarrollo de la artritis. Por el contrario, la transferencia de LB de ratones DBA/1 Il-10−/− no protegió al ratón de la inducción experimental de la enfermedad20; indicando que la producción de IL-10 por parte de los LB, similar a lo observado en el modelo de EAE, cumple un papel en el control del desarrollo de la CIA y parece ser dependiente de la estimulación por CD40.
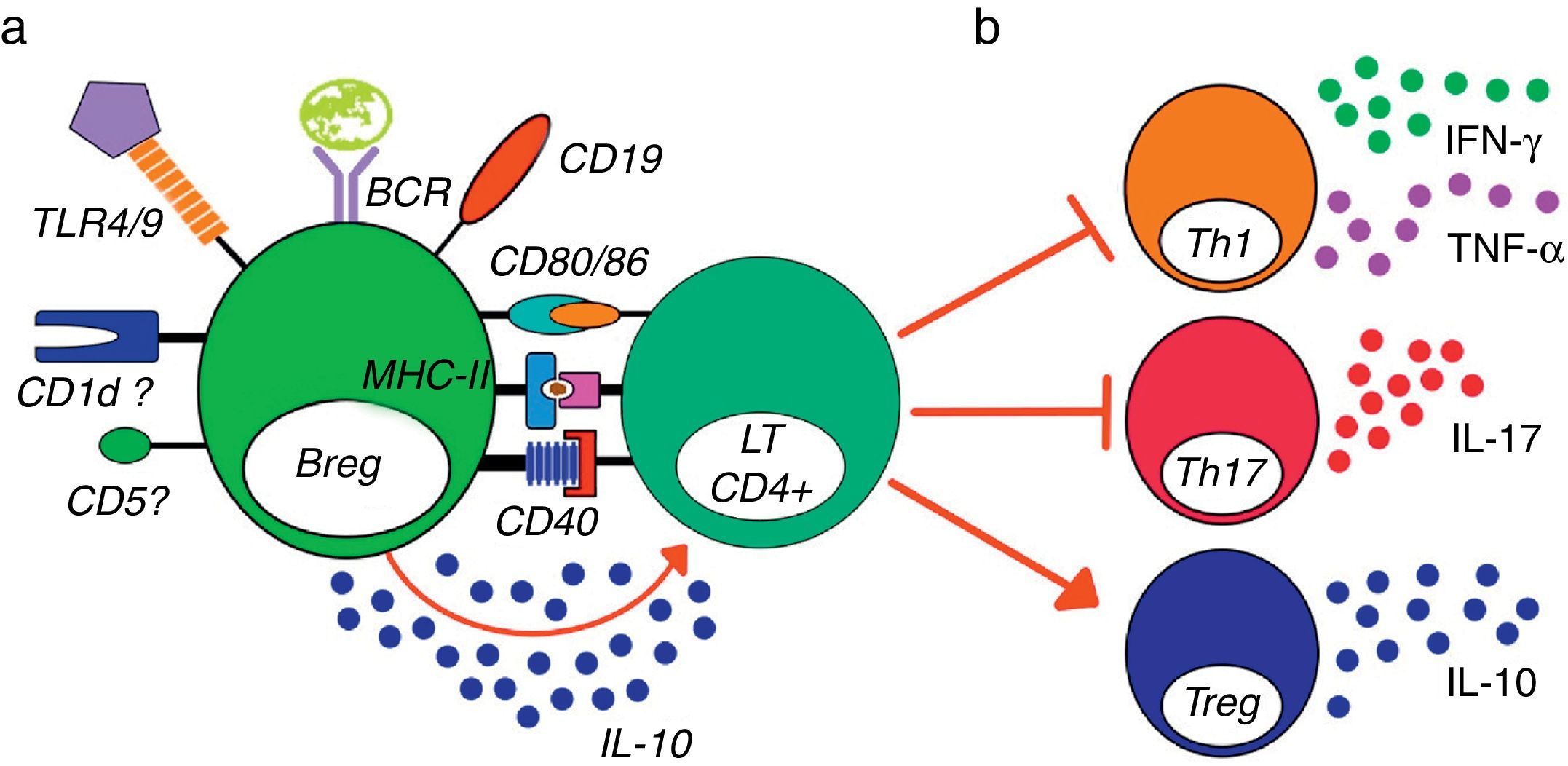
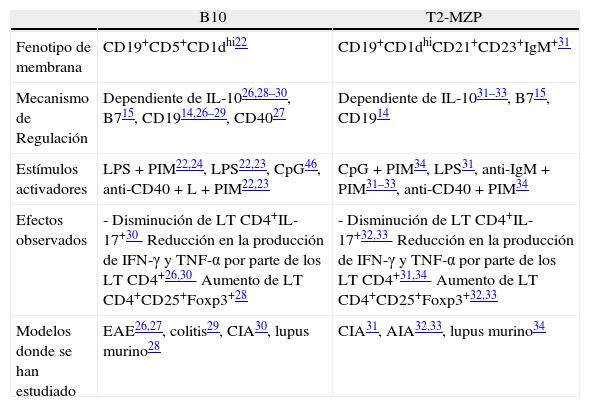
En conjunto, estos estudios demostraron que los LB tienen la capacidad de regular las manifestaciones autoinmunes en diferentes modelos murinos principalmente mediante la producción de IL-10. Además, el uso de ratones deficientes reveló la importancia de moléculas en esta función reguladora, como: CD1d, TLR, MyD88, CD19, CD40, CD80 y CD86. Estas investigaciones iniciales también permitieron un mejor entendimiento de la función de las células B con capacidad reguladora (Breg), por ejemplo su acción sobre los LT CD4+ efectores que conlleva a la menor producción de citocinas proinflamatorias como el TNF-α y el IFN-γ14,19 y la inducción de los marcadores asociados con LT reguladores (Treg) IL-10 y Foxp3, los cuales tienen un papel protector en el contexto de la autoinmunidad15,21 (fig. 1). Sin embargo, el desconocimiento de marcadores específicos que permitieran la selección y diferenciación clara de Breg de otras subpoblaciones de LB, condujo al desarrollo de diferentes trabajos que se encaminaron a una caracterización más detallada de estas células en diferentes modelos murinos de enfermedad autoinmune.
Modelo de activación y función general de las células Breg murinas. Un modelo de activación y función de las células B reguladoras de murinos, independientemente de la subpoblación estudiada. a. La estimulación vía TLR, BCR, la presencia de CD1d, CD5, CD19 y MHC-II, así como la coestimulación por CD40 y CD80/86, se han implicado en la activación de las células Breg y en la producción de IL-10 por parte de estas células. b. Las células Breg poseen la capacidad de inhibir la proliferación, la secreción de citocinas proinflamatorias por LT CD4+, al igual que inhibir la diferenciación de estas células a los perfiles Th1 y Th17 y promover la conversión de LT CD4+ a Treg productores de IL-10 y aumentar la expresión de Foxp3 en Treg previamente diferenciadas.
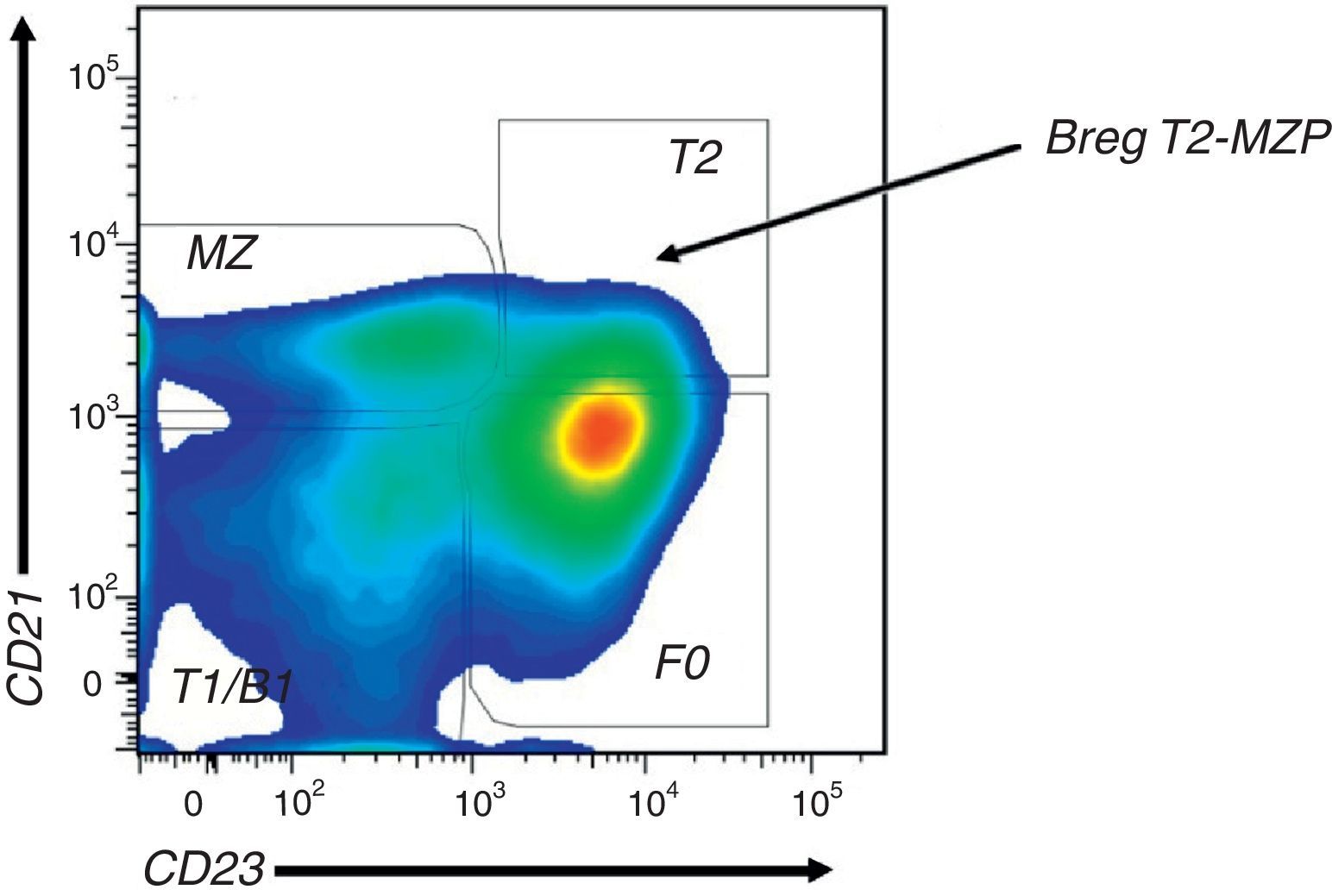
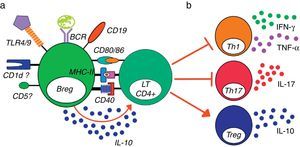
Se han descrito diversos marcadores de superficie para identificar las Breg de ratones, de los cuales hay algunos comunes a las células B1 (CD1dhiCD5+), a las de zona marginal (ZM, CD1dhiCD23-IgMhi) y a las transicionales 2 (T2, CD23+IgMhi) (fig. 2). Sin embargo, la fenotipificación de Breg todavía es controversial dado que aún se desconoce si existe una o varias clases o si las diferencias encontradas se deben a estadios de maduración y diferenciación disímiles. En resumen, en el modelo murino se han descrito al menos 2 clases de células B con capacidad reguladora mediada por la producción de IL-10 (tabla 1).
Subpoblaciones de Linfocitos B. Gráfico de densidad de citometría de flujo a partir de LB CD19+ de bazo de ratones C57BL/6. Definición de las subpoblaciones de LB basados en la expresión de CD21 y CD23: FO (CD21lowCD23+), T2 (CD21hiCD23+), ZM (CD21+CD23−) y T1/B1 (CD21low/-CD23−). Las Breg con fenotipo T2-MZP hacen parte del grupo de LB T2, mientras que las células B10 no han sido claramente designadas en ninguno de estos grupos.
Características de los linfocitos B reguladores de murinos
| B10 | T2-MZP | |
| Fenotipo de membrana | CD19+CD5+CD1dhi22 | CD19+CD1dhiCD21+CD23+IgM+31 |
| Mecanismo de Regulación | Dependiente de IL-1026,28–30, B715, CD1914,26–29, CD4027 | Dependiente de IL-1031–33, B715, CD1914 |
| Estímulos activadores | LPS+PIM22,24, LPS22,23, CpG46, anti-CD40+L+PIM22,23 | CpG+PIM34, LPS31, anti-IgM+PIM31–33, anti-CD40+PIM34 |
| Efectos observados | - Disminución de LT CD4+IL-17+30- Reducción en la producción de IFN-γ y TNF-α por parte de los LT CD4+26,30- Aumento de LT CD4+CD25+Foxp3+28 | - Disminución de LT CD4+IL-17+32,33- Reducción en la producción de IFN-γ y TNF-α por parte de los LT CD4+31,34- Aumento de LT CD4+CD25+Foxp3+32,33 |
| Modelos donde se han estudiado | EAE26,27, colitis29, CIA30, lupus murino28 | CIA31, AIA32,33, lupus murino34 |
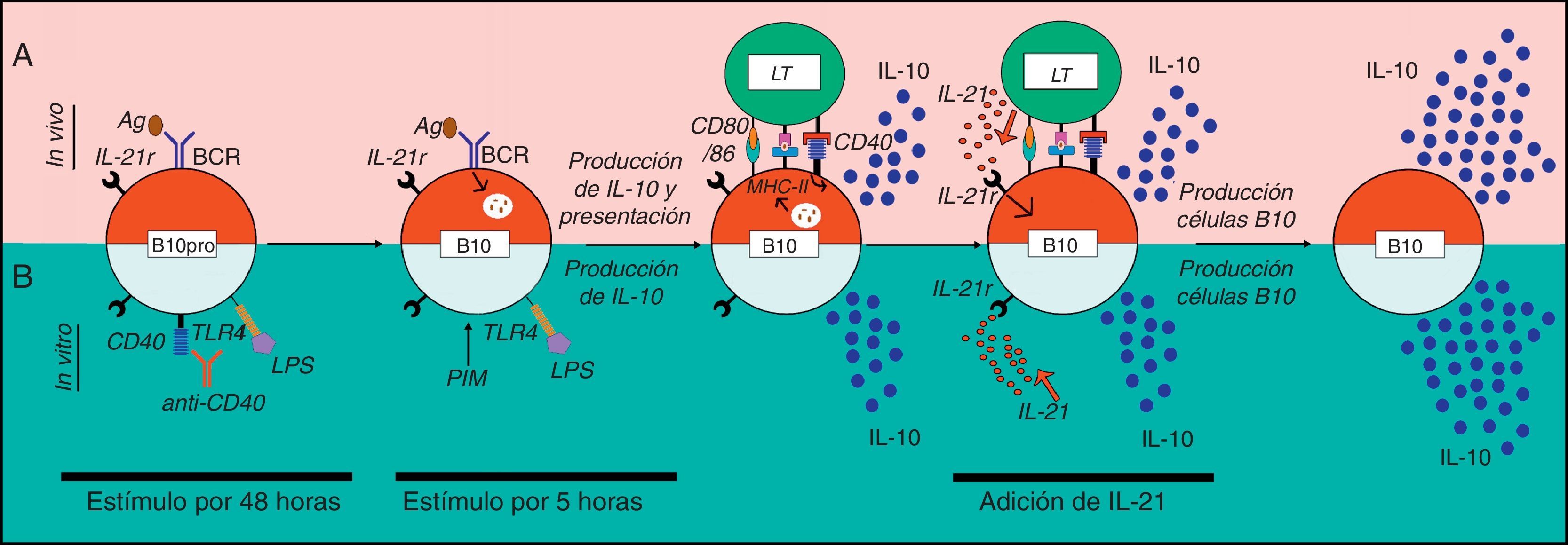
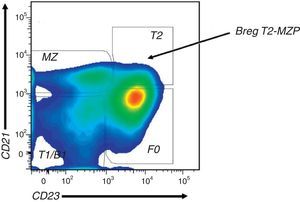
En el ratón, los LB con fenotipo CD19+CD5+CD1dhi, también llamados B10, son hasta el momento los LB reguladores más estudiados, y han sido descritos como potentes productores de IL-10, con capacidad de regular diferentes respuestas inmunes y de aminorar el progreso de los síntomas autoinmunes en modelos murinos. En ratones C57BL/6 se ha observado que LB esplénicos estimulados durante 5h con LPS, PMA (del inglés «phorbol 12-myristate 13-acetate») más ionomicina (L+PI) en presencia de monensina (L+PIM) producen ex vivo mayores niveles de IL-10 comparados con células derivadas de ratones Cd19−/−. Los LB CD19+CD5+CD1dhi productores de IL-10 provienen principalmente del bazo y de la cavidad peritoneal de estos ratones22. La estimulación in vitro de LB con fenotipo B10 usando un anticuerpo específico para CD40 o LPS durante 48h y PIM en las 5h finales condujo a que 4-5 veces más células produjeran IL-1022,23. Estos hallazgos sugirieron que existen tanto linfocitos B10 con producción rápida de IL-10 luego de la estimulación ex vivo, así como otra población denominada B10pro, que adquirieren la competencia de producir IL-10 luego de ser estimuladas in vitro (fig. 3).
Modelo de activación de células B10 en ratones. a. Se presenta un modelo de activación de las células B10 in vivo. Hasta el momento, se desconoce el mecanismo por el cual las células B10pro adquieren la competencia de producir IL-10 in vivo. Sin embargo, se postula que estas células reconocen el antígeno (Ag) a través de su BCR, lo internalizan, lo procesan y lo presentan al LT CD4+ vía MHC-II. El LT activado expresa el CD40L que al unirse a su ligando induce la produccion de IL-10 por parte de estos LB. Dependiendo del microambiente y de las señales coestimuladoras, el LT CD4+ podría secretar IL-21 que induce la proliferación de las células B10 y la secreción de más IL-10. b. Se presenta un modelo de activación de las células B10 in vitro. La estimulación in vitro con un anticuerpo agonista anti-CD40 o LPS durante 48h conduce a las células B10pro a diferenciarse a células B10 y, luego de una estimulación durante 5h con L+PIM producen IL-10. La adición de IL-21 al medio lleva a un incremento sustancial en la proliferación de B10 y a la producción de IL-10.
Se ha observado que las células B10 no requieren de la producción de IL-10 para su generación y mantenimiento en periferia. Esto se evidenció en ratones C57BL/6 modificados genéticamente para servir como reporteros del gen Il-10 por medio de la inserción de la secuencia de la proteína verde fluorescente o de la molécula de superficie Thy1.1 corriente abajo del promotor de la IL-10; que a la vez alteraba la secuencia del gen de esta citocina y su posterior expresión. Se observó que los ratones reporteros Il-10−/− tenían una frecuencia similar de células con fenotipo B10 a la de los ratones silvestres y que, luego de 48h de estimulación con LPS in vitro expresaron la proteína verde fluorescente o la molécula Thy1.1 en niveles similares a los de los ratones silvestres. Las células B10 con el gen de Il-10 alterado se diferenciaron en células plasmáticas productoras de anticuerpos (principalmente IgM), luego de 3 días de estimulación in vitro con LPS24. La IgM se ha asociado con protección en autoinmunidad, mediante la disminución de carga antigénica (células apoptóticas) y evitando la activación de señales proinflamatorias a través de los FcγR25.
El estudio de estas células B10 en la inducción de EAE en ratones inmunizados con MOG mostró que los animales C57BL/6 Il-10−/− presentaron una frecuencia similar de células B10 comparado con ratones silvestres, mientras que los Cd19−/− tuvieron una reducción significativa y los ratones hCD19Tg (con sobreexpresión de CD19 humano) un aumento marcado de estas células. Se observó igualmente que el tratamiento in vivo de ratones C57BL/6 con EAE con un anticuerpo contra el CD22 eliminó preferencialmente las células B10 de bazo, lo que exacerbó dramáticamente la severidad de la enfermedad. En este mismo estudio, células B10 estimuladas in vitro con un anticuerpo agonista del CD40 durante 48h y L+PI durante las 5h finales inhibieron la producción de TNF-α e IFN-γ por parte de LT CD4+ estimulados con anti-CD3, lo que no se observó con LB de ratones Il-10−/−26. Estos hallazgos sugirieron que las células B10 tienen la capacidad de regular la producción de citocinas proinflamatorias importantes en la inmunopatología de la EAE y, aunque IL-10 no fue necesaria para la generación de las células B10, esta citocina fue relevante para la regulación ejercida por estas células.
Recientemente se reportó que la IL-21 induce la expansión de células con fenotipo B10 productoras de IL-10. La estimulación in vitro de células B10 de ratones C57BL/6 con IL-21 durante 48 y 72h junto con L+PIM durante las 5h finales incrementó en al menos 3 veces la proporción de LB productores de IL-10, mientras que la estimulación de LB no B10 no mostró efecto alguno. La transferencia adoptiva de células B10 de ratones C57BL/6 silvestres a ratones Cd19−/− inmunizados con MOG, los cuales sufren de una EAE crónica sin remisión, disminuyó los síntomas a niveles comparables con los ratones silvestres, redujo la proporción de LT CD4+ productores de IL-17 e IFN-γ así como la proliferación de estos linfocitos. Este efecto no se observó cuando se emplearon células B10 provenientes de ratones Cd40−/−, MHC-II−/− o Il-21r−/− (fig. 3). Adicionalmente, la transferencia adoptiva de células B10 estimuladas con IL-21 a ratones silvestres con EAE disminuyó los signos de la enfermedad de forma más rápida que la de los ratones que recibieron células no B10; esta mejoría se observó incluso cuando la transferencia se hizo días después de instaurada la EAE27. Estos hallazgos llevan a plantear la expansión de Breg in vitro como una posible estrategia terapéutica.
En otros modelos murinos también se evidencia el papel regulador de las células B10. Se ha observado en ratones NZB/W, los cuales desarrollan espontáneamente una enfermedad tipo LES, que cuando son deficientes de Cd19 tienen menor supervivencia y presentan manifestaciones más severas de la enfermedad, así como daño renal marcado y glomerulonefritis severa, en comparación con los ratones silvestres. En estos ratones Cd19−/− se observó una disminución significativa en el número y frecuencia de células con fenotipo B10 y en la producción de IL-10 por parte de LB esplénicos. La transferencia adoptiva de linfocitos B10 de ratones silvestres a un ratón Cd19−/− disminuyó la severidad de la enfermedad y aumentó el número de LT CD4+CD25+Foxp3+ productores de IL-10, comparado con la transferencia de células no-B1028. Estos resultados sugieren que las células B10 tienen un papel regulador de la progresión del lupus y que los mecanismos efectores que emplean estas células pueden deberse al menos en parte a la conversión de LT CD4+ a un perfil regulador.
Los ratones C57BL/6 silvestres sufren de inflamación intestinal cuando se les administra DSS (del inglés «dextran sulphate sodium») y además, cuando son deficientes de Cd19 sufren de una enfermedad más severa. Se encontró que los ratones silvestres tuvieron una clara expansión de linfocitos B10 luego del tratamiento con DSS, mientras que en los ratones Cd19−/− se encontró ausencia de estas células y no hubo producción de IL-10 por parte de los LB en respuesta al LPS más ionomicina. La transferencia adoptiva de células B10 de ratones silvestres a ratones Cd19−/− antes de la inducción de la inflamación con DSS redujo la severidad de la enfermedad, mientras que la transferencia de células B10 a partir de ratones Il-10−/− no tuvo dicho efecto29. Estos hallazgos muestran la importancia de estas células en la regulación de la inflamación intestinal, mediada principalmente por la producción de IL-10.
En un modelo de CIA se observó que la transferencia adoptiva de células B10 a ratones DBA/1 inmunizados con colágeno tipo ii disminuyó significativamente el desarrollo de artritis y redujo la frecuencia de LT Th17, mientras que el uso de linfocitos con fenotipo B10 provenientes de ratones Il-10−/− no mostró el efecto regulador30. Esta evidencia sugiere que las células B10 tienen la capacidad de regular los LT con perfil proinflamatorio Th17 presentes por lo menos en algunas enfermedades autoinmunes.
En resumen, los datos que se tienen hasta el momento demuestran claramente la existencia de células con fenotipo B10 productoras de IL-10, las cuales están implicadas en la regulación de diversos modelos murinos de enfermedades autoinmunes como AR, esclerosis múltiple, LES y colitis. Esta regulación es mediada principalmente por la IL-10 y depende de la presencia de múltiples moléculas como CD19, CD1d, CD40, CD80, CD86, MHC-II e IL-21R; estas células tiene la capacidad de reducir la frecuencia de LT de los perfiles proinflamatorios Th1 y Th17, así como promover el aumento de Treg (figs. 1 y 3).
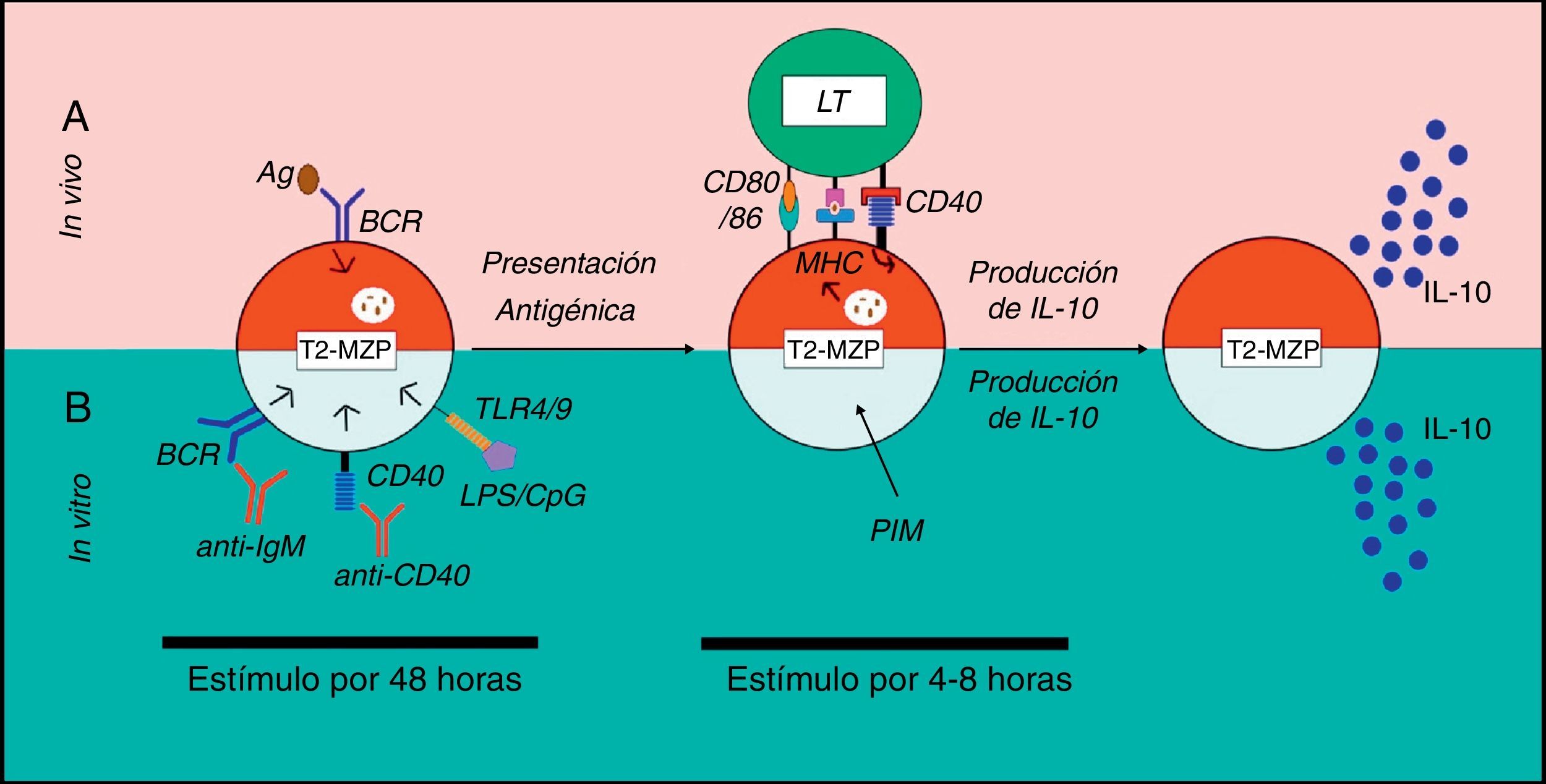
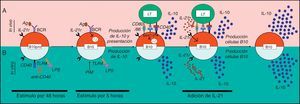
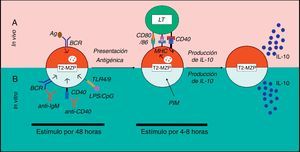
Células transicionales 2 precursoras de células de zona marginalAdicional a las células B10, se ha identificado en ratones una población de LB productores de IL-10 cuyo fenotipo CD19+CD1dhiCD21hiCD23hiIgMhiIgDhi es equivalente a LB transicionales 2 (T2) precursores de células de ZM o T2-MZP (del inglés «T2-marginal zone precursors»). Las células reguladoras T2-MZP fueron caracterizadas por primera vez en el modelo murino de CIA a partir de LB de bazo de ratones DBA/1, como células productoras de IL-10 en respuesta a la estimulación in vitro con LPS o anti-IgM (fig. 4). En este estudio se observó que la transferencia adoptiva de LB T2-MZP provenientes de ratones en fase de remisión de la CIA a ratones en el día de la inmunización con colágeno tipo ii disminuyó las manifestaciones autoinmunes, reduciendo en un 60% el infiltrado celular y minimizando el daño en el cartílago de estos ratones. La transferencia de LB de ZM y foliculares (FO) de ratones silvestres o de LB T2-MZP de ratones Il-10−/− no mostró el efecto regulador. El cocultivo de LB junto con LT CD4+ en presencia de colágeno tipo ii mostró que las células T2-MZP, pero no las ZM o FO, inhibieron la producción de IFN-γ por parte de los LT31. Estos hallazgos sugirieron que los LB T2-MZP son células reguladoras y que requieren de la producción de IL-10 para ejercer su función.
Modelo de activación de células T2-MZP en ratones. a. Se presenta un modelo de activación de los LB T2-MZP reguladores in vivo. Se desconocen las señales que llevan a la producción in vivo de IL-10 por parte de las células T2-MZP, pero se cree que estas células Breg reconocen el antígeno vía BCR, lo internalizan, lo procesan y lo presentan al LT CD4+ por medio del MHC-II. El LT activado expresa CD40L, que al unirse a su ligando induce la producción de IL-10 en estos LB. b. Se presenta un modelo del funcionamiento de los LB T2-MZP reguladores in vitro. La estimulación con un anticuerpo agonista anti-IgM o anti-CD40 o LPS/CpG durante 48h y posteriormente con PIM durante las 4-8h finales, lleva a la producción de IL-10 por parte de los LB T2-MZP.
La transferencia adoptiva de LB T2-MZP provenientes de ratones C57BL/6 silvestres en remisión de AIA (del inglés «adjuvant-induced arthritis») a ratones Il-10−/− previamente inmunizados con mBSA (del inglés «methylated bovine serum albumin») para inducir AIA llevó a un aumento en la proporción de LT CD4+Foxp3+ en los nódulos linfáticos (a 14,3% a partir de un 8,03% del total de LT). En el mismo estudio, se encontró que la frecuencia de LT CD4+IFN-g+ y LT CD4+IL-17+ disminuyó con la transferencia adoptiva de LB T2-MZP de ratones silvestres pero no cuando está subpoblación provino de ratones Il-10−/−. El cocultivo de LT CD4+CD25− y LB T2-MZP de ratones silvestres en presencia de mBSA, evidenció la diferenciación de estos LT a células Foxp3+ (20,3% del total de LT), en contraste con el uso de LB de Il-10−/− (0,84%)32,33. Estos resultados muestran que las Breg T2-MZP tienen la capacidad de inducir la diferenciación de LT CD4+ efectores en Treg y sugieren que estas Breg pueden regular el balance entre los perfiles Th1-Th17/Treg.
Se ha determinado que los LB T2-MZP de ratones MRL/lpr, los cuales desarrollan espontáneamente una enfermedad tipo LES, producen IL-10 al ser estimulados in vitro con anti-CD40 (fig. 4). El cocultivo de estas células T2-MZP previamente activadas con un agonista del CD40 junto con LT CD4+CD25− estimulados con anti-CD3, inhibió la producción de TNF-α e IFN-γ por parte de estos LT. La transferencia adoptiva de las células T2-MZP a ratones MRL/lpr disminuyó significativamente los niveles de proteinuria, la infiltración glomerular e intersticial, así como la mortalidad de estos ratones, en comparación con la transferencia de LB FO o de MZ34.
En síntesis, las células T2-MZP murinas han mostrado un papel regulador en modelos de enfermedades autoinmunes como la AR y LES, principalmente mediante la producción de IL-10 desencadenada mediante la estimulación del CD40. Similar a lo reportado para las células B10, las T2-MZP también reducen la proporción de LT de los perfiles proinflamatorios Th1 y Th17 e inducen un aumento en los LT reguladores CD4+CD25+Foxp3+ productores de IL-10.
Células B con fenotipo regulador en humanosLa caracterización de Breg en humanos es más controversial que la de murinos debido a la existencia de datos discordantes sobre el tema. En general, se podría decir que se han identificado 3 clases de Breg en humanos (tabla 2), pero todavía se desconoce si algunas de estas células son de una misma subclase o si por el contrario existen como subgrupos diferenciados de Breg.
Características de los linfocitos B reguladores de humanos
| CD19+CD25+ | CD19+CD24hiCD38hi | CD19+CD24hiCD27+ | |
| Fenotipo | CD25hiCD27hiCD86hiCD1dhi36 | IgMhiIgDhiCD5+CD10+CD20+CD27−CD1dhi37 | CD19hiCD38hiCD1dhiD20hiCD21hiCD23hiCD24hiCD25hiCD27hi41 |
| Mecanismo de regulación | Dependiente de contacto célula-célula36. Independiente de IL-1036 | Dependiente de IL-10, CD80, CD86 y CD4037 | Dependiente de CD40. Regulación de la producción de citocinas por LT CD4+ independiente de IL-1041,42 y dependiente de IL-10 en monocitos41,42 |
| Estímulos activadores | CD40L recombinante + CpG + IL-436 | Anti-CD40+PIM37, anti-CD8037, anti-CD8637 | CpG41,42, LPS41, anti-CD4041,42, PIB41 |
| Estudiada en | Individuos sanos36 | Individuos sanos37, AR38,39, LES37,38, Sjögren37,38, osteoartritis37 | Individuos sanos41, LES41, AR41, esclerosis múltiple41, Sjögren41, enfermedad de Graves42 |
Se ha observado que los LB humanos CD19+CD25+ provenientes de sangre periférica de personas sanas producen más IL-10 y menos IL-2 en respuesta a CpGs en comparación con las células CD19+CD25−35. Recientemente se reportó la existencia de unos LB de sangre periférica con un fenotipo regulador CD25hiCD27hiCD86hiCD1dhi, productores de altos niveles de IL-10 y TGF-β. En este estudio se observó, además, una menor proliferación de LT CD4+ estimulados con anti-CD3 cuando estos eran cocultivados con LB que exhibían el fenotipo anteriormente mencionado, comparado con el cocultivo empleando LB CD25low. El cocultivo de LB CD19+CD25+ con linfocitos Treg (CD4+CD25hiFoxp3+) en presencia de la proteína recombinante CD40L, CpG e IL-4 indujo un aumento significativo en la expresión de Foxp3 y de CTLA-4 en estos Treg; mientras que el uso del receptor soluble de IL-10 no afectó dicho incremento, sugiriendo un efecto de estas Breg independiente de IL-10. Además, mediante el cocultivo de estos linfocitos separados por una membrana, se encontró que las células Breg inducen la expresión de Foxp3 y de CTLA-4 de una forma dependiente de contacto36. Como se verá más adelante, el fenotipo anteriormente descrito referente a la expresión de CD1d tiene similitud con otras células Breg reportadas, por lo que es posible que se trate de subpoblaciones equivalentes; sin embargo, se requieren otros estudios para resolver esta incógnita.
Linfocitos B CD19+CD24hiCD38hiSe ha reportado que los LB de sangre periférica de individuos sanos con fenotipo CD19+CD38hiCD24hi son productores de IL-10 y tienen capacidad reguladora sobre LT. Estas Breg poseen el fenotipo IgMhiIgDhiCD5+CD10+CD20+CD27−CD1dhi, similar a los LB T2 humanos. Se encontró que estas células estimuladas vía CD40 suprimieron la producción de TNF-α e IFN-γ pero no de IL-17 por LT CD4+, así como parte de la proliferación de estas células en respuesta al anti-CD3. La adición de un anticuerpo anti-IL-10 así como el bloqueo de la coestimulación mediada por CD80 y CD86 evitó que estas Breg inhibieran la proliferación de LT CD4+, pero se siguió observando el bloqueó en la producción de TNF-α e IFN-γ. Contrariamente, el bloqueo de la interacción CD40-CD40L impidió que las Breg suprimieran la proliferación de LT, pero no se observó efecto sobre la producción de IFN-γ y TNF-α37,38. Estos datos sugieren que la regulación mediada por estas células Breg requiere, por una parte, de IL-10 y la coestimulación vía CD80/86 para inhibir la producción de citocinas proinflamatorias, y por otra, de la coestimulación del CD40 para inhibir la proliferación de LT.
En pacientes con LES se ha encontrado que la proporción de estas células Breg está aumentada (15% del total de LB) en comparación con controles sanos y con pacientes con síndrome de Sjögren y osteoartritis (10%). A pesar del número elevado en LES, se ha observado que estas células son incapaces de suprimir la producción de TNF-α e IFN-γ por parte de LT CD4+ estimulados con anti-CD3, mientras que las células de individuos sanos así como de pacientes con síndrome de Sjögren y osteoartritis sí lo hacen37. Las células Breg de pacientes con LES estimuladas con un anticuerpo agonista de CD40 tuvieron una producción significativamente menor de IL-10 en comparación con controles sanos, sin que se observara en los pacientes defectos en el nivel de expresión de esta molécula coestimuladora37. Estos resultados sugieren alteraciones en la señalización de CD40 en las células Breg de los pacientes con LES, lo cual podría explicar en parte las alteraciones en la tolerancia que presentan estos pacientes.
Otro estudio reportó que la supresión mediada por esta clase de Breg se encuentra defectuosa en pacientes con LES; la proliferación de LT estimulados con anti-CD3 fue regulada negativamente por las células Breg de pacientes con AR y síndrome de Sjögren y no por las Breg de pacientes con LES38. Se ha encontrado que pacientes con AR tratados con anti-CD20 (rituximab), un anticuerpo que reduce significativamente las poblaciones de LB (en un 97%), repueblan su sangre periférica con LB CD27− e IgD+, los cuales presentan un incremento en la expresión de CD38 y CD539, sugiriendo que la mejoría clínica observada en los pacientes luego del uso de rituximab podría asociarse con un incremento de LB con fenotipo regulador. Sin embargo, se requieren estudios adicionales que permitan sacar conclusiones definitivas al respecto.
Las células Breg CD19+CD38hiCD24hi de sangre periférica de individuos sanos indujeron en LT CD4+CD25+ estimulados con anti-CD3 un perfil regulador productor de IL-10 e inhibieron la diferenciación de estos linfocitos a los perfiles Th1 y Th17. Sin embargo, las células Breg de pacientes con AR fueron incapaces de inducir dicho fenotipo regulador y de inhibir el perfil Th17, pero conservaron la capacidad de bloquear la diferenciación a Th140. También se observó que pacientes con AR activa tenían un menor número de Breg circulantes comparado con individuos sanos y con AR inactiva40. Estos resultados muestran que los pacientes con AR activa tienen alteraciones tanto en número como en función de las células Breg que podrían estar involucradas en la fisiopatología de la enfermedad.
Linfocitos B CD19+CD24hiCD27+Similar a las células B10 murinas, los LB CD24hiCD27+ (B10 humanos) aislados de sangre periférica de humanos y estimulados con LPS y anti-CD40 producen cantidades importantes de IL-10. Las células B10 humanas productoras ex vivo de IL-10 representan el 0,6% del total de LB en sangre periférica, pero su frecuencia aumenta a 12,1% luego de la estimulación in vitro con LPS y anticuerpo agonista para CD40. Esto indica que los LB CD24hiCD27+ pueden capacitarse para la producción de IL-10, semejante a lo observado con las células B10pro de murinos41. Se ha observado que las células B10 humanas tratadas con CpG y anti-CD40 regulan negativamente la producción de TNF-α por parte de LT CD4+ estimulados con anti-CD3. El cocultivo de estas células B10 con monocitos circulantes también redujo la producción de TNF-α por parte de estas células. Mediante el uso de un anticuerpo específico para IL-10 en estos experimentos, se observó que la inhibición mediada por estas células Breg es independiente de esta citocina para LT CD4+ pero dependiente de ella para los monocitos41,42. Estas células B10 humanas se han caracterizado con los marcadores CD19hiCD38hiCD1dhiCD20hiCD21hiCD23hiCD24hiCD25hiCD27hi41.
Se ha reportado un aumento en la frecuencia de estas células B10 en sangre periférica de pacientes con LES, AR y síndrome de Sjögren (2,4; 2,3 y 1,6%, respectivamente) en comparación con individuos sanos (0,7%) y pacientes con esclerosis múltiple (0,8%). No obstante, la frecuencia de LB con el fenotipo B10pro en mononucleares estimulados con CpG y PIB (de su sigla en inglés «phorbol ester and ionomycin plus BFA») se encontró significativamente aumentada en pacientes con LES (21%), AR (20%), síndrome de Sjögren (17%) y esclerosis múltiple (9%) en comparación con individuos sanos (4%)41. Asimismo, se ha reportado que el porcentaje de estas células Breg está disminuido significativamente en pacientes con enfermedad de Graves en comparación con individuos sanos y que dichos niveles se normalizan luego del tratamiento con metimazol. Las células Breg de pacientes con enfermedad de Graves activa produjeron menores niveles de IL-10 y fueron incapaces de inhibir la producción de TNF-α e IFN-γ por parte de LT CD4+, comparados con controles sanos42.
Conclusiones y perspectivasLa caracterización que se tiene hasta el momento de las Breg independiente de la producción de IL-10 no permite una definición precisa y exacta de estas células, ya que los marcadores de membrana utilizados se comparten con otras poblaciones de LB que no poseen propiedades reguladoras y/o poseen características de células inmaduras (fig. 2). Por lo tanto, se requiere de estudios que permitan definir mejor el fenotipo de estas células. Algo similar ocurre con los mecanismos funcionales, ya que aún son controversiales los elementos que participan en la regulación mediada por estas células; por ejemplo, se desconoce cuál es el papel de la presentación antigénica y la expresión de moléculas como FasL, TRAIL (del inglés «tumor necrosis factor–related apoptosis-inducing ligand»), PD-L1, PD-L2 y granzimas43. Adicionalmente, falta por esclarecer si estas células recirculan por los sitios de inflamación y si regulan además de los LT, otros tipos celulares como las células dendríticas, monocitos, NKT (de su sigla en inglés «natural killer T»), entre otras. También es necesario aclarar el papel que cumple el CD1d expresado por las células Breg; esta molécula ha sido relacionada con la presentación antigénica a células NKT, a las cuales se les han descrito funciones reguladoras como la inhibición de la producción de IL-17 e inducción del reclutamiento de Treg44. Recientemente, se ha reportado en ratones que los LB productores de IL-10 son capaces de diferenciarse a células secretoras de anticuerpos tipo IgM e IgG; en humanos se ha observado que los LB productores de IL-10 provenientes de sangre periférica de individuos sanos expresan 10 veces más niveles de ARNm que codifica para anticuerpos tipo IgG4 en comparación con los LB que no producen IL-10; a estos anticuerpos IgG4 se les ha asociado un papel no-inflamatorio, dado que no activan el complemento24,45. El papel regulador de los LB productores de IL-10 y de anticuerpos queda por esclarecer, pero es posible que la secreción de IgM e IgG4 sea parte del mecanismo mediante el cual las células Breg son capaces de regular las manifestaciones autoinmunes.
Los datos obtenidos hasta el momento revelan las diferencias existentes en el fenotipo y función de las células Breg humanas y murinas. Por ejemplo, en estos últimos la regulación es mediada principalmente por la producción de IL-10, mientras que algunos datos de Breg humanas muestran que el efecto regulador de la proliferación de LT CD4+ es independiente de la producción de esta citocina. Por lo tanto, se requiere aclarar si efectivamente la IL-10 producida por las Breg humanas está implicada parcialmente en la regulación de las manifestaciones autoinmunes. A pesar de esta discordancia, hay similitud en el requerimiento de moléculas coestimuladoras como el CD40, CD80 y CD86 para que las Breg puedan inhibir la proliferación de LT CD4+CD25− y/o la producción de citocinas proinflamatorias como el IFN-γ, TNF-α e IL-17.
Hasta el momento se desconoce si el aumento de las manifestaciones autoinmunes en ciertas inmunodeficiencias primarias se debe en parte a la existencia de alteraciones en la generación o función de LB con fenotipo regulador. Sin embargo, en inmunodeficiencias humorales se desarrolla un porcentaje importante de estas manifestaciones, lo que sugiere un papel de los LB en el balance de las respuestas anti y proinflamatorias de estos individuos. El estudio continuado de las células Breg en el humano y el modelo murino permitirá un mejor entendimiento de los mecanismos regulatorios, así como la comprensión del papel que cumplen estas células en la inmunopatología de las enfermedades autoinmunes y la búsqueda de nuevas terapias o abordajes terapéuticos alternativos para los pacientes con enfermedades inflamatorias crónicas.
FinanciaciónEl presente trabajo ha sido financiado por COLCIENCIAS, proyecto 111554531390, y ha recibido apoyo del Programa de Sostenibilidad 2013-2014 de la Universidad de Antioquia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.