Describir la incidencia de neumonía por Pneumocystis (PCP) en pacientes con síndrome de inmunodeficiencia adquirida hospitalizados en el Hospital La María de Medellín durante 2008–2009.
IntroducciónEl Pneumocystis jirovecii (P. jirovecii) es un hongo oportunista que produce enfermedad pulmonar en personas inmunosuprimidas, principalmente por el virus de la inmunodeficiencia humana (VIH). Es la segunda enfermedad definitoria del síndrome de inmunodeficiencia adquirida en países desarrollados, luego de la candidiasis esofágica, y la principal causa de ingreso a la unidad de cuidado intensivo en esta población. Su incidencia varía según la población estudiada y el método diagnóstico utilizado.
Materiales y métodosSe realizó un estudio observacional, descriptivo, retrospectivo, mediante la revisión manual de 218 historias clínicas de todos los pacientes hospitalizados en el Hospital La María de Medellín con diagnóstico de infección por VIH desde enero de 2008 hasta diciembre de 2009. Se incluyeron pacientes VIH positivos con diagnóstico confirmado de PCP por tinción de plata metenamina en muestra de lavado broncoalveolar.
ResultadosSe encontró una incidencia de PCP de 11,9% (26 pacientes); el 61,5% fueron hombres y el 38,5% mujeres, la edad promedio fue 33,1 años (21–49), fue la enfermedad definitoria de síndrome de inmunodeficiencia adquirida en 5 pacientes (19,2%), el 15,2% era desconocedor de su condición de infección por VIH, el 92,3% no se encontraban recibiendo profilaxis contra PCP y el 76,9% no recibían terapia antirretroviral altamente efectiva. Ingresaron a la unidad de cuidado intensivo 6 pacientes (23,1%), de los cuales, 3 fallecieron. La mortalidad general fue del 11,5%. El recuento promedio de linfocitos T CD4 fue de 60 células/μL. En el 47,88% de los pacientes, la presentación clínica fue de curso subagudo, con 2 semanas de evolución de la sintomatología. Entre los síntomas más frecuentes al ingreso fueron tos (96,2%), disnea (96,2%) y taquipnea (96,2%) con hipoxemia (presión arterial de oxígeno < 70mmHg) en el 49,5%. Can-didiasis orofaríngea se presentó concomitantemente en 18 pacientes (69,2%), y tuberculosis en 19,2%. El 77% de los pacientes recibió trimetoprim/sulfametoxazol como terapia, acompañada de corticosteroides en el 46,2%.
ConclusionesLa PCP es una de las principales infecciones oportunistas en pacientes con VIH en nuestro medio y asociada al diagnóstico tardío de infección por VIH.
To describe the incidence of Pneumocystis pneumonia (PCP) in patients with AIDS, hospitalized in the Hospital La María in Medellín, Colombia during 2008–2009. Pneumocystis jirovecii (P. jirovecii) is an opportunistic fungus that compromises the pulmonary tract mainly in immunosuppressed individuals infected with the human immunodeficiency virus (HIV). It is one of the principal defining illnesses for Acquired Immune Deficiency Syndrome (AIDS) in developed countries after esophageal candidiasis, and the main cause of admission to the intensive care unit (ICU) in this population. Its incidence varies based on the population stud-ied and diagnostic method used.
MethodsWe performed an observational, descriptive, retrospective study that involved manual analysis of 218 medical records of all the patients admitted with AIDS between January 2008 and December 2009. All patients had a confirmed diagnosis of PCP using a lung sample taken with bronchoalveolar lavage (BAL), stained with methenamine silver
ResultsThis study found a PCP incidence of 11.9% (26 patients), 61.5% were men and 38,5% women, the mean age was 33.1 years (21–49). It was the AIDS-defining illness in 5 patients (19.2%), and 15.2% of the population did not know they were HIV-infected, 92.3% had not received prophylaxis for PCP, and 76.9% were not receiving HAART. Six patients were admitted to the ICU (23.1%), and three of them died. The overall mortality was 11.4% (3 patients). The mean CD4 T lymphocyte count was 60 cells/μL. According to the clinical presentation, 47.88% of the patients presented with a subacute course (2 weeks of symptoms). The most frequent symptoms of admission were cough (96.2%), dyspnea (96.2%) and tachypnea (96.2%), with hypoxemia (PaO2<70mmHg) in 49.5% of the patients. Oropharyngeal candidiasis was concomitant in 18 patients (68.4%) and tuberculosis in 19.2%. Trimethoprim/Sulfamethoxazole was the therapy in 77% of the patients, and 46.2% required corticosteroids
ConclusionsPCP in our region is still one of the leading causes of morbidity-mortality in patients with AIDS, and is associated with a late diagnosis of HIV infection.
El Pneumocystis jirovecii (P. jirovecii) antes era denominado P. carinii, pero a partir de 1999 su nombre cambió para especificar que el P. jirovecii es el único que infecta a los humanos1, también estaba clasificado como un protozoo, pero después de su análisis genético, en 1988, se reclasificó como hongo2–4.
La epidemia del síndrome de inmunodeficiencia adquierida (sida) se inició en 1981 con la descripción, por parte del Cen-ter for Disease Control and Prevention, de 5 casos de neumonía por Pneumocystis (PCP) en pacientes homosexuales previamente sanos en Los Ángeles, California5. Desde entonces, la PCP ha sido una de las principales enfermedades definitorias de sida en países desarrollados (en EE. UU., representa el 25%5, en Europa el 17,3%6) y una de las fundamentales en países en vías de desarrollo, donde ocupa un lugar predominante junto con la candidiasis esofágica y la tuberculosis (TB)7–11. En nuestro medio, se ha encontrado en los pacientes con VIH coinfección con TB en el 25 al 30% de los pacientes12. En el año 2009, la Organización Mundial de la Salud estimó que en el mundo existían 33,3 millones de personas que convivían con VIH13. Previo al inicio de la epidemia de VIH, se reportaban menos de 100 casos de PCP por año en Estados Unidos; posterior a esta el número de reportes, se incrementó 100 veces, convirtiéndose en una de las principales enfermedades definitorias de sida14. La prevalencia de infección por VIH en Colombia es del 0,59% en la población general15.
La incidencia de PCP ha disminuido gracias a la introducción de la profilaxis con trimetoprim-sulfametoxasol (TMP-SMX) a partir del año 1989 y el uso de terapia antirretroviral altamente efectiva (HAART) en 19961,16–18. Su incidencia varía con la ubicación geográfica y el método diagnóstico utilizado, con una incidencia reportada en los Estados Unidos de 3,4% en 199816,19, en Europa de 17,3%6, en Brasil de 13–55%20, en Colombia fue reportada en 21,2% de los lavados broncoalveolares (LBA) de pacientes con sida y síntomas pulmonares9,21, en África varía entre 8 y 33%22,23 y en Tailandia del 27 al 40%2 en personas que conviven con VIH.
Los factores de riesgo asociados a PCP en los pacientes infectados con el VIH son: 1) recuento de linfocitos T CD4 (LTCD4) < 200 o < 14%20, y 2) presencia de candidiasis orofaríngea5,24,25.
Ante la presencia de cualquiera de estos factores, se considera necesaria la profilaxis contra P. jirovecii26, ya que de no recibirla, estos pacientes tendrían 9 veces más riesgo de sufrir PCP que aquellos que la reciben24. Se utiliza TMP-SMX, 1 tableta de 160/800mg/día27,28, la cual, además de prevenir PCP protege contra toxoplasmosis29 y neumonías bacterianas (Evidencia AI).
Su presentación clínica es inespecífica, comienza generalmente como un cuadro subagudo, con síntomas vagos e inespecíficos que duran entre 3 y 7 semanas30,31. Debido a esto, en algunos casos el diagnóstico es difícil y se requiere una alta sospecha clínica para hacerlo. La tríada clásica consiste en fiebre baja, tos seca y disnea de esfuerzo, aunque esta no siempre se presenta21,24; también puede darse taquipnea, taquicardia, dolor pleurítico y pérdida de peso19,27,32,33. La PCP es la principal causa de neumotórax en pacientes con sida34. La auscultación pulmonar es variable, puede ser normal en el 54–70% de los pacientes24, y el hallazgo patológico más común es la presencia de crépitos basales bilaterales19,24.
En la radiografía de tórax se aprecia desde un patrón de infiltrado retículo-intersticial bilateral simétrico en el 68% de los casos, hasta infiltrados intersticiales focalizados, consolidación segmentaria y patrón quístico o en “panal de abejas”19,32,35. En el 39% de los pacientes, la radiografía del tórax es normal33.
El recuento de leucocitos es generalmente normal, la lactato deshidrogenasa (LDH) suele estar aumentada, hallazgo desafortunadamente inespecífico, ya que es un marcador del daño del parénquima pulmonar producido por múltiples patologías24,36. Los gases arteriales suelen mostrar hipoxemia (presión arterial de oxígeno [PaO2] < 70mmHg), y la gran mayoría de los pacientes tienen recuentos de LTCD4 < 200 céll/μL, con un promedio de 36 céll/μL5,27.
Entre los factores de mal pronóstico se encuentran: edad avanzada, hipoxemia al ingreso, LDH alta, hemoglobina y albúmina bajas, presencia de comorbilidades, episodios previos de PCP, presencia de infección por citome-galovirus, bacterias o neutrofilia en el LBA y requerimiento de ventilación mecánica37,38. Al principio de la epidemia del sida, la mortalidad reportada a PCP era mayor del 80%27; ahora se encuentra entre el 10 y el 20%39–41; pero en aquellos casos graves que requieren UCI, la mortalidad es del 50%36,42.
Para su diagnóstico, la muestra espontánea de esputo tiene baja sensibilidad (< 50%) y esta depende grandemente de la experiencia del laboratorista o patólogo, por lo cual no debe ser sometida al laboratorio para el diagnóstico de PCP. La muestra ideal es el LBA tomado por fibrobroncoscopia, con una sensibilidad del 90-99%, y biopsia transbronquial o biopsia pulmonar abierta con 95–100% de sensibilidad, métodos que no están disponibles en todos los niveles de salud32,36. Las tinciones Giemsa, Diff-Quick y Wright detectan tanto quistes como trofo-zoitos, pero no tiñen la pared del quiste, que sí lo hacen tinciones como Gomori plata metenamina, cristal violeta y azul de toluidina, y algunos laboratorios prefieren la inmu-nofluorescencia directa. Otras formas de recolección de la muestra son el esputo inducido, el lavado orofaríngeo y el enjuague oral43–45, ejemplar que se contamina frecuentemente, y cuya sensibilidad y especificidad dependerá de la experiencia de quien lo realiza, pudiendo llegar al 58 y 83%, respectivamente10,46. Otras pruebas menos utilizadas son la medición de niveles plasmáticos de S-Adenosilmetio-nina, que se encuentra disminuida en casos de PCP activa, y la medición sérica del (3-D-glucano, afectada en su sensibilidad por la presencia de este antígeno en otras infecciones fúngicas47,48. Nuevas técnicas de diagnóstico en la búsqueda de ácidos nucleicos se vienen desarrollando, y se perfilan como importantes para apoyar el diagnóstico con sensibilidad cercana al 100%, pero con menor especificidad que las pruebas colorimétricas o inmunológicas, pero las cuales pueden ser combinadas con la evaluación de muestras obtenidas por métodos no invasivos como esputo inducido y enjuague bucal4,40.
En la actualidad, el TMP-SMX, 15mg/kg de TMP, es el tratamiento de escogencia (Evidencia AI) durante 21 días8,27,31, presentando una respuesta favorable en 60–90%. Otras opciones de tratamiento son: clindamicina con prima-quina (Evidencia BI), usada en pacientes alérgicos a sulfas, dapsona con TMP (Evidencia BI), atovaquona (Evidencia BI), pentamidina intravenosa (Evidencia AI)49. En casos graves (PaO2 < 70mmHg o diferencia (A-a) de O2 > 35mmHg), se recomienda el uso de corticosteroides para disminuir la inflamación pulmonar, principalmente cuando su inicio se produce durante las primeras 72h del diagnóstico y tratamiento antifúngico, y debe continuarse por 21 días con un esquema de disminución progresiva (Evidencia AI)27.
Debido a la ausencia de información acerca de la PCP en nuestro medio, se decidió realizar este estudio con el objetivo de obtener una descripción local de la incidencia, las características demográficas, la presentación clínica, los hallazgos de laboratorio y la mortalidad de la PCP en Medellín, y de esta forma, poder comparar con el comportamiento de la enfermedad en otros lugares.
Materiales y métodosSe realizó un estudio observacional, descriptivo, transversal, retrospectivo, en el que se tomaron 218 historias clínicas, que pertenecían a todos los pacientes hospitalizados en el Hospital La María de Medellín, Colombia, desde enero de 2008 hasta diciembre de 2009, con diagnóstico confirmado de infección por VIH por medio de Western Blot. En estos pacientes, se estableció el diagnóstico de PCP mediante la observación microscópica del microorganismo en una muestra de LBA obtenida por fibrobroncoscopia teñida con plata metenamina.
El estudio fue aprobado por el Comité de Investigación de la Universidad CES y el Comité Científico del Hospital La María de Medellín. Se tomó la información de cada paciente de fuente secundaria, donde se incluyeron las siguientes variables: edad, género, conocimiento de infección por VIH, comorbilidades, duración del cuadro clínico, tos, expectoración, dolor pleurítico, disnea, fiebre (≥ 38°C), taquicardia (≥ 100latidos por minuto), taquipnea (≥ 20respiraciones por minuto), auscultación pulmonar, ingreso a UCI, historia de PCP previo, comorbilidades, hallazgos en rayos X de tórax, uso de terapia HAART, uso de profilaxis para PCP, hemoleuco-grama, gases arteriales, LDH, carga viral, recuento de LTCD4, tratamiento, presencia de neumotórax y mortalidad.
Análisis estadísticoEl análisis de la información se realizó en 2 fases: la primera consistió en un análisis univariado donde las variables cuantitativas se describieron al usar medidas de tendencia central (media aritmética), posición (mediana) y de dispersión (desviación estándar y rango intercuartil); para las variables cualitativas, se calcularon frecuencias y porcentajes, y la representación de la información se hizo a través de tablas y figuras.
La segunda fase consistió en explorar factores asociados al estado de egreso de los pacientes con variables como ingreso a UCI, antecedente de PCP, tratamiento con esteroides; para este análisis, se utilizó la prueba exacta de Fisher, dado que se encontraron valores esperados inferiores a 5; adicionalmente, se relacionó el estado de egreso con LDH, PaO2, hemoglobina, para lo cual se utilizó la prueba t de Student previa comprobación del comportamiento normal de estas variables con la Prueba Shapiro-Wilk. El nivel de significación estadística se estableció en 5%. La tabulación de la información se realizó en una hoja de cálculo de Microsoft Excel, y el análisis estadístico se realizó con el programa Stata 10.0 de licencia de la Universidad CES.
ResultadosVariables demográficasEl estudio incluyó 218 historias de pacientes infectados con VIH, hospitalizados. Tuvieron diagnóstico de PCP 26 pacientes, con una incidencia de 11,9%; de estos, el 61,5% (16) de los pacientes fueron hombres y el 48,5% fueron mujeres (10). El promedio de edad al momento del diagnóstico fue 33,19 años (21–49), fue la enfermedad definitoria de sida en 5 pacientes (19,2%), 5 pacientes presentaron 2 episodios de PCP (18,7%) y 4 pacientes (15,4%) desconocían su estado de portadores de VIH (tabla 1). El 92,3% no tenían profilaxis para PCP, y el 76,9% no recibían HAART.
Aspectos demográficos.
| Incidencia | 11,9% (26 de 218 pacientes) |
| Edad promedio | 33 años (21–49) |
| Género | Masculino 61,50% |
| Femenino 38,50% | |
| PCP definitoria de sida | 19,20% |
| Sin profilaxis para PCP | 92,30% |
| Sin terapia HAART | 76,90% |
| Promedio de LTCD4 | 60 células/μL |
HAART: terapia antirretroviral altamente efectiva; LTCD4: linfocitos T CD4; PCP: neumonía por Pneumocystis; sida: síndrome de inmunodeficiencia adquirida.
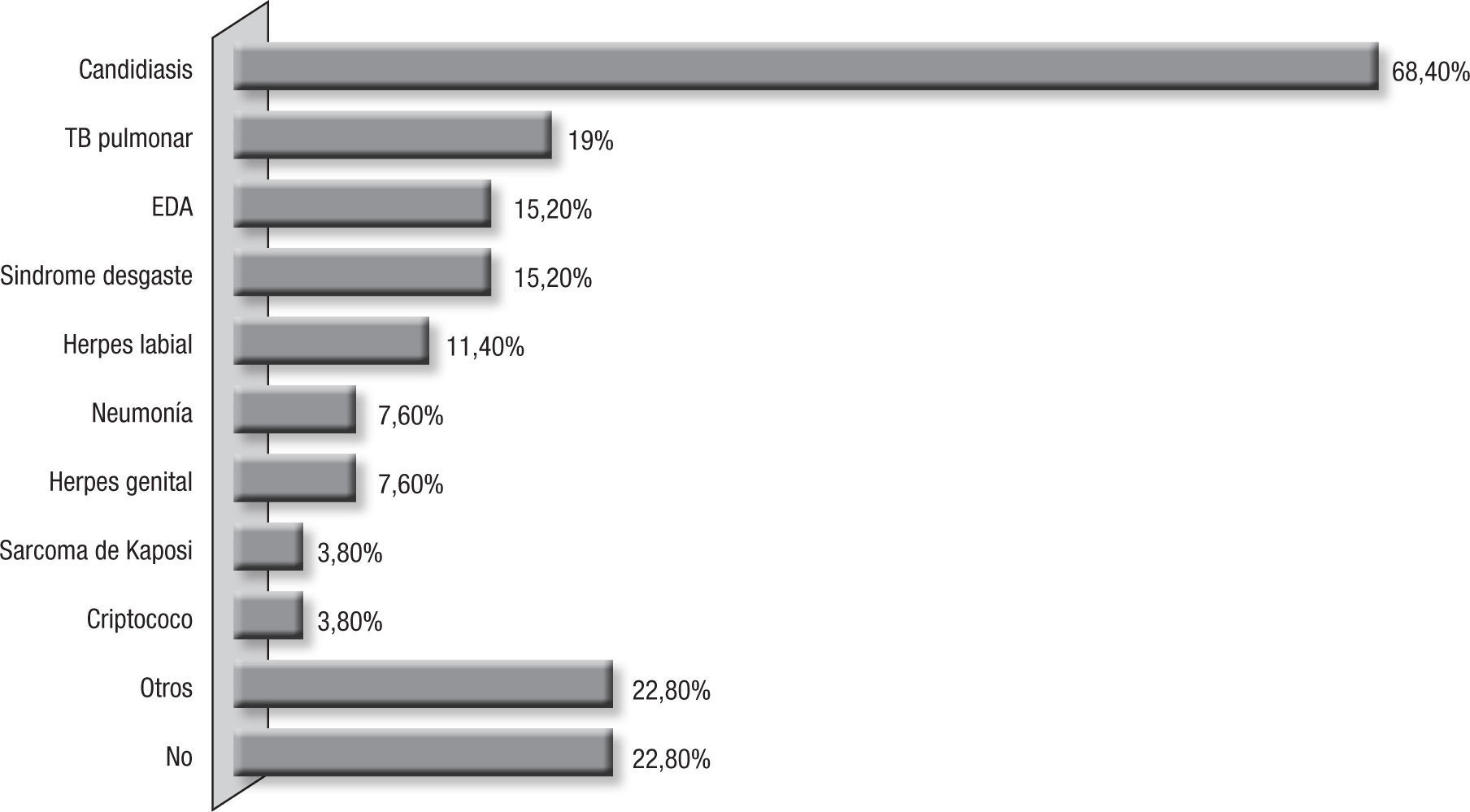
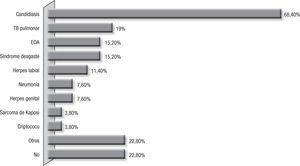
La candidiasis orofaríngea fue la comorbilidad más común y se presentó en 18 pacientes (69,2%); TB pulmonar asociada en 19,2%, y 15,2%, enfermedad diarreica aguda y síndrome de desgaste (fig. 1).
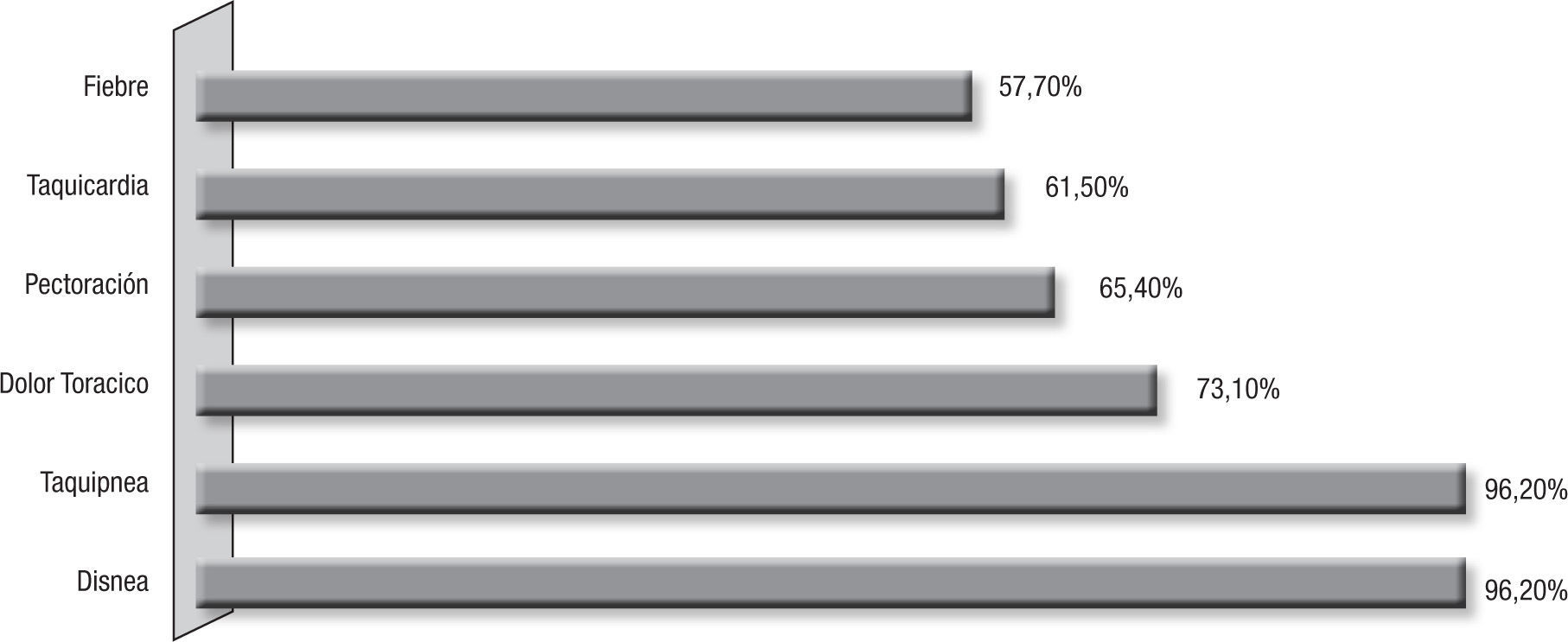
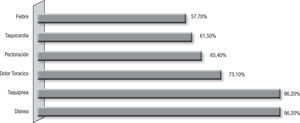
Presentación clínicaLa duración de los síntomas fue correspondiente a un cuadro agudo, menor de 2 semanas, en el 47,82% de los pacientes, encontrándose entre estos un 13% con una semana de duración; y en el resto de los pacientes, los síntomas se presentaron en forma subaguda y crónica con un período de 3 a 7 semanas de evolución de los síntomas. Los pacientes presentaron temperatura mayor de 38° C en 57,7%, taquicardia en el 61,5% y tos, disnea y taquipnea en el 96,2% de los casos, acompañado de dolor torácico en el 73,1% y tos seca en el 36% (fig. 2). La auscultación pulmonar fue muy variable, el hallazgo más común fue la disminución del murmullo vesicular con crépitos (30,8%), crépitos (19,2%), roncus (11,5%), y fue normal en el 7,7%.
LaboratorioLa hemoglobina promedio fue de 11,75mg/dl, los gases arteriales mostraron una PaO2 promedio de 64,3mmHg, y el 49,5% presentó hipoxemia (PaO2 < 70mmHg). Al comparar la mortalidad de los pacientes incluidos en el estudio según los valores de PO2, se encontraron diferencias, puesto que el promedio en los pacientes que egresaron vivos fue de 65,09mmHg (DE 16,02), y en los pacientes que fallecieron fue de 59,57mmHg (DE 27,58); pero estas diferencias no fueron significativas (t=0,511; valor p=0,615).
El promedio de linfocitos LTCD4 fue de 60células/μL (2–239), con valores menores de 50 células en el 47,3%, y con carga viral promedio de 709.147copias/ml (377–3.778). La reacción en cadena de la polimerasa promedio fue de 3,7 (0,5–16,6) y LDH de 1.233 Al comparar la mortalidad de los pacientes incluidos en el estudio según los valores de LDH, se encontraron diferencias, puesto que el promedio en los pacientes que egresaron vivos fue de 1.097,63mg/dl (DE 592,47mg/dl), y en los pacientes que fallecieron fue de 2.528,0mg/dl (DE 1.875,25mg/dl); pero estas diferencias no fueron significativas (t=-1,073; valor p=0,475).
ImágenesSe le realizó rayos X de tórax a 25 pacientes, y se encontraron los siguientes hallazgos: infiltrados intersticiales en el 48% (12), infiltrados alveolares en el 20% (5), normal en el 8% (2), granuloma calcificado perihiliar en el 8% (2), infiltrados mixtos en el 8% (2), infiltrado alveolar con derrame pleural en el 4% (1) y lesiones fibrosas residuales en el 4% (1).
TratamientoEl 77% de los pacientes recibió TMP-SMX (Evidencia IA) vía venosa y oral por 21 días, y en el 46,2% de los pacientes se administró terapia conjunta con esteroides.
Tres pacientes fallecieron, lo que equivale a una mortalidad de 11,5%. Del total de los pacientes, 6 ingresaron a UCI (23.07%), de los cuales falleció el 50% (3 pacientes) (tabla 2). En cuanto a la relación entre el estado de egreso del paciente y el ingreso a UCI, se encontró que el total de pacientes que fallecieron habían ingresado a UCI (100,0%), mientras que de los pacientes que egresaron vivos solo el 13,0% habían ingresado a UCI; por lo tanto, se encontró asociación estadísticamente significativa entre la mortalidad y el ingreso a UCI en estos pacientes (valor Fisher p=0,008) (tabla 2).
DiscusiónLa PCP continúa presentándose como una enfermedad oportunista común en los pacientes infectados con VIH, especialmente en aquellos con enfermedad avanzada, aunque su incidencia es variable en los diferentes informes. La incidencia hallada en el estudio fue de 11,9%, lo cual está acorde con los datos reportados en otros países en vías de desarrollo9,22,37,50,51.
Se cree que la incidencia podría ser mayor, ya que esta puede alterarse debido a las limitaciones locales en la realización de la fibrobroncoscopia, ya que en algunos pacientes esta se realiza varios días después de iniciada la terapia con TMP-SMX, y así la sensibilidad del método diagnóstico puede variar; es así como al incluir en la muestra tanto los pacientes con diagnóstico confirmado como los que tienen diagnóstico clínico probable de PCP, la incidencia aumenta a 22,4%; lo cual demuestra la importancia de la sospecha clínica para llegar a la confirmación del diagnóstico.
En un poco más de la mitad de los pacientes (52,18%) la infección se presentó con un cuadro clínico subagudo o crónico caracterizado por fiebre, tos seca, dolor torácico, disnea y taquipnea con hallazgos a la auscultación pulmonar consistentes en disminución del murmullo vesicular y/o crépitos en el 80% y el hallazgo característico de infiltrados intersticiales bilaterales en la mitad de ellos, aspectos que por su baja especificidad ayudan poco para establecer el diagnóstico si la entidad no es incluida en la sospecha diagnóstica inicial.
Solo el 3,8% de los pacientes recibían profilaxis con TMP-SMX, y el 19,2% estaban bajo esquema de terapia HAART; estos 2 factores, muy posiblemente relacionados con la presencia de PCP. Se debe considerar que el 15,4% de los pacientes desconocían el estado de portadores del VIH, por lo cual no recibían profilaxis ni terapia HAART, y en el 19,2% fue la enfermedad defini-toria de sida, cifra más baja que la reportada en países desarrollados6,16,26,33,36,52. Esto podría obedecer a que en los países en desarrollo, la TB continúa presentándose como la primera entidad definitoria de sida7,11, aspecto que vemos reflejado en la presencia de TB en 19,2% de los pacientes en este grupo estudiado, dificultando enormemente el diagnóstico por la superposición de sintomatología respiratoria y constitucional. Y tal como ha sido informado en la literatura, una frecuente asociación de PCP con candidiasis orofaríngea, 68,4%, reflejando esta comorbilidad el estado avanzado de compromiso inmu-nológico, el cual se puede evidenciar por la presencia de LTCD4 < 50 células en el 47,3% de los pacientes. Este promedio de células TCD4 se asemeja a los reportados en la literatura1,5. Es de resaltar que uno de los pacientes del estudio presentó la enfermedad teniendo un recuento de 239 LTCD4/μL,aspecto anotado en la literatura, en la cual se reporta que del 10 al 15% de los casos de PCP ocurren en pacientes con recuentos mayores de 200 LTCD4/μL46.Este hallazgo podría explicarse por el porcentaje de los LTCD4 comparados con el número absoluto de LT, ya que se ha informado que cuando este valor es menor del 14%, independientemente del valor absoluto, se asocia con mayor riesgo de presentar enfermedades oportunistas y entre ellas PCP27,46.
De los exámenes de laboratorio realizados, la alteración más notoria se presentó en los niveles de LDH, ya que 16 de los 21 pacientes (76,19%) a los que se les realizó esta medición presentaron un valor elevado. La asociación buscada entre el valor de LDH y el desenlace del paciente mostró un valor de LDH 2,3 veces más alto en aquellos pacientes que fallecieron frente a aquellos que sobrevivieron, alteración que a pesar de no demostrar significancia estadística, debe tenerla el clínico como forma indirecta de evaluar el compromiso pulmonar que puede poner en riesgo la vida del paciente.
La mitad de los pacientes presentaron hipoxemia, lo cual ha sido informado como factor de mal pronóstico asociado a severo compromiso pulmonar38. En el presente estudio, la hipoxemia no constituyó estadísticamente un factor asociado con mortalidad (p=0,615), debido posiblemente al número de pacientes analizados; aun así, la diferencia numérica (5,52mmHg) constituye un aspecto que el clínico debe tener en cuenta en la evaluación del paciente y el cual es definitivo en el momento de evaluar el requerimiento de terapia esteroidea asociada.
Cinco pacientes (18,7%) presentaron recaída de PCP, 2 de los cuales fallecieron en el episodio registrado, lo cual ha sido informado por otros autores, donde el antecedente de PCP previo constituye un factor de mal pronóstico38; y en este grupo, el antecedente de PCP estuvo presente en el 66,7% de los pacientes que fallecieron, y solo en el 8,7% de aquellos que egresaron vivos, a pesar de no encontrarse significancia estadística (p=0,052).
La mortalidad global fue del 11,5%, que es similar a lo reportado en otros estudios en donde se muestran cifras entre el 10 y el 20%40,50,53. Entre los factores analizados que influyeron sobre esta, el ingreso a UCI presentó una asociación estadísticamente significativa (p=0,008) con mortalidad del 50% de los pacientes, lo que está acorde con la literatura38.
Algunas variables del proyecto se pueden ver afectadas negativamente, debido a que por ser un estudio retrospectivo en algunos casos no se tuvo acceso a la totalidad de los datos analizados.
ConclusionesA pesar de la reducción en su incidencia, la PCP continúa siendo una enfermedad oportunista frecuente y de gran importancia clínica.
En los países en vías de desarrollo como Colombia, los pacientes con VIH siguen siendo una población con alto riesgo de sufrir PCP, en especial aquellos que desconocen su estado de infección por el VIH, ya que no reciben tratamiento antirretroviral ni profilaxis para infecciones oportunistas. Su cuadro clínico es inespecífico y compartido con otras enfermedades oportunistas respiratorias, lo cual puede demorar el diagnóstico y afectar al pronóstico del paciente.
Por medio de este artículo, se pretende mostrar e informar a la comunidad científica que, si bien la TB representa una enfermedad frecuente y de gran importancia localmente, la infección por P. jirovecii posee una alta incidencia y mortalidad, en especial en pacientes con diagnóstico tardío de infección por VIH y con grandes dificultades para realizar una terapia y profilaxis continua y vigilada, por lo cual se hace necesario tenerla en cuenta en el diagnóstico diferencial en pacientes con infección por VIH que consultan por síntomas respiratorios de evolución aguda, subaguda o crónica.
Desafortunadamente, el presente trabajo adolece de falencias originadas en la dificultad para obtener toda la información en los estudios que se conducen en forma retrospectiva, pero tiene la fortaleza de ser un grupo de pacientes atendidos en un hospital público de tercer nivel, que atiende a población vulnerable del departamento de Antioquia.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses de ningún tipo en el trabajo realizado.
Los investigadores agradecen a la Universidad CES, por el apoyo brindado durante la realización del proyecto de investigación; al Hospital La María, por la disposición para ayudarnos en la recolección de los datos; a la Corporación para Investigaciones Biológicas, por abrirnos las puertas, y a la doctora Ángela Restrepo, por su apoyo y acompañamiento.