La baja especificidad de los signos y síntomas presentes en el paciente con infección por el virus de inmunodeficiencia humana y con HDP concomitante dificulta grandemente su diagnóstico. La elección de la terapia antimicótica de inducción se basa en la valoración clínica de la gravedad del paciente, que lleva a la decisión del tratamiento inicial que afecta directamente a la mortalidad. Es muy importante, por consiguiente, identificar variables clínicas y de laboratorio que ayuden a evaluar el grado de afectación en el paciente con HDP y sida para, de esta manera, elegir rápida y adecuadamente la terapia de inducción. Se efectuó una búsqueda bibliográfica en PubMed y LILACS utilizando como palabras clave: histoplasmosis, prognosis, pronóstico y prognostic. Se seleccionaron artículos entre 1995 y 2011 con énfasis en estudios analíticos. Se identificaron variables clínicas y de laboratorio que predijeran de forma independiente el riesgo de mortalidad en pacientes con histoplasmosis y sida, tales como: disnea, falla renal aguda, insuficiencia respiratoria. En el laboratorio, se identificaron: concentración de hemoglobina < 8g/dL, recuento de plaquetas < 100.000/mm3, aspartato aminotransferasa 2,5 veces > la concentración normal, creatinina > 2,1mg/dL, albúmina < 3,5g/dL, lactato deshidrogenasa aumentada al doble de lo normal. Como factor protector al desarrollo de complicaciones, se identificó el uso previo de terapia antirretroviral. El reconocimiento de estas variables pudiera ser de gran utilidad para definir qué pacientes requerirían estrategias de tratamiento inicial y cuidado más agresivas.
Currently, clinical suspicion of histoplasmosis in AIDS patients is based on the evaluation of signs and symptoms presented by the patient, and on the use of nonspecific laboratory tests. The low specificity of the signs and symptoms seriously hinders their diagnosis. The choice of the initial antimycotic therapy is based on the clinical evaluation of the patients condition and this decision will directly affect mortality. It is therefore important to identify clinical and laboratory variables that could help to evaluate the degree of patient's involvement and in this way make a prompt and adequate choice of the induction therapy. We conducted a litera-ture search via PUBMED and LILACS using the key words histoplasmosis, prognosis, pronóstico and prognostic. We selected articles published between 1995 and 2011, making emphasis on analytical studies. We identified clinical and laboratory variables that independently predict the risk of mortality in AIDS patients with histoplasmosis including dyspnea, acute renal failure and respiratory insuficiency. As far as laboratory values, we identified the following variables: hemoglobin concentration less than 8g/dl, plaque count less than 100.000per mm3, aspar-tate aminotrasferase (AST) 2.5 times the normal concentration, creatinine above 2.1mg/dl, albumin below 3.5g/dl, lactate dehydrogenase (LDH) elevated to more than twice the normal value. As a protective factor at the onset of complications, we identified the previous use of antirretroviral therapy. The identification of these variables could be of much use for defining which patients would need more aggressive initial treatment and special care.
La histoplasmosis es causada por el hongo dimórfico Histoplasma capsulatum (H. capsulatum); esta enfermedad se ha reportado en todo el mundo, pero es más frecuente en países del continente americano y en algunas regiones de Asia y África1,2. Con el término histoplasmosis diseminada progresiva (HDP) se designa a una de las formas de presentación clínica de esta entidad, caracterizada por la incapacidad del sistema inmune del hospedero para controlar el progreso de las lesiones producidas por el hongo, luego de su ingreso por vía respiratoria3–6. Uno de los problemas más importantes con esta micosis es que puede manifestarse como reactivación de la infección primaria, producto del contacto previo con el agente etiológico o como infección reciente. Desde 1987, se ha observado que más del 90% de los casos reportados de HDP ocurren en pacientes con virus de la inmunodeficiencia humana (VIH)/síndrome de inmunodeficiencia adquirida (sida), lo cual llevó al Centers for Disease Control and Prevention a reconocer esta enfermedad como marcadora de sida1,7. A pesar del gran desarrollo en el tratamiento de la infección por el VIH, aún son comunes los informes donde se reportan altas tasas de incidencia y mortalidad en este grupo de pacientes, aspectos atribuidos a este agente infeccioso8–13. Por ello, se considera la histoplasmosis como un problema importante de salud pública, sobre todo en países en desarrollo de Centroamérica y Suramérica, ya que la población frecuentemente afectada es aquella con acceso limitado a servicios de salud públicos o privados, y con limitaciones importantes para acceder a los métodos de laboratorio necesarios para el diagnóstico de esta micosis1.
Agente etiológico y ecologíaEl primer reporte publicado de histoplasmosis lo hizo en 1906 el médico estadounidense Samuel T. Darling. Este primer caso, identificado en la zona del canal de Panamá, se caracterizó por ser la forma diseminada de una enfermedad con desenlace fatal, erróneamente diagnosticada en su momento como una leishmaniasis14. Posterior a este primer reporte, pasaron varias décadas para probar que la enfermedad era causada por el hongo dimórfico H. capsulatum. Este microorganismo ha sido aislado en suelos, principalmente en aquellos contaminados con guano de murciélago y excretas de aves. Varios estudios han demostrado que H. capsulatum no crece en suelos con pH < 5 o > 10, y en ambientes con temperaturas superiores a 40°C15–18. Actualmente, por medio del uso de técnicas moleculares se conoce que el agente causal se clasifica filogenéticamente en 8 clados distribuidos de la siguiente manera: Norteamérica clases 1 y 2 (clados I y II), Latinoamérica grupos A y B (clados III y IV), clado australiano (clado V), clado Países Bajos (¿Indonesia?) (clado VI), clado euroasiático (clado VII) y clado africano (clado VIII)19.
EpidemiologíaSe han informado casos de histoplasmosis en todo el mundo, si bien esta enfermedad ocurre con mayor frecuencia en las Américas, desde los Estados Unidos hasta la República Argentina, en donde se han identificado regiones endémicas1,2. Se han reportado brotes epidémicos de la enfermedad, pero la mejor caracterización de estos se ha hecho en Norteamérica, principalmente en los valles de los ríos Ohio y Misisipi, brotes que han estado asociados sobre todo a proyectos de construcción y actividades de demolición de edificios viejos2,18. Entre las actividades de riesgo para desarrollar histoplasmosis se cuentan tareas de limpieza de corrales para crianza de aves, áticos y graneros, exploración de cavernas y actividades de remoción de suelos y limpieza de puentes2. En los Estados Unidos, la histoplasmosis es la primera manifestación de sida en el 50 al 75% de los pacientes que residen en regiones endémicas. En este mismo país, se han reportado tasas de incidencia de histoplasmosis entre el 2 al 5% de los pacientes con sida, pero en zonas altamente endémicas (Indianápo-lis, Kansas, Memphis y Nashville) esta incidencia puede ser bastante elevada, llegándose al 27% en esta población6. En Colombia, en 1976, Carmona20 observó un promedio de reactividad a la histoplasmina del 22% en 5 importantes regiones del país, lo cual, en su época, lo llevó a calcular un valor aproximado de seis millones de personas infectadas, cálculo realizado en su momento sobre una población de 30 millones de habitantes20. Recientemente, en 2011, Arango et al. publicaron en nombre del Grupo Colombiano para el Estudio de la Histoplasmosis, coordinado por el Grupo de Microbiología del Instituto Nacional de Salud y la Corporación para Investigaciones Biológicas, los resultados de una encuesta nacional. En este trabajo, se reportaron 434 casos de histoplasmosis diagnosticados entre 1992 a 2008, donde el 70% de los casos correspondieron a pacientes con VIH/sida. En este artículo, el 87% de los reportes provienen de los 3 principales departamentos del país (Antioquia, Valle y Cundinamarca)21. Datos preliminares de una programa de apoyo al diagnóstico de la histoplasmosis, coordinado por la Unidad de Micología Médica y Experimental de la Corporación para Investigaciones Biológicas, en el cual se analizaron muestras biológicas de 293 pacientes con sospecha clínica de histoplasmosis, reportó una incidencia del 16%. Del total de estos pacientes con histoplasmosis, el 82% de ellos tenían coinfección por el VIH22.
Patogénesis y manifestaciones clínicasLa infección es adquirida cuando el hospedero entra en contacto con las partículas infectantes del hongo (micro-conidias, restos miceliares), las cuales se encuentran en el ambiente y son vehiculizadas como aerosoles resultantes de la incursión del hombre en el medio ambiente del microorganismo, ya sea por actividades laborales o recreativas17,18. Una vez hecho el contacto con el hongo, se da inicio en el hospedero a una infección pulmonar primaria, durante la cual el hongo se disemina desde el pulmón y por vía hemática a otros órganos ricos en células fagocíticas mono nucleares, razón por la cual todas las infecciones primarias pueden ser consideradas diseminadas. En el 95% de los hospederos con integridad de su sistema inmune, la infección se resuelve espontáneamente, y aunque la inmunidad celular suele controlar la infección primaria, el foco primario no queda completamente libre de levaduras, y algunas pueden permanecer viables por muchos años en un estado latente y con la capacidad de reactivarse posteriormente3,16.
Las manifestaciones clínicas de la histoplasmosis dependerán de diversos factores como son la cantidad de microorganismos inhalados con el inóculo, la integridad del órgano primario (pulmón) y las alteraciones estructurales o inmunológicas presentes en el paciente en el momento de la infección. En 1981, Goodwin et al. propusieron una clasificación para esta enfermedad con el fin de identificar signos y síntomas, establecer un diagnóstico y posterior tratamiento3,4. La clasificación propuesta y vigente se presenta en la figura 1.
Histoplasmosis diseminada progresivaEl término HDP se refiere al crecimiento incontrolable del microorganismo en múltiples órganos diferentes al pulmón resultante de la reactivación de un foco latente producto de contacto previo o por una nueva infección. Esta forma clínica es más frecuente en pacientes con edades ubicadas en los extremos de la vida, aquellos que reciben terapias inmunosupresoras (corticosteroides, antineoplásicos y antagonistas del factor de necrosis tumoral alfa), receptores de órganos sólidos, pero principalmente en individuos coinfectados con el VIH y cuyo recuento de linfocitos T CD4 sea inferior a 150 células por μl4,16
La HDP puede manifestarse bajo 3 formas de presentación clínica, como sigue:
Histoplasmosis diseminada progresiva agudaCuadro clínico de menos de 15 días de evolución, caracterizado por choque séptico. Inicialmente, fue reportado en niños debido a la inmadurez de la respuesta inmune de tipo celular, pero en la actualidad es más frecuente en pacientes con sida. Se caracteriza por presentar un síndrome febril de inicio abrupto y malestar general, seguido por pérdida de peso, tos y diarrea; este suele acompañarse de hepatoesplenomegalia, linfoadenopatías, anormalidades pulmonares auscultatorias como crépitos, ictericia y alteraciones hematológicas, tales como anemia en el 90% y trombocitopenia y leucopenia en el 80% de los pacientes, que ocasionalmente pueden resultar en coagulopatía. En este grupo de pacientes, se observan con frecuencia lesiones en piel23, principalmente en pacientes residentes en Suramérica. La mortalidad de los pacientes con esta forma clínica puede llegar a ser del 100% sin tratamiento, y con tratamiento, la sobrevida puede llegar al 80%3,4.
Histoplasmosis diseminada progresiva subagudaSe caracteriza por la evolución más prolongada de los síntomas, 1 a 3 meses, con la presencia de úlceras en orofaringe y genitales. Las alteraciones hematológicas son menos frecuentes y severas que en la forma aguda, la anemia se presenta en el 40%, hay leucopenia y trombocitopenia en el 20% de los pacientes. Una característica de este estadio clínico es la presencia de úlceras en el tracto gastrointestinal, principalmente en colon y región ileocecal, compromiso que ha sido reportado hasta en el 70% de autopsias de pacientes con VIH que fallecieron por HDP. El compromiso neurológico puede presentarse ocasionalmente. El síndrome de Addison es poco habitual (menos del 10%), pero, análisis histopatológicos post mórtem de glándulas suprarrenales reportan la presencia de blastoconidas de H. capsulatum hasta en el 70% de los pacientes analizados, dato que se correlaciona con ligero un aumento en el tamaño de la glándulas adrenales al utilizar tomografía axial computarizada3,4.
Histoplasmosis diseminada progresiva crónicaGeneralmente, la si nto mato logía es más leve y prolongada, entre 3 y 6 meses. La adimania y la letargia son los síntomas más frecuentes, acompañados de fiebre y en menor frecuencia por úlceras en mucosas y labios. Un tercio de estos pacientes presenta hepatoesplenomegalia con hepatitis granulomatosa. Es poco frecuente el compromiso hemato-lógico y de otros órganos (sistema nervioso central, corazón y gandulas adrenales). Los pacientes con esta forma clínica son de difícil diagnóstico, y pueden progresar a la muerte si no se instaura oportunamente un tratamiento3.
Diagnóstico por el laboratorio de la Histoplasmosis diseminada progresivaEl diagnóstico por el laboratorio de la HDP se realiza por medio de diversas técnicas, entre las que se pueden incluir: la observación directa del agente etiológico al utilizar coloraciones especiales, el cultivo del hongo en medios especiales, la detección de anticuerpos específicos, la detección de antígenos específicos y, más recientemente, pruebas moleculares que detectan el ácido desoxi-rribonucleico del microorganismo.
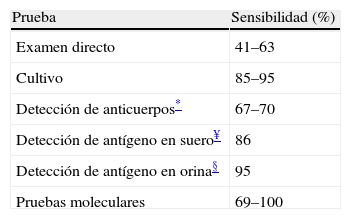
En el caso de los pacientes con HDP y coinfección por el VIH, los valores de sensibilidad de estos métodos pueden variar, y se hace necesario elegir y combinar de la mejor forma estas herramientas diagnósticas24,25. Los valores de sensibilidad de los métodos de laboratorio disponibles para el diagnóstico de la HDP en pacientes VIH positivos se resumen en la tabla 1.
Sensibilidad de los métodos diagnósticos en pacientes con histoplasmosis diseminada progresiva y coinfección por virus de la inmunodeficiencia humana
| Prueba | Sensibilidad (%) |
| Examen directo | 41–63 |
| Cultivo | 85–95 |
| Detección de anticuerpos* | 67–70 |
| Detección de antígeno en suero¥ | 86 |
| Detección de antígeno en orina§ | 95 |
| Pruebas moleculares | 69–100 |
Fuentes: Wheat et al. TRENDS in Microbiology. 2003;11:488-94. Muñoz et al. Infectio. 2010;14:S145-58.
Las guías prácticas para el manejo del paciente con histoplasmosis, publicadas en el año 200726, recomiendan las siguientes medidas para el manejo del paciente con HDP:
- 1)
Clasificar el estado del paciente mediante la evaluación clínica y el análisis de marcadores bioquímicos. Los estados de clasificación pueden ser: a) severa; b) severa-moderada, moderada, y c) leve26.
- 2)
Suministrar el esquema de tratamiento de acuerdo con la clasificación de la siguiente manera:
- •
Formas severa o severa-moderada: iniciar con anfotericina B deoxicolato, 0,75-1mg/kg/día por 1 o 2 semanas o hasta mejoría clínica y, con posterioridad, cambiar a itraconazol, 200mg 3 veces al día por 3 días (dosis de carga) y, después, 200mg 2 veces al día por un tiempo mínimo de 12 meses (nivel de evidencia AI)26. A pesar del esquema de tratamiento anterior, en este grupo de pacientes se presentan recaídas de la enfermedad en el 15% de los pacientes, razón por la cual es necesario mantener al paciente en terapia con itraconazol 200mg/día hasta mejoría de la situación inmune del paciente.
- •
Formas moderada o leve: iniciar itraconazol, 200mg 3 veces al día por 3 días y, posteriormente, cambiar a 200mg 2 veces al día por un tiempo mínimo de 12 meses (nivel de evidencia AI I)26.
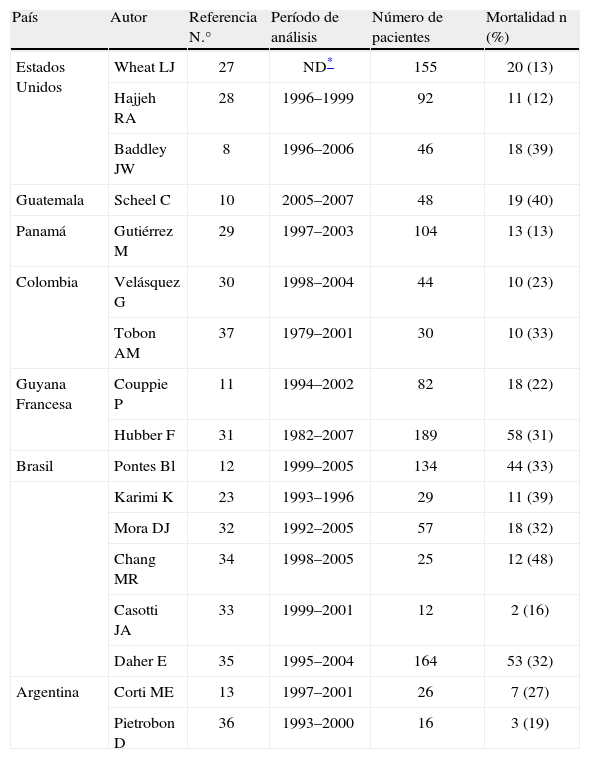
A pesar del desarrollo de la terapia antirretroviral altamente efectiva, aún se reportan altas tasas de incidencia y mortalidad debidas a la histoplasmosis en pacientes coinfectados con el VIH. Diferentes estudios realizados en países del continente americano en cohortes de pacientes con sida e histoplasmosis han reportado tasas de mortalidad variables, entre el 12 y el 48%8,10–13,23,27–36, valores que se presentan en la tabla 2. Las tasas de mortalidad más altas son reportadas en países en vías de desarrollo o en regiones con dificultad para acceder a servicios médicos. Diferentes trabajos de investigación han demostrado el papel protector del uso previo de la terapia terapia antirretroviral altamente efectiva en la reducción de la mortalidad en este grupo de pacientes8,13,30,37.
Mortalidad asociada a histoplasmosis en pacientes con sida, en países del continente americano
| País | Autor | Referencia N.° | Período de análisis | Número de pacientes | Mortalidad n (%) |
| Estados Unidos | Wheat LJ | 27 | ND* | 155 | 20 (13) |
| Hajjeh RA | 28 | 1996–1999 | 92 | 11 (12) | |
| Baddley JW | 8 | 1996–2006 | 46 | 18 (39) | |
| Guatemala | Scheel C | 10 | 2005–2007 | 48 | 19 (40) |
| Panamá | Gutiérrez M | 29 | 1997–2003 | 104 | 13 (13) |
| Colombia | Velásquez G | 30 | 1998–2004 | 44 | 10 (23) |
| Tobon AM | 37 | 1979–2001 | 30 | 10 (33) | |
| Guyana Francesa | Couppie P | 11 | 1994–2002 | 82 | 18 (22) |
| Hubber F | 31 | 1982–2007 | 189 | 58 (31) | |
| Brasil | Pontes Bl | 12 | 1999–2005 | 134 | 44 (33) |
| Karimi K | 23 | 1993–1996 | 29 | 11 (39) | |
| Mora DJ | 32 | 1992–2005 | 57 | 18 (32) | |
| Chang MR | 34 | 1998–2005 | 25 | 12 (48) | |
| Casotti JA | 33 | 1999–2001 | 12 | 2 (16) | |
| Daher E | 35 | 1995–2004 | 164 | 53 (32) | |
| Argentina | Corti ME | 13 | 1997–2001 | 26 | 7 (27) |
| Pietrobon D | 36 | 1993–2000 | 16 | 3 (19) |
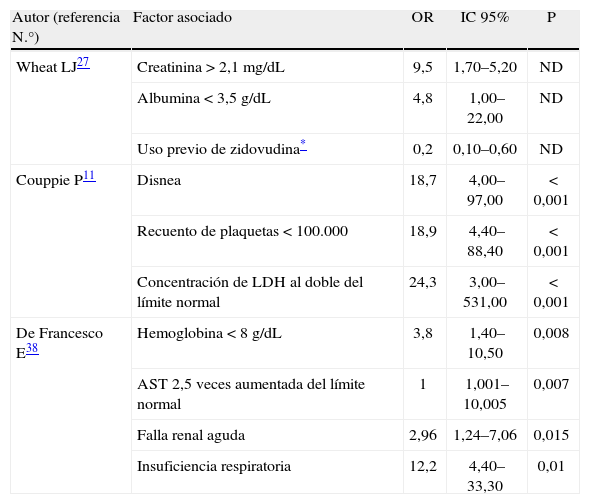
Durante la revisión bibliográfica se identificaron 3 publicaciones en revistas indexadas, en las cuales se reportaban variables clínicas y de laboratorio con capacidad de identificar el compromiso clínico y predecir el riesgo de muerte en pacientes con sida e histoplasmosis11,27,38. Estos 3 trabajos utilizaron métodos estadísticos multivariados, con el fin de identificar el riesgo individual para cada una de las variables analizadas, siendo este riesgo expresado como odds ratio (OR) con sus respectivos intervalos de confianza del 95% (IC 95%). El primero de estos estudios fue realizado en el año 2000 por Wheat et al.27, que identificaron en una cohorte de pacientes estadounidenses con sida 2 factores asociados a manifestaciones severas de HDP y 1 factor protector. Como factores asociados a mal pronóstico, se reportó la concentración de creatinina > 2,1mg/dl (OR=9,5; IC 95% 1,7–52) y la concentración de albúmina < 3,5g/dl (OR=4,8; IC 95% 1–22), mientras que el tratamiento previo con medicación antirretroviral (zidovudina) demostró disminuir el riesgo de desarrollo de enfermedad severa (OR=0,3; IC 95% 0,1–0,7)27.
En el segundo trabajo del año 2004, en la Guyana Francesa, Couppie et al.11 identificaron 3 variables asociadas a mal pronóstico en pacientes con sida que desarrollaron HDP. Estas variables fueron: presencia de disnea (OR=18,7; IC 95% 4–97), recuento de plaquetas < 100.000célu-las/mm3 (OR=18,9; IC 95% 4,4–88,4) y la concentración de la lactato deshidrogenasa elevada al doble del valor normal (OR=24,3; IC 95% 3-531)11.
Más recientemente, en Brasil, en el año 2006, De Francesco et al.38 analizaron una cohorte retrospectiva de 164 pacientes con sida e HDP e identificaron 4 variables con capacidad de predecir, de forma independiente, el riesgo de muerte. Estas variables fueron: concentración de hemoglobina < 8g/dl (OR=3,8; IC 95% 1,4–10,5), AST 2,5 veces aumentada del límite normal (OR=1; IC 95% 1,001–10,005), insuficiencia renal aguda (OR=2,96; IC 95% 1,24-7,06) y disnea (OR=12,2; IC 95% 4,4–33,3)38. La tabla 3 resume los hallazgos de estos 3 trabajos.
Factores asociados al mal pronóstico en pacientes con sida e histoplasmosis diseminada progresiva
| Autor (referencia N.°) | Factor asociado | OR | IC 95% | P |
| Wheat LJ27 | Creatinina > 2,1mg/dL | 9,5 | 1,70–5,20 | ND |
| Albumina < 3,5g/dL | 4,8 | 1,00–22,00 | ND | |
| Uso previo de zidovudina* | 0,2 | 0,10–0,60 | ND | |
| Couppie P11 | Disnea | 18,7 | 4,00–97,00 | < 0,001 |
| Recuento de plaquetas < 100.000 | 18,9 | 4,40–88,40 | < 0,001 | |
| Concentración de LDH al doble del límite normal | 24,3 | 3,00–531,00 | < 0,001 | |
| De Francesco E38 | Hemoglobina < 8g/dL | 3,8 | 1,40–10,50 | 0,008 |
| AST 2,5 veces aumentada del límite normal | 1 | 1,001–10,005 | 0,007 | |
| Falla renal aguda | 2,96 | 1,24–7,06 | 0,015 | |
| Insuficiencia respiratoria | 12,2 | 4,40–33,30 | 0,01 |
Los factores identificados en los 3 estudios anteriormente mencionados se ajustan al grupo de manifestaciones clínicas y hallazgos del laboratorio, descritos con frecuencia en otras cohortes de pacientes con sida e HDP8,23,29–33,36,37.
En conclusión, el compromiso hematológico (recuento de plaquetas < 100,00/mm3 y hemoglobina < 8mg/dl), el compromiso respiratorio (insuficiencia respiratoria y disnea), el compromiso hepático (AST 2,5 veces aumentado del valor normal), el compromiso renal (creatinina > 2,1mg/dl y falla renal aguda) y el mal estado nutricional (albúmina < 3,5g/dl) y el lactato deshidrogenasa al doble del valor normal se mostraron con factores que, al estar presentes en el paciente, podrían ayudar al médico tratante a que direccione de manera adecuada la estrategia de tratamiento y cuidado del paciente, ya que su presencia podría llegar a predecir complicaciones o, incluso, la muerte en este. Como hallazgo importante, se anota la reducción del riesgo en el desarrollo de complicaciones en aquellos pacientes que tuvieron acceso previo a la terapia terapia antirretroviral altamente efectiva (zidovudina), que fuera descrito menos frecuentemente en los reportes de pacientes provenientes de países latinoamericanos, pero que podría explicar la marcada diferencia en la mortalidad de estos pacientes, al compararlos con aquellos residentes en algunas regiones de los Estados Unidos, donde el acceso temprano a esta terapia es la regla8,27,28,30,36,37.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses de ningún tipo en el trabajo realizado.