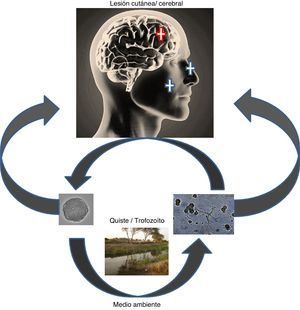
Las amebas de vida libre son microorganismos abundantes en el suelo y agua en todo el planeta. Algunas especies de estas amebas son capaces de causar muerte en el ser humano y animales, así como Naegleria fowleri (N. fowleri), Acanthamoeba sp. T4 principalmente y Balamuthia mandrillaris (B. mandrillaris). El 98% de los casos reportados en el mundo han fallecido. En Perú alrededor de 8 casos de meningoencefalitis por Acanthamoeba sp. se han reportado y más de 55 casos por B. mandrillaris. Ningún caso por N. fowleri ha sido documentado oficialmente en el Perú. B. mandrillaris es de difícil diagnóstico y aislamiento en medios de cultivo. En esta revisión pretendo documentar la historia de casos reportados de los últimos 40 años y describir los medios de cultivo útiles para su crecimiento. La identificación morfológica y molecular de Balamuthia es crítica en el diagnóstico de meningoencefalitis amebiana.
Free-living amoebae are abundant microorganisms in soil and water worldwide. Some species of these amoebae are capable of causing death in humans and animals, such as Naegleria fowleri (N. fowleri), Acanthamoeba sp. T4, and Balamuthia mandrillaris (B. mandrillaris). Some 98% of cases reported in the world have resulted in death. In Peru, 8 cases of meningoencephalitis due to Acanthamoeba sp. have been reported and more than 55 cases per B. mandrillaris. No case of N. fowleri has been officially documented in Perú. B. mandrillaris is difficult to diagnose and isolate in culture media. In this review we document the history of reported cases of the last 40 years and describe useful methods for their growth. Morphological and molecular identification of Balamuthia is critical to the diagnosis of amoebic meningoencephalitis.
Las amebas de vida libre (AVL) son microorganismos altamente patógenos y oportunistas como Acanthamoeba spp., Balamuthia mandrillaris (B. mandrillaris) y Naegleria fowleri (N. fowleri), que se han registrado desde todas las partes del mundo, incluyendo los trópicos1.
Las AVL son protistas inherentes habitantes del suelo, lodo y agua. Algunos de ellos son causa importante de enfermedades de baja frecuencia pero con una altísima mortalidad (mayor a 98%). El cuadro clínico de mayor importancia es la meningoencefalitis aguda y/o crónica que producen al infectar a los humanos y animales2,3. Sin embargo, muchos casos no se detectan debido a la escasez de recursos, baja frecuencia en el diagnóstico y bajo número de necropsias, las cuales son el método por el que la mayoría de las infecciones se detectan.
Las AVL por lo general ingresan por la cavidad nasal y atacan al sistema nervioso central (neurotropismo), pero también pueden ingresar a través de la piel causando enfermedad en individuos: inmunocompetentes e inmunodeficientes. Las 4 especies causantes de lesiones neurológicas son Acanthamoeba genotipo T4 principalmente, B. mandrillaris y Sappinia pedata conocidas como encefalitis granulomatosa amebiana (EGA); e infecciones oportunistas como meningoencefalitis amebiana primaria por N. fowleri. La infección puede adquirirse por el contacto con aguas contaminadas o suelo, como en los casos por Acanthamoeba y/o Naegleria. La exposición a suelo o arena puede ser un factor de riesgo y el nadar en estanques y lagos parece ser un antecedente común.
B. mandrillaris, fue aislada en 1986 y publicado en 19904,5. El aislamiento se consiguió tras la muerte de un mandril (Papio sphinx) del zoológico de San Diego de una extraña enfermedad cerebral4. El primer aislamiento ambiental de B. mandrillaris fue del suelo de una maceta en la casa de un niño infectado6. Pero el primer caso de infección humana por B. mandrillaris fue comunicado en 1991 en un paciente con síndrome de inmunodeficiencia adquirida (sida)7. Existen reportes en el cual los pacientes con VIH/sida son infectados por Acanthamoeba T4 o B. mandrillaris8–12, en Sudamérica se han publicado algunos casos provenientes de Argentina, Venezuela, Brasil, y unos pocos casos en Perú13–16. B. mandrillaris es la ameba que ocasiona la mayor cantidad de casos de EGA en el Perú.
Ciclo biológico de Acanthamoeba y BalamuthiaAcanthamoeba tiene dos estadios de su ciclo de vida, una de alimentación y reproducción en fase de trofozoíto y un estado de quiste resistente. Los trofozoítos se alimentan de bacterias presentes en el medio ambiente y se multiplica por binaria fisión. Una característica única de Acanthamoeba es la presencia de finos y estrechos pseudópodos en forma de espinas llamado «acantopodia», que sobresalen de su superficie. Los trofozoítos varían en tamaño de 15 a 45μm y por lo general tienen un solo núcleo localizado en el centro, el núcleo es densamente teñido. El citoplasma es finamente granular y contiene numerosas mitocondrias, los ribosomas, vacuolas alimenticias y una vacuola contráctil. Los quistes son de doble pared y varían en tamaño de 10 a 29μm. La pared del quiste externo, el exoquiste, está arrugado con pliegues y ondulaciones que contienen proteínas y lípidos. La pared del quiste interno, el endoquiste, contiene celulosa y por lo tanto es ácido periódico de Schiff-positivo. Es estrellada, poligonal, oval, o esférica. Los poros u ostiolos, en el cruce del exoquiste y la endoquiste están cubiertos por opérculos convexo-cóncavos que se abren en el momento del desenquistamiento. Los quistes son también uninucleados y poseen un nucléolo densamente colocado en posición central. Los quistes pueden resistir la desecación durante más de 20 años17.
B. mandrillaris, así como Acanthamoeba solo tienen dos estadios de su ciclo de vida (figs. 1 y 6). El trofozoíto es pleomórfico y mide 12 a 60μm con una media de 30μm. Los trofozoítos por lo general son uninucleados, pero formas binucleadas pueden ser observadas. El núcleo se ubica centralmente, con un nucléolo denso, y en ocasiones los trofozoítos con 2 o 3 cuerpos nucleares se pueden observar, especialmente en los tejidos infectados. Los quistes también son uninucleados, más o menos esféricos y pueden variar en tamaño desde 12 hasta 30μm, con una media de 15μm. Bajo la luz del microscopio los quistes parecen ser de doble pared, con una pared exterior ondulada y una pared interior ronda. Balamuthia presenta dos tipos de locomoción; un tipo es el movimiento por la locomoción ameboideo típica en los cultivos, el segundo tipo presenta una locomoción tipo araña en donde los pseudópodos son piernas y están extendidos alimentándose en cultivo de células. B. mandrillaris desplaza sus pseudópodos de forma similar a una araña con una velocidad estimada de 0,15μ/s, es más lentas que cualquier otra ameba5,18.
Clasificación taxonómicaLas AVL patógenas. Los Protozoa consisten en cuatro grupos: Sarcodina (amebas); Mastigóforos (flagelados); Sporozoa (además de las formas esporas protozoos parásitos); e Infusoria (ciliados). La Sociedad Internacional de Protozoología abandono la taxonomía clásica y creo un nuevo sistema basado sobre los enfoques morfológicos actualizados empleando parámetros bioquímicos y filogenética molecular19. De acuerdo con este nuevo esquema, los eucariotas se han clasificado en seis grupos o «super grupos»: Amoebozoa, Opisthokonta, Rhizaria, Archaeplastida, Chromalveolata y Excavata. Acanthamoeba y Balamuthia se incluyen en el super grupo Amoebozoa (Acanthamoebidae); N. fowleri bajo super grupo Excavata (Heterolobosia, Vahlkampfiidae) y Sappinia bajo super grupo Amoebozoa (Flabellinea, Thecamoebidae)19.
Diagnóstico clínico y métodos de laboratorioB. mandrillaris no es fácilmente observada y aislada del LCR, aunque en dos casos se aisló de SNC obtenida en la necropsia20,21.
El examen bioquímico del LCR revela normal a bajo nivel de glucosa, pero aumento de los niveles de proteína y pleocitosis linfocititaria con menos de 500 células/mm3. B. mandrillaris ha sido cultivada premortem a partir de biopsias cerebrales de varios pacientes, solo en EE. UU. y Gran Bretaña17,22. En Perú, solo se ha aislado una vez de biopsia de piel y algunas veces del medio ambiente23,24.
Es difícil diferenciar B. mandrillaris de Acanthamoeba spp. en tejido fijado en formol e incrustado en parafina bajo el microscopio de luz porque tienen apariencia muy similar. Sin embargo, pueden ser diferenciados por técnicas de inmunohistoquímica mediante el uso anti-Acanthamoeba o anti-B. mandrillaris de sueros de conejo3,17. Los cultivos in vitro de Balamuthia se puede establecer mediante la inoculación cerebro fresco o congelado y tejido de la piel en cultivo de células22,25,26. Para el diagnóstico confirmatorio la técnica molecular del PCR es útil para identificar B. mandrillaris, amplifica el gen 16S ADNr mitocondrial, el cual tiene un tamaño de 1,075 pb17,26.
Materiales y métodosSe realizó la búsqueda de casos clínicos analizando la base de datos de PubMed, research Google®, Google Scholar® y LILACS y todas las palabras clave para la búsqueda de información sobre meningoencefalitis por AVL. Los artículos antiguos de varias revistas de distribución nacional (Lima, Perú) fueron obtenidos de la biblioteca de la Universidad Peruana Cayetano Heredia (UPCH) y copias originales de los propios autores.
Los casos de Acanthamoeba fueron confirmados por cultivo en algunos casos y otros solo fue posible la confirmación por la presencia de trofozoítos en las láminas histológicas. En los casos de B. mandrillaris, la confirmación de la ameba fue por inmunohistoquímica, inmunofluorescencia y/o PCR confirmando el diagnóstico de EGA por B. mandrillaris. El PCR fue realizado muchas veces en el CDC y algunas veces por el Instituto de Medicina Tropical Alexander von Humboldt (IMT AvH UPCH) Lima-Perú. La gran mayoría de estas muestras han sido tejido de lesión cutánea. Este estudio es un análisis comparativo de reportes de casos publicados oficialmente en el Perú. Evaluamos la exposición ambiental y las características geográficas de los que podrían ser factores presumiblemente asociados a EGA.
Antecedentes epidemiológicos de los casos en el PerúEn 1957 Lima-Perú, se publicó el primer caso de absceso amebiano cerebral y meningoencefalitis sin compromiso hepático ni pulmonar27. El cuadro clínico sugerente por las lesiones cutáneas (placa de color roja-oscuro centrofacial o lesión macular eritematosa, algunas veces lesiones ulcerocostrosas necrotisantes) señalaron a Acanthamoeba como la responsable de la patología, pero no hay evidencia serológica ni molecular disponible. Entre los años 1976 y 2006 (Takano, 1976; Arce y Asato, 1979; Narváez, 1996; Galarza et al., 1997, 2006)28–33 han documentado algunos casos de encefalitis por Acanthamoeba sp. Estos reportes están basados en estudios de anatomía patológica y según los autores las características cutáneas muestran ser acordes con Acanthamoeba, en algunos casos se han aislado las cepas. Sin embargo, en el resto de casos no hay evidencia molecular que identifique la especie, Martínez et al., (1980)34 reportó una serie de casos que le fueron remitidos de varias partes del mundo entre ellas Perú, a las cuales le realizó estudios inmunológicos, no halló reacción con ninguna especie de Acanthamoeba ni N. fowleri en los tejidos del caso publicado por Albújar (1979)30,34. Cabe mencionar que morfológicamente son indistinguibles Acanthamoeba de Balamuthia en tejido infectado31–34.
Para comienzos del 2000, Recavarren-Arce et al. (1999); Campos et al. (1999); Gotuzzo (2000), McConnell (2000); Ballona y Aquije (2003); Sánchez et al. (2004); Bravo, et al. (2011; 2012), describen casos de EGA por B. mandrillaris, algunos de estos reportes fueron referidos al CDC en su momento y fueron identificados como B. mandrillaris por ensayos de inmunohistoquímica, inmunofluorescencia y/o PCR35–43.
Recientemente, Bravo y Seas (2011; 2012; 2015)42–44 informan que la serie peruana tiene alrededor de 55 casos de EGA por B. mandrillaris hasta el 2011, aún no se dispone de datos clínicos (datos sin publicar). En Perú, cinco pacientes supervivientes han sido tratados con una combinación de fluconazol o itraconazol, además de albendazol y miltefosina44. Tres pacientes tuvieron compromiso del SNC en el momento de su presentación y solo dos tuvieron compromiso cutáneo44.
Entre el 96-98% de los casos peruanos cursan con lesión cutánea y esta antecede a la lesión cerebral. Inexplicablemente en EE. UU. solo existen 3 casos con lesión cutánea de los 75 reportados por ese país. Posiblemente los factores ambientales en Perú sean predisponentes y genere diferencia en la presentación clínica (el polvo ambiental, luz UV-B) además de las actividades relacionadas con la jardinería/suelo.
Cabello-Vílchez et al., (2013)45 documentaron la presencia de Acanthamoeba genotipo T4 y T15 en mucosa nasal de individuos sanos en la costa norte y central de Perú. Cabello-Vílchez et al., se basaron en el estudio de Červa et al. (1973) y Badenoch et al. (1988)46,47 quienes aislaron Acanthamoeba, Hartmanella (ahora Vermamoeba) y Naegleria sp. en mucosa nasal. La tasa de aislamiento de AVL (Acanthamoeba y otras AVL) en Perú es superior a los descritos en la literatura. Se aisló alrededor del 28,4% muestras positivas para Acanthamoeba y se identificó una cepa del genotipo T15 y veinte del genotipo T4 con gran producción de serín proteasas. Los datos preliminares del mismo estudio demostraron un 45,9% 34(74) voluntarios sanos estaban colonizados con 44,1% Acanthamoeba sp. 17,64% de Naegleria sp. y un 38,23% otras amebas48 (fig. 1).
Recientemente se ha documentado el tratamiento de EGA con miltefosina, fluconazol y albendazol. Martínez et al. (2010)23 describe la experiencia clínica al tratar una paciente de 21 años con lesión cutánea a la altura de la rodilla aislándose B. mandrillaris y confirmado por PCR de la lesión cutánea y del jardín de la casa de la paciente (fig. 2). La paciente desarrolló lesión cerebral a pesar del tratamiento inicial con fluconazol, albendazol y anfotericina B. Al incluir miltefosina (150mg por día durante 12 días, 100mg por día durante 7 meses) se logró remisión de la lesión cutánea y neurológica, la paciente continúa asintomática hasta la actualidad. Entre los años 2006-2014 se han presentado algunos casos de EGA en el IMT-AvH, pero desafortunadamente no se nos ha permitido realizar las necropsias.
Esto sin duda obliga al aislamiento de B. mandrillaris de las lesiones de piel o del suelo (lugar más probable donde adquirió la infección). El Perú tiene una importante casuística, alrededor de 55 casos B. mandrillaris identificados en la actualidad en el IMT-AvH sin contar los casos de otras instituciones de salud del país (fig. 3).
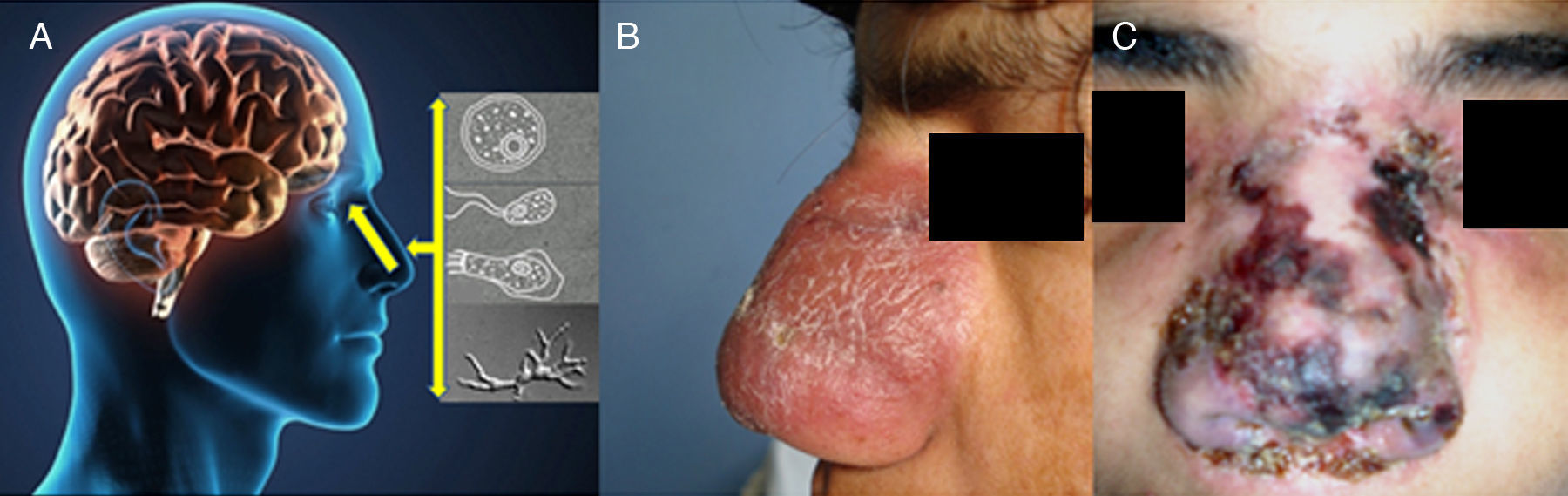
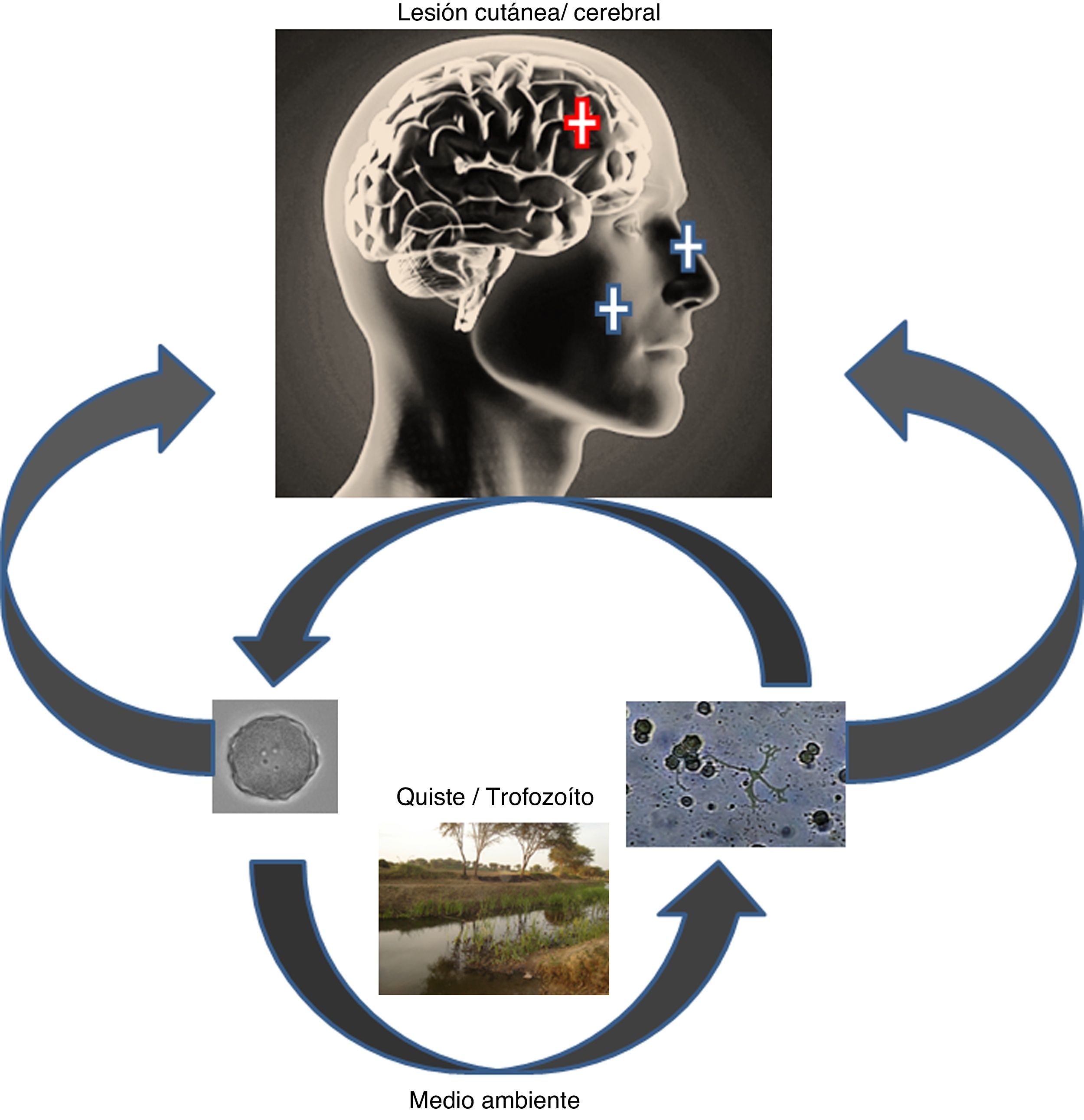
A) La cavidad nasal es la vía de ingreso para la infección para Acanthamoeba, Balamuthia mandrillaris y Naegleria fowleri en humanos, el trofozoíto es el estadio infeccioso. B y C) lesiones centro-faciales de pacientes peruanos que desarrollaron encefalitis fatal. (Foto [C], Cortesía Instituto Nacional de Salud del Niño ISN Lima).
La exposición a fuentes ambientales contaminadas con amebas como por ejemplo: charcos, estanques, lagunas, y zonas desérticas, permiten el ingreso y colonización de las amebas en la mucosa nasal principalmente. En la figura 3A se observa la vía de ingreso de algunas amebas como Acanthamoeba, Balamuthia y Naegleria. Las dos primeras amebas causan compromiso cutáneo, estas son muy características en Perú, pero no exclusivas. ¿Por qué algunos pacientes hacen lesión cutánea y otros no?, ¿por qué algunos pacientes hacen una lesión cutánea grotesca y necrótica y otros no? (tabla 1 y fig. 3B,C) son preguntas que actualmente no tienen respuesta. Por ello el Instituto de Medicina Tropical “Alexander von Humboldt” (IMT-AVH) de la Universidad Peruana “Cayetano Heredia” (UPCH) ha considerado importante como línea de investigación a las AVL por ser de interés en salud pública, debido principalmente a su alta mortalidad>98%. Es necesario mencionar que las lesiones cutáneas más comunes en Perú son centro-faciales y como segunda zona en importancia es a la altura de la rodilla (comunicación personal Martínez). Los Dres. Gotuzzo y Bravo han venido observando estos casos en los últimos 30 años en el IMT- AvH UPCH.
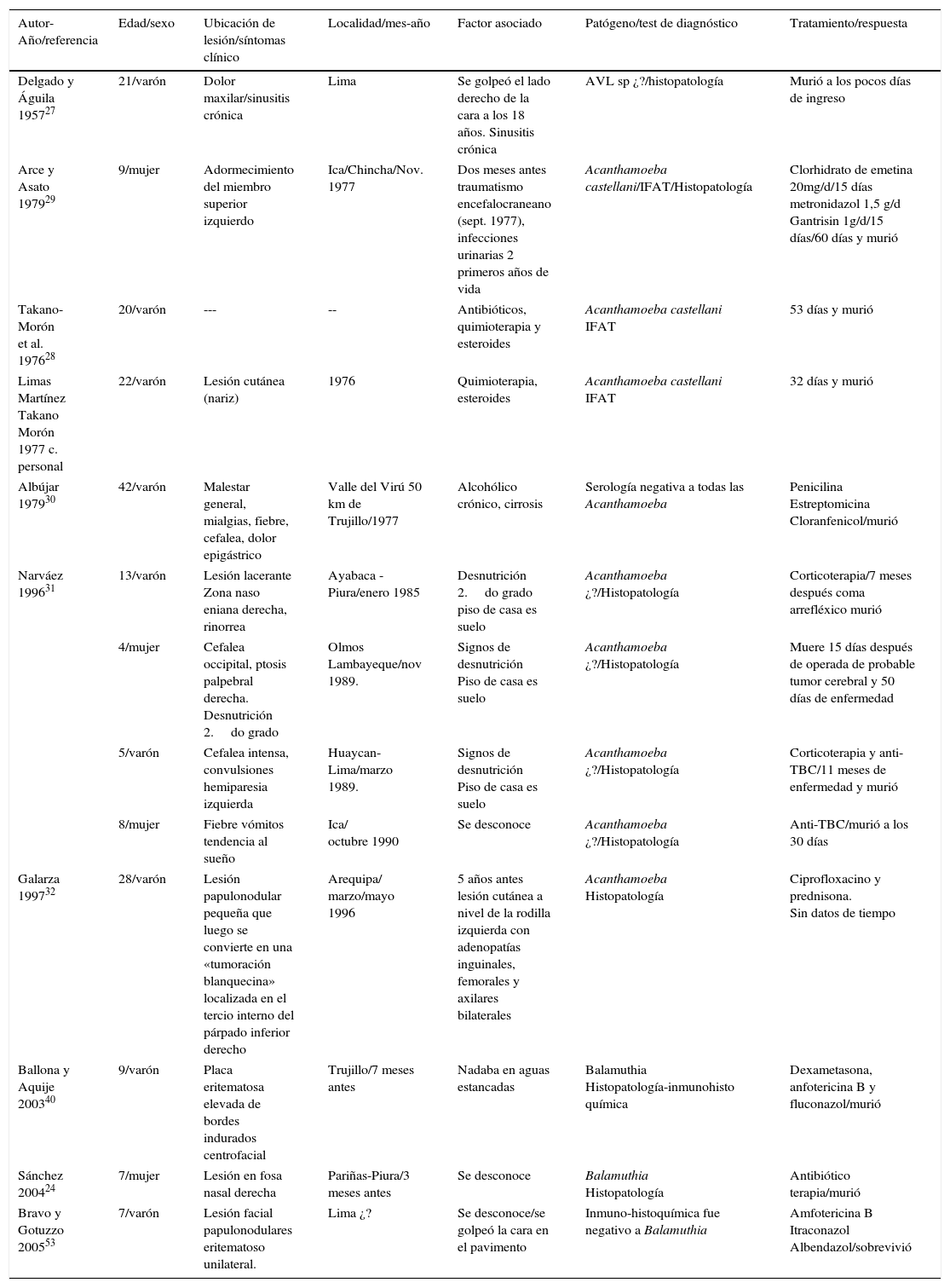
Casos reportados de EGA en el Perú. IFAT (Inmunofluorescent antibody technique)
| Autor-Año/referencia | Edad/sexo | Ubicación de lesión/síntomas clínico | Localidad/mes-año | Factor asociado | Patógeno/test de diagnóstico | Tratamiento/respuesta |
|---|---|---|---|---|---|---|
| Delgado y Águila 195727 | 21/varón | Dolor maxilar/sinusitis crónica | Lima | Se golpeó el lado derecho de la cara a los 18 años. Sinusitis crónica | AVL sp ¿?/histopatología | Murió a los pocos días de ingreso |
| Arce y Asato 197929 | 9/mujer | Adormecimiento del miembro superior izquierdo | Ica/Chincha/Nov. 1977 | Dos meses antes traumatismo encefalocraneano (sept. 1977), infecciones urinarias 2 primeros años de vida | Acanthamoeba castellani/IFAT/Histopatología | Clorhidrato de emetina 20mg/d/15 días metronidazol 1,5 g/d Gantrisin 1g/d/15 días/60 días y murió |
| Takano-Morón et al. 197628 | 20/varón | --- | -- | Antibióticos, quimioterapia y esteroides | Acanthamoeba castellani IFAT | 53 días y murió |
| Limas Martínez Takano Morón 1977 c. personal | 22/varón | Lesión cutánea (nariz) | 1976 | Quimioterapia, esteroides | Acanthamoeba castellani IFAT | 32 días y murió |
| Albújar 197930 | 42/varón | Malestar general, mialgias, fiebre, cefalea, dolor epigástrico | Valle del Virú 50 km de Trujillo/1977 | Alcohólico crónico, cirrosis | Serología negativa a todas las Acanthamoeba | Penicilina Estreptomicina Cloranfenicol/murió |
| Narváez 199631 | 13/varón | Lesión lacerante Zona naso eniana derecha, rinorrea | Ayabaca -Piura/enero 1985 | Desnutrición 2.do grado piso de casa es suelo | Acanthamoeba ¿?/Histopatología | Corticoterapia/7 meses después coma arrefléxico murió |
| 4/mujer | Cefalea occipital, ptosis palpebral derecha. Desnutrición 2.do grado | Olmos Lambayeque/nov 1989. | Signos de desnutrición Piso de casa es suelo | Acanthamoeba ¿?/Histopatología | Muere 15 días después de operada de probable tumor cerebral y 50 días de enfermedad | |
| 5/varón | Cefalea intensa, convulsiones hemiparesia izquierda | Huaycan-Lima/marzo 1989. | Signos de desnutrición Piso de casa es suelo | Acanthamoeba ¿?/Histopatología | Corticoterapia y anti-TBC/11 meses de enfermedad y murió | |
| 8/mujer | Fiebre vómitos tendencia al sueño | Ica/ octubre 1990 | Se desconoce | Acanthamoeba ¿?/Histopatología | Anti-TBC/murió a los 30 días | |
| Galarza 199732 | 28/varón | Lesión papulonodular pequeña que luego se convierte en una «tumoración blanquecina» localizada en el tercio interno del párpado inferior derecho | Arequipa/ marzo/mayo 1996 | 5 años antes lesión cutánea a nivel de la rodilla izquierda con adenopatías inguinales, femorales y axilares bilaterales | Acanthamoeba Histopatología | Ciprofloxacino y prednisona. Sin datos de tiempo |
| Ballona y Aquije 200340 | 9/varón | Placa eritematosa elevada de bordes indurados centrofacial | Trujillo/7 meses antes | Nadaba en aguas estancadas | Balamuthia Histopatología-inmunohisto química | Dexametasona, anfotericina B y fluconazol/murió |
| Sánchez 200424 | 7/mujer | Lesión en fosa nasal derecha | Pariñas-Piura/3 meses antes | Se desconoce | Balamuthia Histopatología | Antibiótico terapia/murió |
| Bravo y Gotuzzo 200553 | 7/varón | Lesión facial papulonodulares eritematoso unilateral. | Lima ¿? | Se desconoce/se golpeó la cara en el pavimento | Inmuno-histoquímica fue negativo a Balamuthia | Amfotericina B Itraconazol Albendazol/sobrevivió |
| Autor-año/referencia | Edad/sexo | Lugar de lesión/síntomas clínico | Localidad/mes-año | Factor asociado | Patógeno/test de diagnóstico | Tratamiento/respuesta |
|---|---|---|---|---|---|---|
| Galarza 200633 | 25/varón | Lesiones ulcerativas y necrotizantes de 3 meses de evolución localizadas en dorso torácico | Lima/3 meses antes del ingreso | HIV +/¿? | Acanthamoeba ¿?/Histopatología | Tratamiento antituberculoso itraconazol y anfotericina B |
| 31/mujer | Sinusitis y lesión en la piel | Lima-Huachipa/4 meses | HIV +/¿? | Acanthamoeba ¿?/Histopatología | Itraconazol/6 meses después murió | |
| 22/varón | Lesión ulcerativo necrosante a nivel de miembro inferior derecho además y lesión similar en muñeca derecha | Madre de Dios/3 meses | HIV +/¿? | Acanthamoeba/Histopatología | Antimoniato de n-metilglucamina | |
| Valverde 200649 | 7/varón | Pápula sintomática del dorso de la nariz/lesión centrofacial | Trujillo/7 meses antes | Desnutrición | Balamuthia/PCR | Itraconazol, albendazol, 4 semanas/murió |
| Seas y Bravo 200650 | 8/varón | Pansinusitis | Piura | Rinosinusitis | Balamuthia/histopatología | 4 semanas y murió |
| 10/mujer | Pansinusitis | Piura | Rinosinusitis | Balamuthia/histopatología PCR | 4 semanas y murió | |
| Paucar 201051 | 46/varón | Lesión en la rodilla derecha, signos meníngeos | Lima | Jardinero | Balamuthia/histopatología, PCR | 1 año and 3 meses y murió |
| Galarza 200915 | 36/varón | Lesión cutánea múltiple, ulceronecrótico, abdomen y miembros inferiores | Lima/febrero 2006 | Linfoma | Acanthamoeba sp ¿? MEG/histopatología | 7 meses murió |
| Martínez 201023 | 21/mujer | Lesión en la rodilla derecha. Signo de daño cerebral | Villa María del Triunfo- Lima | Se golpeó la rodilla en el jardín | Balamuthia/histopatología PCR | Itraconazol, albendazol, miltefosina/sobrevivió |
| Cabello-Vílchez AM et al. sin publicar | 21/varón | Sin lesión cutánea/signos de meningitis | Viajes de Piura – Bagua julio 2006. | Desconocido Uso de alcohol y drogas | Balamuthia – like TB meníngeo/Exm directo LCR identificación amoeba por morfología y TB por PCR | Metronidazol, anfotericina B/65 días y murió |
| Autor-año/referencia | Edad/sexo | Lugar de lesión/síntomas clínico | Localidad/mes-año | Factor asociado | Patógeno/test de diagnóstico | Tratamiento/respuesta |
|---|---|---|---|---|---|---|
| Velarde C 199952 tesis | 23/varón | Lesión centrofacial | Lima – 6m 1985 | Desconocido | Balamuthia Histopatología Immuno-fluorescencia | Murió |
| Velarde C 199952 Tesis | 22/varón | Lesión centrofacial | Lima -5m 1988 | Desconocido | Balamuthia Histopatología Immuno-fluorescencia | Murió |
| Velarde C 199952 tesis | 5/varón | Lesión centrofacial Gluteus | Lima – 17d 1989 | Desconocido | Balamuthia Histopatología immuno-fluorescencia | Murió |
| Velarde C 199952 tesis | 10/varón | Lesión centrofacial | Lima-10 d 1989 | Desconocido | Balamuthia histopatología immuno-fluorescencia | Murió |
| Velarde C 199952 tesis | 12/varón | Lesión centrofacial | Lima-2m 1992 | Desconocido | Balamuthia histopatología immuno-fluorescencia | Murió |
| Velarde C 199952 tesis | 50/mujer | Gluteus, submentoniana | Piura-11d 1992 | Desconocido | Balamuthia histopatología immuno-fluorescencia | Murió |
| Velarde C 199952 tesis | 34/varón | Lesión centrofacial | Lima-3m 1993 | Desconocido | Balamuthia histopatología immuno-fluorescencia | Murió |
| Velarde C 199952 tesis | 14/varón | Miembro inferior, lumbar, toráccica | Lima-25 d 1993 | Desconocido | Balamuthia Histopatología Immuno-fluorescencia | Murió |
| Velarde C 199952 tesis | 28/varón | Lesión centrofacial | Piura-40 d 1994 | Desconocido | Balamuthia histopatología immuno-fluorescencia | Murió |
| Visvesvara et al., 19904 | 30/varón | No se describe | No se describe 1988 Perú | No se describe | Balamuthia histopatología immuno-fluorescencia | Murió |
| Recavarren S et al. 199935 | 22/varón | No se describe | No se describe/2 meses | Desconocido | Balamuthia histopatología immuno-fluorescencia | Murió |
| Recavarren S et al. 199935 | 9/varón | Lesión centrofacial (piramidal) | No se describe/1 mes | Desconocido | Balamuthia histopatología immuno-fluorescencia | Murió |
En esta revisión de casos clínicos me limito a revisar los casos publicados oficialmente desde finales de los años 70 en adelante. En esta revisión analizamos 35 casos de EGA, de los cuales 14 (40%) casos han sido atribuidos a Acanthamoeba sp., algunos a A. castellanii identificados por IFAT y 21 (60%) a B. mandrillaris identificados y diagnosticados por histología, inmunohistoquímica y PCR. De los casos publicados, hubo 7 casos en mujeres y 28 en varones, esto es una proporción de 4:1. El rango de edades es de 5 a 46 años en los varones. Los casos se circunscriben geográficamente a la costa de Perú Piura, Lima e Ica, excepcionalmente Lambayeque y Trujillo. De los 21 (60%) casos por B. mandrillaris, 13 describen lesión en la región nasal y 8 en miembros inferiores y tórax, la rodilla es la otra región observada (Martínez, comunicación personal). La tasa de letalidad bordea el 94,2% y 47% de los casos fueron niños. La distribución de géneros en EGA para B. mandrillaris fue 17 (81%) varones y 4 (19%) mujeres, la letalidad en niños fue del 100% (n=10) (tabla 1).
En muchos de nuestros casos el factor asociado es difícilmente comprendido, sin embargo hay unos cuantos hechos que podrían ser el factor común, el golpe previo a la lesión, estados de desnutrición y exposición a suelo (granjero, jardinero o habitante de caseríos cercanos al desierto).
Los casos peruanos comienzan con un nódulo generalmente centro-facial (región nasal), pero pueden también aparecer en la región infraorbital hasta la región cigomática, comprometiendo algunas veces la región labial y la bucal.
Manifestaciones cutáneasLas lesiones clínicamente se ven como placas, algunas veces solas y otras ocasiones con lesiones satélites. Los bordes de las lesiones algunas veces parecen lesiones anulares. El diámetro de las lesiones puede ser muy variado. La tonalidad de la lesión puede ser de ligeramente rojo a una tonalidad violácea. A la palpación pueden sentirse lisas o rugosas. Algunos casos han desarrollado sinusitis, úlceras necrosantes, eritema, y cuando no han sido tratadas, las lesiones abarcan el rostro del paciente. Se observó lesión cutánea en el 100% de los pacientes con 100% presencia de amebas, 25 con placas dolorosas, 4 lesión extra facial, 3 múltiples lesiones, 2 con lesión a la altura de la rodilla y una sin lesión facial (tabla 1)42–44.
Métodos de diagnóstico: cultivo monoxénico y axénicoDifícilmente los laboratorios clínicos realizan cultivos de AVL, por esta razón es importante establecer el diagnóstico histopatológico inicial, la sospecha debe realizarse cuando los resultados suelen dar negativo a los microorganismos típicos como bacterias y hongos y no reaccionar a las pruebas de leishmania u otra condición similar como TB cutánea. Para ello la biopsia de la lesión cutánea o LCR debe ser evaluada rigurosamente. La muestra debe ser sembrada en medios básicos pero selectivos (monoxénico y cultivo celular) para AVL.
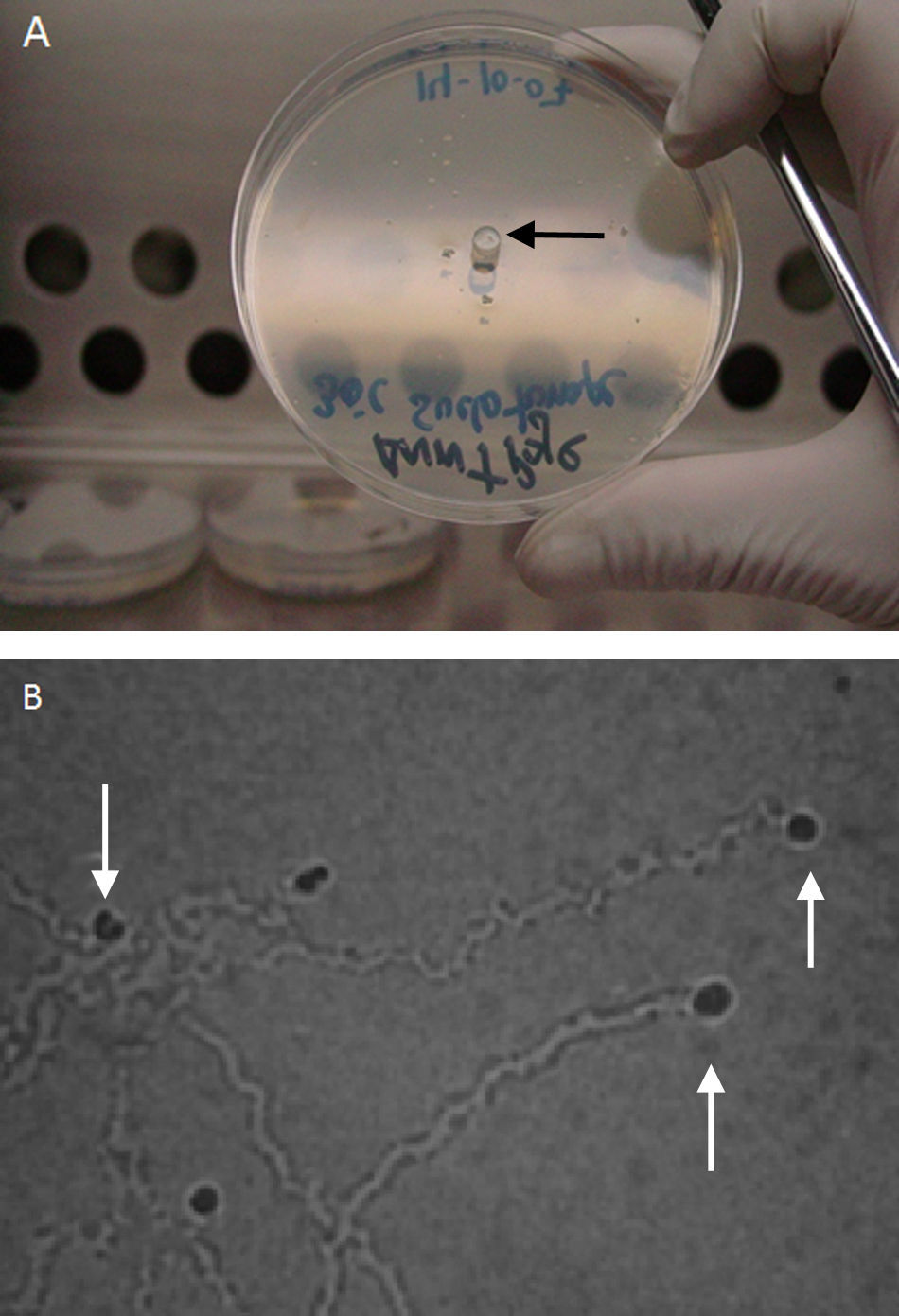
El diagnóstico de EGA por Acanthamoeba se realiza por la visualización de amebas en extensiones de LCR o en cultivos ya sea monoxénico o celular. El mayor porcentaje de aislamientos ocurre en estadios relativamente precoces de la enfermedad cuando la ameba está confinada a la piel (en casos de lesión cutánea). Con el tiempo las amebas penetran en tejidos más profundos llegando a ingresar en el torrente sanguíneo y diseminarse a través de las paredes de los vasos. La exploración de la cavidad nasal (lavado nasal) también debe ser incluida como muestra para la búsqueda de AVL en los casos de sinusitis y/o lesiones nasales. Las amebas se visualizan en extensiones directas, teñidas con Giemsa, PAS y/o calcoflúor. El agar no nutritivo con Escherichia coli (E. coli) ATCC 25922 viva, es el medio de cultivo de elección para aislar amebas. La muestra clínica debe colocarse sobre el agar y este se incubará 28°- 30°C durante 7 a 20 días, revisándolas cada 24h. (fig. 4A). Es característica la formación de ríeles (fig. 4B) en el medio de cultivo por donde avanzan los trofozoítos, la clonación de estos microorganismos puede realizarse cogiéndose el quiste solitario en la placa de agar después de haberse desplazado varios días antes.
Medio de cultivo monoxénicoSe empleará el agar base como solidificante y la solución Page (10X): (tabla 2). Se disuelve en orden de lista en agua destilada, y se dispensa 100ml en 900ml de agua.
Fórmula de la solución Page (10 x), se disuelve en orden de lista en agua destilada y se dispensa 100 ml en 900 ml de H2O
| Compuestos (sol. Page 10X) | Concentración |
|---|---|
| Cloruro de sodio NaCl | 120mg |
| Sulfato de magnesio MgSO4 x 7H2O | 4mg |
| Fosfato de sodio dibásico Na2HPO4 | 142mg |
| Fosfato potásico monobásico KH2PO4 | 136mg |
| Cloruro de calcio CaCl2 x 2H2O | 4mg |
| Agua destilada H2O (d) | 1,000ml |
Para preparar medio sólido agregar 2% de agar.
Generalmente se emplea la solución Page con una concentración al 2% de agar, este se debe verter en caja de Petri y una suspensión de E. coli en solución Page y/o agua estéril debe cubrir la placa (deberá extraerse el exceso de líquido) esto será la fuente de alimento. Para el aislamiento de Acanthamoeba y/o N. fowleri, las muestras de biopsia cerebral y/o LCR (por lo general) se puede emplear el mismo medio monoxénico.
Cultivos axénicosSon medios de cultivo líquidos y son de varias formulaciones que ayudan al aislamiento de los trofozoítos libres de bacterias.
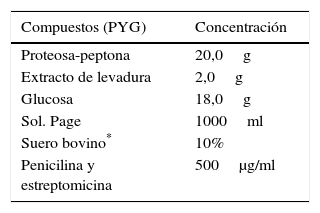
Proteosa-peptona (Acanthamoeba sp.) (PYG)22
Los dos primeros componentes se disuelven en solución Page, la glucosa se suele añadir al final después de esterilizarlo por autoclave (tabla 3), colocar 10ml del medio en frascos de cultivo de 25 cm2.
Fórmula del medio (PYG) proteosa-peptona, extracto de levadura y glucosa, para el aislamiento de Acanthamoeba sp
| Compuestos (PYG) | Concentración |
|---|---|
| Proteosa-peptona | 20,0g |
| Extracto de levadura | 2,0g |
| Glucosa | 18,0g |
| Sol. Page | 1000ml |
| Suero bovino* | 10% |
| Penicilina y estreptomicina | 500μg/ml |
Medio Nelson (Naegleria sp.)54
Preparar la solución salina de Page y luego mezclar los componentes y esterilizar por autoclave (tabla 4), colocar 10ml de medio en frascos de cultivo de 25 cm2.
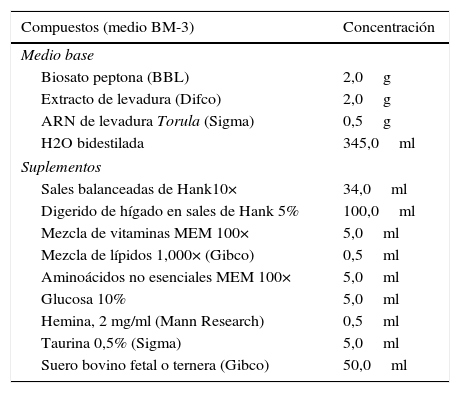
B. mandrillaris: para el aislamiento de B. mandrillaris de muestras ambientales puede usarse el medio monoxénico (tabla 2, figs. 5 y 6), pero para las clínicas, debe sembrarse en cultivo celular y luego el medio BM-3 para su axenización, este último fue desarrollado por Schuster en 199655. En el cultivo celular puede emplearse (Primary Human Brain Microvascular Endothelial Cells), células Vero de riñón de un adulto normal (African green monkey E6) y también puede usarse células de neuroblastomas45.
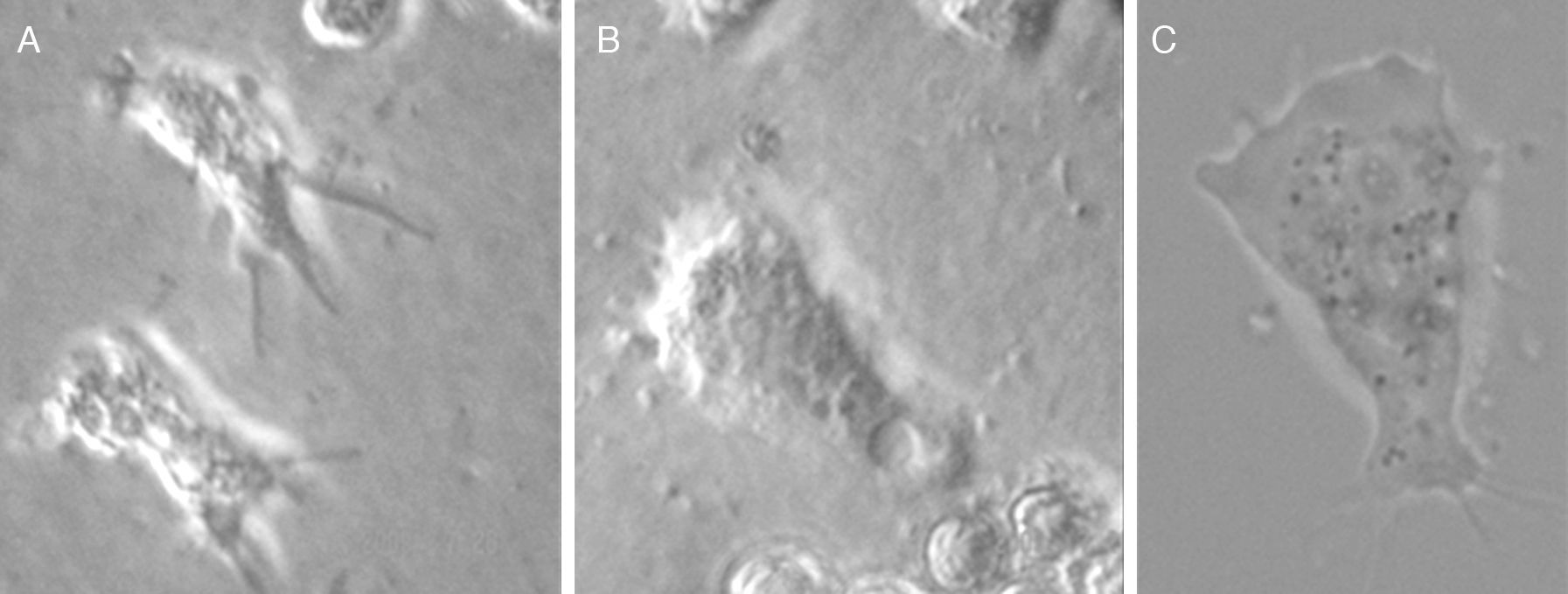
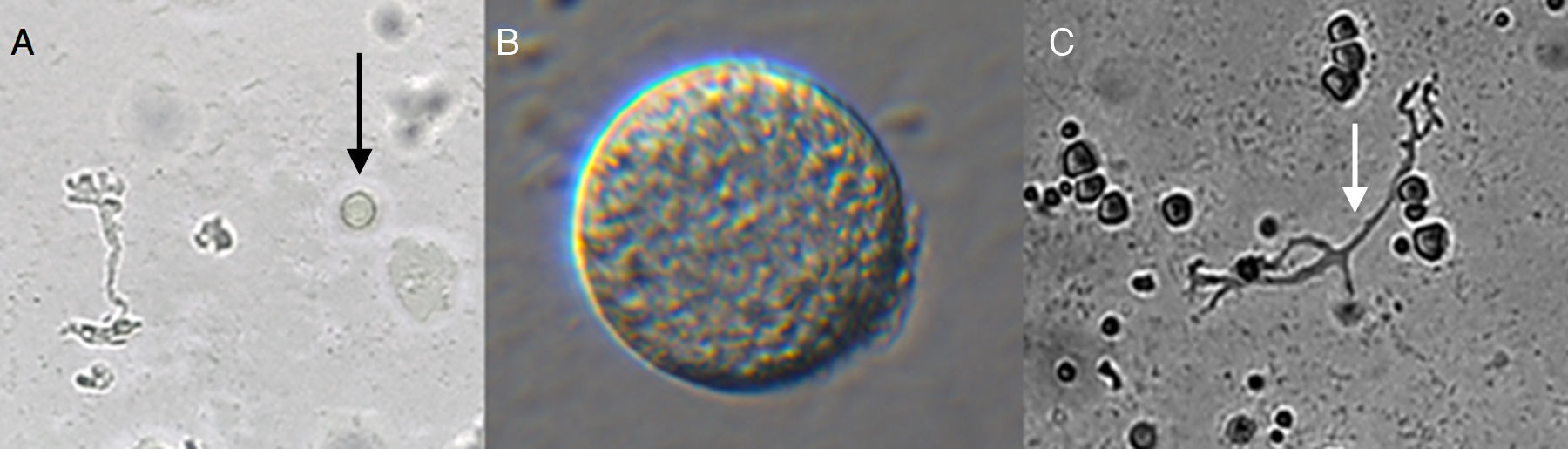
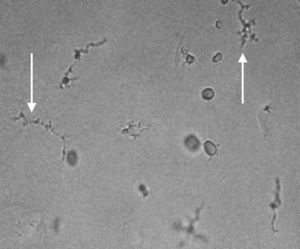
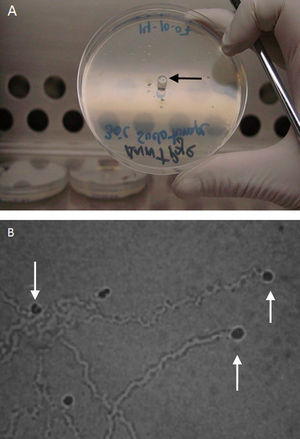
A) Trofozoíto y quiste (flecha negra) de Balamuthia mandrillaris en cultivo monoxénico con una Acanthamoeba como fuente de alimento aislado de Piura-Perú [cepa MC-13A]. B) Quiste de B. mandrillaris CG-13 aislado en cultivo celular. C) Trofozoíto típico de Balamuthia mandrillaris en cultivo monoxénico [cepa CG-13].
Medio BM-3 (B. mandrillaris)55
Este medio de cultivo (BM-3) es muy rico en nutrientes, por tanto debe ser preparado con mucha cautela. Las cepas que logren crecer en medios axénicos deben ser conservadas reemplazado el medio de cultivo cada 5-7 días en el caso de las Acanthamoeba y cada 3 días en el caso de Balamuthia44,45. Las muestras clínicas de piel y cerebro deben ser sembradas en cultivos celulares y observados diariamente por un lapso de 7 a 10 semanas hasta que crezcan en un número suficiente y después transferir al medio axénico (tabla 5).
Composición del medio de cultivo BM-3. Ajustar el pH a 7.2 con 1N NaOH estéril. Agregar luego suero bovino fetal (Gibco) al 10% y penicilina (100 U/ml) y estreptomicina (100 μg/ml). Este medio de cultivo (BM-3) es muy rico en nutrientes por tanto debe ser preparado con mucha cautela para evitar contaminaciones
| Compuestos (medio BM-3) | Concentración |
|---|---|
| Medio base | |
| Biosato peptona (BBL) | 2,0g |
| Extracto de levadura (Difco) | 2,0g |
| ARN de levadura Torula (Sigma) | 0,5g |
| H2O bidestilada | 345,0ml |
| Suplementos | |
| Sales balanceadas de Hank10× | 34,0ml |
| Digerido de hígado en sales de Hank 5% | 100,0ml |
| Mezcla de vitaminas MEM 100× | 5,0ml |
| Mezcla de lípidos 1,000× (Gibco) | 0,5ml |
| Aminoácidos no esenciales MEM 100× | 5,0ml |
| Glucosa 10% | 5,0ml |
| Hemina, 2 mg/ml (Mann Research) | 0,5ml |
| Taurina 0,5% (Sigma) | 5,0ml |
| Suero bovino fetal o ternera (Gibco) | 50,0ml |
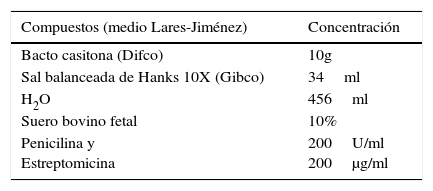
Mientras se escribía este artículo Lares et al., 2015, publicó un reciente trabajo donde describe un medio útil para la axenización de B. mandrillaris. Este medio permite el crecimiento de B. mandrillaris con un tiempo de generación de 52,72 h (tabla 6)56.
Algunas cepas de Balamuthia no es posible su axenización, se desconoce la razón para este comportamiento, en ese caso deben ser mantenidas en cultivo celular o ser criopreservadas.
DiscusiónLos factores asociados a la infección cutánea por B. mandrillaris son discutidos aquí, B. mandrillaris es una ameba de vida libre especializada que consume otras células eucariotas, crece en cultivo celular y solo algunas cepas son capaces de su axenización.
La balamutiasis es una enfermedad crónica que por lo general es de curso fatal. Se ha postulado que la vía de ingreso es la cavidad nasal y/o abertura en la piel, en algunos casos la lesión cutánea aparece meses después de una herida o golpe cerca del rostro (descripción en los casos peruanos). También se ha postulado que los casos peruanos serian inmunocompetentes, sin embargo no hay evidencia que demuestre esta afirmación24,52. En las lesiones parenquimales cerebrales no se hallaron granulomas, pero sí se encontró infiltrado inflamatorio crónico. La ausencia de granulomas a nivel parenquimal, difiere de otros autores, tampoco se encontraron lesiones granulomatosas en las meninges52.
Los estados de inmunosupresión transitorio no son fáciles de establecer, sin embargo la evidencia de malnutrición podría ayudar a establecer el estado inmunológico deficiente en las poblaciones. Es muy común ver cuadros de malnutrición en la costa norte y en la misma capital. En Piura la desnutrición crónica en niños menores de 5 años fue del 23% y en el área rural 45,7% en el 2007 y 49% de niños de 6 a 36 meses de nacidos tenían anemia57. Este otro dato podría explicar en parte el compromiso inmunológico de muchos niños infectados por B. mandrillaris. El 66,8% de la población de Piura son menores de 34 años y el 33% son menores de 14 años, el 41% de las viviendas tiene material de ladrillo y cemento, el 32,5% adobe (lodo en forma de ladrillo), quincha 15,8%, madera 4,6% y esteras, piedra con barro 6,1%. El 59,1% de los domicilios (Piura) tiene «suelo» como piso, este dato es de gran importancia y explicaría en parte la recurrencia de casos de la costa norte57. Posiblemente algunos pacientes se infectan en sus propias casas, esta posibilidad se basaría en los casos publicados por Martínez et al., 2010, Paucar et al., 2010 y Cabello-Vílchez et al., 201423,51,58, Narváez también hace mención a esta característica domiciliaria en sus 4 casos, donde los niños vivían en casas con el piso de suelo31. Debe tenerse en cuenta que otro factor ambiental capaz de perturbar el sistema inmune es la incidencia de UV-B que en Piura es particularmente muy alto. La ausencia de lesiones granulomatosas podría indicar un estado de inmunosupresión, y por el otro lado la presencia de granulomas indicaría una respuesta del sistema inmune.
En muchos casos no está claro cuál podría haber sido la fuente de infección ni tampoco la vía de ingreso. Posiblemente las amebas atraviesen la piel y de ser posible esto, la radiación ultravioleta B (UV-B) afectaría el sistema inmune, este no sería capaz de detectar a las amebas principalmente por el estado de inmunosupresión transitorio, luego se incrementaría los niveles de IL-10 por acción de UV-B y algunas otras citoquinas, esto podría explicar por qué algunos pacientes hacen proceso granulomatoso y otros no40,42,44,49,59.
En el caso de la costa central, existiría un factor propio de la geografía como lo es la contaminación atmosférica pues el polvo ambiental suele estar cargado con quistes de amebas45,58. Este factor podría ser un condicionante porque existe una alta frecuencia de lesiones en la cavidad nasal. Sin embargo, se debe tener en cuenta que también existen casos con lesiones a la altura de la rodilla. Se debe considerar el diagnóstico de EGA en todo paciente con lesión cutánea cuando no se llegue a identificar el agente causal y que curse con lesión neurológica compatible de causa no precisada.
Finalmente, deseamos que esta contribución sirva de ayuda a los laboratorios clínicos para identificar AVL causantes de meningoencefalitis. El aislamiento y secuenciación de cepas de B. mandrillaris aisladas de pacientes y del medio ambiente pueden ayudarnos a establecer las características patogénicas más importantes a través de una relación filogenética entre las cepas patógenas y las posibles cepas no patógenas de Balamuthia sp. Estos estudios están siendo llevados a cabo por el grupo del IMT-AvH del UPCH.
ConclusionesB. mandrillaris en el Perú es una entidad poco estudiada por los clínicos y microbiólogos clínicos.
B. mandrillaris se transmite a través del contacto con el suelo, y la infección puede ocurrir entre inmunocompetentes. Dos presentaciones clínicas se han descrito: algunos pacientes desarrollar una lesión cutánea inicial (generalmente centro-facial) seguida por el desarrollo de manifestaciones neurológicas en semanas o meses, mientras que otros se presentan con afectación del SNC, ambos con una alta tasa de mortalidad.
En general, el número de reportes sobre esta patología sigue siendo bajo a pesar de tener una mayor casuística sobre el continente sudamericano. Las lesiones cutáneas sospechosas son un factor importante para el diagnóstico de balamuthiasis en Sudamérica, Perú.
Ha sido valioso el aislamiento de B. mandrillaris de los jardines de algunos de los pacientes, esto ha permitido incrementar nuestro conocimiento de su biología en el laboratorio. Sin embargo presentan una gran dificultad para identificar debido a la pleomorfía de B. mandrillaris.
El 94,2% de los pacientes han fallecido a pesar de la terapia en etapa temprana de la enfermedad, no existe aún una terapia efectiva que pueda recomendarse, sin embargo hemos tenido relativo éxito tratando los últimos casos con miltefosina.
En nuestro país hay una necesidad de investigar esta entidad clínica y de solicitar al Ministerio de Salud del Perú estrategias de vigilancia al respecto como sí las hay por ejemplo en México.
FinanciaciónEl manuscrito fue realizado por A.M. Cabello-Vílchez (AMCV) de la Universidad Peruana Cayetano Heredia - Instituto de Medicina Tropical Alexander von Humboldt (UPCH-IMT-AvH). AMCV es investigador del Grupo amebas de vida libre del IMT-UPCH. Este trabajo fue autofinanciado. AMCV es un PhD investigador de UPCH en Lima Perú, que actualmente está trabajando en amebas patógenas oportunistas aisladas de Perú. Su interés se centra en la filogenia y la fisiopatología de B. mandrillaris. Además de estudiar la patogenia de Mycobacterium ulceran y de Mycobacterium leprae como simbiontes.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.
Esta revisión fue desarrollada en vista de no encontrar ninguna revisión completa en castellano respecto a amebas de vida libre en el Perú, y de diversas conversaciones con algunos especialistas en enfermedades infecciosas en Lima-Perú. Agradezco a los médicos que gentilmente proporcionaron sus resúmenes y presentaciones de casos clínicos, especialmente al Dr. Juan Takano-Morón. Mi sincero agradecimiento a Verónnika I. Peña Mg y Jorge Alave MD por la revisión del manuscrito.



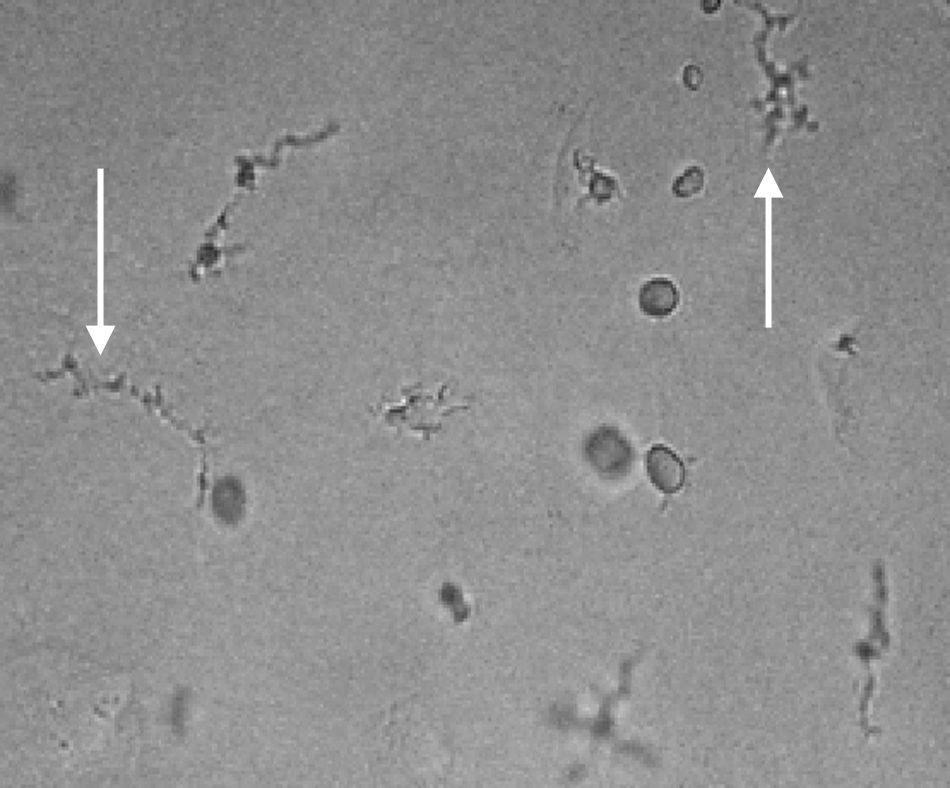


![Trofozoítos de amebas de vida libre (Vexilliferas sp. [A], Mayorella sp. [B,C]) 400X, aislados en cultivo celular de mucosa nasal de voluntarios sanos de Piura costa norte de Perú. Trofozoítos de amebas de vida libre (Vexilliferas sp. [A], Mayorella sp. [B,C]) 400X, aislados en cultivo celular de mucosa nasal de voluntarios sanos de Piura costa norte de Perú.](https://static.elsevier.es/multimedia/01239392/0000002000000002/v2_201703220234/S0123939215001010/v2_201703220234/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
![A) La cavidad nasal es la vía de ingreso para la infección para Acanthamoeba, Balamuthia mandrillaris y Naegleria fowleri en humanos, el trofozoíto es el estadio infeccioso. B y C) lesiones centro-faciales de pacientes peruanos que desarrollaron encefalitis fatal. (Foto [C], Cortesía Instituto Nacional de Salud del Niño ISN Lima). A) La cavidad nasal es la vía de ingreso para la infección para Acanthamoeba, Balamuthia mandrillaris y Naegleria fowleri en humanos, el trofozoíto es el estadio infeccioso. B y C) lesiones centro-faciales de pacientes peruanos que desarrollaron encefalitis fatal. (Foto [C], Cortesía Instituto Nacional de Salud del Niño ISN Lima).](https://static.elsevier.es/multimedia/01239392/0000002000000002/v2_201703220234/S0123939215001010/v2_201703220234/es/main.assets/thumbnail/gr3.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
![A) Trofozoíto y quiste (flecha negra) de Balamuthia mandrillaris en cultivo monoxénico con una Acanthamoeba como fuente de alimento aislado de Piura-Perú [cepa MC-13A]. B) Quiste de B. mandrillaris CG-13 aislado en cultivo celular. C) Trofozoíto típico de Balamuthia mandrillaris en cultivo monoxénico [cepa CG-13]. A) Trofozoíto y quiste (flecha negra) de Balamuthia mandrillaris en cultivo monoxénico con una Acanthamoeba como fuente de alimento aislado de Piura-Perú [cepa MC-13A]. B) Quiste de B. mandrillaris CG-13 aislado en cultivo celular. C) Trofozoíto típico de Balamuthia mandrillaris en cultivo monoxénico [cepa CG-13].](https://static.elsevier.es/multimedia/01239392/0000002000000002/v2_201703220234/S0123939215001010/v2_201703220234/es/main.assets/thumbnail/gr5.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)