Los pacientes con insuficiencia renal crónica en tratamiento con hemodiálisis constituyen un grupo de riesgo para la infección con el virus de la hepatitis C. La infección por este virus representa la causa más frecuente de enfermedad hepática crónica en los hemodializados.
ObjetivoEvaluar la prevalencia y realizar la caracterización de la infección por el virus de la hepatitis C en un grupo de pacientes en hemodiálisis de la ciudad de Posadas (Argentina).
Materiales y métodosSe evaluó la presencia del virus de la hepatitis C mediante enzimoinmunoanálisis en 113 muestras de sangre total obtenidas por venopunción de pacientes con insuficiencia renal crónica en tratamiento con hemodiálisis. En los casos positivos se confirmó la presencia de genoma viral por medio de una RT-PCR anidada de la región 5′ no codificante del virus de la hepatitis C y se determinó el genotipo y subtipo viral mediante análisis del polimorfismo de longitud de fragmentos de restricción.
ResultadosDe una población de 113 pacientes con insuficiencia renal crónica en tratamiento con hemodiálisis, el 89,4% (n=101) de los casos fueron no reactivos para anticuerpos contra el virus de la hepatitis C mediante enzimoinmunoanálisis, mientras que el 10,6% (n=12) de los casos fueron reactivos. Se confirmó el resultado reactivo en los 12 casos por RT-PCR, y se determinó la infección por genotipo 1a (7/12) y genotipo 2a (5/12).
ConclusiónLa prevalencia de la infección por el virus de la hepatitis C en este grupo de pacientes en hemodiálisis fue del 10,6%, y los genotipos virales del virus de la hepatitis C encontrados (1a y 2a) coinciden con los genotipos que prevalecen en la población infectada de Argentina.
Patients with chronic renal failure on hemodialysis comprise a risk group for infection with hepatitis C. This viral infection is the most common cause of chronic liver disease in hemodialysis.
ObjectiveTo evaluate the prevalence and to characterise hepatitis C virus infection in a group of patients from the city Posadas (Argentina) who are on hemodialysis.
Materials and methodsThe presence of the virus of hepatitis C was evaluated by enzyme immunoassay of 113 samples of whole blood obtained from patients with chronic renal failure undergoing hemodialysis. In positive cases, the presence of the viral genome was confirmed by RT-nested PCR of the 5’-noncoding region of the hepatitis C virus, and the viral genotype and subtype were determined by restricted fragment length polymorphism analysis.
ResultsOf a population of 113 patients with chronic renal failure on hemodialysis, the detection of hepatitis C virus infection was performed by enzyme immunoassay, of which 89.4% (n=101) of the cases were non-reactive, and 10.6% (n=12) of cases were reactive. We confirmed the reactive results in 12 cases by RT-PCR, and we determined that these cases were genotype 1a (7/12) and genotype 2a (5/12).
ConclusionThe prevalence of infection with hepatitis C virus in this group of patients on hemodialysis was 10.6%, and the hepatitis C virus genotypes found (1a and 2a) were the same as the prevalent genotypes in the infected population of Argentina.
El virus de la hepatitis C (VHC) fue caracterizado molecularmente en 19891, después de múltiples investigaciones para la detección del genoma del virus de las hepatitis no-A, no-B. Se estima que 200 millones de personas (el 3% de la población mundial) se encuentran infectadas con VHC2.
La transmisión del VHC es fundamentalmente parenteral. La infección por VHC causa hepatitis aguda, generalmente asintomática dentro de los primeros 3-6 meses de iniciada la infección. El período de incubación puede variar entre 14 y 180 días (promedio 6-7 semanas)3. Aunque entre el 10-15% de los pacientes infectados resuelven favorablemente la infección, en la mayoría de los casos se produce la transición hacia la infección crónica de forma subclínica (asintomática). Esta transición hacia la infección persistente se produce aun en presencia de una respuesta inmune específica del huésped, tanto humoral (anticuerpos neutralizantes) como celular (respuesta citotóxica). Entre los factores que contribuyen a la progresión hacia la cronicidad se encuentran factores del hospedador (por ejemplo, herencia de polimorfismos en la región IL28B, ciertos alelos del complejo mayor de histocompatibilidad clase i), y factores del virus (a la alta tasa de mutación que facilita mecanismos de escape, elevada producción de viriones –1012 viriones/día–, etc.)4. La hepatitis crónica C tiene una evolución lenta pero progresiva: con tasas de progresión a cirrosis compensada probada histológicamente de entre el 2-3% hasta el 50% tras 20 años de infección, según los estudios5. Una vez establecida la cirrosis, se estima un riesgo anual del 3-6% para una descompensación hepática y del 1-5% para el desarrollo de carcinoma hepatocelular. Tras la descompensación, el riesgo de muerte al año se estima entre el 15-20%, y este estadio terminal de la infección crónica por VHC es una de las principales indicaciones de trasplante hepático6–8. Por estas razones, se prevé para el futuro próximo un aumento de la morbimortalidad y utilización de los recursos de salud2,9.
La alta variabilidad genómica de los aislamientos de VHC ha permitido su clasificación en 7 genotipos diferentes (designados del 1 al 7) con una identidad de secuencias del orden del 69%; a su vez, cada genotipo incluye varios subtipos con una identidad cercana al 79%10,11. Se ha relacionado a los diferentes genotipos con una distribución geográfica particular (1a, 1b, 2a y 2c distribuidos en todo el mundo; y 4, 5a, 6a y 7 solo en ciertas regiones específicas), con la vía de transmisión de la infección (por ejemplo, en Europa Occidental, los genotipos 3a y 1a predominan en pacientes con antecedentes de uso de drogas por vía parenteral) y la respuesta al tratamiento antiviral12,13.
Los estudios de prevalencia de los diversos genotipos del VHC en Argentina demostraron que el genotipo 1 (67,6%) es el más prevalente con una prevalencia similar de subtipos 1a y 1b equivalente al 33,3 y 33,5%, respectivamente, seguido por el genotipos 2a/c y 3a con una prevalencia del 14,5%14–17, observándose el genotipo 3 particularmente en drogadictos16. También se han detectado infecciones mixtas18.
Los pacientes con insuficiencia renal crónica en tratamiento con hemodiálisis constituyen un grupo de alto riesgo para la infección de VHC y esta es la causa más frecuente de enfermedad hepática en ellos. La infección crónica por VHC en estos pacientes, al igual que en la mayoría de los individuos infectados con dicho virus, tiene una evolución clínica asintomática acompañada de valores de transaminasas normales o fluctuante.
La prevalencia de VHC en este grupo de pacientes está asociada al tiempo de duración de la hemodiálisis y al número de unidades de sangre o hemoderivados recibidos antes de la introducción de la detección de anticuerpos anti-VHC en donantes de sangre entre 1990 y 199219–22. El riesgo de infección es mayor con hemodiálisis que con diálisis peritoneal y se incrementa a medida que aumenta el tiempo de diálisis.
Según un informe de los Centros para el control y la prevención de enfermedades (CDC) la prevalencia de la infección por VHC aumenta un promedio del 12% para pacientes que recibieron hemodiálisis por menos de 5 años al 37% para los que la recibieron durante 5 o más años23.
A estos pacientes se les realiza la determinación del nivel de aminotransferasas (ALT) en suero antes del inicio de la diálisis y mensualmente, y la detección de la respuesta inmunológica humoral contra proteínas virales (anticuerpos anti-VHC) mediante enzimoinmunoanálisis, antes del inicio de la diálisis y después, cada 6 meses para detectar la infección en forma precoz según las recomendaciones del CDC. El enzimoinmunoanálisis para VHC determina anticuerpos de tipo IgG, lo cual explica la existencia de un período de «ventana serológica» de 1-6 meses. Un resultado positivo demuestra el contacto del sistema inmune del paciente con el VHC.
En pacientes inmunosuprimidos (coinfección con el virus de inmunodeficiencia humana, hemodializados) puede no detectarse los anticuerpos anti-VHC (según el CDC, en promedio el 3,4% de los pacientes hemodializados son anti-VHC negativo a pesar de tener viremia)23, aunque hay que tener en cuenta que esto puede estar sobreestimado ya que en esos pacientes no se realiza un seguimiento para evaluar la seroconversión9,24. La confirmación de la replicación viral en pacientes con anticuerpos anti-VHC positivos por enzimoinmunoanálisis se realiza mediante la determinación de la existencia del ácido ribonucleico (ARN) viral en suero o plasma (viremia) por medio de la retrotranscripción de la región 5′ no codificante del virus (5’NC), seguida de una amplificación génica por medio de la reacción en cadena de la polimerasa anidada (RT-PCR anidada). Además, la detección de genoma viral se aplica también para definir infección por VHC en hepatitis agudas durante el período ventana cuando aún no son positivos los anticuerpos anti-VHC25.
La determinación del genotipo de VHC ha adquirido relevancia clínica y epidemiológica ya que se ha relacionado con los diferentes genotipos con una distribución geográfica particular, con la vía de transmisión de la infección y con la respuesta al tratamiento antiviral. Además, a diferencia del virus de hepatitis B, la infección con un genotipo o subtipo no protege contra sobreinfecciones o reinfecciones (infección con otro subtipo del VHC durante la infección crónica por el subtipo/cepa original, o tras su eliminación, respectivamente)12,26.
En Argentina en el año 2006 se informó una prevalencia de anticuerpos anti-VHC en pacientes en hemodiálisis del 11-24% (51% entre 1992 y 1994) y una incidencia anual del 0,05-2,7%. A pesar del estudio sistemático de anticuerpos anti-VHC en donantes y de la utilización de eritropoyetina, la infección por VHC sigue siendo un problema relevante ya que se han detectado infecciones por VHC en hemodializados sin marcadores previos (anticuerpos o ARN-VHC) del virus, y en ausencia de otros factores parenterales, por lo que se sugirió la existencia de una trasmisión nosocomial del VHC de paciente a paciente en los centros de hemodiálisis27. La transmisión nosocomial (horizontal) de VHC constituye la principal vía de transmisión entre estos pacientes y puede prevenirse si se siguen estrictamente las recomendaciones para control de las infecciones de los pacientes hemodializados del CDC23. Si bien el aislamiento no está recomendado para los pacientes infectados por VHC, la determinación de rutina de ALT y de anti-VHC es importante para detectar las transmisiones dentro de un centro y asegurarse de que las precauciones están siendo aplicadas en forma adecuada y continua. Por lo tanto, el adecuado diagnóstico de la infección por VHC del paciente hemodializado y el cumplimiento de las medidas universales de bioseguridad son de suma importancia tanto para el paciente como para los otros que comparten la misma unidad de hemodiálisis23.
Materiales y métodosSe incluyeron en este estudio 113 pacientes con diagnóstico de insuficiencia renal crónica en tratamiento con hemodiálisis durante un lapso mayor a 3 meses, que asisten a 2 centros de hemodiálisis de la ciudad de Posadas (Argentina).
De cada paciente se obtuvo por venopunción: a) una muestra de 5ml de sangre en tubo estéril con anticoagulante EDTA, del cual se separó el plasma en condiciones de esterilidad para efectuar los estudios de biología molecular; y b) una muestra de 5ml de sangre en tubo seco, del cual se separó el suero para la determinación de anticuerpos. Ambas muestras se conservaron a –20°C hasta su procesamiento. Las personas que colaboraron en el estudio concurren diariamente al centro de hemodiálisis y su participación fue voluntaria. Sin embargo, debido a que se trata de un estudio biomédico, se tomaron los recaudos éticos y legales, pidiendo la autorización con un consentimiento escrito informado de cada paciente que se integró al estudio, luego de explicarle los alcances del proyecto en cuestión.
Se obtuvo la siguiente información de las historias clínicas: sexo, edad, fecha de inicio de hemodiálisis, antecedentes de transfusiones, cirugías (incluyendo trasplante), antecedentes de drogadicción y antecedentes de convivientes con infección por VHC.
Se realizó la detección de anticuerpos anti-VHC de tipo IgG utilizando un ensayo inmunoenzimático de 3.a generación (Wiener laboratorios S.A.I.C.). Este ensayo es un ELISA basado en el principio «sandwich» para la detección de anticuerpos anti-VHC en suero o plasma humano. Se realizó el procedimiento según lo indicado en el manual de instrucciones del fabricante. El equipamiento utilizado fue un lector de placa (como instrumental óptico), la lectura se realizó a 450nm, se relacionó la absorbancia de la muestra respecto al valor cut-off (CN+0,150 D.O., donde CN es el promedio de las lecturas del control negativo) para inferir el resultado de la muestra problema. Se define como zona de indeterminación al cut-off±10%. Se considera como: a) muestra reactiva: aquella con absorbancia superior al límite superior de la zona de indeterminación, b) muestra no reactiva: aquella con absorbancia inferior al límite inferior de la zona de indeterminación, y c) muestra indeterminada: aquella con absorbancia que se encuentra dentro de la zona de indeterminación.
El ARN total fue extraído a partir de 500μl de plasma utilizando un método de partículas de sílice con un kit comercial (Nuclisens Magnetic Extraction Reagents miniMag, Biomérieux, Durham, Inglaterra) y eluyendo con tampón inorgánico en un volumen final de 50μl, según el protocolo del fabricante.
Se determinó la presencia de VHC en las muestras amplificando un fragmento de 251pb de la región 5’NC del genoma viral, mediante RT-PCR anidada. Las secuencias de los cebadores, descrito por Gismondi et al.16, que se usaron para la primera ronda de la PCR fueron las siguientes: sentido 5’-GTGAGGAACTACTGTCTTCACGCAG-3’, y antisentido 5’-TGCTCATGGTGCACGGTCTACGAGA-3’. Para la segunda ronda de PCR la secuencia de cebadores fueron: sentido 5’-TTCACGCAGAAAGCGTCTAG-3’, y antisentido 5’-CACTCTCGAGCACCCTATCAGGCAGT-3’. La mezcla de reacción de RT-PCR, cada 50μl contuvo 50mM ClK, 10mM Tris-ClH (pH=8,4), 1,5mM Cl2Mg, 0,15mM de cada uno de los desoxinucleótidos trifosfato, 1μM de cada iniciador, 1U de Taq ADN polimerasa (Promega®) y 20U de retrotranscriptasa M-MLV (Promega®). Esta mezcla de reacción fue sometida a un ciclo de retrotranscripción a 42°C 15min, luego la primera ronda de PCR constará de un ciclo 95°C 3min, 30 ciclos 95°C 1min, 62°C 1min y un ciclo 72°C 7min. La segunda ronda de PCR se realizó con igual mezcla de reacción que la primera, pero sin la retrotranscriptasa y se sometió a iguales ciclos de amplificación. Los 20μl del producto de amplificación obtenido de la segunda ronda fueron sometidos a electroforesis en gel de agarosa al 2% con 1,4mg/mL de bromuro de etidio16. En los geles se utilizó un marcador de peso molecular de ADN de 100pb para poder inferir el tamaño de las bandas de los productos de amplificación obtenidos, un control positivo y 2 controles negativos (uno de la primera ronda de PCR y el otro de la segunda ronda de PCR).
El producto de amplificación de 251pb de la región 5’NC obtenido por RT-PCR se digirió con enzimas de restricción según lo descrito por Davidson et al.28 y modificaciones16. Los productos de PCR fueron digeridos con HaeIII/RsaI y HinfI/MvaI y se analizaron los productos de restricción por electroforesis en gel de poliacrilamida al 15% en buffer TBE 1 X, para determinar el genotipo viral (genotipos 1 a 6). Para los genotipos 1 y 2-3 se realizó una segunda restricción con BstUI y ScrFI respectivamente y se determinó el subtipo (a-b-c) por la misma técnica. Se utilizó un marcador de peso molecular de ADN de 50 o 25pb para poder inferir el tamaño de los productos de digestión. El gel fue teñido con bromuro de etidio 100μl/mL sin exposición a la luz durante 15min y luego visualizado bajo luz ultravioleta.
Para llevar a cabo el análisis de la información obtenida, se desarrolló un sistema de información en línea que permite la carga sistematizada de los datos del estudio realizado. El sistema permite el análisis computacional y despliegue de información a través de reportes y gráficos estadísticos. Los gráficos estadísticos han sido diseñados con el fin de proveer una lectura simple de los resultados del estudio descrito en este trabajo. Para los análisis estadísticos se utilizó el software InfoStat. Se utilizó la prueba de Chi-Cuadrado para comparar las variables categóricas de muestras independientes. De acuerdo al tamaño de muestra se aplicó el estadístico Chi cuadrado de Pearson, en tablas 2×2, cuando todos los valores esperados bajo la hipótesis de independencia eran mayores o iguales a 5, y se aplicó la prueba de Fisher cuando los valores eran menores de 5. Un valor de p<0,05 se consideró como estadísticamente significativo. Para las variables continuas de muestras independientes, se realizó la prueba no paramétrica U Mann-Whitney, y se consideró como estadísticamente significativo (test de 2 colas) un valor de p<0,05.
ResultadosSe incluyeron un total de 113 pacientes, la edad promedio fue de de 54 años, con una mediana de 56 años. La distribución por sexo fue de 72 (63,7%) varones y 41 (36,3%) mujeres. Todos los pacientes no presentaron antecedentes de tatuajes, piercing, contacto con familiares enfermos de VHC, ni uso de drogas ilícitas y no se encontró coinfección por virus de hepatitis B en ninguno de los casos.
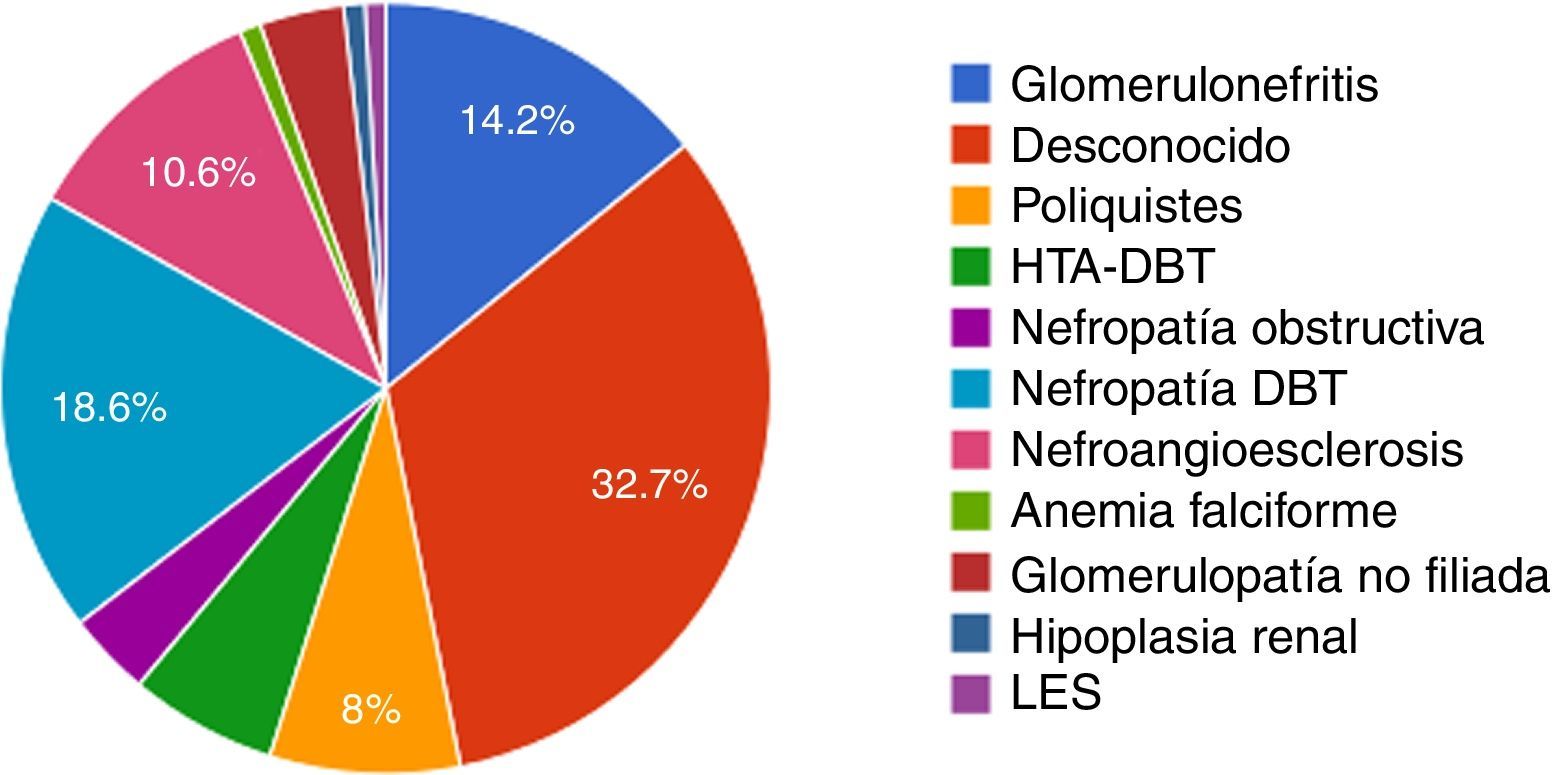
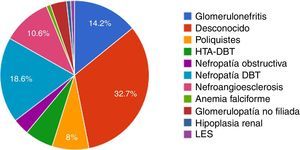
La etiología de la insuficiencia renal crónica por la cual estos pacientes requieren del tratamiento de hemodiálisis se detalla en la figura 1. La causa de insuficiencia renal más frecuente por lo cual estos pacientes requieren del tratamiento de hemodiálisis fue desconocida (32,7%), seguida de la nefropatía diabética (18,6%).
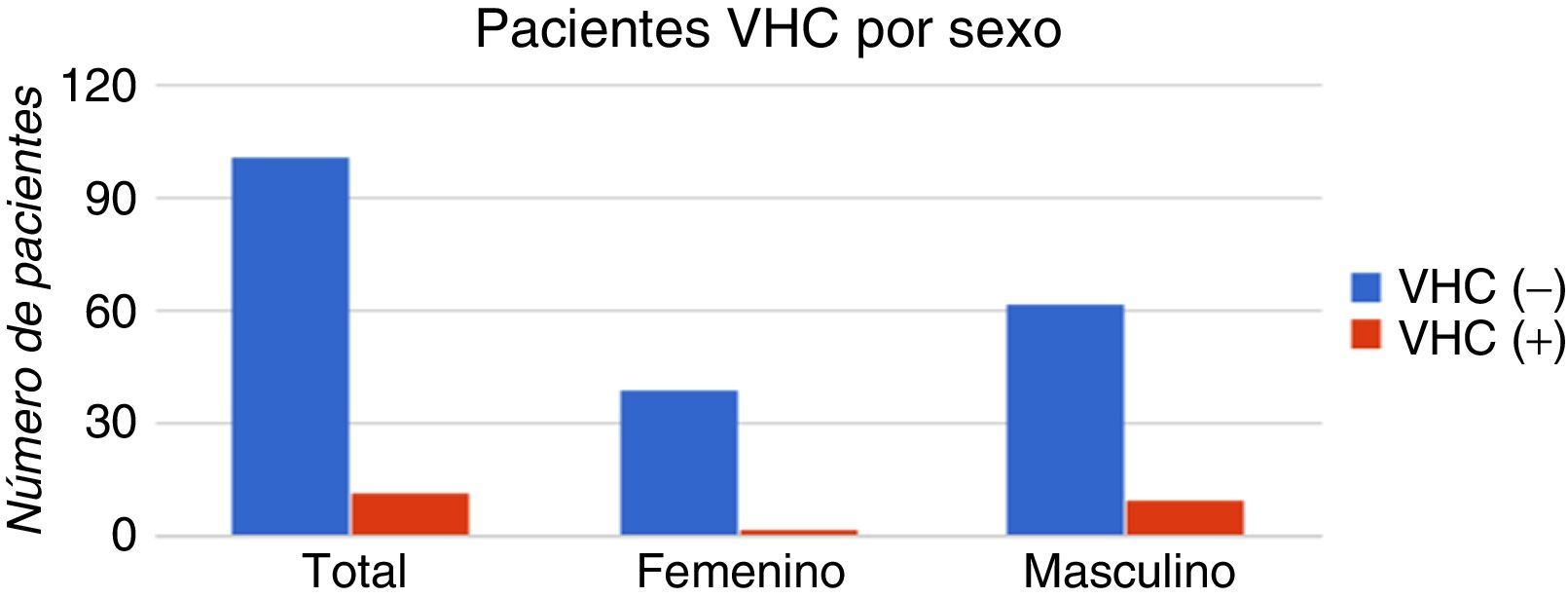
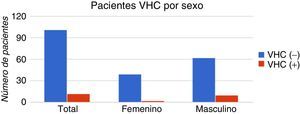
La determinación de anticuerpos anti-VHC mediante ELISA en los pacientes hemodializados dio como resultado 12 (12/113) casos reactivos (anti-VHC [+]), y 101 (101/113) casos no reactivos (anti-VHC [−]). Se registró una prevalencia mayor de casos anti-VHC (+) en varones (10/12) que en mujeres (2/12), pero no hubo diferencia significativa con respecto a la presencia de anti-VHC (p=0,2). En la figura 2 se muestra la distribución de los casos clasificada por sexo.
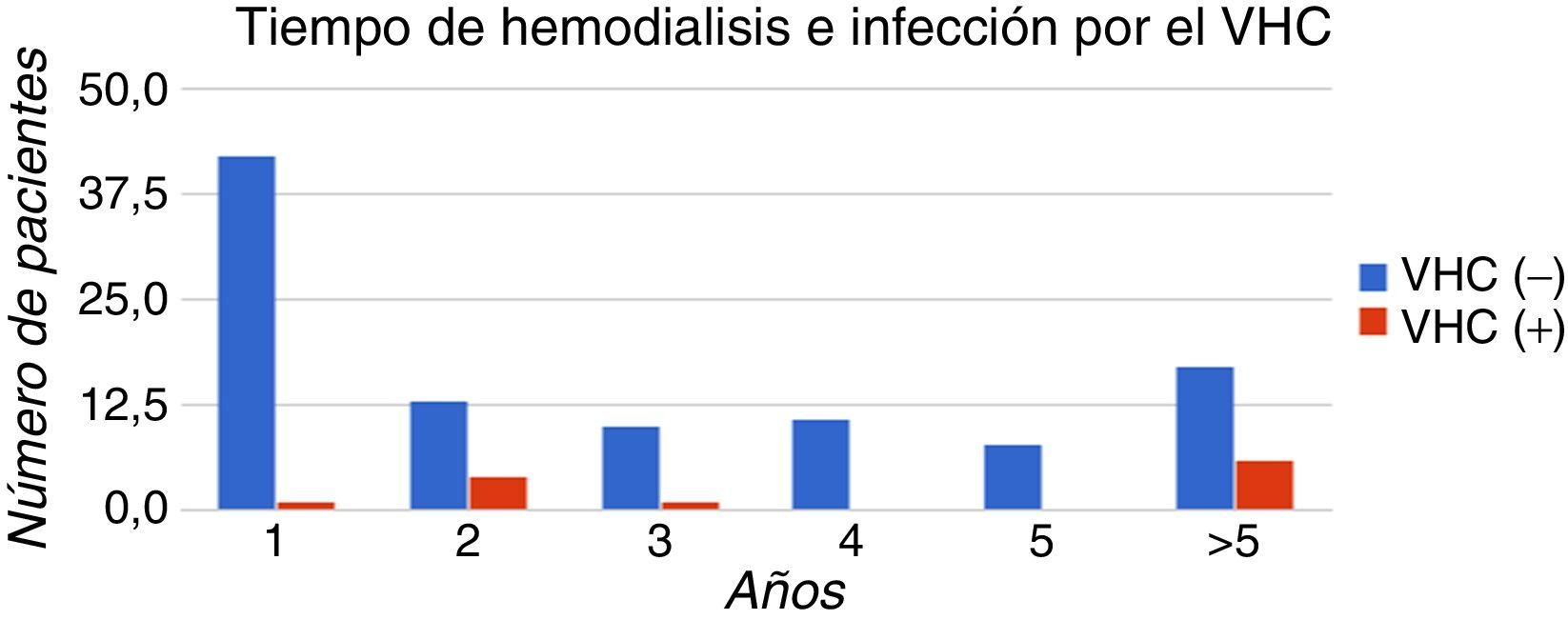
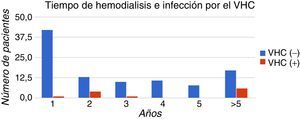
El 50% (6/12) de los pacientes anti-VHC (+) presentó un tiempo promedio de tratamiento de hemodiálisis de 3 veces por semana mayor a 5 años. La correlación del tiempo de hemodiálisis con la presencia de anti-VHC fue estadísticamente significativa (p=0,02). En la figura 3 se muestra la distribución de los casos clasificados por tiempo de hemodiálisis.
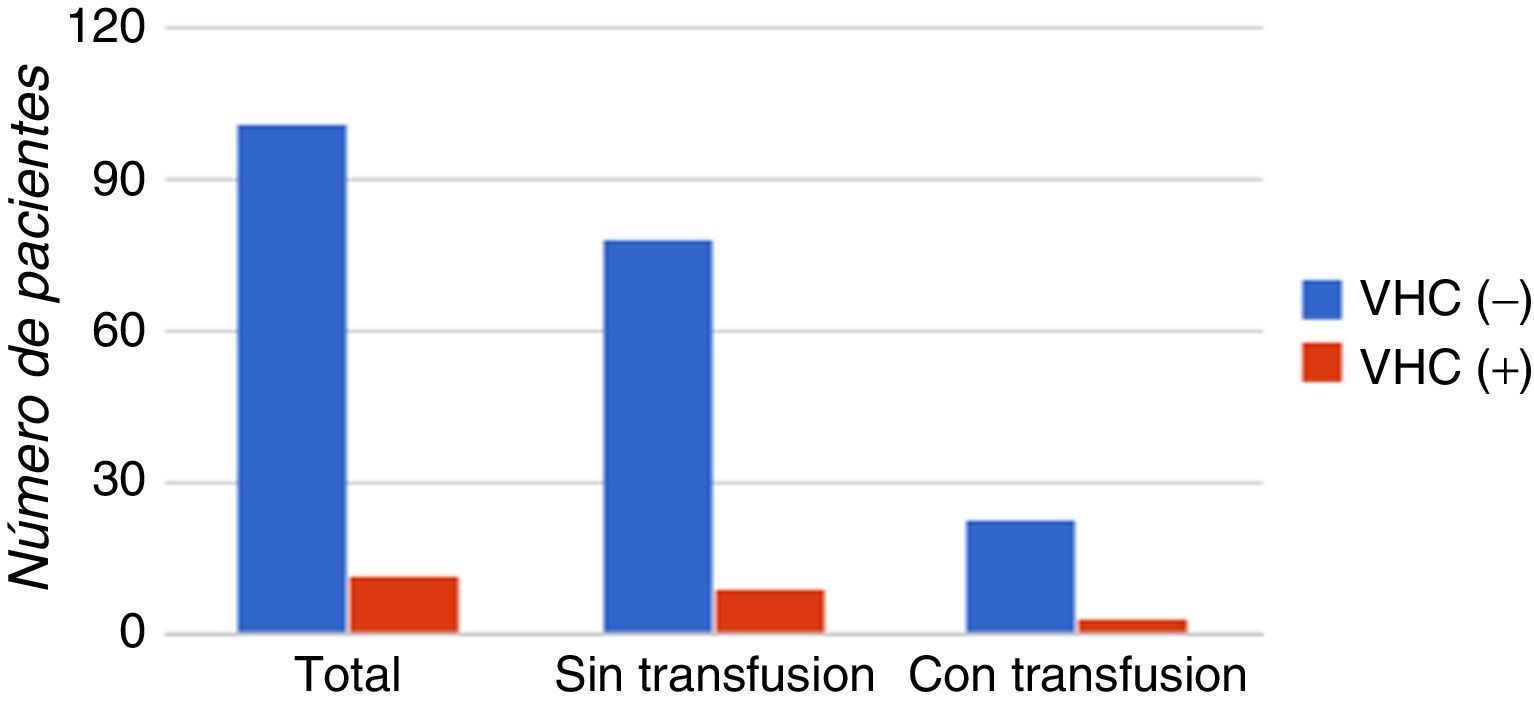
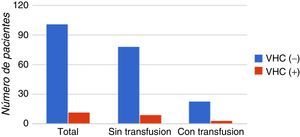
El antecedente de haber recibido transfusiones previas fue observado en el 25% (3/12) de los pacientes anti-VHC (+), mientras que el 75% (9/12) de los pacientes anti-VHC (+) no presentan antecedentes de haber recibido transfusiones. El antecedente de haber recibido transfusiones no mostró una correlación estadística significativa con la presencia de anti-VHC (p>0,9). En la figura 4 se muestra la distribución de los casos con base en los antecedentes de recepción de transfusión.
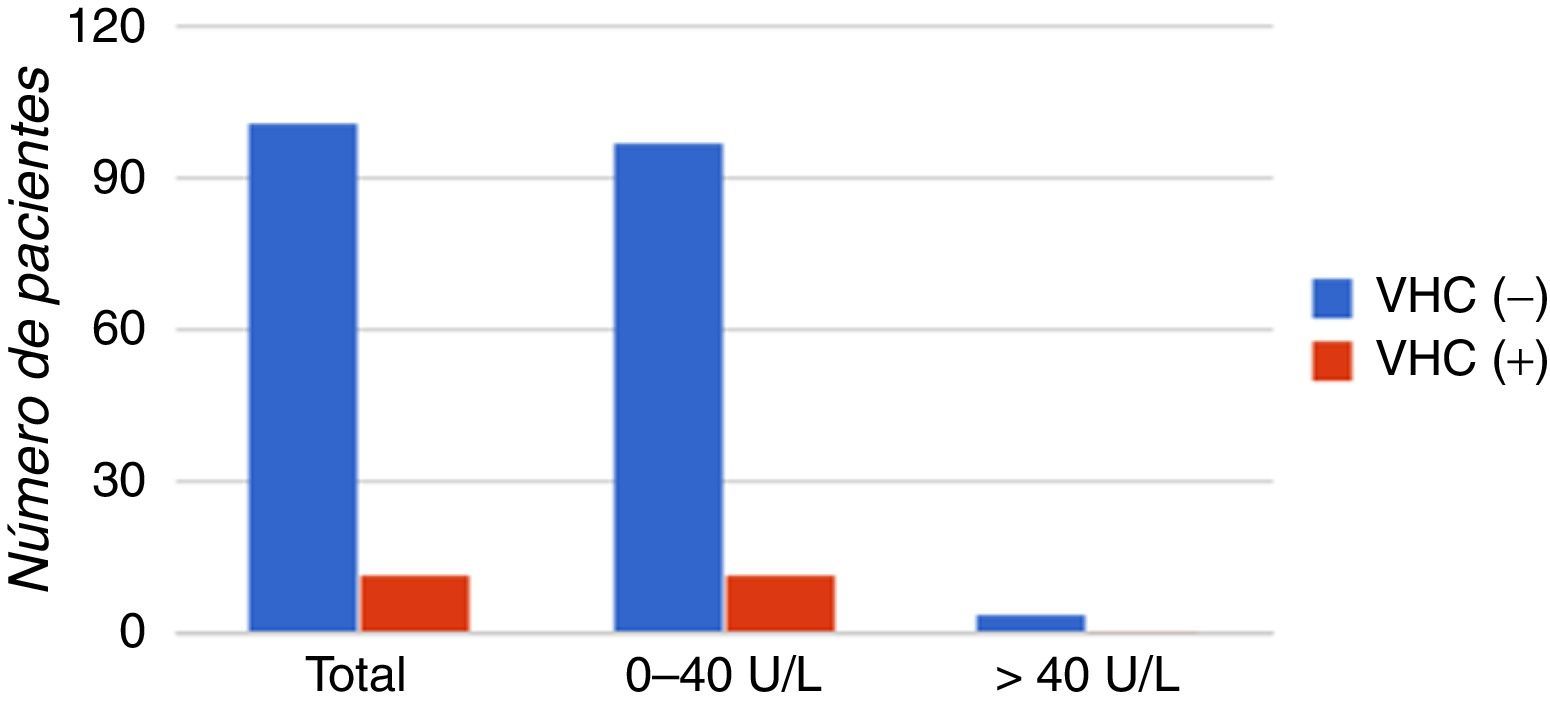
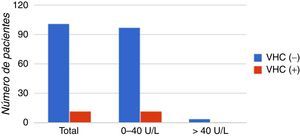
Se observaron valores normales (2-40U/L) de transaminasas tanto en pacientes con anticuerpos reactivos como no reactivos, y la correlación entre estos parámetros no resultó estadísticamente significativa (p>0,9). Este parámetro analizado se muestra en la figura 5.
Se realizó la extracción del ARN de los 12 pacientes con resultado anti-VHC (+), detectándose el genoma del VHC en las 12 muestras por medio de una RT-PCR anidada. La caracterización de los diferentes genotipos fue la siguiente: 7 pacientes con genotipo 1a (7/12) y 5 pacientes con genotipo 2a (5/12).
DiscusiónLos pacientes con insuficiencia renal crónica terminal en tratamiento con hemodiálisis constituyen un grupo de alto riesgo para la infección por VHC. La mayoría de los estudios muestran una fuerte influencia del tiempo transcurrido en hemodiálisis, las transfusiones de sangre y sus derivados, la transmisión intranosocomial y las medidas de bioseguridad sobre la prevalencia e incidencia de la infección por el virus VHC en los enfermos portadores de insuficiencia renal crónica en hemodiálisis29.
El análisis de las muestras de sangre de individuos en hemodiálisis incluidas en este estudio presentó anticuerpos anti-VHC por ELISA en un 10,6% (12/113) de los casos, y la variable período de tiempo que el paciente lleva en hemodiálisis mostró una relación estadísticamente significativa con la infección de VHC. Los resultados obtenidos en nuestro estudio coinciden con lo reportado por el registro Argentino de diálisis crónica donde la prevalencia varía según las provincias entre 1,70 y 21%, y la prevalencia nacional del VHC es del 4,92%, y es mayor, sin alcanzar valores significativos, en varones que en mujeres30. Sin embargo la prevalencia hallada del 10,6% resulta inferior a la prevalencia del 71% que se observó en un estudio realizado en un centro de hemodiálisis de Caracas-Venezuela31, y la hallada en un estudio realizado en Cuba donde la prevalencia de VHC en pacientes hemodializados fue del 90%32, y en el Estado de Santa Catarina-Brasil donde la prevalencia de VHC fue del 33,4% en pacientes hemodializados33. Particularmente, la prevalencia de VHC en pacientes hemodializados del Brasil varía como en Argentina según las regiones (un 23,8% en el nordeste, un 45,5% en el norte, un 46,7% en el oeste medio y un 35,3% en el sudeste21,34) como así también en Perú donde la prevalencia oscila entre el 90 y 4,65%35, y en Uruguay varía del 16 al 3%36.
Curiosamente, en estudios realizados en unidades de hemodiálisis de Cali y Bogotá-Colombia, la prevalencia de anticuerpos anti-VHC fue muy baja (2,9 y 2,7% respectivamente)37,38 comparada con nuestros resultados, sin embargo en Medellín la prevalencia fue elevada (42,2%)39. Posiblemente esta baja prevalencia en las unidades de hemodiálisis de Cali y Bogotá sea el reflejo del estricto control de las medidas universales de bioseguridad que se implementaron desde hace más de una década, y que también se ve reflejado por otro estudio realizado en Colombia en el que se incluyeron pacientes hemodializados donde la prevalencia de VHC fue del 6,1%40.
Se notificaron resultados similares a los nuestros en un estudio realizado en 2 unidades de hemodiálisis de Sao Pablo-Brasil donde se observó una prevalencia del 14,6%41.
Existe una importante variación en la prevalencia de seropositividad para VHC en personas en hemodiálisis según la zona involucrada. En un estudio realizado en pacientes con insuficiencia renal crónica en Bolonia, Italia, se observó un 38% de infección por VHC42, y en un estudio realizado en Japón, se vio una prevalencia del 51,6% en pacientes hemodializados43.
Los distintos genotipos hallados, 1a (7/12) y 2a (5/12), coinciden con los genotipos que prevalecen en la población infectada en Argentina y de acuerdo a la distribución mundial. Específicamente, en un estudio realizado en Córdoba, Argentina por Re et al. observaron que el 75% de los pacientes hemodializados tienen genotipo 244. En otros estudios realizados en Argentina donde incluyeron pacientes hemodializados, la distribución de genotipos de VHC en estos pacientes no era diferente a la de los pacientes que tenían otros factores de riesgo14–16,18,45.
A diferencia de los genotipos hallados en nuestro estudio, en Colombia se observa en pacientes hemodializados los genotipos 1b y 3a46. También en Brasil y Venezuela los genotipos 1b, 3a y 1a predominan en pacientes en hemodiálisis33,47–49.
En otras zonas del mundo como Indonesia predomina el genotipo 1a y 1b50 y en Jordania el predominio de genotipos es 1a, 1b y 451. En pacientes Japoneses los genotipos son 1b, 2a y 2b52. Sin embargo los pacientes hemodializados egipcios tienen un alto predominio de genotipo 4 (84%) seguido del genotipo 153. Los pacientes alemanes al igual que los pacientes franceses tienen un alto predominio del genotipo 1b54,55 y los pacientes Italianos genotipos 1b, 3a y 2a-b56.
La infección por VHC sigue siendo un problema relevante. Si bien el aislamiento no está recomendado para los pacientes hemodializados infectados por VHC, la determinación mensual de ALT y semestral de anti-VHC es importante para detectar las transmisiones dentro de un centro y asegurarse de que las precauciones están siendo aplicadas en forma correcta y continua. Por lo tanto, el adecuado diagnóstico de la infección por VHC del paciente hemodializado y el cumplimiento de las medidas universales de bioseguridad son de suma importancia tanto para el paciente como para los otros que comparten la misma unidad de hemodiálisis.
En este estudio realizado en un grupo de pacientes con insuficiencia renal crónica en tratamiento con hemodiálisis de la ciudad de Posadas (Argentina), la prevalencia de los anticuerpos anti-VHC fue del 10,6% y los genotipos hallados 1a y 2a coinciden con los genotipos que prevalecen en la población infectada en Argentina.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia
Contribución de los autoresKarina Salvatierra: diseño del estudio, procesamiento de muestras, análisis de los datos, discusión de resultados y redacción del manuscrito.
Hector Florez: diseño y análisis de los datos, redacción del manuscrito.
FinanciaciónEste proyecto fue apoyado por la Cátedra de Virología, Facultad de Ciencias Exactas, Químicas y Naturales, Universidad Nacional de Misiones, Posadas, Argentina, y el grupo de investigación «Innovación en Tecnologías de Información (ITI)» de la Universidad Distrital Francisco José de Caldas, Bogotá, Colombia.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses en torno al manuscrito.
Universidad Nacional de Misiones y Universidad Distrital Francisco José de Caldas.