La sensibilidad al gluten no celiaca (SGNC) es la última enfermedad incorporada al grupo de trastornos relacionados con el gluten. Esta revisión aborda la evidencia sobre su etiología, diagnóstico diferencial y sintomatología. Aunque la SGNC se define por una reacción al gluten, se han descrito otros posibles mecanismos etiopatogénicos, como una respuesta inadecuada a otros componentes del trigo o a los FODMAP, extendiéndose últimamente el término sensibilidad al trigo no celiaca. Existen resultados contradictorios sobre la validez del protocolo diagnóstico de los expertos de Salerno. La evidencia sobre biomarcadores diagnóstico para la SGNC escasea, aunque algunos estudios señalan los siguientes: anticuerpos antigliadina, zonulina, prueba ALCAT, micro-ARN, incARN y ciertas citoquinas. En la SGNC, el dolor abdominal y la fatiga son los síntomas más comunes. Además, es frecuente la alteración del estado nutricional. En conclusión, se necesita más investigación sobre la SGNC para mejorar nuestro conocimiento de su etiopatogenia y clínica.
Non-celiac gluten sensitivity (NCGS) is the latest pathology incorporated into the group of gluten-related disorders. This review addresses the evidence on its etiology, differential diagnosis and symptomatology. Although NCGS is defined by a reaction to gluten, other possible etiopathogenic mechanisms have been described, such as an inadequate response to other components of wheat or to FODMAPs, with the term non-celiac sensitivity to wheat recently being extended. There are contradictory results on the validity of the diagnostic protocol of the Salerno experts. Evidence on diagnostic biomarkers for NCGS is scarce, although some studies indicate the following: antigliadin antibodies, zonulin, ALCAT test, micro-RNA, incRNA and certain cytokines. In NCGS, abdominal pain and fatigue are the most common symptoms. In addition, altered nutritional status is common. In conclusion, more research on NCGS is needed to improve understanding of its etiopathogenesis and clinical features.
Los trastornos relacionados con el gluten (TRG) suponen un creciente e importante problema de salud. Dichos trastornos pueden ser clasificados en 3 grupos: 1) las respuestas alérgicas, 2) las enfermedades autoinmunes, como la dermatitis herpetiforme, la ataxia por gluten y la enfermedad celiaca (EC) y 3) la sensibilidad al gluten no celiaca (SGNC), el TRG más recientemente comunicado.
La SGNC se caracteriza por una reacción al gluten, tanto intestinal como extraintestinal, en pacientes que mejoran clínicamente con una dieta sin gluten (DSG)1–3. La prevalencia de esta enfermedad no está bien definida, si bien un estudio en este sentido determinó que hasta el 13% de la población tenía una sensibilidad al gluten auto-diagnosticada, que además se manifiesta más en las mujeres4. Aunque el concepto de SGNC fue acuñado por primera vez hace más de 40 años5, aun no existe un consenso claro sobre la etiopatogenia, el diagnóstico y el tratamiento de esta enfermedad. La variedad de síntomas, su impacto en la calidad de vida y su estimada elevada prevalencia reflejan la necesidad de estudio. Aunque existe una revisión sobre esta enfermedad relativamente reciente6, esta es poco exhaustiva en: 1) la descripción de los síntomas, no incluyendo un análisis de la prevalencia de los mismos, 2) el diagnóstico diferencial con otras enfermedades relacionadas y 3) la revisión de los biomarcadores con utilidad diagnóstica. Por este motivo, el objetivo de este trabajo fue resumir de manera crítica la información clínica actual disponible sobre la SGNC.
Metodología de la búsqueda bibliográficaLa búsqueda se llevó a cabo en 3 bases de datos diferentes: Medline (a través del buscador de Pubmed), Scopus y Web of Science, y en todas ellas se siguieron los mismos criterios de búsqueda. En las bases de datos Scopus y Web of Science la búsqueda por defecto se realiza en título, abstract y keywords; mientras que en Pubmed se efectúa en todos los campos. Por tanto, para aunar criterios, en esta última, se seleccionó la opción de realizar la búsqueda en título y resumen. La búsqueda se realizó usando el algoritmo siguiente: «non-celiac gluten sensitivity» OR «non-celiac wheat sensitivity». La búsqueda se realizó el 22 de febrero de 2021.
Se incluyeron estudios publicados en idioma español e inglés, y se excluyeron artículos basados en casos inusuales y artículos centrados exclusivamente en otras enfermedades relacionadas con el gluten.
Resultados y discusiónEtiología de la sensibilidad al gluten no celiacaPor definición, la SGNC consiste en una reacción patológica a la ingesta de gluten en pacientes sin EC. Pero algunos estudios han demostrado que un cierto número de pacientes diagnosticados con SGNC pueden tolerar la ingesta de gluten. Moleski SM et al. evaluaron los efectos de la ingesta baja (0,2g/día) y alta (2g/día) de gluten en pacientes con SGNC, no observando un empeoramiento significativo de los pacientes en comparación con el grupo control sano. Si bien los resultados de este estudio están fuertemente limitados por las dosis de gluten en ambos grupos de intervención, muy bajas en comparación con las recomendaciones de los expertos de Salerno (8g/día)7.
Con un objetivo similar, Roncoroni L et al. analizaron la respuesta sintomática de 24 pacientes con SGNC a dosis crecientes de gluten: primera semana: 3,4-4g/día; segunda semana: 6,7-8g/día; y tercera semana: 10-13g/día. Un subgrupo respondió de forma inmediata y adversa a las dosis bajas, refiriendo un empeoramiento de su bienestar general y su calidad de vida; por el contrario, otros pacientes pudieron enfrentarse a dosis más altas sin manifestar ningún efecto desfavorable8. De hecho, la evidencia actual nos conduce a pensar que los pacientes con SGNC pueden llevar una dieta menos estricta, en la que algunos de ellos podrían valorar una ingesta determinada de gluten evitando la aparición de síntomas9. Estos resultados, por otro lado, ponen en evidencia la teoría etiológica de la SGNC, y abren la puerta a otras posibles causas de este trastorno.
Papel de los FODMAPLos FODMAP (oligosacáridos, disacáridos, monosacáridos y polioles fermentables) son hidratos de carbono no digeribles10 que se encuentran en una amplia variedad de alimentos extensamente consumidos como frutas, verduras, legumbres, cereales, lácteos y derivados, edulcorantes y miel10,11. La evidencia mostrada por ciertos estudios sugiere que los FODMAP en vez de o además del gluten, podrían ser el estímulo que desarrolla la respuesta patológica en individuos con SGNC. Así, los síntomas gastrointestinales de algunos pacientes con SGNC parecen mejorar al seguir una dieta baja en FODMAP12,13. A su vez, la sensibilidad a los FODMAP podría explicar el recrudecimiento de síntomas reportado tras la ingesta de harina sin gluten en casi la mitad de sujetos con SGNC en el ensayo cross-over doble-ciego de Zanini B et al.14. Por otro lado, en un estudio donde se comparó el efecto de la ingesta de gluten con el de fructanos (un tipo de FODMAP) en pacientes con SGNC auto-diagnosticada, se observó que la intensidad de los síntomas registrada tras la ingesta de fructanos (puntuación Gastrointestinal Symptoms Rating Scale [GSRS]=38,6±12,3) fue mayor que tras la ingesta del gluten (33±13,1), siendo la diferencia estadísticamente significativa15. De hecho, la DSG lleva implícita una reducción parcial de los FODMAP16, ya que se descartan alimentos que los contienen como el trigo o el centeno11, lo cual podría explicar la mejoría sintomática en pacientes con SGNC al seguir una DSG sin que necesariamente fuese el gluten el origen de la enfermedad.
Alternativamente, un estudio reciente ha propuesto una etiología multifactorial de la SGNC, con implicación de una respuesta inmune al gluten, una alteración de la microbiota y un efecto de los FODMAP16. Así, Dieterich W et al. concluyeron que cuando los pacientes con SGNC reducen la ingesta de FODMAP, la intensidad de sus síntomas gastrointestinales disminuye de forma significativa, produciendo una mejora general y del bienestar psicológico aumentando esta al excluir también el gluten de la dieta16. Finalmente, otra de las posibles hipótesis planteadas para la etiología de la SGNC por Biesiekierski JR et al. es que el gluten induzca síntomas únicamente en presencia de FODMAP12.
Diagnóstico de la sensibilidad al gluten no celiacaEn la actualidad, no existen manifestaciones clínicas y biomarcadores específicos definidos para el diagnóstico de la SGNC17–19. En consecuencia, su diagnóstico se basa en criterios de exclusión y en la valoración de las respuestas sintomáticas17, por lo que existe la necesidad de buscar alternativas que faciliten un diagnóstico claro, objetivo y definitivo19,20. Pese a todo, el criterio más aceptado a día de hoy para el diagnóstico de la SGNC es el establecido en el protocolo de los expertos de Salerno19. Este protocolo no puede utilizarse en la práctica clínica, por su enorme complejidad, pero su valor radica en que permite la selección homogénea de pacientes para ensayos clínicos o estudios observacionales, dada la elevada heterogeneidad de la SGNC.
Protocolo de los expertos de SalernoEl primer paso consiste en someter a un paciente que llevará al menos 6 semanas manteniendo una dieta con gluten (DCG), a una DSG durante otras 6 semanas. La respuesta clínica a esta nueva dieta se evaluará semanalmente mediante cuestionarios donde el paciente registrará la puntuación GSRS (con escala modificada) para uno o hasta 3 síntomas principales, comparando los síntomas basales, anteriores a la DSG, con los que vayan surgiendo durante la DSG. Un paciente se considerará respondedor cuando se produzca una reducción de al menos un 30% de la intensidad de 1-3 síntomas principales con respecto al valor basal, o al menos en un síntoma sin que exista un empeoramiento en los demás síntomas, durante como mínimo 3 de las 6 semanas de seguimiento19.
A continuación, para la confirmación del diagnóstico de SGNC en pacientes que responden al tratamiento de DSG, se lleva a cabo un ensayo controlado a doble ciego contra placebo (DCCGP, por el término en inglés), con ingesta de gluten. El ensayo consiste en ingerir una dosis de gluten de 8g al día durante una semana mientras se sigue una DSG, seguida de una semana de lavado manteniendo la DSG, y posteriormente, el cruce con placebo junto con la DSG. La evaluación de los síntomas en lugar de ser semanal como en el primer paso, en este ensayo es diaria. Al igual que en el paso uno, para identificar al paciente como SGNC (respondedor), deberá producirse una variación de la intensidad de los síntomas de al menos un 30% entre la semana en la que se administra el gluten y la semana en la que se administra el placebo19.
Limitaciones del protocolo de SalernoSi bien esta parece ser la mejor alternativa diagnóstica de SGNC hasta el momento en un contexto de investigación, no está exenta de limitaciones19, ya que los resultados de algunos estudios conducen a una dudable fiabilidad de la misma14,20,21. Así, Elli L et al. demostraron que la mayoría de los pacientes (75,5%) que sufren síntomas gastrointestinales recurrentes, llevan una DCG y previamente se les ha descartado EC y alergia al trigo, responden favorablemente a una DSG; mientras que tan sólo una minoría (14% de la cohorte) responde al ensayo DCCGP y son finalmente diagnosticados con SGNC20. Estos resultados van en línea con los de Di Stefano M et al.21 y Zanini B et al. publicados en 201514, en los que partiendo de pacientes que cumplían los criterios de Salerno para el diagnóstico de la SGNC y se consideraban respondedores a la DSG, tan solo el 3414 o el 52%21 de los participantes respectivamente fueron finalmente diagnosticados con SGNC tras la prueba ciega de ingesta de gluten. Es cierto que el tamaño muestral de estos 2 últimos estudios es reducido; sin embargo, concuerdan con el de Kabbani TA et al., en el que participaron 238 pacientes con síntomas gastrointestinales que responden a la DSG, de los cuales, al enfrentarse a la prueba del gluten, únicamente el 52,5% fueron diagnosticados con SGNC9. Una posible explicación para los individuos que responden a la DSG sin tener realmente SGNC (puesto que no responden a la ingesta de gluten), es que el propio seguimiento médico que se establece al participar en el estudio fuese el responsable de la mejoría clínica en pacientes con una enfermedad funcional digestiva no relacionada con el gluten.
Otra limitación observada en el diagnóstico de la SGNC siguiendo el protocolo de Salerno es el efecto «nocebo», según el cual los pacientes podrían anticiparse a las posibles consecuencias de la prueba ciega del gluten y mostrar sintomatología en respuesta al placebo11,12,15,20,21. En una línea similar, en el estudio realizado por Zanini B et al. en 201514, en el cual participaban sujetos SGNC que llevaban una DSG por considerarse respondedores de la misma, el 16% de la muestra no reaccionó a ninguna de las ingestas ciegas, placebo o gluten, lo que sugiere que los síntomas de la vida cotidiana al ingerir gluten podrían ser una consecuencia de una anticipación psicológica14.
Estos resultados junto a la creciente evidencia de un posible papel de los FODMAP en la etiología de la enfermedad (cómo se ha descrito anteriormente), han debilitado el empleo del término SGNC1,12,14,16 y han hecho que cada vez más investigadores se inclinen a denominar este trastorno como sensibilidad al trigo no celiaca17,20,22,23.
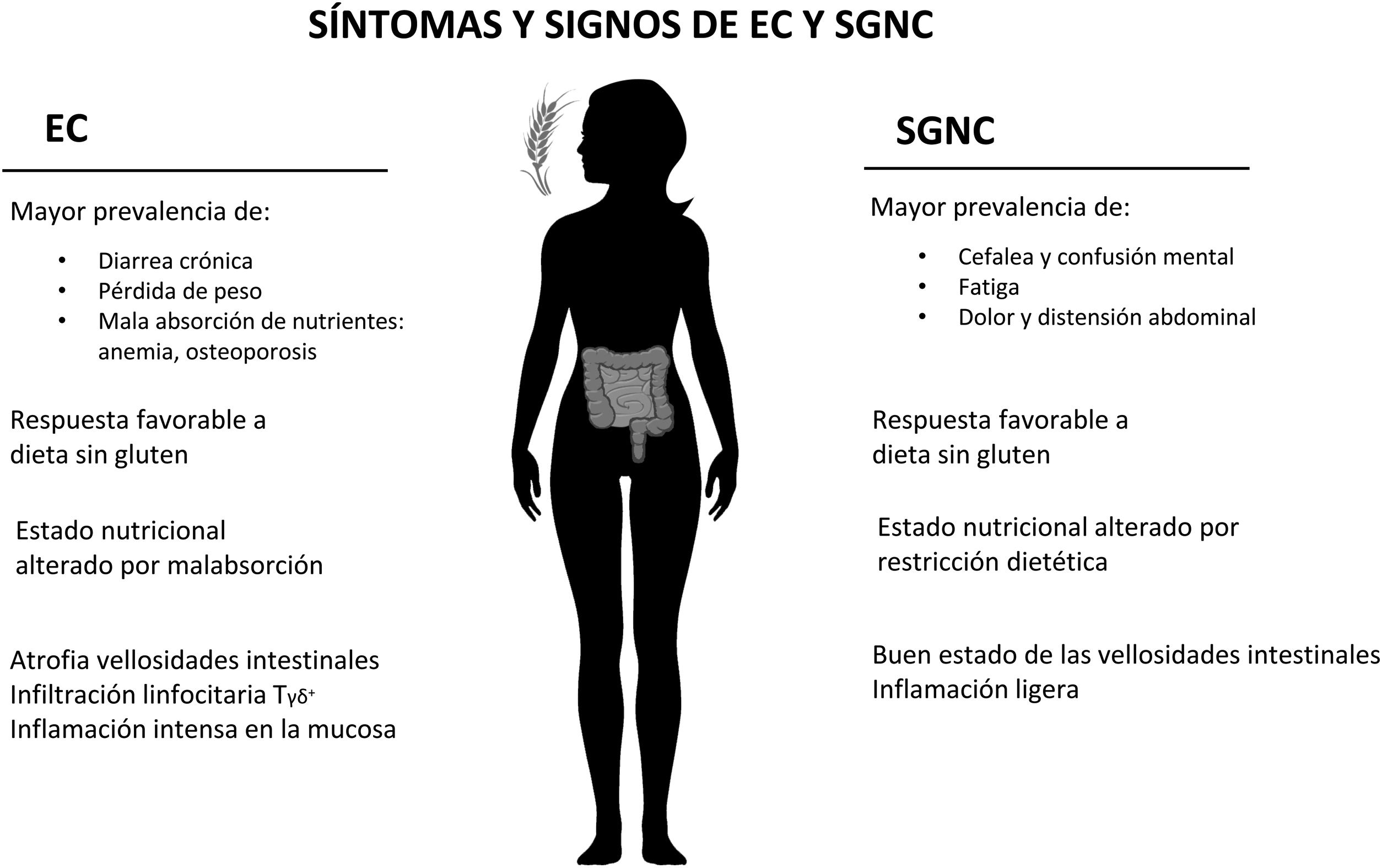
Diferenciación clínica y diagnóstica con otras enfermedadesSensibilidad al gluten no celiaca y enfermedad celiacaDesde el punto de vista clínico, las manifestaciones de la EC y la SGNC son similares, lo que en determinadas circunstancias puede suponer un desafío en el diagnóstico diferencial7,11, teniendo como consecuencia que pacientes con SGNC sean equívocamente diagnosticados con EC9. Así, la respuesta favorable a una DSG es común en EC y SGNC9,24. No obstante, en el diagnóstico inicial se han observado diferencias en la prevalencia de la sintomatología intestinal y extraintestinal (fig. 1); la SGNC presenta mayor prevalencia de episodios de dolor y distensión abdominal, así como fatiga, cefalea y confusión mental 1; por otro lado, en la EC se observó mayor prevalencia de déficit nutricionales asociados a una malabsorción de nutrientes como anemia y osteoporosis, así como diarrea crónica y pérdida de peso1,9,25. Además, al reintroducir el gluten en la dieta de pacientes con SGNC, estos desarrollaron síntomas músculo esqueléticos, cardiovasculares y gastrointestinales con mayor intensidad que los pacientes con EC o controles sanos26. Sin embargo, este último estudio debe interpretarse con precaución, ya que solo los pacientes con EC que no presentaron síntomas graves fueron incluidos y los sujetos con SGNC no tenían un diagnóstico confirmado.
En relación con los factores genéticos, es ampliamente aceptada una relación de los genotipos HLA-DQ2 y HLA-DQ8 con el riesgo de sufrir EC9,15,27, estando presente en un 95% de los pacientes con EC. Sin embargo, su asociación con la detección de la SGNC no está clara. Por un lado, se ha detectado una prevalencia de HLA-DQ2 y DQ8 en sujetos con SGNC que va desde un 32%11 hasta un 53%9, y algunos estudios sugieren la detección de HLA-DQ2 y DQ8 como un posible marcador de SGNC22,27. Por el contrario, otros estudios han propuesto la ausencia de este genotipo como un factor diagnóstico de pacientes con SGNC9,11. Para ello se basan en que la prevalencia de este tipo de genotipo en la población general (30-40%) es similar o solo ligeramente inferior a la encontrada en los pacientes con SGNC. Además, estos valores algo mayores en los pacientes con SGNC podrían deberse a un sesgo de selección, ya que entre el 12 y el 25% de los pacientes con SGNC tienen familiares de primer o segundo grado con EC y, por tanto, con genotipo HLA-DQ2 y DQ89,11,15,28, lo cual podría favorecer una mayor consulta al clínico y una mayor probabilidad de diagnóstico.
Otro de los grandes rasgos diferenciales de EC y SGNC es el estado de las vellosidades intestinales. En el caso de los pacientes con SGNC, las vellosidades suelen encontrarse en buen estado. De hecho, en más de la mitad de los pacientes son normales11,15,29,30, existiendo bastante consenso en la literatura sobre esto. En consonancia con esto, en un estudio muy reciente no se encontraron diferencias en los niveles séricos de marcadores de daño epitelial (ocludina, claudina-1, porteína de unión a lipopolisacárido, proteína de unión a ácidos grasos intestinal, péptidos de la familia de la zonulina) entre pacientes con SGNC y controles sanos31. Una posible explicación es el menor grado de inflamación encontrado en pacientes con SGNC comparados con pacientes con EC. Así, estudios de inmuno-histoquímica de la mucosa intestinal mostraron que los pacientes con SGNC tenían una mayor producción de algunas citoquinas que los controles, pero menor que los pacientes con EC32,33. De manera similar, un estudio reciente realizado con microscopio electrónico de transmisión sí ha reportado cierto nivel de daño en la barrera intestinal de pacientes con SGNC, comparado con controles sanos34, pero a un nivel menor que en los pacientes con EC no tratada. Hasta donde las autoras de esta revisión han podido saber, solo hay un estudio que haya mostrado niveles similares de permeabilidad intestinal entre pacientes con SGNC y EC activa, siendo en ambas condiciones mayores que los de los controles sanos35. En cualquier caso, cabe destacar que fue un estudio ex vivo de bajo tamaño muestral (n=6 para cada grupo) realizado con explantes de biopsias duodenales en los que se midió la permeabilidad intestinal tras incubación con gliadina.
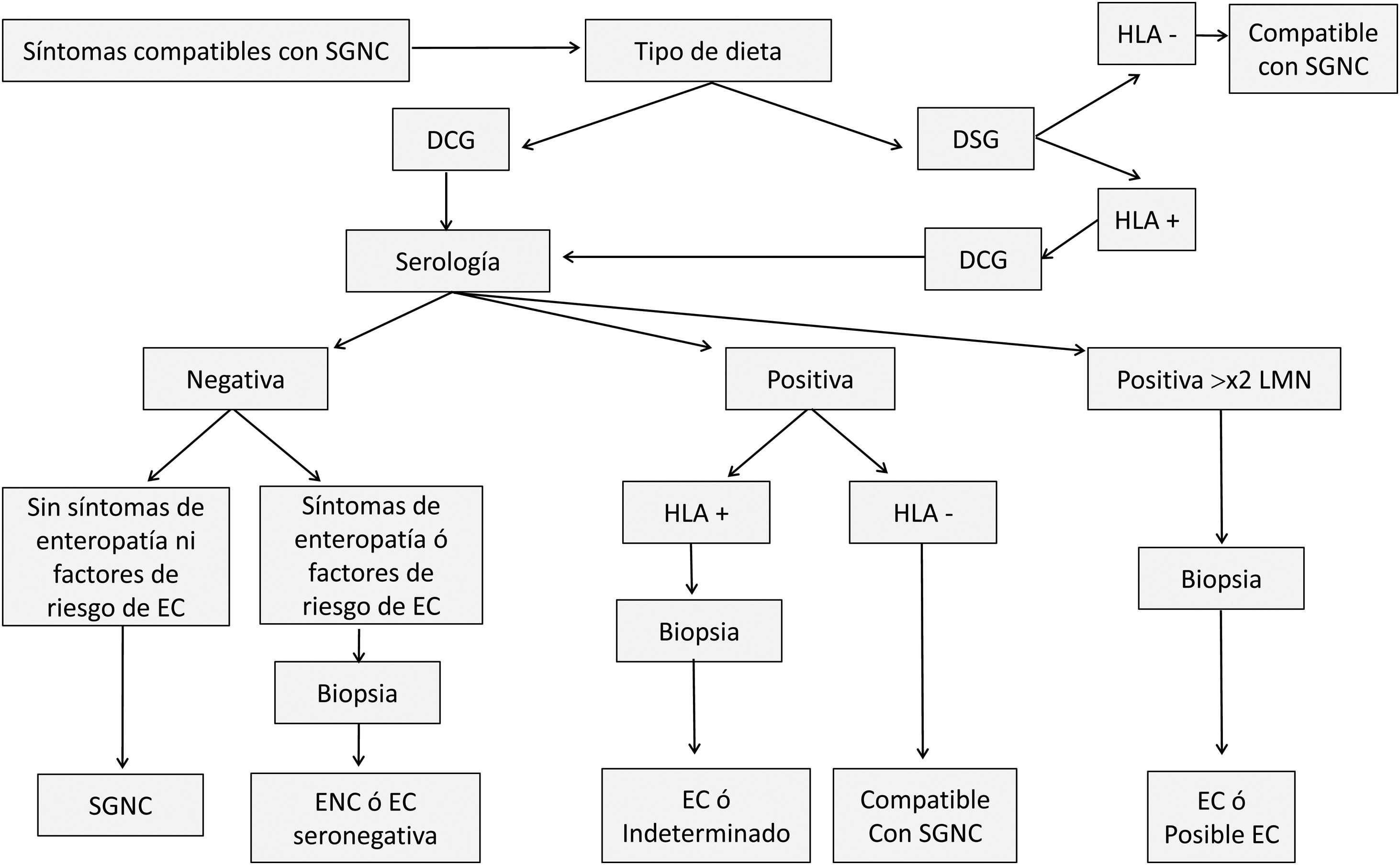
Se ha propuesto un modelo de diagnóstico diferencial de la EC y la SGNC, que se resume en la figura 2 y en la tabla 1, adaptado del propuesto por Kabbani et al.9, y que intenta minimizar el número de pruebas invasivas. El protocolo varía según la dieta del paciente. Si no ha iniciado aún una DSG, el diagnóstico comienza con una prueba serológica de EC, la cual detecta anticuerpos anti-transglutaminasa tisular IgA o anticuerpos anti-péptidos desaminados de gliadina IgA/IgG. Se estima que alrededor del 2-15% de pacientes con EC tienen una serología negativa36. En SGNC se ha reportado serología negativa para anticuerpos anti-transglutaminasa tisular IgA y resultados variables anticuerpos anti-péptidos desaminados de gliadina IgA/IgG (revisado en Elli et al.37 y detallado en el apartado Histología asociada a la SGNC). Dependiendo del resultado, se siguen 3 estrategias diagnósticas; así los valores que dupliquen el rango superior normal son considerados compatibles con la EC y se procede a realizar una biopsia para confirmar el diagnóstico. Con una serología positiva, pero que no alcance el doble de lo normal, se analizan los genotipos HLA-DQ2 y DQ8, y si no se detectan, este resultado sería compatible con un diagnóstico de SGNC. Los pacientes que presentan una serología negativa junto con la ausencia de factores de riesgo para la EC y sin síntomas compatibles con una enteropatía, son diagnosticados como SGNC con una especificidad de diagnóstico del 100% y la razón de verosimilitud positiva del 80,9%. Por último, si el paciente ya había iniciado una DSG se realiza un análisis del genotipo asociado con la EC, la ausencia de HLA-DQ2 y HLA-DQ8 determina un diagnóstico compatible con SGNC. Así, siguiendo este modelo, los autores encontraron una elevada especificidad en el diagnóstico evitando en determinados casos la realización de una endoscopia en el diagnóstico de SGNC.
Esquema de pruebas diagnósticas para diferenciar la SGNC de la EC.
Fuente: adaptado de Kabbani et al.9.
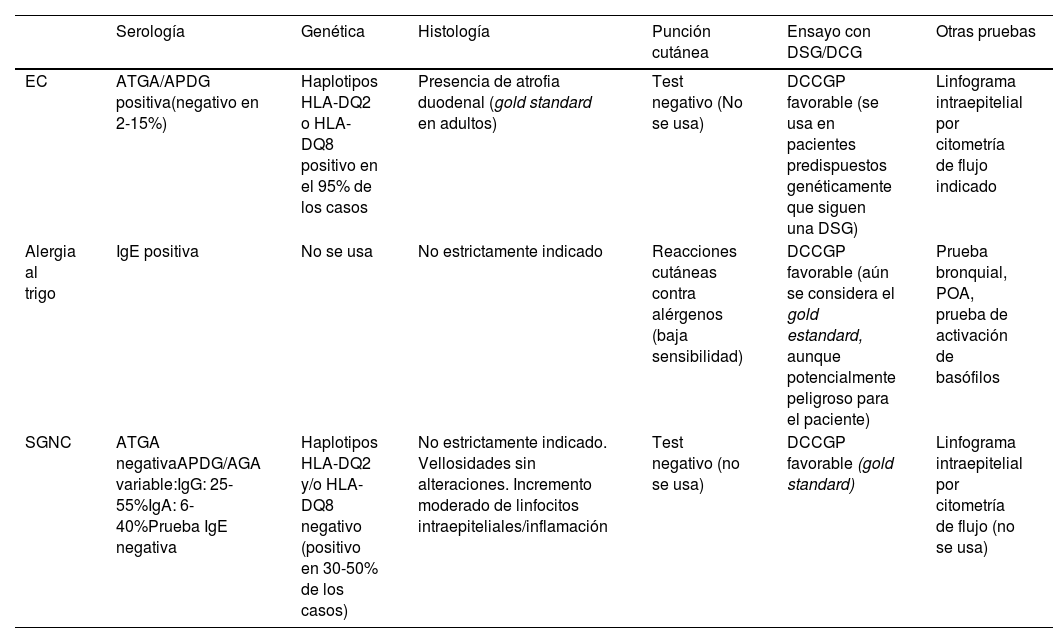
Pruebas diagnósticas para los trastornos relacionados con el gluten
| Serología | Genética | Histología | Punción cutánea | Ensayo con DSG/DCG | Otras pruebas | |
|---|---|---|---|---|---|---|
| EC | ATGA/APDG positiva(negativo en 2-15%) | Haplotipos HLA-DQ2 o HLA-DQ8 positivo en el 95% de los casos | Presencia de atrofia duodenal (gold standard en adultos) | Test negativo (No se usa) | DCCGP favorable (se usa en pacientes predispuestos genéticamente que siguen una DSG) | Linfograma intraepitelial por citometría de flujo indicado |
| Alergia al trigo | IgE positiva | No se usa | No estrictamente indicado | Reacciones cutáneas contra alérgenos (baja sensibilidad) | DCCGP favorable (aún se considera el gold estandard, aunque potencialmente peligroso para el paciente) | Prueba bronquial, POA, prueba de activación de basófilos |
| SGNC | ATGA negativaAPDG/AGA variable:IgG: 25-55%IgA: 6-40%Prueba IgE negativa | Haplotipos HLA-DQ2 y/o HLA-DQ8 negativo (positivo en 30-50% de los casos) | No estrictamente indicado. Vellosidades sin alteraciones. Incremento moderado de linfocitos intraepiteliales/inflamación | Test negativo (no se usa) | DCCGP favorable (gold standard) | Linfograma intraepitelial por citometría de flujo (no se usa) |
AGA: anticuerpos anti-gliadina IgA; APDG: anticuerpos anti-péptidos desaminados de gliadina IgA/IgG; ATGA: anticuerpos anti-transglutaminasa IgA; DCCGP: ensayo controlado a doble ciego contra placebo; DSG: dieta sin gluten; EC: enfermedad celiaca; POA: provocación oral con alimentos; SGNC: sensibilidad al gluten no celiaca.
Otras enfermedades relacionadas con el gluten y que deben excluirse para el diagnóstico diferencial de SGNC son la alergia al trigo y el síndrome de intestino irritable (SII). La alergia al trigo representa otro tipo de reacción inmunológica adversa a la ingestión de proteínas presentes en el trigo y otros cereales. Las IgE median la respuesta inflamatoria a diferentes proteínas alergénicas (alfa-amilasa/inhibidor de tripsina, proteína de transferencia de lípidos no específica, gliadinas y gluteninas de elevado peso molecular)37,38. El diagnóstico de esta enfermedad se basa convencionalmente en una prueba de punción cutánea, una prueba de anticuerpos IgE y en pruebas funcionales, tales como la prueba bronquial para el asma del panadero, el ensayo controlado a doble ciego contra placebo o la provocación oral con alimentos. Pero ninguna de ellas está exenta de inconvenientes. Las 2 primeras tienen una insatisfactoria predictibilidad diagnóstica. Y las pruebas funcionales poseen un riesgo de reacciones severas, así como dificultad para utilizarlas en la práctica clínica diaria37. Como alternativa surge la prueba de activación de basófilos por citometría de flujo, una técnica funcional in vitro que se utiliza cada vez más para el diagnóstico de la alergia alimentaria37,39.
La sintomatología de la SGNC se solapa también con la del SII23,40, una condición compleja y multifactorial de a veces difícil diagnóstico, ya que se confunde con formas atípicas o atenuadas de la enfermedad inflamatoria intestinal o la EC28. El SII se caracteriza por la presencia recurrente de dolor abdominal asociado a alteraciones del ritmo en las deposiciones, frecuente hinchazón y distensión abdominal, con síntomas iniciados al menos 6 meses antes del diagnóstico41–43. Actualmente se utiliza el criterio de Roma IV para el diagnóstico del SII43, con presencia de dolor abdominal recurrente presente al menos un día a la semana en los últimos 3 meses, con 2 o más de las siguientes características: 1) Asociado a defecación; 2) Relacionado con un cambio en la frecuencia de las deposiciones, y 3) Relacionado con un cambio en la consistencia de las deposiciones.
Histología asociada a la sensibilidad al gluten no celiacaActualmente no existe un indicador histológico riguroso para el diagnóstico de la SGNC. La biopsia duodenal se considera útil para confirmar una EC seronegativa, pero no para diagnosticar la SGNC, ya que como se mencionaba anteriormente, en la mayoría de pacientes la arquitectura intestinal está intacta. Igualmente, se ha descrito que un estudio inmuno-histoquímico de la mucosa puede permitir detectar más casos de EC44, pero no de SGNC45. Si bien existe controversia sobre los hallazgos inmuno-histoquímicos en la SGNC, puesto que existen estudios que demuestran cierta activación inmunitaria en la mucosa de pacientes con SGNC30,32,33,46. Puede ser que la activación inmunitaria sea específica de linaje inmunitario y dependiendo de los marcadores analizados en el estudio, se detecte o no. Así por ejemplo no se han encontrado diferencias en la expresión mucosa de IL-17A47, IL-6, IL-8, IL-2 e IFN-γ32,33 entre pacientes con SGNC y controles, pero sí en la expresión de TNF, IL-1β, IL-12 e IL-1532. Por otro lado, es interesante destacar que tras la ingesta de gluten, los pacientes con SGNC sí responden con una mayor expresión de IFN-γ en la mucosa rectal33,48. Esto pone de manifiesto la importancia de la selección de pacientes con un diagnóstico correcto y que se encuentren en la misma condición con respecto a la ingesta de gluten.
Sobre la infiltración de linfocitos intraepiteliales, hay resultados contradictorios en la literatura científica, que muestran que no hay diferencias32 o sí las hay33 en el contaje de dichos linfocitos entre pacientes con SGNC y controles sanos. Esto sugiere que, si bien la citometría de flujo de la biopsia duodenal49 parece ser muy útil en la confirmación del diagnóstico de la EC36,50, existiendo un perfil en estos pacientes con predominio de linfocitos T con receptor γδ+51, se requieren más estudios para confirmar su utilidad en el diagnóstico de la SGNC. Especialmente teniendo en cuenta que estas técnicas no son coste-efectivas para el diagnóstico diferencial en el caso de pacientes con test genético negativo, ya que la EC queda prácticamente descartada36.
Por último, en la valoración de la histología en el estudio de un paciente con sospecha de SGNC es fundamental también descartar otras causas posibles de aumento de linfocitos intraepiteliales sin que ocurra alteración de las vellosidades como pueden ser las infecciones por Helicobacter pilory, Giardia lamblia o Cryptosporidium (revisado en Brown et al.52).
Biomarcadores de la sensibilidad al gluten no celiacaEl desconocimiento parcial de la fisiopatología y etiología de la SGNC53, las limitaciones del protocolo de Salerno para el diagnóstico de la misma19, y las similitudes clínicas con otras enfermedades cuyos diagnósticos se confunden, hace ineludible la búsqueda de biomarcadores específicos y discriminativos de la SGNC27.
Anticuerpos antigliadinaLa gliadina, una de las proteínas que constituyen el gluten54, es reconocida como desencadenante de los síntomas de la EC y la SGNC. Pero existen resultados contradictorios sobre la utilidad de los anticuerpos antigliadina (AGA) en el diagnóstico de la SGNC. Por un lado, se ha observado positividad para estos anticuerpos en sujetos diagnosticados con SGNC, con prevalencias que oscilan entre el 6 y el 40% para AGA-IgA y entre el 25 y el 55% para AGA-IgG12,23, Además, se ha visto que la tasa de positividad entre los pacientes con SGNC fue mayor que entre otros con enteritis microscópica no relacionada con el gluten55. Por otro lado, se han observado diferencias no significativas al comparar la positividad de estos anticuerpos en pacientes con SGNC con controles sanos (17,9 vs. 12,5%)24. Así mismo, se ha visto una baja sensibilidad (59,3% AGA-IgA; 83,1% AGA-IgG) y especificidad (61,8% AGA-IgA; 42,6% AGA-IgG) para los AGA como marcador diagnóstico de la SGNC27.
La inconsistencia de estos resultados podría deberse a varios motivos, como el diferente tamaño muestral, los criterios de inclusión y exclusión empleados por los investigadores, o bien el seguimiento más o menos estricto del protocolo de Salerno para el diagnóstico11. Por ejemplo, en el estudio multicéntrico de Volta U et al. con 486 participantes, se encontró una baja prevalencia de anticuerpos anti-AGA positivos, pero muchos de los pacientes ya mantenían una DSG11. Es más, Caio G et al. estudiaron el efecto de una DSG seguida durante 6 meses en 44 pacientes con SGNC, con niveles basales positivos para AGA-IgG. Tras el seguimiento, solo 3 de ellos (6,8% de la cohorte) mantuvieron los niveles de AGA-IgG positivos, un bajo cumplimiento de la dieta56. Sin embargo, en el grupo de EC, los AGA-IgG se mantuvieron tras el periodo de DSG, indistintamente de la adherencia o la respuesta clínica.
ZonulinaLa gliadina es responsable de la liberación de zonulina, una proteína monocatenaria que actúa sobre las células epiteliales aumentando así la permeabilidad intestinal29. Los niveles de zonulina se encontraron elevados en pacientes con SGNC y EC, comparado con controles asintomáticos y pacientes con síndrome del intestino irritable29. Se estudió también el efecto de la abstención de gluten en los niveles de zonulina, pero la disminución no fue significativa29. En el mismo estudio se observó una correlación positiva entre los niveles séricos de zonulina y los síntomas de dolor abdominal, la gravedad y frecuencia de la distensión abdominal, la ansiedad, y una correlación inversa con la calidad de vida. Y su validez como marcador diagnóstico fue elevado, con un área bajo la curva de 0,865, con una especificidad del 88% para una concentración sérica límite de 10,3-10,7pg/ml29.
Prueba ALCATALCAT 5 es una prueba in vitro en la que se exponen neutrófilos a extractos de cereales con gluten (trigo, centeno, cebada y avena) con el objetivo de medir el efecto tóxico de este hacia esas células. Cuando el tamaño, el volumen o la forma de los neutrófilos cambian, respecto a las características basales, la prueba se considera positiva. Se evaluó esta prueba en 25 sujetos con síntomas abdominales de los cuales 13 fueron diagnosticados con SGNC siguiendo el protocolo de Salerno. La prueba ALCAT 5 tuvo una sensibilidad del 81% y una especificidad del 22,2%, siendo así el valor predictivo positivo del 65% y el valor predictivo negativo del 40%. Estos resultados evidencian el valor de esta prueba como complemento en la sospecha clínica de SGNC, sin embargo, este estudio estuvo fuertemente limitado por la ausencia de un grupo de control sano21.
Micro-ARNLos micro-ARN (miARN) son secuencias de ARN cortas involucradas en la regulación de la expresión de genes y en el control de las funciones celulares. Recientemente, Clemente E et al.17, identificaron en biopsias duodenales 7 miARN diferenciales cuya expresión en pacientes con SGNC es mayor que la observada en los que presentan la EC. Entre ellos, se consideraron con mayor valor predictivo hsa-miR-19b-3p y hsa-miR-30e-5p. Utilizando solamente el primer marcador, el 70,4% de los pacientes fueron reclasificados en el grupo de SGNC. A su vez, hsa-miR-30e-5p fue el más predictivo en el diagnóstico diferencial de SGNC y EC, ya que, basándose en su expresión, el 74,1% de los pacientes se incluyeron en el grupo de SGNC.
Se ha propuesto que la alteración de la tolerancia inmunológica podría causar la SGNC, debido a un aumento de la respuesta inflamatoria mediada por los miARN17. Siguiendo con esta hipótesis, otros trabajos también han relacionado las enfermedades autoinmunes con la SGNC, encontrándose coexistencia de ambas en un 14% de pacientes11.
ARN largo no codificante (lncARN)Con el objetivo de ampliar los biomarcadores para el diagnóstico de SGNC, Efthymakis K et al.18, identificaron 300 secuencias de ARN expresadas diferencialmente en la mucosa intestinal de pacientes con SGNC en comparación con controles. La mayoría de estas secuencias correspondieron a lncARN y en menor parte a ARN codificador de proteínas. Actualmente, las funciones de lncARN son poco conocidas; los autores sugieren que pueden estar implicados tanto en respuestas inflamatorias como en la modulación del sistema inmunológico, por lo cual, su expresión puede alterarse en enfermedades autoinmunes. Este estudio refuerza el papel del sistema inmunológico en la SGNC18.
Citoquinas diferenciales de la sensibilidad al gluten no celiacaLos resultados de Masaebi F et al.57, proponen las citoquinas medidas en suero como biomarcadores en el diagnóstico de la EC y la SGNC. Ellos encontraron que la IL-8 era la citoquina con mayor valor predictivo positivo para distinguir la EC de la SGNC. Esto es coherente con otros estudios que mostraron que, entre varias citoquinas analizadas, la IL-8 fue la única con mayor concentración en pacientes con EC que en aquellos con SGNC58, no existiendo diferencias en los valores séricos de esta citoquina entre pacientes con SGNC y controles sanos31. Y con otro estudio de inmuno-histoquímica que encontró el mismo resultado para el análisis de expresión de IL-8 en mucosa33.
Otra citoquina inflamatoria con posible relación con la SGNC es la CXL10. En el estudio in vitro de Valerii MC et al.59, se cultivaron células mononucleares de sangre periférica procedentes de pacientes con SGNC con extractos de proteínas de diferentes cereales y se observó un aumento en la secreción de CXL10. Sin embargo, los datos de este estudio no fueron homogéneos ni en pacientes con SGNC, ni en controles, y solo se analizó esta citoquina.
Síntomas y signos en pacientes con sensibilidad al gluten no celiacaSíntomas gastrointestinalesLos pacientes diagnosticados con SGNC sufren algún síntoma intestinal, y más de la mitad padecen 2 o más, siendo el dolor abdominal el más frecuente de ellos, padeciéndolo entre el 33 y el 84,1% de los pacientes1,11,16,24,30. Otros síntomas gastrointestinales frecuentes son distensión abdominal, diarrea, estreñimiento, gases o flatulencia y dolor epigástrico16,23,24,30.
Con respecto a cuáles son los síntomas percibidos como más graves por los pacientes, Elli L et al. registraron como más intensos (medidos en escala del 1 al 10) la distensión abdominal (8,2±2,8), la plenitud posprandial (6,6±3,0), la saciedad precoz (6,4±2,8), y el dolor abdominal (5,4±2,4)20. Por otro lado, en un ensayo cross-over doble ciego de DCG/DSG en pacientes diagnosticados con SGNC llevado a cabo por Zanini B et al., se observó que aquellos que identificaron correctamente la dieta con gluten en base a sus síntomas, describieron la intensidad de estos (medida con la escala GSRS, de 1 a 7) de la siguiente forma: indigestión, 3,2±1,1; diarrea, 2,9±1,5; estreñimiento, 2,9±1,3; dolor, 2,6±1,0 y reflujo, 2,2±0,914.
Síntomas extraintestinalesLos síntomas extraintestinales son frecuentes en los pacientes diagnosticados con SGNC, con porcentajes descritos del 76%15 y hasta del 100%1. Los más comunes son: fatiga, confusión mental y dolor de cabeza1,11,24,29. Asimismo, se han descrito también como síntomas extraintestinales el malestar general, la ansiedad/depresión y el dolor articular1,7,11,16,30. Y se cree que los factores psicológicos o psicosomáticos como ansiedad o síntomas depresivos podrían también afectar a los síntomas intestinales26.
Tiempo de comienzo de los síntomas tras la ingesta de glutenVolta U et al. registraron que en más de la mitad de los pacientes con SGNC, la aparición de los síntomas se daba en las 6h posteriores a la ingesta de gluten; en aproximadamente el 40% de ellos, entre 6 y 24h después; y en menos del 10%, 24h después de la ingesta11. Estos datos concuerdan con el estudio de Croall ID et al. en el que los síntomas aparecieron durante las primeras 12h tras la ingesta de gluten en el 87% de los pacientes24.
Estado nutricionalEl estado nutricional de pacientes con SGNC puede estar alterado. En pacientes con sospecha de SGNC se han observado niveles bajos de ferritina, ácido fólico y vitamina D en el 23, 5 y 11% de los sujetos, respectivamente, mientras que el 24% de los pacientes presentaron anemia, en la mayoría de los casos ferropénica11. En otro estudio, un 18,4% de los pacientes con SGNC presentó alguna deficiencia de nutrientes9. Además de esto, se estimó pérdida de peso en un 35% de los pacientes con SGNC22. Es importante destacar que la restricción dietética y exclusión de alimentos a la que se someten los pacientes con SGNC es la causa de la frecuente pérdida de peso y de algunas de las deficiencias nutricionales, ya que en la SGNC no hay una malabsorción de los nutrientes al mantenerse la arquitectura del epitelio intestinal. Por tanto, estos tratamientos dietéticos deberían estar prescritos y controlados por sanitarios22,23.
ConclusionesLos pacientes con SGNC constituyen un grupo heterogéneo, en el que se han observado diferencias interindividuales, pero en los que el dolor abdominal y la fatiga son los síntomas más frecuentes. Además, la heterogeneidad en la respuesta a la DSG hace sospechar otros posibles mecanismos etiopatogénicos, incluyendo una posible respuesta a otros componentes del trigo, por lo que el término «sensibilidad al trigo no celiaca» está comenzando a sustituir al de SGNC. El protocolo para el diagnóstico de la SGNC estandarizado por los expertos de Salerno ha presentado resultados contradictorios en diversos estudios, especialmente en la respuesta ciega al gluten. En cualquier caso, es hasta la fecha el mejor criterio diagnóstico, si bien dada su complejidad solo puede implementarse en investigación y no en la práctica clínica. Entre los biomarcadores analizados en diversos estudios, existe cierto consenso en que valores elevados de IL-8 puedan distinguir pacientes con EC de los de SGNC. En cualquier caso, no existen hasta el momento procedimientos clínicos de laboratorio de tipo serológico o genético para el diagnóstico de la SGNC, limitándose este a un diagnóstico de exclusión. Son necesarios nuevos estudios que profundicen en el conocimiento de esta enfermedad, su diagnóstico y su tratamiento, para poder mejorar la calidad de vida de estos pacientes.
Responsabilidades éticasEste estudio no tiene consideraciones éticas al tratarse de una revisión.
FinanciaciónEste estudio se ha realizado sin financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.