La tuberculosis (TBC) peritoneal aislada es una forma de presentación extrapulmonar poco frecuente en los países industrializados. En la mayoría de los casos surge como resultado de la reactivación y la diseminación hematógena de una infección latente. Aunque la clínica y el análisis del líquido ascítico (predominio linfocítico, gradiente de albúmina entre suero y líquido ascítico inferior o igual a 1g/dl y concentración de adenosina deaminasa superior o igual a 39U/l) dan la sospecha diagnóstica, el diagnóstico de certeza es microbiológico. Por otro lado, Mycobacterium bovis es el causante de la TBC en animales, y su transmisión a humanos es poco frecuente en áreas desarrolladas, dado que suele ocurrir a través de la ingestión de leche contaminada no pasteurizada. Se presenta el caso de un paciente con cirrosis y ascitis causada por una infección muy poco común en España.
Isolated peritoneal tuberculosis is an uncommon extrapulmonary form of presentation of tuberculosis in industrialized countries. In most cases, this disease is the result of reactivation and secondary hematogenous spread of a latent infection. Although the suspected diagnosis is given by clinical manifestations and analysis of ascitic fluid (lymphocytic predominance, albumin gradient between serum and ascitic fluid ⩽1g/dl and adenosine deaminase concentration ⩾39U/L), microbiologic assessment is required for the definitive diagnosis. Mycobacterium bovis causes tuberculosis in animals. Transmission to humans is rare in developed areas, given that it usually occurs through ingestion of unpasteurized contaminated milk. We present a patient with cirrhosis who developed ascites caused by an exceptional infection in our setting.
Varón de 86 años con antecedente de cardiopatía hipertensiva y cirrosis hepática de origen enólico, compensada, en estadio A de la clasificación de Child-Pugh. Ingresó en el Servicio de Digestivo por un aumento del perímetro abdominal de 3 semanas de evolución, astenia, febrícula de predominio vespertino y pérdida de peso de 8kg en los últimos 2 meses. No había presentado descompensación de la hepatopatía con anterioridad. Como antecedente epidemiológico más importante hay que reseñar que el paciente consumía de forma habitual leche no pasteurizada.
En la exploración física destacaba una temperatura axilar de 37,4°C y semiología de ascitis moderada; el resto era normal. El hemograma, las pruebas bioquímicas de función hepática y renal (iones, creatinina y urea séricas), así como las pruebas de coagulación, no mostraron hallazgos significativos. El análisis del líquido ascítico reveló un exudado linfocítico, un gradiente de albúmina de 0,7g/dl y una concentración de adenosina deaminasa (ADA) de 109U/l. El examen citológico del líquido ascítico mostró células mesoteliales reactivas y linfocitos, sin hallazgos indicativos de malignidad. En la radiografía de tórax se apreciaba pinzamiento de ambos senos costofrénicos por derrame pleural bilateral y engrosamiento inespecífico de ganglios mediastínicos. En la ecografía abdominal y en la tomografía toracoabdominal sólo se observaron signos de hepatopatía crónica y ascitis en una cantidad moderada. La prueba de Mantoux fue negativa.
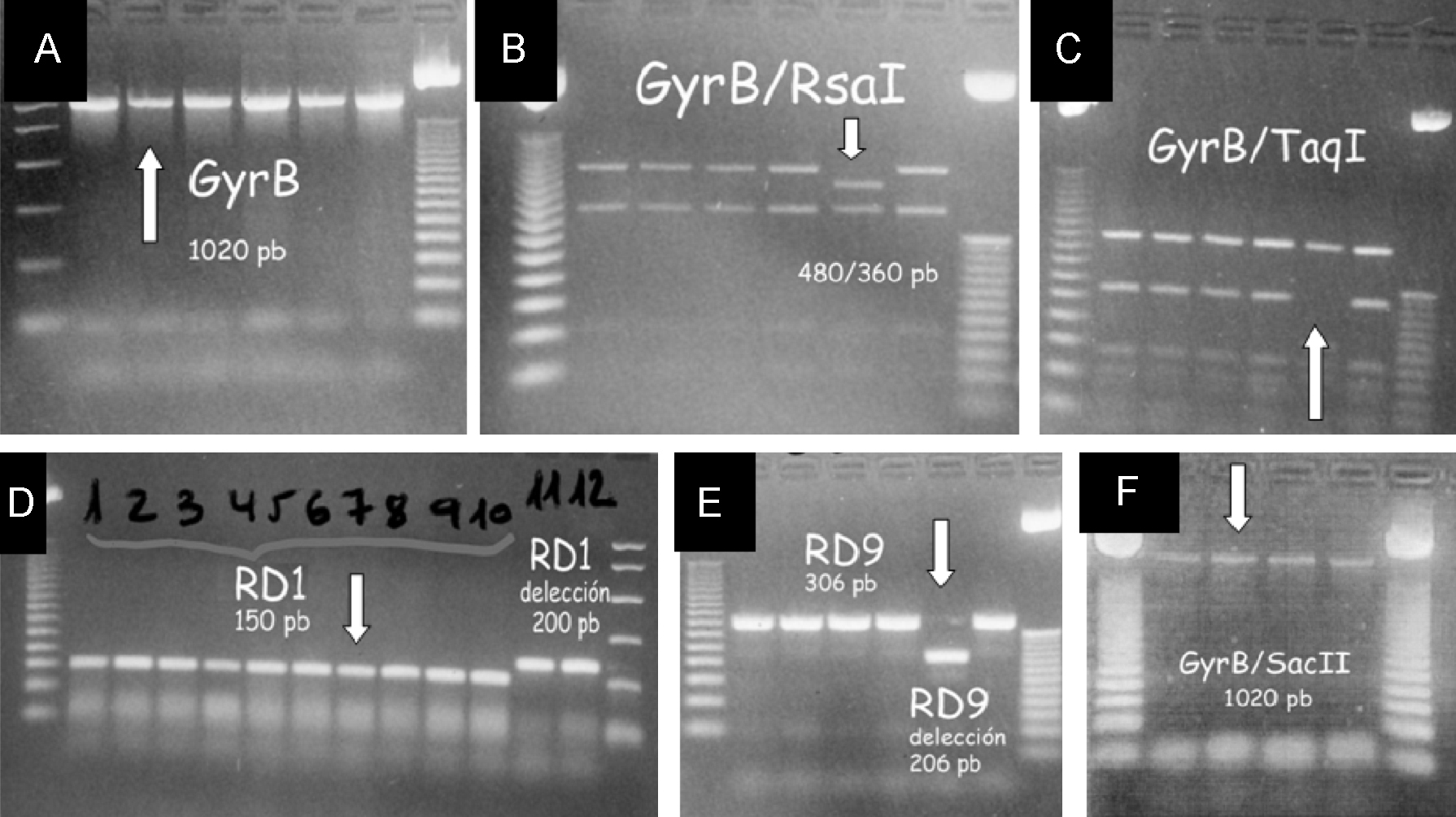
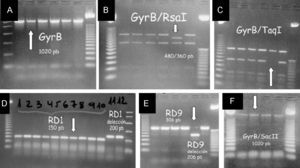
Respecto al estudio microbiológico del líquido ascítico, hay que destacar que no se vieron microorganismos con la tinción de Gram y que el cultivo convencional fue negativo tras 7 días de incubación. Con la tinción de auramina no se observaron bacilos resistentes al ácido y al alcohol; sin embargo, en los medios de cultivo para micobacterias, tras 2 semanas de incubación, crecieron bacilos resistentes al ácido y al alcohol que se identificaron inicialmente como Mycobacterium tuberculosis complex mediante sondas de ácido desoxirribonucleico marcadas con ésteres de acridina. Finalmente, se completó la identificación de la especie mediante PCR (polymerase chain reaction ‘reacción en cadena de la polimerasa’) y polimorfismos en la longitud de los fragmentos de restricción, que evidenciaron la presencia de Mycobacterium bovis. Este procedimiento combina la amplificación de un fragmento del gen gyrB de 1.020pb con el análisis de los productos de restricción con las enzimas RsaI, TaqI y SacII. Asimismo, en esta cepa se investigó la presencia o ausencia de regiones RD1 y RD91,2 (figura 1). Las pruebas de sensibilidad demostraron que la cepa era resistente a piracinamida y sensible a isoniacida, rifampicina, estreptomicina y etambutol.
Figura 1. Algoritmo de identificación de Mycobacterium bovis (flecha) mediante reacción en cadena de la ligasa. A) amplificación del gen GyrB (identifica Mycobacterium complex). B, C, F) resultado de los fragmentos obtenidos tras la digestión con las enzimas RsaI, TaqI, SacII, respectivamente. D) se constata la presencia de la región RD1 y E) ausencia de la región RD9. La combinación de estos resultados indica que se trata de Mycobacterium.
Desde el punto de vista clínico, dada la presencia de ADA elevada (mayor de 39U/l) de predominio linfocítico en el líquido ascítico se sospechó tuberculosis (TBC) peritoneal y se inició tratamiento con isoniacida, piracinamida, etambutol y levofloxacino con buena tolerancia. Tras 10 días de tratamiento, el paciente comenzó a mejorar, se quedó sin fiebre, ganó peso, y disminuyó la ascitis de forma progresiva hasta su desaparición. A las 3 semanas del ingreso presentó un episodio de disnea rápidamente progresiva y falleció. No se solicitó necropsia.
DiscusiónLa M. bovis es una de las especies integrantes del taxón M. tuberculosis complex (que incluye M. tuberculosis, M. africanum I y II, M. bovis, bacilo M. bovis de Calmette y Guérin, M. canetti, M. microti, M. caprae, M. pinnipedii). La M. bovis es la causante de la TBC en animales salvajes y domésticos, especialmente de la TBC bovina. La transmisión a humanos (zoonosis) se describió por primera vez a comienzos del siglo xx . Las vías de transmisión pueden ser la ingestión (la más frecuente), la inhalación o el contacto con mucosas o heridas de la piel de animales contaminados (menos frecuente). La mayor parte de los casos descritos se han producido tras la ingestión de leche contaminada no pasteurizada3,4. A partir de mediados del siglo xx , con el comienzo de la pasteurización de la leche y los controles sanitarios sobre las vacas, la incidencia de TBC bovina en humanos descendió de forma drástica5. En la actualidad se trata de una afección rara, especialmente en los países industrializados, y representa del 0,2 al 0,5% del total de casos de TBC registrados6. Los datos clínicos, radiológicos y patogénicos son indistinguibles de los producidos por M. tuberculosis, si bien M. bovis produce con especial frecuencia casos de TBC extrapulmonar (entre el 50 y el 60% del total de los casos)7; probablemente este hecho esté relacionado con que la vía de entrada más frecuente sea la digestiva. La TBC abdominal es una forma de presentación extrapulmonar con una incidencia aproximada del 5%. La localización más frecuente es la intestinal, seguida de la peritoneal y de la linfadenitis mesentérica8.
En los países desarrollados, la TBC peritoneal suele presentarse en grupos de riesgo, mientras que en los países en vías de desarrollo continúa siendo una causa frecuente de ascitis en estudio. En la mayoría de los casos, la enfermedad es el resultado de la reactivación y la diseminación hematógena de una infección latente. En el momento del diagnóstico, el 97% de los pacientes presenta ascitis, mientras que sólo en un 3% de los casos la enfermedad se manifiesta como una variante “seca”, con predominio de adherencias fibrosas9. Los síntomas más frecuentes son distensión abdominal (como consecuencia de la ascitis), fiebre, pérdida de peso, dolor abdominal y diarrea. La prueba de la tuberculina puede ser negativa hasta en el 30% de los casos.
El diagnóstico se basa en al análisis bioquímico y microbiológico del líquido ascítico (tabla 1).
Tabla 1. Análisis del líquido ascítico para el diagnóstico de tuberculosis peritoneal
| Datos citoquímicos | Datos microbiológicos |
| Celularidad: predominio linfocítico | Baciloscopia (S=3%) |
| Gradiente de albúmina <1g/dl | Cultivo de micobacterias en medios sólidos y líquidos (S=3 al 20%) |
| ADA ⩾39U/l | Técnicas de amplificación genómica (PCR, LCR, AMT) |
| CA125 elevado (>35U/ml) |
ADA: adenosina deaminasa; AMT: amplificación mediada por transcripción; CA: marcador tumoral; LCR: ligase chain reaction ‘reacción en cadena de la ligasa’; PCR: polymerase chain reaction ‘reacción en cadena de la polimerasa’; S: sensibilidad.
En el análisis del líquido ascítico hay un predominio de linfocitos, salvo en las fases tempranas de la enfermedad, en que pueden predominar los leucocitos polimorfonucleares10.
Hay 3 parámetros bioquímicos a los que debe prestarse atención: gradiente de albúmina, marcador tumoral CA125 y ADA10. En la TBC peritoneal, el gradiente de albúmina entre el suero y el líquido ascítico es inferior a 1,1g/dl (lo que demuestra una concentración de proteínas en el líquido ascítico mayor que en el plasma). El CA 125 es un marcador tumoral que se encuentra elevado en el suero y en el líquido ascítico de estos pacientes. Su concentración sérica disminuye a medida que la enfermedad remite. El tercer parámetro importante para el diagnóstico de la TBC peritoneal es la ADA; valores superiores a 39U/l son muy indicativos de TBC peritoneal, este hecho aparece recogido en un metaanálisis publicado recientemente (sensibilidad del 100%, especificidad del 97%, AUROC [area under the receiver operating characteristic ‘área bajo la curva de eficacia diagnóstica’] de 0,99)11. Por esto, en aquellos casos con sospecha clínica y ADA elevada, se recomienda iniciar el tratamiento tuberculostático sin esperar los resultados histológicos o microbiológicos11.
Para el diagnostico microbiológico suelen emplearse varias técnicas: a) el examen microscópico (baciloscopia) para evidenciar la propiedad de resistencia al ácido y al alcohol; la tinción Ziehl-Nielsen, o la de auramina, es una técnica rápida, pero con una sensibilidad muy baja (en el líquido ascítico aproximadamente de un 3%), y b) el cultivo de micobacterias en medios sólidos (Coletsos, Löwenstein-Jensen, o similar) o líquidos (Bactec MGIT 960, BacT/ALERT 3D, VersaTREK, o similar) mejoran el rendimiento de la baciloscopia, pero presentan cifras de sensibilidad muy variables (del 3 al 20% cuando sólo se emplean medios sólidos), que pueden llegar a ser del 80% si la cantidad de líquido ascítico analizada es superior a 1 l y si se emplean medios de cultivo líquidos12. El principal inconveniente es que los resultados suelen demorarse entre 3 y 4 semanas3. Con las técnicas de amplificación genómica (principalmente, la PCR convencional o en tiempo real, la amplificación mediada por transcripción, y la LCR [ligase chain reaction ‘reacción en cadena de la ligasa’]) se puede disponer de resultados entre 48 y 72h; sin embargo, la sensibilidad es inferior a la del cultivo en medios líquidos, sobre todo en muestras extrarrespiratorias con baciloscopia negativa13.
Aunque el diagnóstico de certeza es microbiológico, el estudio anatomopatológico de muestras obtenidas por biopsia puede orientar a TBC cuando se observan granulomas caseosos (sin embargo, no son totalmente específicos ya que, en raras ocasiones, también pueden aparecer en otras enfermedades, como es el caso de la sarcoidosis o de la enfermedad de Hodgkin); pero dado que para su obtención se requiere una laparoscopia o una laparotomía, y que estos procedimientos no están exentos de riesgos, en la actualidad la indicación de cirugía exploratoria se limita a casos seleccionados8,10.
El régimen terapéutico recomendado para tratar la TBC peritoneal incluye isoniacida y rifampicina más estreptomicina y etambutol. El efecto secundario más importante es la hepatotoxicidad, por esto, en estudios recientes se recomienda que en pacientes con enfermedad hepática crónica se sustituya la rifampicina por el levofloxacino más la pirazinamida14.
En conclusión, el interés de este caso clínico se basa en que M. bovis es causante únicamente de un 3% de los casos de TBC en el mundo. En los países industrializados supone un hallazgo excepcional debido al control veterinario del ganado y a la pasteurización de la leche. Además, la TBC peritoneal aislada como única manifestación de una reactivación de una infección pasada por M. bovis es una entidad muy poco frecuente, dado que lo más típico es que curse con ileitis terminal, afectación genitourinaria, linfadenitis o infección osteoarticular. Por esto, los autores de este artículo han querido comunicar este caso clínico.