INTRODUCCIÓN
Aproximadamente el 40% de los brotes graves de colitis ulcerosa (CU) no responden al tratamiento clásico con corticoides intravenosos1,2. La colectomía era la única alternativa hasta que se demostró que la ciclosporina era un tratamiento eficaz, capaz de evitar la cirugía en la fase aguda en la mayoría de los pacientes, si bien en algunos se producen a medio y largo plazo recaídas que finalmente requieren colectomía3. Por otro lado, aproximadamente el 25% de los pacientes que inicialmente responden a los corticoides recaen tras su retirada y precisarán otros inmunomoduladores para mantener la respuesta4. Ni la azatioprina ni la mercaptopurina, fármacos de elección en este escenario clínico, consiguen respuestas superiores al 70% a largo plazo5. Por tanto, un número significativo de pacientes con CU no pueden controlarse con el tratamiento médico estándar.
El factor de necrosis tumoral alfa (TNFa) ha mostrado ser una buena diana terapéutica en la enfermedad de Crohn (EC)6 y el infliximab, anticuerpo monoclonal quimérico capaz de inhibir al mediador se ha consolidado en los últimos 8 años, como alternativa terapeútica en situaciones de refractariedad y/o dependencia a los esteroides en la EC6,7. Inicialmente, se asumió que la CU respondía a un modelo de inflamación Th2, con una supuesta menor relevancia del TNFa, por lo que en un principio no se plantearon estudios en esta entidad. No obstante, la aparición de varios estudios observacionales con resultados prometedores8,9, motivó la realización de 3 ensayos clínicos controlados en los se consiguió probar la eficacia del fármaco en la CU10,11. Su publicación en el año 2005 dio lugar a la aprobación tanto por la Agencia Europea del Medicamento (EMEA) como por la Food and Drug Administration (FDA) del uso de infliximab en la CU. Ambas agencias reguladoras indican el uso de infliximab en situaciones de refractariedad a los tratamientos estándares, situaciones que a menudo están mal definidas incluso en los ensayos clínicos de referencia.
Convencidos de que los buenos datos observacionales contribuyen a un mejor conocimiento de la realidad clínica, presentamos en este trabajo nuestra experiencia preliminar con el infliximab en la CU.
MATERIAL Y MÉTODOS
Se lleva a cabo un análisis retrospectivo de todos los casos de CU tratados con infliximab entre junio de 2005 y diciembre de 2006 en las unidades de enfermedad inflamatoria intestinal de 2 hospitales de referencia.
Se utilizan el cumplimiento de los criterios de Lennard-Jones12 como condición para el diagnóstico de CU, la clasificación de Montreal13 para definir la extensión de la enfermedad y el índice modificado de Truelove-Witts14 para clasificar la actividad de la colitis en leve, moderada o grave. Se recoge de cada paciente el tiempo de evolución de la enfermedad y el tratamiento previo a la primera infusión del infliximab; en caso de que éste incluya los corticoides, el tiempo de administración no debe interrumpirse hasta iniciar el infliximab, independientemente de la dosis y la vía de administración.
Se dividió a los pacientes en 2 grupos según la indicación asumida para la administración del infliximab:
1. Dependencia a corticoides. Definida como una reactivación de la clínica tras la suspensión o el descenso de las dosis de corticoides, o bien como la constatación de 3 brotes en un año o 2 brotes en 6 meses que precisen corticoides sistémicos. Se incluyen también en este grupo los casos que, a pesar de recibir azatioprina o mercaptopurina como terapia de mantenimiento, no responden adecuadamente; es decir, no están en remisión a pesar de haber recibido durante > 6 meses las dosis completas de azatioprina (2 a 3 mg/kg de peso) o mercaptopurina (1 a 1,5 mg/kg de peso), limitadas básicamente por los leucocitos totales. En ambos centros todos los pacientes eran tratados con azatioprina (o mercaptopurina) antes de considerar el infliximab, y sólo ante la falta de respuesta o necesidad de respuesta rápida, o toxicidad grave de la azatioprina, se utilizaba infliximab.
2. Brote grave corticorresistente. Casos que, tras 7 días de tratamiento con corticoides intravenosos en dosis plenas, no presentan respuesta clínica y/o analítica. En ambos centros se utiliza ciclosporina o infliximab en los brotes graves según la decisión del clínico responsable.
En ambos grupos se descartó una posible sobreinfección bacteriana o por citomegalovirus (CMV) mediante coprocultivos, biopsias de colon teñidas con hemoxilina-eosina y evaluadas mediatne inmunohistoquímica, y determinación en las heces de la toxina de Clostridium difficile (como mínimo en 2 ocasiones).
En todos los casos se administró infliximab (Remicade, Centocor) según las recomendaciones GETECCU15 para la enfermedad de Crohn: infusión intravenosa de 5 mg/kg de peso con repeticiones de la dosis a las 2 y a las 6 semanas. En los casos en que se obtuvo respuesta se administraron dosis de mantenimiento cada 8 semanas. Para valorar el efecto se determinó la actividad de la enfermedad y las concentraciones de proteína C reactiva (PCR) previamente al tratamiento y a las 8 semanas de la primera infusión. Se definió la respuesta clínica como un descenso del índice de Truelove-Witts en al menos 3 puntos, y la remisión clínica cuando el índice fue inferior a 11 puntos.
En los pacientes dependientes a los corticoides, en quines el tiempo de seguimiento lo permitió, se estableció un segundo corte de evaluación en la semana 30. Si la indicación fue el brote grave refractario, se valoró la necesidad o no de realizar colectomía antes de 3 meses. Se recogieron también los efectos adversos que aparecieron durante la administración del tratamiento.
Dada la naturaleza del estudio, la estadística es meramente descriptiva, y se facilitan únicamente los intervalos de confianza (IC) del 95% en las cifras más relevantes.
No se ha requerido un consentimiento informado formal para el estudio, porque todos los pacientes han sido tratados dentro de la práctica clínica habitual; pero en todos los casos han sido informados exhaustivamente por sus médicos responsables (S.G., M.A. y/o F.G.), de acuerdo con la Ley de Autonomía del Paciente. Todo el estudio se ha llevado a cabo de acuerdo con las normas contenidas en la última versión de la Declaración de Helsinki.
RESULTADOS
Se recogieron datos de 19 pacientes, con una media de edad de 38,3 años (rango, 20-72), de los cuales 13 (68,4%) eran varones. En 13 (68,4%) la afección era extensa (E3), y en el resto (31,57%) estaba limitada al colon izquierdo (E2). La indicación para iniciar el tratamiento fue la dependencia a los corticoides en 15 casos (78,9%) y el brote grave corticorrefractario en 4 (21,1%). Todos ellos, en el momento de iniciar el infliximab, estaban en tratamiento con corticoides orales o intravenosos en dosis variables, durante un tiempo ininterrumpido de 1,5 meses de media (rango, una semana-3 meses). Todos seguían tratamiento de mantenimiento con mesalazina y 11 recibían, además, azatioprina o mercaptopurina.
En todos ellos se descartó la presencia de una infección tuberculosa (mediante Mantoux y radiografía de tórax), así como por el virus de la inmunodeficiencia humana, o los virus de la hepatitis C o B mediante la realización de serologías. El seguimiento medio tras la infusión de la primera dosis de infliximab fue de 33,2 semanas (rango, 8-108).
Durante el tratamiento se detectó un solo efecto adverso grave (neumonía cavitaria por Pseudomonas aeruginosa, que requirió un ingreso de más de 30 días) y obligó a suspender el tratamiento. En el momento del diagnóstico el paciente estaba recibiendo azatioprina y prednisona (60 mg/día) por una recidiva de la colitis, y la última dosis de infliximab se administró un mes antes del inicio de la neumonía. Este paciente, curiosamente, 5 meses después mantiene la remisión completa con mesalazina (3 g/día) y una dosis decreciente (en este momento 5 mg/día) de prednisona.
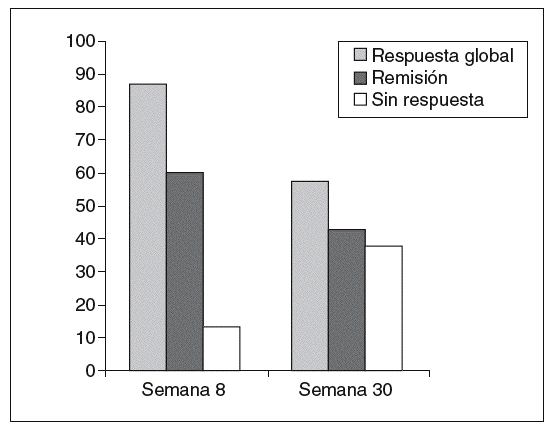
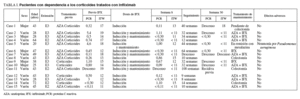
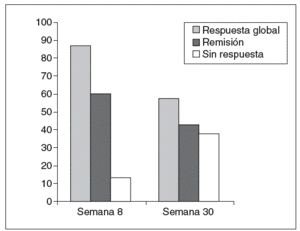
En el grupo de pacientes con dependencia a los corticoides (tabla I) se produjo una respuesta clínica en 13 de los 15 casos a las 8 semanas (86,6%; IC del 95%, 59-98), y lograron la remisión clínica 9 casos (60%; IC del 95%, 32-83,7). Dos pacientes no respondieron (13,3%; IC del 95%, 1,6-40,5), por lo que se ofreció la colectomía como alternativa terapéutica, aunque sólo la aceptó uno de ellos. Los valores de PCR descendieron también de forma paralela a la mejoría clínica. Siete pacientes que respondieron a las 8 semanas han sobrepasado la semana 30 de seguimiento. De ellos, 4 mantienen la respuesta (57,1%;) pero 3 (42,8%) han recidivado y han requerido colectomía electiva o están pendientes de su realización. En general, el infliximab se ha añadido al tratamiento inmunomodulador con azatioprina, aunque en algún caso (la paciente 9) se utilizó como tratamiento único porque la paciente sufrió una pancreatitis por azatioprina.
Entre los 4 pacientes con brote grave corticorrefractario (tabla II) sólo 2 (50%) respondieron a infliximab a las 8 semanas, uno de ellos logrando incluso la remisión clínica. Uno de los pacientes había recibido ciclosporina intravenosa sin respuesta clínica, a pesar de presentar unos valores sanguíneos adecuados. Los valores de PCR también se correlacionaron en este caso con la evolución clínica. En uno de ellos se suspendió el infliximab tras las 3 dosis de inducción, a pesar de haber respondido satisfactoriamente, y presentó un nuevo brote, en este caso moderado, que motivó la reintroducción del fármaco, de nuevo con éxito. Ambos mantuvieron la respuesta a los 3 meses en tratamiento con 5 mg/kg de infliximab cada 8 semanas y azatioprina oral. La colectomía fue necesaria en los otros 2 pacientes, uno de ellos por presentar una hemorragia grave en el curso del brote.
DISCUSIÓN
Varios ensayos controlados publicados en el último año y medio han demostrado la eficacia del infliximab como tratamiento para la CU10,11. Durante 2006, la EMEA aprobó definitivamente su uso en esta enfermedad. Las evidencias actuales sugieren que los pacientes con dependencia a los corticoides, a pesar de inmunosupresores, y el brote grave corticorresistente son, probablemente, las dos indicaciones que más se podrían beneficiar de la nueva terapia. Sin embargo, no es fácil extrapolar datos de los 2 grandes ensayos controlados publicados (ACT1 y ACT2) para la práctica diaria, puesto que la población incluida es muy heterogénea, y no siempre parece corresponder con los protocolos de actuación habituales en nuestro medio. Como mínimo, es sorprendente comprobar el alto número de pacientes incluidos en ensayos clínicos con infliximab que estaban recibiendo mesalazina como tratamiento único. Es más, la utilización del índice de Mayo (p. ej., con un 25% de su valor dependiente del criterio subjetivo del médico) hace muy difícil la comparación con otros estudios y con nuestra experiencia clínica diaria. Éstos y otros factores hacen necesario disponer de una información más ajustada a nuestro proceder diario, que es lo que intentamos proporcionar en este trabajo preliminar. Aunque sólo sea una impresión subjetiva, tenemos que señalar que el consenso entre los clínicos expertos en enfermedad inflamatoria intestinal es que los ensayos realizados con vistas a la aprobación de fármacos y/o nuevas indicaciones, son difícilmente extrapolables a la clínica real.
La experiencia con el fármaco en la enfermedad de Crohn ha facilitado en gran medida su introducción en la CU, administrándose en ambas entidades de forma muy similar. Sin embargo, los estudios realizados hasta ahora se centran en resultados de eficacia a corto y medio plazo (seguimiento máximo de 54 semanas en el estudio ACT 1)11, sin establecer la duración óptima del tratamiento. En los 2 centros en que se realizó este estudio la tendencia es mantener el infliximab al menos durante un año tras las 3 dosis de inducción, con un intervalo entre dosis de 8 semanas.
Los resultados obtenidos en los pacientes con dependencia a los corticoides a las 8 semanas desde la primera infusión muestran la eficacia de este tratamiento para disminuir la actividad clínica e inflamatoria de la enfermedad. Sin embargo, las tasas de remisión obtenidas son llamativamente más altas que las comunicadas en los ensayos clínicos presentados a las autoridades reguladoras. No obstante, no en todos los pacientes la respuesta se mantiene a largo plazo, y observamos que a las 30 semanas las recidivas disminuyen notablemente el porcentaje de éxitos (fig. 1). El número de pacientes tratados por brote grave corticorresistente es bastante menor; sin embargo, aparentemente la respuesta suele ser inferior a la del primer grupo, ya que sólo la mitad evitaron la colectomía. De hecho, un análisis post hoc del trabajo de Jarnerot sugiere que en los casos más graves el infliximab puede ser menos eficaz10.
Fig. 1. Tasa de respuesta y remisión en pacientes con dependencia a los corticoides tratados con infliximab.
Llama también la atención la demora con la que se instauró el tratamiento con infliximab. La falta de decisión a la hora de iniciar las terapias de segunda línea conlleva una administración demasiado prolongada de corticoides, lo que les resta eficacia, teniendo además en cuenta que en muchos casos son administrados en dosis subóptimas. Probablemente, éste sea un aspecto en el que merezca la pena seguir insistiendo, con el objetivo de evitar el uso incorrecto de una medicación con importantes efectos secundarios. Una mayor difusión de los índices predictivos de respuesta a los corticoides, aplicados de manera precoz, podrían ayudarnos a evitar esta situacion16,17. Una parte de la demora se justifica, no obstante, porque al tratarse de una nueva indicación, los clínicos tardan (tardamos) más tiempo en considerar esta opción, simplemente por falta de experiencia.
En el brote grave corticorresistente el infliximab aparece como alternativa a la ciclosporina (CyA). A pesar de que nunca se han comparado de forma directa en un ensayo clínico, los resultados a corto plazo parecen muy equiparables, cercanos en ambos casos al 80%10,11. La seguridad de infliximab parece ser mayor que la de la CyA, que además precisa una monitorización estricta de sus valores18,19. En nuestro grupo de pacientes sólo uno presentó efectos adversos (una neumonía grave por P. aeruginosa), si bien hay que considerar el papel que pudieran desempeñar la azatioprina y los corticoides que el paciente tomaba de forma concomitante. La respuesta a largo plazo del infliximab es por ahora una incógnita, pero los limitados resultados de la CyA tampoco parecen decantar la balanza a su favor20. No se ha observado ningún caso de tuberculosis, tras seguir las recomendaciones oficiales de GETECCU, excepto la aplicación del booster en los casos graves21.
En definitiva, el infliximab parece una alternativa válida a la colectomía en la CU en los pacientes con dependencia a los corticoides que no responden a azatioprina o mercaptopurina, si bien está por establecer cuánto tiempo debe administrarse durante el mantenimiento22,23. En el brote grave no hemos obtenido resultados tan espectaculares, si bien hay que considerar el escaso número de pacientes incluidos en este grupo. Quizás con una introducción más precoz del tratamiento podría mejorarse su eficacia24.