La incidencia creciente de los tumores quísticos de páncreas representa un problema en la práctica clínica diaria. Estos pacientes se ven sometidos a programas de seguimiento de dudosa eficacia clínica, que sobrecargan la actividad asistencial en las unidades de endoscopia. Sería de gran utilidad disponer de tratamientos alternativos a la cirugía para este tipo de pacientes, y que estos fueran seguros y eficaces. En esta revisión se intenta realizar una puesta al día crítica sobre la utilidad de los tratamientos ablativos de los tumores quísticos del páncreas.
The growing incidence of cystic pancreatic tumours has become a major problem in daily clinical practice. These patients usually undergo follow-up programmes of questionable clinical efficacy that put significant strain on endoscopy units. Safe and effective alternatives to surgery are desperately needed in these cases. The aim of this study was to critically review the utility of ablative therapies in cystic pancreatic tumours.
La prevalencia actual de las lesiones quísticas del páncreas en la población general es aproximadamente del 2%, aumentando de forma significativa en la población de edad avanzada1. En los últimos años se ha descrito un aumento en la incidencia de este tipo de lesiones debido al mayor uso de pruebas de imagen abdominales como la tomografía computarizada (TC) y la resonancia magnética1–3.
Las lesiones quísticas pancreáticas pueden dividirse en lesiones mucinosas y no mucinosas, con diferencias en su potencial de malignización.
Dentro de los tumores quísticos mucinosos del páncreas, los más frecuentes son la neoplasia mucinosa papilar intraductal (NMPI) y la neoplasia quística mucinosa4,5. La NMPI se clasifica en función del conducto pancreático al que afecte: 1) conducto principal, o 2) rama secundaria4,5. Todas las lesiones mucinosas tienen potencial maligno, y su histología y comportamiento biológico pueden variar desde lesiones benignas sin displasia epitelial hasta lesiones malignas con carácter o capacidad infiltrante.
El algoritmo de actuación ante estas lesiones no es sencillo. Como ya hemos mencionado, la incidencia de tumores quísticos aumenta con la edad, alcanzando su máxima incidencia en los pacientes mayores de 75 años. La elevada morbimortalidad de la cirugía pancreática, especialmente en los pacientes de edad avanzada, y la baja probabilidad de malignización de algunas de estas lesiones, implica la necesidad de un manejo individualizado. El abordaje depende tanto de las características de la lesión como del paciente. Ambos factores tienen un peso importante a la hora de indicar un tratamiento quirúrgico agresivo o un abordaje más conservador mediante controles con pruebas de imagen periódicas.
Recientemente se han publicado varías guías de consenso para establecer recomendaciones de manejo y toma de decisiones ante un paciente que presente este tipo de lesiones4,5. El algoritmo de actuación que se propone es el siguiente:
- •
Manejo conservador: mediante control con RM periódica cada 2 años en lesiones pequeñas (< 3cm), de paredes no engrosadas, sin nódulos murales y con un conducto pancreático principal no dilatado (conducto de Wirsung <5mm).
- •
Valoración por ecoendoscopia: en las lesiones que presentan algún signo de riesgo (tamaño> 3cm, engrosamiento parietal, presencia de nódulos en la pared o conducto pancreático principal dilatado entre 5 y 9mm). En caso de que se confirme la presencia de un componente sólido parietal y dilatación del conducto pancreático, se suele recomendar la realización de punción aspirativa con aguja fina guiada por ecoendoscopia (USE) y contemplar la resección quirúrgica según el contexto clínico del paciente. No obstante, en casos seleccionados o de alto riesgo para cirugía, podría valorarse realizar un control mediante resonancia magnética anual y la realización de tratamientos ablativos (inyección de alcohol o fármacos ablativos, termo- o crioablación).
- •
El tratamiento quirúrgico de resección: está indicado en las lesiones catalogadas como de alto riesgo de malignidad (presencia de ictericia obstructiva, nódulo parietal hipercaptante en pruebas de imagen, dilatación marcada del conducto principal (> 10mm), displasia de alto grado o carcinoma en el estudio citohistopatológico4,5.
A pesar de estas recomendaciones, frecuentemente no se consigue alcanzar suficiente evidencia con las pruebas de imagen y estudio citopatológico, sobre qué lesiones deben tratarse quirúrgicamente y cuáles deben seguirse de forma periódica. Ninguna estrategia es perfecta, ya que la cirugía pancreática tiene una elevada morbimortalidad, sobre todo en pacientes de edad avanzada, y el seguimiento radiológico/ultrasonográfico a largo plazo implica un coste económico significativo. En este contexto se han desarrollado tratamientos menos invasivos que pretenden tratar lesiones quísticas en pacientes con alto riesgo quirúrgico, disminuir su potencial de malignización y evitar someter al paciente a cirugías agresivas o a programas costosos de seguimiento.
La mayoría de estas técnicas son guiadas por ecoendoscopia. Aunque existe aún poca evidencia sobre su efectividad las más desarrolladas son la ablación con alcohol (etanolización), la administración de agentes quimioterápicos (placlitaxel) y la aplicación de radiofrecuencia.
Tratamientos guiados por ecoendoscopia de los tumores quísticos de páncreasAblación mediante etanolización e inyección de agentes quimioterápicosLa inyección de alcohol (etanolización) en el interior de una lesión quística produce lisis de las membranas del epitelio del quiste, seguida de desnaturalización proteica y oclusión vascular. Históricamente, la ablación de lesiones quísticas mediante la inyección de alcohol se ha llevado a cabo en lesiones quísticas renales de forma percutánea con excelentes tasas de éxito6–7. La localización retroperitoneal, periduodenal y en parte retrogástrica del páncreas, así como el tamaño de los quistes pancreáticos hacen que su abordaje percutáneo sea complicado, tanto para efectuar una punción como para plantear un tratamiento. En este punto, la ecoendoscopia aporta ventajas, ya que debido a la localización del páncreas en vecindad con duodeno y estómago, la lesión se encuentra próxima al transductor endosonográfico, lo que permite la realización de terapeútica guiada en tiempo real.
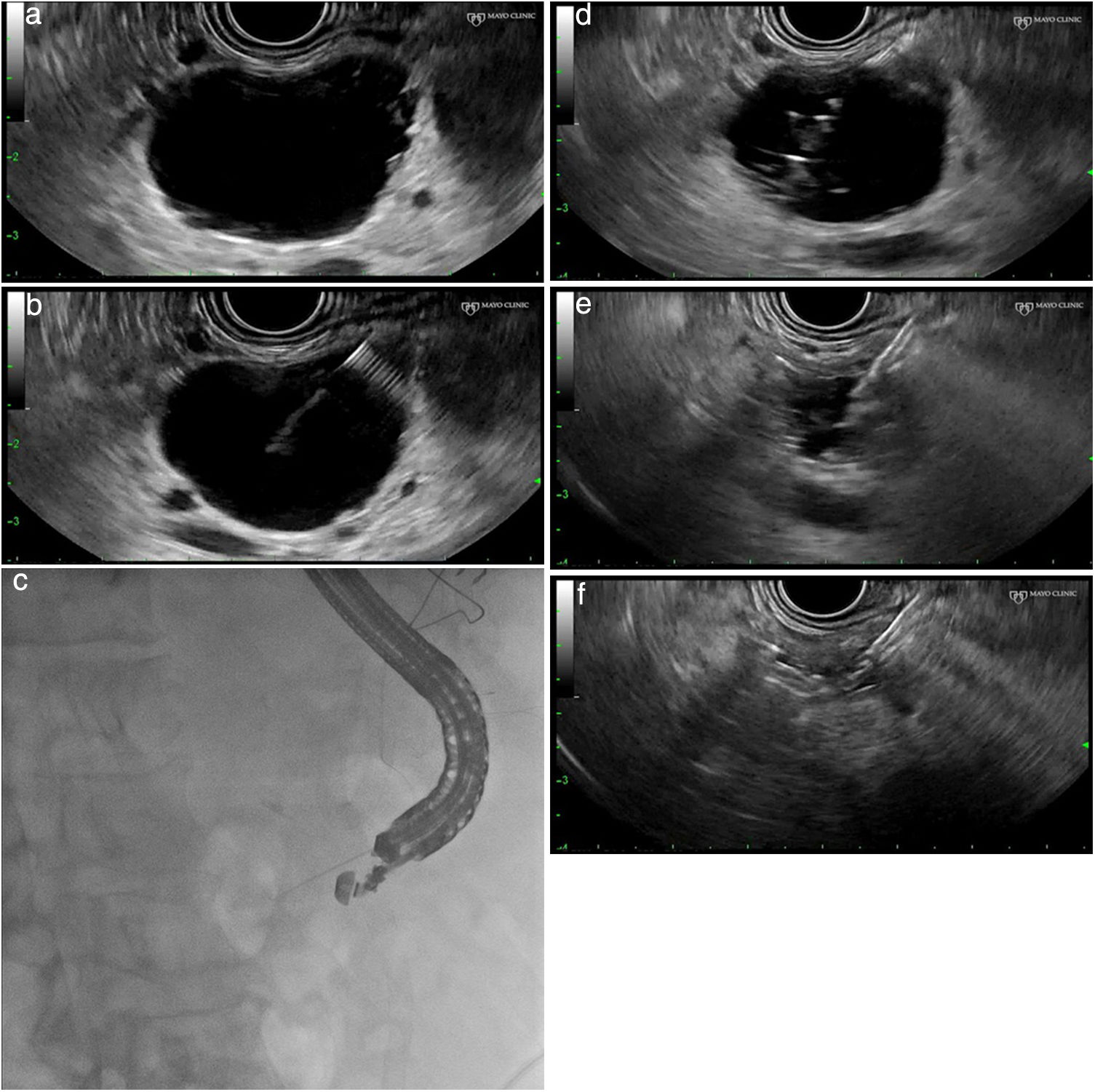
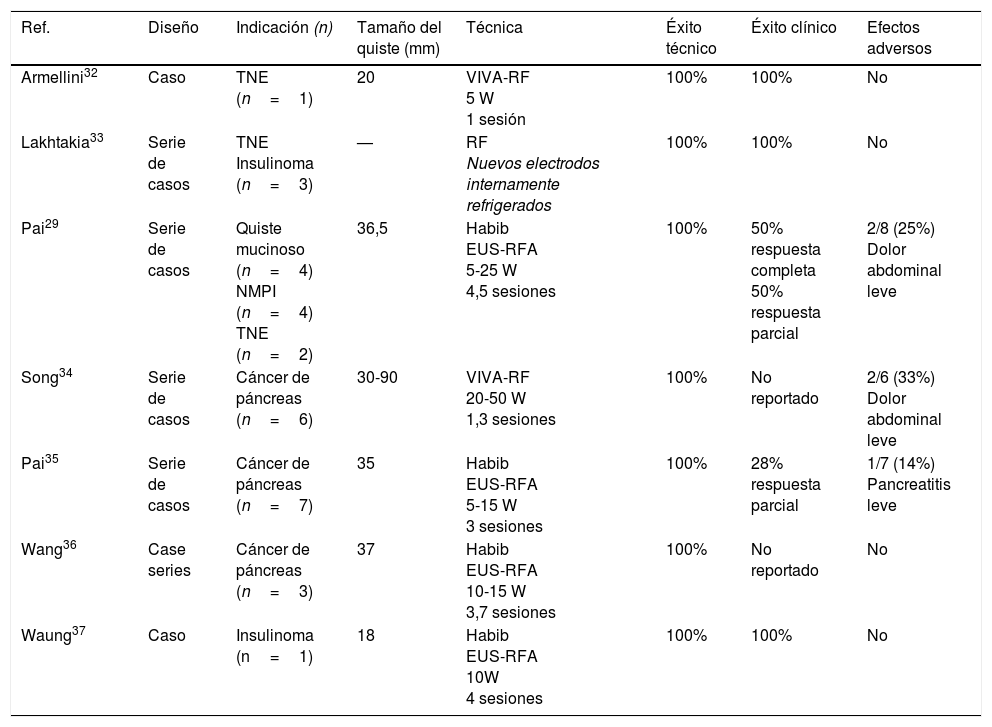
Procedimiento técnico (fig. 1a-f)Este tipo de tratamiento no está estandarizado y varía entre unos centros y otros. Es aconsejable realizar estos procedimientos en centros con experiencia en endoscopia avanzada y ecoendoscopia, y a ser posible dentro de protocolos de investigación. Tras la administración de profilaxis antibiótica (generalmente una quinolona iv), se introduce un ecoendoscopio lineal y se explora la anatomía pancreática desde el duodeno y el estómago para determinar el punto de acceso más adecuado para la punción de la lesión.
a) Identificación y caracterización de la lesión. b) Se introduce una aguja de punción guiada por USE. c) Control fluoroscópico del procedimiento. d) Aspirado e inyección alcohol 80-90% hasta replección. e) Aspirado completo del volumen de etanol inyectado. f) Colpaso completo de la lesión quística.
Mediante guía por ecoendoscopia se introduce una aguja fina de 19-22 G (punción aspirativa con aguja fina) en el interior de la cavidad quística, y se aspira el contenido de la lesión, que será enviado para estudio bioquímico y citológico. Algunos autores aconsejan que, tras su vaciamiento, se inyecte contraste en el interior del quiste a través de la aguja, con el fin de descartar, mediante radioscopia, una posible comunicación con el conducto pancreático principal y/o la presencia de una fístula con el parénquima pancreático. Mediante esta maniobra podría reducirse el riesgo de pancreatitis postetanolización.
Una vez que la cavidad quística se encuentra vacía (aspiración completa del contenido del quiste), se inyectan tantosml de etanol (habitualmente al 80%) como líquido se haya aspirado del quiste y, tras un período de lavado de 5min, se aspira de nuevo el contenido del quiste, enviando el material aspirado para su análisis citológico y bioquímico8-14. Hasta la fecha no existe una variante de la técnica descrita para lesiones quísticas septadas, la presencia de septos puede implicar una disminución de eficacia de la técnica al impedir la correcta difusión del alcohol en el interior de la lesión. La mayoría de los autores recomiendan vigilancia hospitalaria (12-24 h) tras realizar el tratamiento.
El control de la respuesta a esta técnica ablativa se realiza mediante pruebas de imagen, habitualmente TC, utilizando como criterio de respuesta la modificación en el tamaño de la lesión.
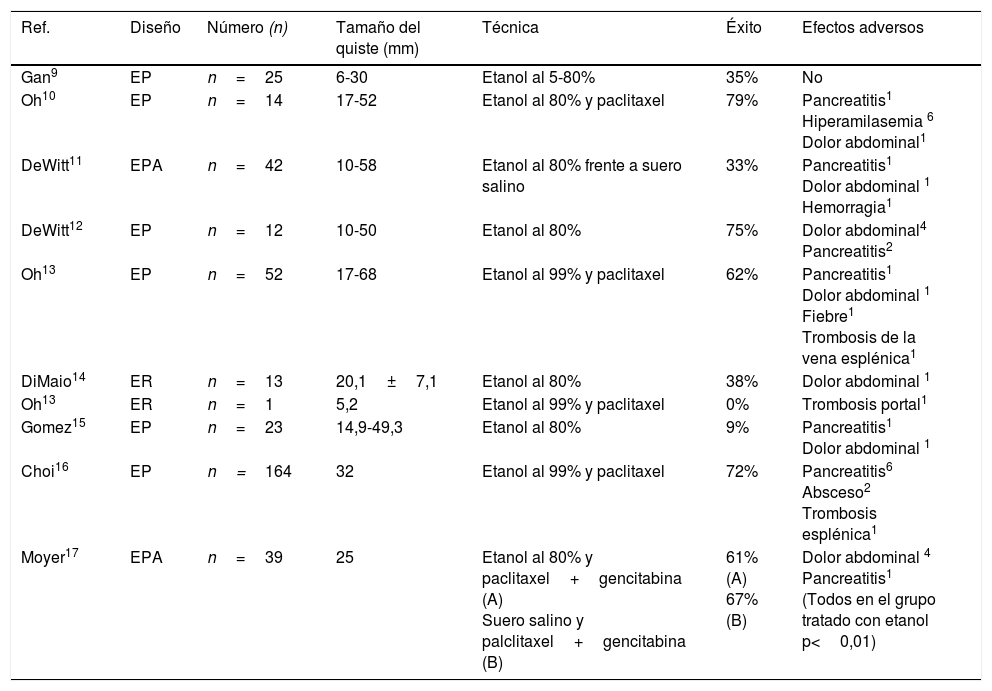
ResultadosEste tipo de tratamiento se encuentra aún en período de investigación, y los resultados de los diferentes estudios deben considerarse aún preliminares. Se ha demostrado una seguridad aceptable tanto en modelos animales como humanos9. No obstante, su utilidad clínica en el tratamiento de lesiones quísticas del páncreas sigue siendo controvertida. La tasa de resolución completa de las lesiones (basada en las imágenes de la TC antes y después de la etanolización± inyección de un quimioterápico local) varía entre el 0 y el 79% en los diferentes estudios (tabla 1)9–17.
Resumen de los estudios publicados sobre la ablación de tumores quísticos de páncreas mediante etanolización guiada por ecoendoscopia
| Ref. | Diseño | Número (n) | Tamaño del quiste (mm) | Técnica | Éxito | Efectos adversos |
|---|---|---|---|---|---|---|
| Gan9 | EP | n=25 | 6-30 | Etanol al 5-80% | 35% | No |
| Oh10 | EP | n=14 | 17-52 | Etanol al 80% y paclitaxel | 79% | Pancreatitis1 Hiperamilasemia 6 Dolor abdominal1 |
| DeWitt11 | EPA | n=42 | 10-58 | Etanol al 80% frente a suero salino | 33% | Pancreatitis1 Dolor abdominal 1 Hemorragia1 |
| DeWitt12 | EP | n=12 | 10-50 | Etanol al 80% | 75% | Dolor abdominal4 Pancreatitis2 |
| Oh13 | EP | n=52 | 17-68 | Etanol al 99% y paclitaxel | 62% | Pancreatitis1 Dolor abdominal 1 Fiebre1 Trombosis de la vena esplénica1 |
| DiMaio14 | ER | n=13 | 20,1±7,1 | Etanol al 80% | 38% | Dolor abdominal 1 |
| Oh13 | ER | n=1 | 5,2 | Etanol al 99% y paclitaxel | 0% | Trombosis portal1 |
| Gomez15 | EP | n=23 | 14,9-49,3 | Etanol al 80% | 9% | Pancreatitis1 Dolor abdominal 1 |
| Choi16 | EP | n=164 | 32 | Etanol al 99% y paclitaxel | 72% | Pancreatitis6 Absceso2 Trombosis esplénica1 |
| Moyer17 | EPA | n=39 | 25 | Etanol al 80% y paclitaxel+gencitabina (A) Suero salino y palclitaxel+gencitabina (B) | 61% (A) 67% (B) | Dolor abdominal 4 Pancreatitis1 (Todos en el grupo tratado con etanol p<0,01) |
EP: estudio prospectivo; EPA: estudio prospectivo aleatorizado; ER: estudio retrospectivo.
Inicialmente, Gan et al.9 realizaron un estudio piloto en el que incluyeron a 25 pacientes, donde se observó una tasa de respuesta completa del 35%, sin describir complicaciones significativas asociadas a la técnica. Basándose en estos resultados prometedores, DeWit et al.11 realizaron un estudio controlado, con diseño doble ciego, donde se aleatorizó al paciente para recibir etanol frente a suero salino, demostrando una tasa de respuesta con el primero del 33% (basándose en las imágenes de la TC). En ese estudio no se evidenciaron diferencias en términos de complicación entre ambos grupos.
Dada la escasa eficacia de la etanolización de lesiones quísticas en alguno de los estudios publicados, ciertos autores han intentado mejorar los resultados mediante la administración conjunta con quimioterapia local intraquística. En 2008, Oh et al. combinaron la administración de etanol al 80-90% con 3mg/mL de paclitaxel (quimioterápico empleado en otros tipos de tumor como el cáncer de mama, el de ovario y el de pulmón de células no pequeñas), y se observó una resolución completa de la lesión quística en el 79% de los pacientes10. Estos prometedores resultados deberían ser corroborados en estudios de mayor tamaño muestral, controlados y aleatorizados, antes de aceptar la posible mejora en la eficacia al asociar paclitaxel al tratamiento ablativo.
Un estudio prospectivo recientemente publicado16 analiza el efecto a largo plazo de la ablación de quistes pancreáticos utilizando etanol más paclitaxel. En este estudio que incluye 164 pacientes se evalúa el resultado de esta técnica ablativa en quistes mucinosos, serosos y de etiología indeterminada. La tasa de efectos adversos fue del 9,8% produciéndose un solo efecto secundario grave. La tasa de resolución completa del quiste fue del 72,2%, mientras que en un 19,6% la resolución fue parcial. Únicamente el 8,2% mantenían la lesión quística sin cambios después de la ablación. Solo hubo dos recurrencias (1,7%) entre las lesiones que se resolvieron completamente. El análisis multivariante mostró que la ausencia de septos intraquísticos (OR 7,12; IC95% 2,72-18,67) y el tamaño del quiste inferior a 35mm (OR 2,39; IC95% 1,11-5,16) eran factores predictivos independientes de resolución completa del quiste tras el tratamiento. Estos autores concluyen que el 98,3% de las lesiones quísticas ablacionadas completamente con alcohol más paclitaxel se mantienen en remisión después de un periodo largo de 6 años y consideran este tratamiento como una alternativa a la cirugía eficaz y duradera.
Además, un estudio recientemente publicado17 prospectivo y a doble ciego, compara la infusión de alcohol más quimioterápicos (placlitaxel más gemcitabina) versus suero salino junto a la misma quimioterapia para la ablación de lesiones mucinosas quísticas de páncreas. Aunque el número de pacientes evaluados es pequeño (10 pacientes), las tasas de resolución parcial y completa fue similar en ambos grupos sugiriendo que posiblemente no sea necesaria la infusión de alcohol cuando se aplica ablación con quimioterápicos. Además, el único efecto secundario grave (pancreatitis aguda) ocurrió en el brazo de tratamiento ablativo con alcohol.
La utilización de otras sustancias ablativas como el lauromacrogol, un fármaco esclerosante con efectos anestésicos leves, se ha evaluado en un estudio prospectivo18 en 29 pacientes consiguiendo tasas de resolución completa del 37,9% a los 9 meses, siendo discretamente menor en las lesiones de proceso uncinado y cabeza respecto a las de cuerpo y cola de páncreas. La localización en cabeza/proceso uncinado fue en la que se presentaron los únicos efectos adversos significativos (dos pancreatitis leves y una fiebre moderada).
Debe considerarse por tanto que la tasa variable de respuesta encontrada en los estudios publicados puede responder a diferencias en el tamaño y características de las lesiones incluidas, la concentración de alcohol o sustancias ablativas empleadas, la utilización conjunta de otros fármacos, el tiempo de seguimiento variable y la ausencia de criterios de respuesta estandarizados y fiables.
Un punto conflictivo es el método para valorar la respuesta al tratamiento; todos los estudios se basan en el tamaño de la lesión tras el tratamiento mediante prueba de imagen. No obstante, el riesgo de malignización depende de la integridad del epitelio y no del tamaño de la lesión. Los estudios en los que tras la ablación se ha efectuado cirugía y, por tanto, se dispone de material anatomopatológico, son de pequeño tamaño muestral y en ellos se ha evidenciado una tasa de ablación completa del epitelio que oscila entre el 50 y el 100%9–12. El mismo problema ocurre cuando se administra localmente paclitaxel junto con el alcohol (el 50% de los pacientes tendrán epitelio del quiste en la pieza quirúrgica)10.
En resumen, en nuestra opinión, la etanolización de las lesiones quísticas pancreáticas guiada por ecoendoscopia no puede considerarse actualmente un tratamiento eficaz para la ablación completa de los tumores quísticos del páncreas. Sin embargo, podría ser una alternativa terapéutica con intención paliativa, con cierta utilidad en pacientes con elevado riesgo quirúrgico, que presenten tumores quísticos <3cm de tamaño, no comunicados con el conducto pancreático principal y sin signos de riesgo en pruebas de imagen (tabiques, nódulos murales). No obstante, esta posibilidad debería ser refrendada por estudios prospectivos y controlados.
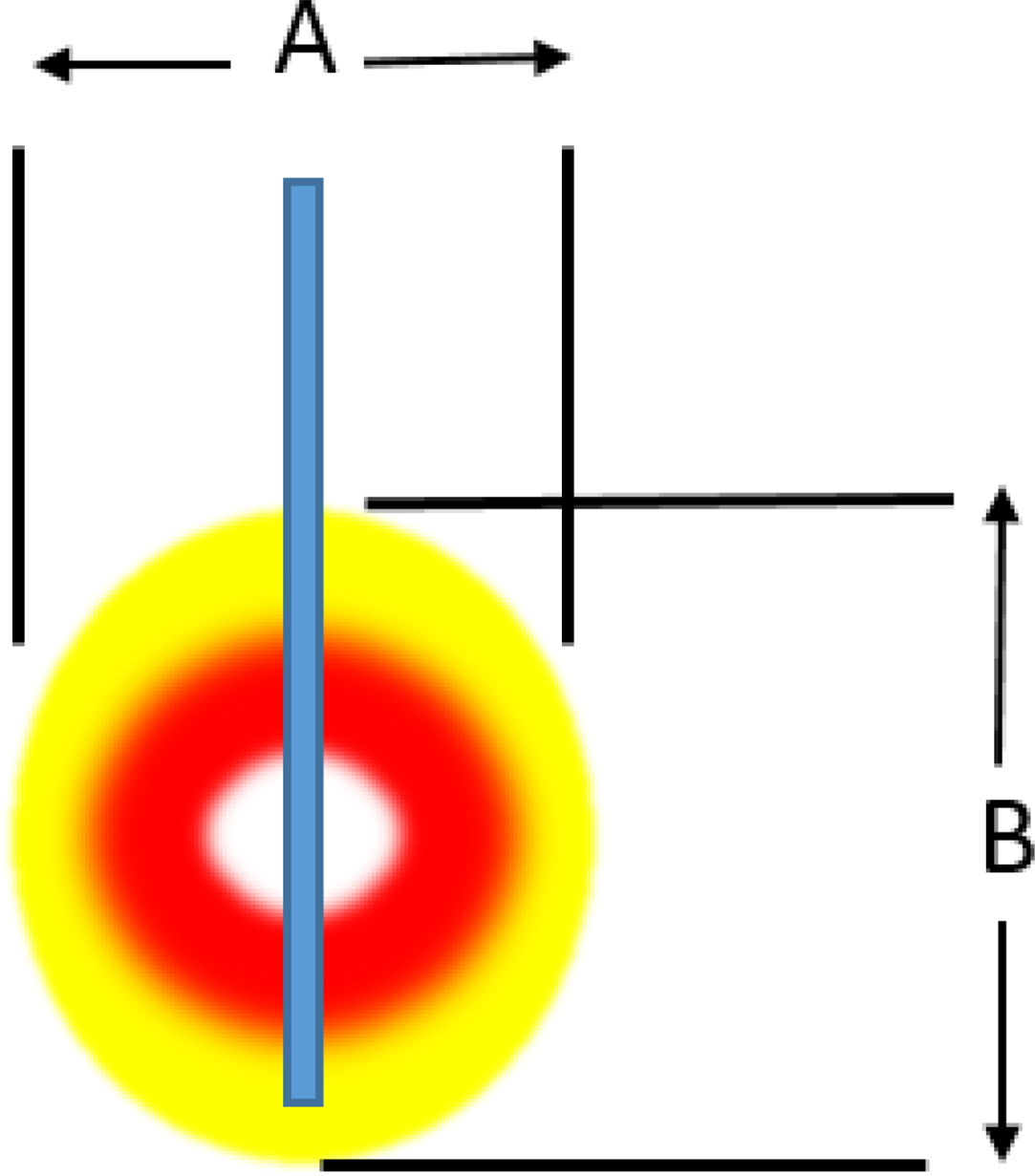
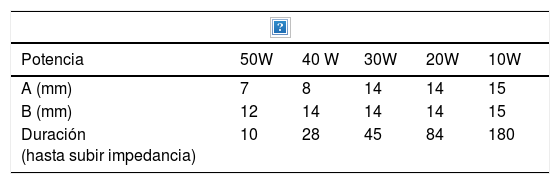
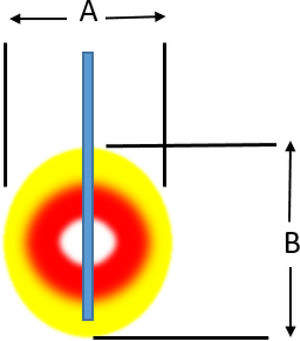
Ablación mediante radiofrecuenciaLa ablación por radiofrecuencia (RF) causa destrucción tisular a través de la aplicación de una corriente alterna de alta frecuencia que genera un aumento a nivel local de la temperatura, lo que induce necrosis coagulativa. El principio físico de la RF se basa en la inducción de calor a través de la producción de un campo eléctrico entre el paciente y dos electrodos: el electrodo activo de RF y el de referencia. Este campo eléctrico induce movimiento oscilatorio de iones y la producción de energía consecuente a la fricción asociada a la corriente iónica. En aplicaciones médicas se utilizan bandas de RF entre 300 y 3000kHz, que se corresponden con ondas de RF media. Los intervalos de temperatura alcanzada dependen de varios factores siendo la potencia de la RF (en watios) y el tiempo de exposición del tejido los más importantes. También intervienen en el volumen de ablación alcanzada, las características biológicas del tumor (sólido o quístico), su localización y orientación y el órgano en que asienta. Finalmente debe tenerse en cuenta también el fenómeno de «heat sink» disipación del calor inducida por el flujo vascular y el enfriamiento debido a los tejidos adyacentes que absorben una parte del calor inducido. La tabla 2a y b orientan sobre el tipo de lesión que se produce según el calor al que se aplica.
Lesión inducida. a) Lesión inducida por un electrodo con punta activa de 1cm
| Potencia | 50W | 40 W | 30W | 20W | 10W |
|---|---|---|---|---|---|
| A (mm) | 7 | 8 | 14 | 14 | 15 |
| B (mm) | 12 | 14 | 14 | 14 | 15 |
| Duración (hasta subir impedancia) | 10 | 28 | 45 | 84 | 180 |
b) Lesión inducida según la temperatura alcanzada en el tejido:
36-40°: homeostasis celular preservada.
42-45°: hipertermia-células susceptibles a lesiones. Ej.RDT /QMT.
46°: lesión celular irreversible con exposición>60min.
50-52°: lesión celular con exposición menor, a 4-6 min.
60-100°: inducción instantánea a coagulación de proteínas:
Lesión irreversible enzimas mitocondrias-citosol, ácidos nucleicos.
Necrosis–coagulación: tiempo aparición variable.
>105°: ebullición, vaporización, carbonización (no iones).
Esta técnica había sido utilizada ampliamente en diferentes tipos de tumores malignos sólidos y actualmente es una parte de la terapéutica estándar del carcinoma hepatocelular19.
Las primeras aplicaciones de RF por USE se realizaron en páncreas porcino en 199920. Previamente se había utilizado en cáncer de páncreas casi siempre intraoperatoriamente, en combinación con cirugía de bypass paliativa21.
Aunque se había demostrado una técnica factible y segura en estudios animales, las primeras aplicaciones clínicas en tumores pancreáticos se asociaron a una tasa muy alta de complicaciones graves y mortalidad debida a lesiones inadvertidas en estructuras adyacentes (páncreas no tumoral, duodeno, árbol biliar y vascularización peripancreática). En estos estudios iniciales se aplicaban temperaturas muy altas (mayores de 90°C), con aplicaciones repetidas para tratar tumores de gran tamaño en una sola sesión y sobre todo en la cabeza pancreática22–25. No obstante, en términos generales, la técnica se considera segura, en función de los hallazgos encontrados tanto en estudios animales como en humanos26,27.
Estudios ex vivo de las características termocinéticas de la RF han permitido determinar que las especificaciones óptimas de aplicación en el páncreas para prevenir lesiones en órganos de vecindad serían temperaturas alrededor de 90°-105°C aplicadas durante menos de 5 min. Sistemas de enfriamiento activo en los vasos y duodeno con suero salino frío alrededor del área de aplicación también reducen el número de complicaciones. Puesto que las complicaciones que generalmente se han asociado a mortalidad en las aplicaciones intraoperatorias han sido hemorragias incontrolables por afectación térmica de grandes vasos peripancreáticos, algunos autores han recomendado limitar el uso de RF solo a tumores de cuerpo y cola del páncreas28–31.
Procedimiento técnicoBásicamente consiste en localizar la lesión que se va a tratar a través de ecoendoscopia. La lesión se punciona con una aguja fina (19 o 22 G), o con agujas específicamente diseñadas para la aplicación de RF, a través de la cual se introduce un catéter de radiofrecuencia. Dependiendo del tipo de catéter se aplica corriente monopolar (catéter Habib EUS RF) o bipolar (sistema VIVA RF) (tabla 3)32. En lesiones quísticas se debe aspirar primero el contenido del quiste antes de aplicar la radiofrecuencia, a fin de que esta sea lo más eficaz posible. Una vez que el catéter se encuentra en el interior de la lesión, se aplica la energía de radiofrecuencia. La duración en tiempo e intensidad en watios dependerá del tipo de catéter utilizado. En la tabla 3 se muestran las características de los dos tipos de catéteres de aplicación de RF actualmente disponibles.
Tipos de catéteres para aplicación de radiofrecuencia guiada por ecoendoscopia
| Tipo de catéter | Tipo de corriente | Tipo de catéter | Longitud | Longitud de la parte activa | Potencia aplicación (watios) | Tiempo de aplicación |
|---|---|---|---|---|---|---|
| Habib EUS RFA® | Monopolar | 1 French (0,33 mm)- se pasa por aguja de 19 y 22 G | 220 cm | 20 mm | 10 W | 120 seg. (repetir hasta 5-10 veces con pausas de 30 seg |
| VIVA RF generator; (STARmed Korea) | Bipolar | Aguja de 18 G con punta activa | 150 cm | 50 W | 10 seg. (repetir 1-2 veces) |
RF: Radiofrecuencia; RFA: ablación por radiofrecuencia; W: watios.
La intensidad de la corriente y el número de pulsos/sesiones más adecuado está aún por definir, y diversos autores han publicado distintos protocolos de actuación, como puede verse en la tabla 4. Esta intervención suele realizarse mediante control radioscópico y ecoendoscópico, para asegurar la correcta colocación del electrodo de radiofrecuencia. Para lesiones de gran tamaño, hay que retirar la aguja y volverla a reubicar dentro del quiste, repitiendo el proceso tantas veces como sea necesario hasta conseguir la ablación de la lesión33.
Resumen de estudios publicados sobre la ablación de lesiones pancreáticas mediante catéteres de radiofrecuencia guiados por ecoendoscopia
| Ref. | Diseño | Indicación (n) | Tamaño del quiste (mm) | Técnica | Éxito técnico | Éxito clínico | Efectos adversos |
|---|---|---|---|---|---|---|---|
| Armellini32 | Caso | TNE (n=1) | 20 | VIVA-RF 5 W 1 sesión | 100% | 100% | No |
| Lakhtakia33 | Serie de casos | TNE Insulinoma (n=3) | — | RF Nuevos electrodos internamente refrigerados | 100% | 100% | No |
| Pai29 | Serie de casos | Quiste mucinoso (n=4) NMPI (n=4) TNE (n=2) | 36,5 | Habib EUS-RFA 5-25 W 4,5 sesiones | 100% | 50% respuesta completa 50% respuesta parcial | 2/8 (25%) Dolor abdominal leve |
| Song34 | Serie de casos | Cáncer de páncreas (n=6) | 30-90 | VIVA-RF 20-50 W 1,3 sesiones | 100% | No reportado | 2/6 (33%) Dolor abdominal leve |
| Pai35 | Serie de casos | Cáncer de páncreas (n=7) | 35 | Habib EUS-RFA 5-15 W 3 sesiones | 100% | 28% respuesta parcial | 1/7 (14%) Pancreatitis leve |
| Wang36 | Case series | Cáncer de páncreas (n=3) | 37 | Habib EUS-RFA 10-15 W 3,7 sesiones | 100% | No reportado | No |
| Waung37 | Caso | Insulinoma (n=1) | 18 | Habib EUS-RFA 10W 4 sesiones | 100% | 100% | No |
Éxito clínico: definido como desaparición de la lesión/aspecto necrótico de la misma en pruebas de imagen o persistencia de la lesión pero con disminución de su tamaño (respuesta parcial).
NMPI: neoplasia mucinosa papilar intraductal; RF: radiofrecuencia; RFA: ablación por radiofrecuencia; TNE: tumor neuroendocrino; W, watios.
Hasta la actualidad se han realizado pocos estudios y con escaso número de pacientes utilizando RF para la ablación de lesiones quísticas o sólidas del páncreas. En los diferentes estudios realizados hasta la fecha, se ha demostrado un éxito técnico, es decir la capacidad de aplicar RF a la lesión diana, del 100%29,33–37.
Con respecto al éxito clínico, los resultados son variables, y hoy en día no están claramente establecidos (tabla 4). Pai et al.29, en un estudio consistente en una serie de casos de tumores quísticos y neuroendocrinos, observaron desde una respuesta completa (100%) hasta la reducción del 50% en el tamaño de la lesión. Aunque no fueran tumores de tipo quístico, también se ha publicado algún estudio con escaso número de pacientes que permite plantear la posibilidad de realizar estudios piloto para evaluar esta técnica en el tratamiento de tumores sólidos del páncreas de tipo adenocarcinoma. En los casos en que se ha aplicado RF dirigida por USE en tumores sólidos ha habido una tasa baja de efectos secundarios alguna reducción en el tamaño del tumor y en los niveles de Ca 19,9; lo que apoyaría de forma indirecta la posible eficacia de este tipo de tratamiento33-37.
En términos de efectos secundarios, tanto en estudios animales como en las series de casos publicadas en humanos, se sugiere que el procedimiento es seguro sin complicaciones clínicas mayores. En las cinco series de casos publicadas sobre experiencia de la ablación de tumores de páncreas mediante radiofrecuencia guiada por ecoendoscopia, el efecto adverso más frecuente ha sido el dolor abdominal leve-moderado tras la intervención, con una incidencia estimada entre el 25 y el 33%29,33–37. En uno de los estudios se observó una incidencia de pancreatitis aguda secundaria del 14%35.
En resumen, en la actualidad la aplicación de RF en tumores de tipo quístico y sólido solo se puede recomendar en la actualidad en el contexto de estudios piloto o ensayos clínicos controlados.
En las lesiones de tipo quístico se requieren más estudios para determinar si realmente se produce una erradicación del epitelio neoplásico que pudiera implicar una reducción del potencial maligno haciendo innecesario, por tanto, el seguimiento a largo plazo.
ConclusionesEl aumento en el uso de pruebas de imagen abdominal ha conducido a un incremento significativo de lesiones quísticas pancreáticas incidentales. El no disponer de marcadores adecuados para predecir cuáles van a evolucionar hacia malignidad, obliga en muchos casos a plantear la indicación quirúrgica o a realizar un seguimiento a largo plazo con el consiguiente impacto sobre la calidad de vida y los costes.
Los métodos ablativos de este tipo de tumores, guiados por ecoendoscopia, son todavía poco fiables en términos de eficacia y seguridad. Sin embargo, como se ha sugerido recientemente38, estos podrían llegar a constituir una alternativa atractiva para intentar manejar este tipo de lesiones con datos iniciales prometedores y un gran camino por recorrer.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.